Способ количественной оценки бактерицидной активности дезинфицирующих средств
Иллюстрации
Показать всеИзобретение относится к области микробиологии и дезинфектологии. Плотную питательную среду засевают исследуемыми штаммами бактерий. Наносят бумажные диски, пропитанные дезинфицирующим средством. Инкубируют в термостате при оптимальной температуре до появления роста бактерий. Измеряют зоны задержки роста бактерий. Подсчитывают количество выросших колоний для построения графика зависимости между зоной задержки роста бактерий и количеством выросших колоний после их взаимодействия с дезинфицирующими средствами. По графику, с использованием карты Шухарта, оценивают активность дезинфицирующего средства к определенным видам микроорганизмов. Дезинфицирующие средства, у которых средние значения результатов измерения зоны задержки роста бактерий располагаются выше верхнего контрольного предела карты Шухарта, оценивают как средства с высокой бактерицидной активностью. Дезинфицирующие средства, у которых средние значения результатов измерения зоны задержки роста бактерий располагаются ниже нижнего контрольного предела карты Шухарта, оценивают как средства с низкой бактерицидной активностью. Дезинфицирующие средства, у которых средние значения результатов измерения зоны задержки роста бактерий располагаются между контрольными пределами карты Шухарта, оценивают как средства со средней бактерицидной активностью по отношению ко всем другим исследованным средствам. Способ обеспечивает возможность оценки бактерицидной активности дезинфицирующих средств. 3 ил., 3 табл., 1 пр.
Реферат
Изобретение относится к медицине, а именно к эпидемиологии, микробиологии, дезинфектологии, и может использоваться для оценки чувствительности бактерий к дезинфицирующим средствам.
В настоящее время для оценки чувствительности бактерий к дезинфицирующим средствам предложена «Методика определения и показатели чувствительности (устойчивости) к дезинфектантам» (Гудкова Е.И., Красильников А.П. Клиническая лабораторная диагностика. - 1994. - №6. - С.48-50). Методика основана на определении эффективности дезинфекции носителей, штифтов штамма-репликатора, контаминированных взвесями испытуемых культур микроорганизмов. Для этого их последовательно погружают в растворы дезинфектантов и нейтрализаторов и помещают на плотные питательные среды посредством прижатия концевых площадок штифтов к поверхности среды на бактериологических чашках.
Недостатками способа является то, что оценка результатов производится только по наличию или отсутствию роста бактерий в зонах посевов-отпечатков, отсутствует количественная оценка результатов.
Известен «Способ определения чувствительности микроорганизмов к дезинфицирующему средству (варианты)» (РФ №2378363, С12Н 1/00). Предлагаемый способ осуществляется выполнением нескольких этапов: приготовление бактериальной взвеси, приготовление растворов-дезинфектантов, соединение микробной взвеси и дезинфектанта, добавление нейтрализатора, после экспозиции высев на плотную питательную среду и подсчет количества выросших колоний на чашке.
Недостатками способа является следующее:
- высокая себестоимость (на одной чашке Петри исследуется только одна культура к одному дезинфицирующему раствору);
- предложенная шкала оценки результатов предполагает выдачу положительных заключений на дезсредства, которые не обладают полной бактерицидной активностью;
- подсчет количества колоний субъективен.
Известен способ определения активности дезинфектантов к различным видам бактерий методом диффузии в агаре с применением стандартных бумажных дисков (Бондарев В.А., Алтайская Г.Б., Горбунова З.А. Лабораторное дело. - 1999. - 2. - С.4-7). Согласно способу плотную питательную среду засевают исследуемыми микроорганизмами, наносят бумажные диски, пропитанные антимикробными препаратами, инкубируют в термостате при оптимальной для данных бактерий температуре до появления видимого роста и по наличию зоны задержки роста вокруг дисков судят о чувствительности бактерий к препарату.
Недостатком этого способа является то, что он не позволяет получить количественную оценку чувствительности бактерий к дезинфицирующим средствам, так как отсутствуют стандартные показатели зон ингибиции роста бактерий для дезинфицирующих средств.
Технический результат выражается в повышении надежности способа, обеспечивающего возможность количественного определения чувствительности бактерий к дезинфицирующим средствам различных химических групп, разработке стандартных таблиц зон ингибирования роста бактерий дезинфицирующими средствами, а также в получении методики оценки и мониторинга бактерицидной активности дезинфицирующих средств.
Для решения указанной задачи в известном способе, заключающемся в том, что плотную питательную среду засевают исследуемыми бактериями, наносят бумажные диски, пропитанные антимикробными препаратами, инкубируют в термостате при оптимальной для данных видов бактерий температуре до появления видимого роста, согласно изобретению дополнительно определяют зависимость между зоной задержки роста бактерий и количеством выросших колоний после их взаимодействия с дезинфицирующим средством, по которым оценивают активность дезинфицирующего средства к определенным видам бактерий.
Измерение зоны ингибирования роста бактерий осуществлялось стандартизованным методом с помощью прибора RedBiotic. Количество выросших колоний подсчитывали на автоматическом счетчике колоний Flash/Go/.
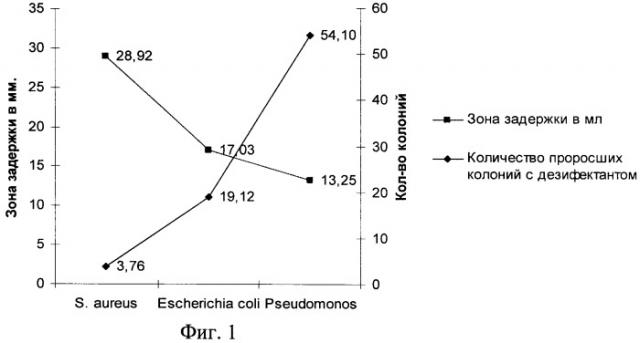
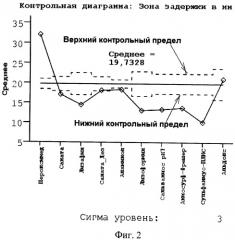
Сущность предлагаемого технического решения поясняется графиками, где на фиг.1 показана зависимость зоны задержки роста бактерий от количества проросших колоний после воздействия дезинфицирующего средства, на фиг.2 - контрольная карта Шухарта.
Способ оценки и мониторинга полученных результатов заключается в следующем: еженедельно в организации, занимающейся медицинской деятельностью, отбирают пробы рабочих растворов-дезинфектантов из различных подразделений и направляют в бактериологическую лабораторию. В соответствии с предложенным способом определяют их бактерицидную активность к штаммам бактерий, выделенных в данной организации (от пациентов и из объектов производственной среды). На основании полученных результатов строят контрольную карту Шухарта (фиг.2) согласно ГОСТ 50779.42-99 «Статистические методы. Контрольные карты Шухарта». Все дезинфицирующие средства, бактерицидная активность которых оказывается ниже минимального контрольного предела, считаются неэффективными для применения и подлежат замене. Проверка устойчивости госпитальных штаммов к применяемым дезинфицирующим средствам должна проводиться в соответствии с п.1.9, гл. II, СанПин 2.1.3.2630-10 с целью предупреждения возможного формирования резистентных к дезинфектантам штаммов микроорганизмов.
Преимущества способа:
1. Низкая себестоимость (на 1 чашке Петри исследуется 1 штамм бактерий и 6 растворов дезинфектантов);
2. Объективность исследования за счет применения прибора. Возможности осуществления способа покажем на контрольном примере.
Отбор и подготовка штаммов микроорганизмов для исследования
Для определения чувствительности к дезинфицирующим средствам взяты штаммы: Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa.
Для исследования устойчивости к дезинфицирующему средству используют чистые культуры бактерий, выделенные с помощью стандартных бактериологических методик. Испытания проводят не позже 1-2 дней после выделения культуры. Перед испытанием культуры засевают на скошенный 1,5% МПА (мясо-пептонный агар), выращивают в термостате при 35°С в течение 16-20 часов.
Для оценки роста культур испытуемых штаммов визуально просматривают каждую пробирку и учитывают характер и массивность роста. При необходимости проводят микроскопию культуры методом окраски по Грамму.
Подготовка расходных материалов для проведения исследования
Материалы, необходимые для выполнения методики: испытуемые культуры, стандартные дезинфектанты, стерильный ватный тампон, стерильные бумажные диски, питательные среды - среда Миллера-Хинтона, тиогликолевая среда для контроля стерильности, бульон Сабуро, Эндо для грамотрицательных бактерий, желточно-солевой агар для стафилококков, скошенный 1,5% МПА, 0,9% раствор хлорида натрия. Для определения оптической мутности суспензии микроорганизмов - денсиляметр, стандарт мутности по МакФарланду. Дозаторы пипеточные на 1000, 500 и 50 нл, стерильные наконечники для дозаторов. Стерильная лабораторная посуда: пинцеты, чашки Петри, пробирки 16×15, мерные флаконы на 250,0 мл, шпателя. Спиртовка, бактериологическая петля - 1 мм, линейка для измерения зоны ингибирования или прибор ReadBiotic, термостат.
Приготовление рабочих растворов дезинфицирующих средств (ДC)
Для исследования чувствительности к дезинфектантам взято 10 видов дезинфицирующих растворов различных химических групп: Пероксимед, Соната, Соната-Дез, Лизафин, Аламинол, Лизоформин, Сальваниос рН7, Аниосурф-Фрешер, Сульфаниус-Плюс, Альдокс.
Для определения бактериальной активности ДС рабочие растворы готовят на нестерильной дистиллированной воде* комнатной температуры в асептических условиях в концентрациях, зависящих от объекта, подлежащего дезинфекции. После внесения определенного количества концентрированного ДС в определенное количество воды тщательно перемешивают полученный раствор с помощью пипетирования до полного растворения дезинфектанта. Сроки и условия хранения готовых рабочих растворов должны строго соответствовать требованиям инструкции по применению для каждого конкретного вида ДС.
*Примечание - при приготовлении рабочих растворов некоторых ДС используется водопроводная вода; необходимо строго следовать инструкции.
Контроль контаминации рабочего раствора ДС.
Контроль концентрации рабочего раствора дезинфицирующего средства.
Концентрацию активного вещества в приготовленном растворе дезинфектанта контролируют с помощью индикаторов.
Приготовление суспензии исследуемых микроорганизмов (инокулюма) из агаровой культуры
Для приготовления рабочей суспензии исследуемого штамма бактерий используют чистую суточную агаровую культуру. Микробную массу берут бактериологической петлей с плотной питательной средой и помещают в стеклянную пробирку, содержащую 4,5 мл стерильного 0,9% раствора хлорида натрия, тщательно гомогенизируют. Исходную бактериальную суспензию оставляют на 15 минут для осаждения негомогенизированных конгломератов и частиц. Полученную надосадочную жидкость отбирают пастеровской пипеткой, переносят в стерильную пробирку, постепенно добавляя по каплям стерильный 0,9% раствор хлорида натрия. Плотность инокулюма точно доводим до концентрации 1,5×108 КОЕ/мл. Практически, наиболее приемлемым методом оценки концентрации бактериальной суспензии является измерение оптической плотности. Значение оптической плотности бактериальной суспензии 0,1 (концентрация 1,5×108 КОЕ/мл), измеряемой на денсиляметре, соответствует стандарту мутности 0,5 по МакФарланду.
Проведение бактериологического контроля фактического количества живых клеток бактерий в приготовленной суспензии
Поскольку в суспензии могут присутствовать мертвые микроорганизмы, которые, как и живые, будут давать изменение ее оптической плотности, необходимо осуществлять бактериологический контроль фактического количества живых клеток бактерий в приготовленной суспензии, чтобы при необходимости внести коррективы и обеспечить требуемые уровни контаминации жизнеспособными клетками бактерий.
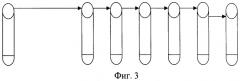
Из суспензии, приготовленной по оптическому стандарту мутности по МакФарланду, делают разведения, как показано на схеме (фиг.3). Первоначальная концентрация суспензии по стандарту мутности №10 соответствует 109 КОЕ/мл - первая пробирка, шесть пробирок с 9 мл стерильного физиологического раствора. Из первой пробирки в последующую после тщательного перемешивания переносится по 1 мл взвеси. Затем из второй пробирки в третью также переносится 1 мл взвеси микробных клеток. Таким образом, получается разведение с 10-кратным шагом до 103 микробных клеток в 1 мл в шестой пробирке. Посев 0,1 мл суспензии из этого разведения на плотную питательную среду позволяет произвести достаточно точный подсчет выросших на среде колоний бактерий, количество которых будет находиться в пределах 100 единиц.
Из разведения 103 производят посев по 0,1 мл на 3 чашки с плотной питательной средой, инкубируют в термостате при 37°С в течение 16-20 часов. Подсчитывают количество выросших колоний на среде, рассчитывают среднее значение из 3-х и делают пересчет количества жизнеспособных клеток в исходной суспензии, учитывая коэффициент разведения. Количество жизнеспособных клеток в рабочей суспензии должно быть в 109 КОЕ/мл.
Расчет количества жизнеспособных бактериальных клеток в приготовленной исходной суспензии осуществляют по следующей формуле:
X=A×107, гдe
Х - количество жизнеспособных бактериальных клеток в 1 мл приготовленной бактериальной суспензии;
А - среднее количество колониеобразующих единиц (КОЕ), выросших на 3 чашках;
107 - коэффициент пересчета, учитывающий степень разведения суспензии (106) и объем, использованный для посева (0,1).
Контроль чистоты роста культуры
Приготовленную бактериальную суспензию в количестве 0,1 мл засевают на плотные питательные среды, используемые для идентификации различных видов бактерий. Температурный режим и время инкубации применяют с учетом исследуемого вида бактерий.
Высев исследуемой культуры на плотную питательную среду (агар Миллера-Хинтона)
Стерильный ватный тампон погружают в пробирку с бактериальной суспензией, тщательно смачивают, отжимают о стенки пробирки. Ватным тампоном наносят бактериальную взвесь на чашки Петри со средой Миллера-Хинтона (глубина агарового слоя в чашке должна быть 4,0 мм) плотными штриховыми движениями в трех направлениях, поворачивая чашку Петри на 60°. Одна чашка - для постановки диска. Посевы инкубируются в термостате при 37°С 24 часа.
Кроме того, можно воспользоваться другим способом: дозатором 100 нл бактериальной взвеси вносят на чашку Петри со средой Миллера-Хинтона (глубина агарового слоя в чашке должна быть 4,0 мм). Затем стерильным шпателем бактериальную взвесь тщательно втирают в питательную среду.
Аналогично засевают чашку с целью постановки контроля контаминации исследуемым штаммом питательной среды. Чашку с контролем также помещают в термостат, инкубируют при 37оС 24 часа.
Пропитывание стерильного диска дезинфицирующим раствором и нанесение его на газон
Стерильный бумажный диск помещают в стерильную чашку Петри. Исследуемый дезраствор в количестве 10 нл дозатором наносят на диск. По прошествии 1 минуты (время, необходимое для пропитывания диска дезраствором) диск переносят стерильным пинцетом на чашку Петри с засеянной культурой.
Чашки помещают в термостат и инкубируют при 37°С в течение 16-24 часов.
Контроль стерильности диска
Из партии стерильных дисков отбирают 1% дисков. Стерильным пинцетом диски помещают в 20 мл тиогликолевой среды и в пробирку с 10 мл бульона Сабуро. Пробирки с тиогликолевой средой инкубируют при 30°С, с бульоном Сабуро - при 22°С в течение 8 суток. При наличии роста отмечается помутнение питательной среды. Делают высев на кровяной агар.
Учет результатов воздействия дезсредства на микроорганизм
По истечении времени инкубации регистрируют диаметр зоны задержки роста (в мм) (просветления) вокруг диска, результаты исследования отражены в таблице 1.
Определение активности дезинфектанта
На большом количестве штаммов бактерий Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa и различных концентраций дезинфицирующих средств проведены параллельные исследования чувствительности указанных штаммов к дезинфицирующим средствам по зоне задержки роста вокруг диска и количеству выросших колоний после воздействия дезсредства (таблицы 2, 3).
Статистический анализ средних значений количества проросших колоний и зон задержки роста бактерий вокруг диска показал, что между этими показателями отмечается обратная зависимость, как видно из графика на фиг.1.
Выбор дезинфектанта из числа включенных в оценку осуществляется с помощью контрольной карты Шухарта (фиг.2), формирование которой выполняется согласно ГОСТ Р 50779.42-99.
Все исследуемые дезсредства, у которых средние значения результатов измерения зоны задержки расположились выше верхнего контрольного предела, признаются как средства с высокой бактерицидной активностью. В нашем конкретном примере это Пероксимед.
Бактерицидная активность средств, результаты измерения которых расположились под нижним контрольным пределом, должна быть признана низкой, в сравнении с Пероксимедом.
Промежуточные позиции занимает дезинфектант, расположившийся между контрольными пределами карты Шухарта. В нашем случае это Альдокс. Его бактерицидная активность оценивается как средняя по отношению ко всем другим исследованным препаратам.
| Таблица 1 | ||||
| Диаметр зоны задержки роста микроорганизмов вокруг диска | ||||
| Виды дезинфектантов | Среднее (мм) | |||
| Группы микробов | ||||
| S. aureus | Escherichia coli | Pseudomonas aeruginosa | Итого | |
| Пероксимед | 38,5 | 27,6 | 30,1 | 32,1 |
| Соната | 23,0 | 15,6 | 12,7 | 17,1 |
| Лизафин | 20,5 | 14,4 | 8,4 | 14,4 |
| Соната-Дез | 28,4 | 15,9 | 10,1 | 18,1 |
| Аламинол | 31,0 | 15,8 | 8,1 | 18,3 |
| Лизоформин | 23,7 | 9,9 | 5,5 | 13,0 |
| Сальваниос рН7 | 22,0 | 10,2 | 7,7 | 13,3 |
| Аниосурф-Фрешер | 23,9 | 9,9 | 7,3 | 13,7 |
| Сульфаниус-Плюс | 15,1 | 7,7 | 7,5 | 10,1 |
| Альдокс | 27,0 | 21,4 | 14,5 | 21,0 |
| Итого | 28,9 | 17,0 | 13,3 | 19,7 |
Количество исследований чувствительности микроорганизмов к дезинфицирующим веществам по зоне задержки роста и количеству проросших колоний
| Таблица 2 | |||||||||
| N | Среднее | Стд. отклонение | Стд. ошибка | 95% доверительный интервал для среднего | Минимум | Максимум | |||
| Нижняя граница | Верхняя граница | ||||||||
| Зона задержки в мл | Staphylococcus aureus | 685 | 28,92 | 10,22 | ,39 | 28,15 | 29,69 | ,00 | 50,00 |
| Escherichia coli | 685 | 17,03 | 8,01 | ,31 | 16,43 | 17,63 | ,00 | 42,00 | |
| Pseudomonos aeruginosa | 685 | 13,25 | 10,19 | ,39 | 12,49 | 14,02 | ,00 | 50,00 | |
| Итого | 2055 | 19,73 | 11,63 | ,26 | 19,23 | 20,24 | ,00 | 50,00 | |
| Количество проросших колоний с дезинфектантом | Staphylococcus aureus | 657 | 3,76 | 24,22 | ,95 | 1,90 | 5,61 | ,00 | 300,00 |
| Escherichia coli | 657 | 19,12 | 63,76 | 2,49 | 14,24 | 24,01 | ,00 | 300,00 | |
| Pseudomonas aeruginosa | 657 | 54,10 | 99,37 | 3,88 | 46,48 | 61,71 | ,00 | 300,00 | |
| Итого | 1971 | 25,66 | 72,67 | 1,64 | 22,45 | 28,87 | ,00 | 300,00 |
| Таблица 3 | ||
| Количество и наименование исследованных дезинфицирующих средств | ||
| № п/п | Наименование дезинфицирующего средства | Количество исследований |
| 1 | Пероксимед | 420 |
| 2 | Соната | 216 |
| 3 | Лизафин | 90 |
| 4 | Соната-Дез | 216 |
| 5 | Аламинол | 672 |
| 6 | Лизоформин | 72 |
| 7 | Сальваниос рН7 | 108 |
| 8 | Аниосурф-Фрешер | 108 |
| 9 | Сульфаниус-Плюс | 108 |
| 10 | Альдокс | 45 |
| Итого | 2055 |
Способ количественной оценки бактерицидной активности дезинфицирующих средств, заключающийся в том, что плотную питательную среду засевают исследуемыми штаммами бактерий, наносят бумажные диски, пропитанные дезинфицирующим средством, инкубируют в термостате при оптимальной температуре до появления роста бактерий, после этого измеряют зоны задержки роста бактерий, подсчитывают количество выросших колоний для построения графика зависимости между зоной задержки роста бактерий и количеством выросших колоний после их взаимодействия с дезинфицирующими средствами, по графику, с использованием карты Шухарта, оценивают активность дезинфицирующего средства к определенным видам микроорганизмов, при этом дезинфицирующие средства, у которых средние значения результатов измерения зоны задержки роста бактерий располагаются выше верхнего контрольного предела карты Шухарта, оценивают как средства с высокой бактерицидной активностью, дезинфицирующие средства, у которых средние значения результатов измерения зоны задержки роста бактерий располагаются ниже нижнего контрольного предела карты Шухарта, оценивают как средства с низкой бактерицидной активностью, дезинфицирующие средства, у которых средние значения результатов измерения зоны задержки роста бактерий располагаются между контрольными пределами карты Шухарта, оценивают как средства со средней бактерицидной активностью по отношению ко всем другим исследованным средствам.