Гидраты солей эритромицина, их получение и применение
Иллюстрации
Показать всеНастоящее изобретение относится к макролидному производному, а именно к гидрату солей эритромицина, который имеет молекулярную формулу C37Н67NO13·A·nH2O, n=1, 5; 2; 3; 3,5; 5; 6 или 11, где А представляет собой лактобионовую кислоту или тиоциановую кислоту; причем n=3; 3,5; 5; 6 или 11, если А является лактобионовой кислотой и n=1,5; 2 или 3, если А представляет собой тиоциановую кислоту, причем гидрат обладает хорошей водорастворимостью и лучшей стабильностью при хранении, что удобно для производства лекарственного средства для лечения и профилактики у людей или животных инфекционных заболеваний, вызванных бактериями, микоплазмами или хламидиями, которые чувствительны к эритромицину. Также заявляется способ получения гидрата солей эритромицина и применение его для приготовления или очистки эритромицина. Еще одним объектом является фармацевтическая композиция, обладающая антибактериальной активностью. 5 н. и 9 з.п. ф-лы, 20 пр., 12 табл., 7 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области медицины и, конкретно, к гидратам солей эритромицина, макролидному производному, их получению и применению.
Уровень техники
Только лактобионат эритромицина [C37H67NO13·C12H22O12, CAS No.: 3847-29-8], тиоцианат эритромицина C37H67NO13·HCNS (CAS No.: 7704-67-8) и им подобные, а также их применения были описаны ранее, но до сих пор не опубликованы сообщения, которые бы раскрывали гидраты солей макролидного производного эритромицина, а также их получение.
Сущность изобретения
В первом аспекте, настоящее изобретение относится к гидратам солей эритромицина, отличающихся тем, что они имеют молекулярную формулу C37H67NO13·A·nH2O, где n=1-11; например, n равно 1, 1,5, 2, 2,5, 3, 4, 4,5, 5, 5,5, 6, 6,2, 1, 8, 10, 11, и A представляет собой фармацевтически приемлемую кислоту.
Во втором аспекте, настоящее изобретение относится к фармацевтической композиции, содержащей гидрат солей эритромицина согласно настоящему изобретению и, по меньшей мере, одно фармацевтически приемлемое вспомогательное вещество.
В третьем аспекте, настоящее изобретение относится к способу получения гидрата солей эритромицина согласно настоящему изобретению.
В четвертом аспекте, настоящее изобретение относится к применению гидрата солей эритромицина согласно настоящему изобретению в производстве лекарственного средства или к способу лечения заболеваний, вызванных бактериями, микоплазмами или хламидиями, которые чувствительны к эритромицину, с использованием гидрата солей эритромицина согласно настоящему изобретению.
В одном воплощении согласно первому аспекту в изобретении предлагается гидрат солей эритромицина, имеющий молекулярную формулу C37H67NO13·A·nH2O, n=1-11, A является фармацевтически приемлемой кислотой, где фармацевтически приемлемая кислота представляет собой лактобионовую кислоту, тиоциановую кислоту, малеиновую кислоту, фумаровую кислоту, тиоциановую кислоту, уксусную кислоту, метансульфокислоту, бензолсульфокислоту, никотиновую кислоту, молочную кислоту, лимонную кислоту, виннокаменную кислоту (включая оптически активную виннокаменную кислоту и рацемическую виннокаменную кислоту), аспарагиновую кислоту (включая L-аспарагиновую кислоту, D-аспарагиновую кислоту, DL-аспарагиновую кислоту), глутаминовую кислоту (включая L-глутаминовую кислоту, D-глутаминовую кислоту, DL-глутаминовую кислоту) или фосфорную кислоту.
В другом воплощении согласно первому аспекту, в изобретении предлагается гидрат солей эритромицина, который представляет собой ундекагидрат лактобионата эритромицина.
В другом воплощении согласно первому аспекту, в изобретении предлагается гидрат солей эритромицина, который представляет собой гексагидрат лактобионата эритромицина.
В другом воплощении согласно первому аспекту, в изобретении предлагается гидрат солей эритромицина, который представляет собой пентагидрат лактобионата эритромицина.
В другом воплощении согласно первому аспекту, в изобретении предлагается гидрат солей эритромицина, который представляет собой гемигепта(3.5)гидрат лактобионата эритромицина.
В другом воплощении согласно первому аспекту, в изобретении предлагается гидрат солей эритромицина, который представляет собой тригидрат лактобионата эритромицина.
В другом воплощении согласно первому аспекту, в изобретении предлагается гидрат солей эритромицина, который представляет собой тригидрат тиоцианата эритромицина.
В другом воплощении согласно первому аспекту, в изобретении предлагается гидрат солей эритромицина, который представляет собой дигидрат тиоцианата эритромицина.
В другом воплощении согласно первому аспекту, в изобретении предлагается гидрат солей эритромицина, который представляет собой гемитри(1.5)гидрат тиоцианата эритромицина.
В другом воплощении согласно первому аспекту, в изобретении предлагается гидрат солей эритромицина, который представляет собой гемипента(2.5)гидрат фосфата эритромицина.
Гидраты солей эритромицина согласно настоящему изобретению могут быть представлены в различных кристаллических формах, но для всех случаев является характерным, что если гидраты по настоящему изобретению дегидрируют при повышенной температуре, то их термограммы (ТГ-ДТА/ДСК) демонстрируют очевидные эндотермические пики и их гигроскопичность, как правило, ниже, чем у безводного соединения. Некоторые из гидратов могут стабильно храниться и имеют преимущества удобного получения или производства твердого состава, а также асептического наполнения состава.
Результаты содержания воды, которое измерено по методу Карла Фишера (Karl Fischer) согласуются с данными термогравиметрии. Термогравиметрические результаты демонстрируют следующие гидраты: кристаллический 3-, 4-, 5-, 6-, ундекагидрат лактобионата эритромицина (C38H69NO13·C12H22O12·3H2О, C38H69NO13·C12H22O12·4H2О, C38H69NO13·C12H22O12·5H2О, C38H69NO13·C12H22O12·6H2О, C38H69NO13·C12H22O12·11H2О), а также кристаллические гидраты тиоцианата эритромицина (1.5-, 2-, 2.5-, 3-гидрат), гидрат фосфата эритромицина, включающий (C38H69NO13·H3PO4·2.5H2O).
В одном воплощении согласно второму аспекту, в изобретении предлагается фармацевтическая композиция, содержащая гидрат солей эритромицина согласно настоящему изобретению и, по меньшей мере, одно фармацевтически приемлемое вспомогательное вещество.
Фармацевтическая композиция или лекарственное средство, содержащее гидрат солей эритромицина согласно настоящему изобретению, может быть включено в состав с образованием лиофилизованного порошка для инъекции, порошка для инъекции с асептическим наполнением, инъекции небольшого объема, дозированной формы для интраэнтерального введения, мази и геля для чрескожного введения, шипучих таблеток или суппозитория для интравагинального или ректального введения.
В одном воплощении согласно третьему аспекту, в изобретении предлагается способ получения гидрата солей эритромицина согласно настоящему изобретению, включающий:
Способ A: в реакционном контейнере, применяют любой из перечисленного: хлороформ, кетон C3-C6, сложный эфир C2-C6, воду и спирт C1-C5 или их смесь в качестве растворителя, добавляют эритромицин, встряхивают, добавляют органическую кислоту, добавляют один или несколько кетонов C3-C6, хлороформ, спирт C1-C5, простой эфир C2-C6, сложный эфир C2-C6 и бензол, после завершения реакции, охлаждают, фильтруют, промывают полученный в результате осадок с помощью одного или нескольких органических растворителей типа спирта C1-C5, кетона C3-C6, простого эфира C2-C6 и хлороформа, фильтруют при пониженном давлении и сушат с получением гидрата соли эритромицина; или
Способ B включает стадии: добавление раствора фармацевтически приемлемой кислоты в требуемом молярном соотношении в реакционный контейнер, содержащий эритромицин и один или несколько из перечисленных компонентов: вода, спирт C1-C5 и кетон C3-C6 в качестве растворителей, встряхивание, реакция при температуре от -10°C до 30°C в течение 0,5-24 ч, обесцвечивание с помощью активированного угля или фильтрация с помощью ультрафильтра после завершения реакции, охлаждение до температуры от -70°C до -30°C и сушка под вакуумом с получением гидрата соли эритромицина; или
Способ C включает стадии: добавление фармацевтически приемлемой кислоты или ее раствора в требуемом молярном соотношении в реакционный контейнер, содержащий эритромицин и воду, встряхивание, реакция при температуре от -5°C до 20°C в течение 0,5-24 ч, обесцвечивание с помощью активированного угля или фильтрация с помощью ультрафильтра после завершения реакции и распылительная сушка с получением гидрата солей эритромицина.
В одном воплощении согласно четвертому аспекту, в изобретении предлагается применение гидрата солей эритромицина согласно настоящему изобретению в производстве лекарственного средства, где лекарственное средство применяется при лечении человека или животного от инфекции, вызванной бактериями, микоплазмами или хламидиями, которые чувствительны к эритромицину.
В другом воплощении согласно четвертому аспекту, в изобретении предлагается способ лечения у человека или животного инфекции, вызванной бактериями, микоплазмой или хламидиями, которые чувствительны к эритромицину, с использованием гидрата солей эритромицина согласно настоящему изобретению.
Авторы настоящего изобретения исследовательским путем обнаружили, что гидраты солей эритромицина согласно настоящему изобретению обладают удивительными техническими эффектами. Конкретно, гидраты солей эритромицина согласно настоящему изобретению имеют гигроскопичность (поглощение влаги), как правило, ниже, чем у соответствующего безводного соединения, а также обычно являются стабильными. Например, в отличие от эритромицина, который частично растворяется в воде, и безводного лактобионата эритромицина, который более гигроскопичен, лактобионат эритромицина, содержащий кристаллическую воду и тому подобное, растворим в воде, обладает хорошей стабильностью во время хранения при комнатной температуре, удобен для получения легко растворимого и абсорбирующего состава, а также удобен для хранения и транспортировки. Кроме того, безводное соединение может быть так увлажнено, что оно должно обрабатываться при изоляции воздуха во избежание налипания, в то время как гидраты обладают хорошим свойством текучести, которое улучшает обработку состава и облегчает получение фармацевтического состава.
Гидраты солей эритромицина согласно настоящему изобретению могут оставаться стабильными при хранении. Образец вышеописанных гидратов запаивали в ампуле и проводили ускоренный тест определения стабильности при 30°C, и изменения содержания основного вещества и сопутствующих веществ измеряли с помощью метода ВЭЖХ (колонка с обращенной фазой C18, 0,01М KH2PO4-ацетонитрил (60:40) в качестве подвижной фазы, длина волны детектирования: 215 нм, температура колонки: 35°C, скорость потока: 1 мл/мин) (в зависимости от различных гидратов солей эритромицина, таких как кристаллические гидраты тиоцианата эритромицина, рН подвижной фазы может быть скорректировано, а KH2PO4 может быть заменен на NaH2PO4, длина волны детектирования может быть изменена на 210 нм, а температура колонки может быть установлена в интервале 35-55°C, как, например, 50°C, для анализа и измерения). Удивительно, но содержание и сопутствующие вещества гидратов солей органической кислоты и эритромицина согласно настоящему изобретению не демонстрируют значительных изменений. Согласно Фармакопее Китая CP2005, 5 г образец гидрата солей эритромицина тестировали с помощью теста на гигроскопичность при 25°C и относительной влажности 75%, и к своему удивлению обнаружили, что гидраты солей органических кислот по настоящему изобретению имеют относительно небольшую долю прибавки массы, вызванную абсорбцией влаги. По сравнению с безводной солью эритромицина, гидраты солей эритромицина согласно настоящему изобретению обладают более низкой гигроскопичностью, т.е. обладают лучшей стабильностью гигроскопичности, которая облегчает их упаковку и хранение, или представляют собой более предпочтительную стабильную форму хранения по сравнению с безводным соединением. Результаты продемонстрированы в следующих таблицах.
| Таблица 1 | ||
| Результаты ускоренного теста определения стабильности для гексагидрата лактобионата эритромицина | ||
| Время отбора образца (Месяц) | Форма | Анализ (%) |
| 0 | грязно-белый порошок | 99,7 |
| 1 | грязно-белый порошок | 99,6 |
| 2 | грязно-белый порошок | 100,2 |
| 3 | грязно-белый порошок | 99,8 |
| 6 | грязно-белый порошок | 99,6 |
| Таблица 2 | ||
| Результаты ускоренного теста определения стабильности для пентагидрата лактобионата эритромицина | ||
| Время отбора образца (Месяц) | Форма | Анализ (%) |
| 0 | грязно-белый порошок | 99,9 |
| 1 | грязно-белый порошок | 100,2 |
| 2 | грязно-белый порошок | 99,8 |
| 3 | грязно-белый порошок | 100,1 |
| 6 | грязно-белый порошок | 99,9 |
| Таблица 3 | ||
| Результаты ускоренного теста определения стабильности для ригидрата лактобионата эритромицина | ||
| Время отбора образца (Месяц) | Форма | Анализ (%) |
| 0 | грязно-белый порошок | 99,9 |
| 1 | грязно-белый порошок | 100,2 |
| 2 | грязно-белый порошок | 99,8 |
| 3 | грязно-белый порошок | 100,1 |
| 6 | грязно-белый порошок | 99,9 |
| Таблица 4 | ||
| Результаты ускоренного теста определения стабильности для тригидрата тиоцианата эритромицина | ||
| Время отбора образца (Месяц) | Форма | Анализ (%) |
| 0 | грязно-белый порошок | 99,8 |
| 1 | грязно-белый порошок | 99,9 |
| 2 | грязно-белый порошок | 100,6 |
| 3 | грязно-белый порошок | 100,3 |
| 6 | грязно-белый порошок | 100,1 |
| Таблица 5 | ||
| Результаты ускоренного теста определения стабильности для дигидрат триоцианата эритромицина | ||
| Время отбора образца (Месяц) | Форма | Анализ (%) |
| 0 | грязно-белый порошок | 99,9 |
| 1 | грязно-белый порошок | 99,9 |
| 2 | грязно-белый порошок | 100,4 |
| 3 | грязно-белый порошок | 100,2 |
| 6 | грязно-белый порошок | 99,8 |
| Таблица 6 | ||
| Результаты ускоренного теста определения стабильности для гемитри(1.5)гидрата тиоцианата эритромицина | ||
| Время отбора образца (Месяц) | Форма | Анализ (%) |
| 0 | грязно-белый порошок | 99,9 |
| 1 | грязно-белый порошок | 100,3 |
| 2 | грязно-белый порошок | 100,5 |
| 3 | грязно-белый порошок | 100,1 |
| 6 | грязно-белый порошок | 100,2 |
| Таблица 7 | |
| Результаты теста на гигроскопичность для солей органической кислоты эритромицина (RH 75%, 25°С) | |
| Время отбора образца (48 ч) относительно 0 ч | Гигроскопическая прибавка массы, % |
| Ундекагидрат лактобионата эритромицина | 0,04% |
| Гексагидрат лактобионата эритромицина | 7,31% |
| Пентагидрат лактобионата эритромицина | 8,93% |
| Тетрагидрат лактобионата эритромицина | 10,12% |
| Тригидрат лактобионата эритромицина | 12,07% |
| Безводный лактобионат эритромицина | 17,86% |
| Таблица 8 | |
| Результаты теста на гигроскопичность для солей органической кислоты эритромицина (RH 75%, 25°С). | |
| Время отбора образца (48 ч) относительно 0 ч | Гигроскопическая прибавка массы % |
| Тригидрат тиоцианата эритромицина | 0,02% |
| Дигидрат тиоцианата эритромицина | 2,03% |
| Гемитри(1.5)гидрат тиоцианата эритромицина | 3,12% |
| Безводный тиоцианат эритромицина | 6,75% |
Гидраты солей эритромицина растворяют в воде или в водном растворе этанола, затем добавляют NaHCO3, или Na2CO3, или аммоний, или другой раствор основания, полученный осадок фильтруют, промывают водой и перекристаллизовывают с помощью одного или нескольких соединений, выбранных из воды или метанола, этанола или ацетона. Полученное в результате кристаллическое вещество соответствует эритромицину согласно удельному вращению, MC и тому подобным данным или спектрам.
Гидраты солей эритромицина согласно настоящему изобретению могут использоваться для получения или очистки эритромицина, для получения эритромицин-оксима, для дальнейшего синтеза интермедиатов макролидов, таких как рокситромицин, кларитромицин, азитромицин, диритромицин, эритромицин с мостиковой связью, цетромицин и лекарственных средств на их основе.
Таблетки, капсулы, порошки, лекарственные порошки (pulvis), предварительно приготовленная смесь, растворимый порошок, гранулы для получения дозированных форм для энтерального введения могут содержать фармацевтически приемлемый наполнитель, такой как крахмал, модифицированный крахмал, лактоза, микрокристаллическая целлюлоза, циклодекстрин, сорбит, маннит, фосфат кальция, аминокислоты; фармацевтически приемлемый разрыхлитель, такой как крахмал, модифицированный крахмал, микрокристаллическая целлюлоза, натрий-карбоксиметил-крахмал, поперечно сшитый поливинилпирролидинон, гидроксипропилцеллюлоза с низкой степенью замещения, ПАВ; фармацевтически приемлемые увлажняющий агент и адгезионный агент, такие как желатинированный крахмал, метилцеллюлоза, натрий-карбоксиметилцеллюлоза, этилцеллюлоза, поливинилпирролидинон, альгиновая кислота и ее соли; фармацевтически приемлемое смазывающее вещество и добавка для повышения текучести, такие как стеариновая кислота, стеарат магния, полиэтиленгликоль 4000-6000, тальк, тонкодисперсный силикагель, лаурилсульфат магния; фармацевтически приемлемые подсластители и вкусовые добавки, такие как аспартам, цикламат натрия, сахарин натрия, сахароза и пищевой ароматизатор.
Гидраты по настоящему изобретению отличаются от эритромицина, который частично растворим в воде, так что скорость растворения его твердой дозированной формы подвержена значительному влиянию со стороны способа составления рецептуры. Гидраты солей эритромицина и органических или неорганических кислот легкорастворимы в воде, так что их твердые дозированные формы обладают хорошей растворимостью, могут легко всасываться и попадать в кровоток, обладают улучшенной биодоступностью и облегчают быстрое проявление их антибактериальных эффектов.
Предварительная смесь гидрата солей эритромицина согласно настоящему изобретению может быть получена путем смешивания гидрата с приемлемыми для животных лекарственными средствами или кормами (включая кукурузный корм), с кормовыми добавками (включая аминокислоты, витамины, ароматические эссенции), связующими агентами. Лекарственный порошок или растворимый порошок гидрата солей эритромицина согласно настоящему изобретению может быть получен с помощью удобного способа и оборудования вместе с другими фармацевтически приемлемыми наполнителями, дезинтегрирующими агентами, увлажняющими агентами и связующими агентами.
Суппозиторий и гель согласно настоящему изобретению отличаются от эритромицинового суппозитория или эритромициновой мази. Так как эритромицин частично растворим в воде, обычно добавляется маслорастворимое вспомогательное вещество, которое может легко вызывать загрязнение, которое с трудом можно очистить. Однако гидраты солей эритромицина более растворимы в воде, так что их суппозиторий и гель обладают свойством быстрого высвобождения, могут легко абсорбироваться и проникать в кровоток, обладая таким образом улучшенной биодоступностью, облегчающей быстрое проявление антибактериальных эффектов. Так как маслорастворимое вспомогательное вещество не нужно, загрязнения обычно не происходит и может быть легко очищено.
Суппозиторий гидратов солей эритромицина: состоит из 5-50% гидрата солей эритромицина и 50-95% основы суппозитория, где основой может быть этанол, глицерин, глицериновый желатин, полиэтиленгликоль 200-8000, полоксамер, полусинтетические эфиры жирных кислот, карбомер (931, 934, 940, 974, AA-1, 1342 и т.д.) и Tween 60-80. Метод получения: смешивают активный ингредиент с основой, нагревают на водяной бане, встряхивают, плавят, равномерно встряхивают, быстро переливают в форму суппозитория, покрытую смазывающим веществом, с небольшим вытеканием из формы суппозитория, охлаждают и шлифуют и удаляют форму с получением суппозитория.
Методы получения геля из гидратов солей эритромицина: равномерно смешивают гидрат солей эритромицина (внесенный в количестве в пересчете на эритромицин) с 50-95% основы, где основой может быть этанол, глицерин, триэтаноламин, глицериновый желатин, полиэтиленгликоль 200-8000, полоксамер, поливинилпирролидинон, полусинтетический сложный эфир жирной кислоты, водорастворимый моноглицерид, карбомер (931, 934, 940, 974, AA-1, 1342, и т.д.) и Tween 60-80. Гель может содержать фармацевтически приемлемый консервант и стабилизирующий агент. При включении в состав, карбомер может быть диспергирован в воде, после чего добавляют глицерин и полиэтиленгликоль 200-8000, нагревают, встряхивают и смешивают, добавляют определенное количество гидрата лактобионата эритромицина, встряхивают, добавляют фармацевтически приемлемое неорганическое или органическое основание, приводят рН к около 5-7, а затем добавляют воду до полного объема. Смесь равномерно встряхивают и наполняют с получением геля.
Методы получения лиофилизованного порошка для инъекции: гидрат солей органических кислот и эритромицина (в количестве в пересчете на эритромицин) и необязательно фармацевтически приемлемый лиофилизованный носитель или вспомогательное вещество растворяют в воде для инъекций, добавляют фармацевтически приемлемую кислоту/основание для достижения рН 5-7,5, если необходимо, добавляют 0,005-0,5% (масс./об.) активированного угля и встряхивают в течение 15-45 мин, фильтруют и фильтрат с добавленной водой фильтруют в стерильных условиях, заполняют в 25-250 мг/флакон (в пересчете на активный ингредиент), лиофилизуют и герметично закрывают с получением продукта.
Методы получения растворов для инъекций небольшого объема в виде гидратов солей органических кислот и эритромицина: гидрат солей органических кислот и эритромицина смешивают с водой для инъекции и фармацевтически приемлемыми добавками, такими как фармацевтически приемлемый агент, регулирующий рН, фармацевтически приемлемый антиоксидант, инертные газы, затем фильтруют и фильтрат стерилизуют с получением раствора для инъекции небольшого объема, имеющего рН 5-7,5.
Фармацевтически приемлемый агент, регулирующий рН, может представлять собой неорганическую или органическую кислоту, неорганическое или органическое основание, а также кислоту или основание Льюиса, и может представлять собой один или несколько компонентов, выбранных из группы, состоящей из соляной кислоты, фосфорной кислоты, пропионовой кислоты, уксусной кислоты, и солей уксусной кислоты, таких как ацетат натрия, молочной кислоты, фармацевтически приемлемых лактатов, фармацевтически приемлемых цитратов, карбоната натрия, гидрокарбоната натрия, гидроксида натрия, гидроксида калия, фосфатов, виннокаменной кислоты и ее фармацевтически приемлемых солей, бората натрия, борной кислоты, янтарной кислоты, капроновой кислоты, адипиновой кислоты, фумаровой кислоты, малеиновой кислоты, тригидроксиаминометана, диэтаноламина, этаноламина, изопропаноламина, диизопропаноламина, 2-амино-2-(гидроксиметил)-1,3-пропан-1,3-диол-амина, гексан-1,2-диамина, N-метилглюкамина, диизопропиламина и его солей, полигидроксикарбоновых кислот и их солей, таких как глюкуроновая кислота, глюконовая кислота, лактобионовая кислота, яблочная кислота, треоновая кислота, глюкогептоновая кислота, аминокислот и солей аминокислот.
Фармацевтически приемлемый антиоксидант и стабилизатор могут представлять собой один или несколько из следующих компонентов: сульфиновую кислоту, сульфиты, гидросульфиты, пиросульфиты, гипосульфиты, тиосульфат сероорганического соединения, такого как тиомочевина, глутатион, димеркаптопропанол, гликолевую кислоту и ее соли, тиомолочную кислоту и ее соли, тиодипропионовую кислоту и ее соли, фенольные соединения, такие как галлиевая кислота и ее соли, кофеиновая кислота, кафеаты, феруловая кислота, ферулаты, ди-трет-бутил-р-фенол, 2,5-дигидроксибензойная кислота, 2,5-дигидроксибензоат, фенол и производные, салициловую кислоту и ее соли; аминокислоту и ее соли; аскорбиновую кислоту и аскорбаты, изоаскорбиновую кислоту и изоаскорбаты, никотинамид, виннокаменную кислоту, нитраты, фосфаты, фармацевтически приемлемые ацетаты, цитраты, ЭДТА и соли ЭДТА, такие как динатриевая соль ЭДТА, тетранатриевая соль ЭДТА, N-ди(2-гидроксиэтил)глицин.
Фармацевтически приемлемый агент, регулирующий изотоничность, может представлять собой один или несколько из следующих компонентов: глюкозу, фруктозу, ксилит, сорбит, маннит, инвертазу, мальтозу, декстран, хлорид натрия, хлорид калия, лактат натрия.
Способ удаления пирогенов и бактерий может содержать: добавление 0,005-3% активированного угля для удаления пирогенов, использование микропористого фильтра для удаления бактерий и применение автоклавов-стерилизаторов, а также применение ультрафильтра для удаления бактерий и пирогенов. При ультрафильтрации используемый ультрафильтр может быть представлен в форме пластинки, цилиндра, трубки, пористого волокна, или круглого корпуса, предпочтительно в форме цилиндра или пористого волокна. После того, как большинство вызывающих повышение температуры веществ и бактерий удалено с использованием фильтрационной мембраны, имеющей нижний предел относительной молекулярной массы 50000-300000, удаляют оставшиеся пирогены с помощью ультрафильтрационной мембраны, имеющей нижний предел относительной молекулярной массы 4000-60000, предпочтительно ультрафильтрационной мембраны, имеющей нижний предел относительной молекулярной массы 6000-30000.
Гидраты лактата эритромицина могут использоваться для получения соединений высокого качества в виде эритромицинового основания или других солей органических кислот и эритромицина или их гидратов; гидрат тиоцианата эритромицина может использоваться для получения эритромицинового основания или эритромицин-оксима или эритромицин A оксима или их солей. Оксим эритромицина или его соли могут дополнительно применяться для синтеза интермедиатов и лекарственных средств макролидного типа, таких как рокситромицин, кларитромицин, азитромицин, диритромицин, эритромицин с мостиковой связью, цетромицин. Например, гидрат тиоцианата эритромицина, гидроксиамин или гидрохлорид гидроксиамина, гидроксид натрия или бикарбонат аммония или другие основания Льюиса или их водные растворы, метанол или изопропанол добавляют в реакционную колбу, реакцию проводят с встряхиванием при температуре около 20-60°C в течение 6-72 ч, охлаждают до 20°C или ниже, фильтруют, фильтрационный осадок добавляют к изопропанолу или ацетону и доводят рН с помощью аммиака, карбоната натрия или NaOH до значения рН 9,5-12, встряхивают, охлаждают для выпадения осадка, который отфильтровывают с получением оксима эритромицина.
Антибактериальные активности гидратов солей эритромицина определяют путем культивирования полученных в клинике бактерий и путем измерения согласно методам фармакологических тестов (метод двойного разведения), результаты представлены в таблицах 9, 10, 11 и 12 ниже.
| Таблица 9 | ||||
| Антибактериальная активность лактобионат гексагидрата эритромицина | ||||
| Бактерии для инфекции | Штаммы | MIC | MIC (мг/л) MIC50 | MIC90 |
| Staphylococcus aureus | 26 | 0,06-128 | 0,12 | 128 |
| Staphylococcus epidermidis | 21 | 0,12-128 | 16 | 128 |
| Pneumococcus | 18 | 0,03-0,5 | 0,06 | 1 |
| Streptococcus viridan | 23 | 0,03-128 | 0,06 | 0,5 |
| Streptococcus hemolyticus | 16 | 0,03-32 | 0,06 | 32 |
| Neisseria gonorrhoeae | 16 | 0,06-2 | 0,25 | 1 |
| Bacillus influenzae | 17 | 0,12-8 | 4 | 8 |
| Escherichia coli | 21 | 0,5-128 | 4 | 128 |
| Bacillus fragilis | 15 | 0,5-64 | 4 | 16 |
| Shigella | 25 | 0,12-128 | 128 | 128 |
| Propionibacterium | 18 | 0,03-16 | 0,06 | 0,12 |
| Anaerobe | 16 | 0,06-64 | 2 | 16 |
| Таблица 10 | ||||
| Антибактериальная активность пентагидрата лактобионат эритромицина | ||||
| Бактерии для инфекции | Штаммы | MIC | MIC (мг/л) MIC50 | MIC90 |
| Staphylococcus aureus | 26 | 0,06-128 | 0,12 | 128 |
| Staphylococcus epidermidis | 21 | 0,12-128 | 16 | 128 |
| Pneumococcus | 18 | 0,03-0,5 | 0,06 | 1 |
| Streptococcus viridan | 23 | 0,03-128 | 0,06 | 0,5 |
| Streptococcus hemolyticus | 16 | 0,03-32 | 0,06 | 32 |
| Neisseria gonorrhoeae | 16 | 0,06-2 | 0,25 | 1 |
| Bacillus influenzae | 17 | 0,12-8 | 4 | 8 |
| Escherichia coli | 21 | 0,5-128 | 4 | 128 |
| Bacillus fragilis | 15 | 0,5-64 | 4 | 16 |
| Shigella | 25 | 0,12-128 | 128 | 128 |
| Propionibacterium | 18 | 0,03-16 | 0,06 | 0,12 |
| Таблица 11 | ||||
| Антибактериальная активность тригидрата лактобионат эитромицина | ||||
| Бактерии для инфекции | Штаммы | MIC | MIC (мг/л) MIC | MIC90 |
| Staphylococcus aureus | 26 | 0,06-128 | 0,12 | 128 |
| Staphylococcus epidermidis | 21 | 0,6-128 | 16 | 128 |
| Pneumococcus | 18 | 0,03-0,5 | 0,06 | 1 |
| Streptococcus viridan | 23 | 0,03-128 | 0,06 | 0,5 |
| Streptococcus hemolyticus | 16 | 0,03-32 | 0,06 | 32 |
| Neisseria gonorrhoeae | 16 | 0,06-2 | 0,25 | 1 |
| Bacillus influenzae | 17 | 0,12-8 | 4 | 8 |
| Escherichia coli | 21 | 0,5-128 | 4 | 128 |
| Bacillus fragilis | 15 | 0,5-64 | 4 | 16 |
| Shigella | 25 | 0,12-128 | 128 | 128 |
| Propionibacterium | 18 | 0,03-16 | 0,06 | 0,12 |
| Таблица 12 | ||||
| Антибактериальная активность дигидрата тиоцианата эритромицина | ||||
| Бактерии для инфекции | Штаммы | MIC | MIC (мг/л) MIC | MIC90 |
| Staphylococcus aureus | 26 | 0,03-128 | 0,12 | 128 |
| Staphylococcus epidermidis | 21 | 0,6-128 | 16 | 128 |
| Pneumococcus | 18 | 0,03-0,5 | 0,06 | 1 |
| Streptococcus viridan | 23 | 0,03-128 | 0,06 | 0,5 |
| Streptococcus hemolyticus | 16 | 0,03-32 | 0,06 | 32 |
| Neisseria gonorrhoeae | 16 | 0,06-2 | 0,25 | 1 |
| Bacillus influenzae | 17 | 0,12-8 | 4 | 8 |
| Escherichia coli | 21 | 0,5-128 | 4 | 128 |
| Bacillus fragilis | 15 | 0,5-64 | 4 | 16 |
| Shigella | 25 | 0,12-128 | 128 | 128 |
| Propionibacterium | 18 | 0,03-16 | 0,06 | 0,12 |
| Anaerobe | 16 | 0,06-64 | 2 | 16 |
Клинические применения гидратов солей эритромицина согласно настоящему изобретению
Гидраты солей макролиднного производного эритромицина по настоящему изобретению в качестве антибактериальных лекарственных средств обладают широким спектром антибактериальных активностей и применяются в лекарствах для лечения или профилактики у человека и животного инфекций, вызванных бактериями, микоплазмами или хламидиями, чувствительными к эритромицину, причем инфекции включают: А - инфекции носоглотки: тонзиллит, фарингит, синусит; В - инфекции нижних дыхательных путей: острый бронхит, острый приступ хронического бронхита и пневмонию; С - инфекции кожи и мягких тканей: импетиго, рожу, фолликулит, фурункул и раневые инфекции; D - острый отит, микоплазменную пневмонию, уретрит и цервицит, вызванный Chlamydia trachomatis; и Е - инфекции, вызванные Legionella, Mycobacterium avium, Helicobacter pylori.
Как правило, для животного или человека с массой тела 10-70 кг, внутримышечная инъекция составляет: 25-500 мг (в пересчете на эритромицин); внутривенное введение: смесь 25-500 мг (в пересчете на эритромицин) инъекции по настоящему изобретению в 50-500 мл 0,9%-раствора NaCl для трансфузии или в 5%-растворе глюкозы, внутривенная инъекция, 1-2 раза в сутки.
Доза и применение для перорального введения (в пересчете на эритромицин): для животного или человека с массой тела 10-70 кг, как правило, составляет 50-500 мг/сутки, один раз в 6-8 ч.
Доза и применение для суппозитория (на основе эритромицина): как правило, 50-500 мг/сутки.
Краткое описание чертежей
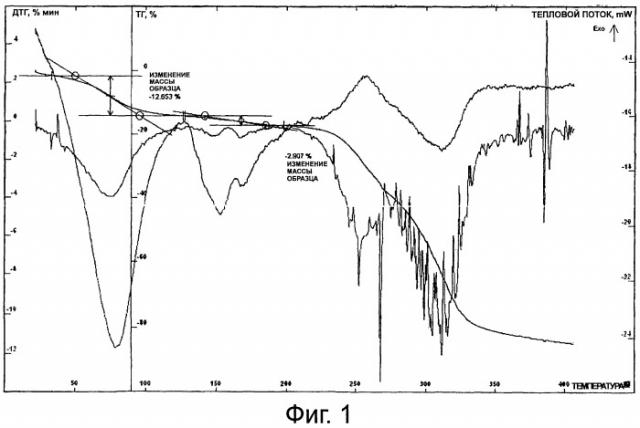
Фиг.1 представляет собой термограмму индекагидрата лактобионата эритромицина.
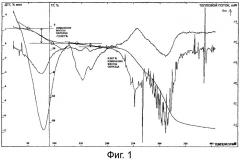
Фиг.2 представляет собой термограмму гексагидрата лактобионата эритромицина.
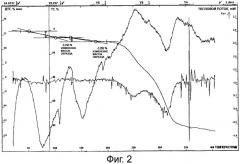
Фиг.3 представляет собой термограмму пентагидрата лактобионата эритромицина.
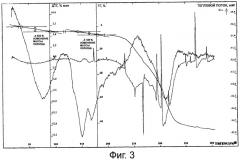
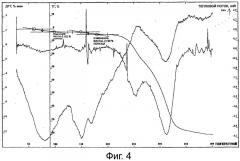
Фиг.4 представляет собой термограмму тригидрата лактобионата эритромицина.
Фиг.5 представляет собой термограмму тригидрата тиоцианата эритромицина.
Фиг.6 представляет собой термограмму дигидрата тиоцианата эритромицина.
Фиг.7 представляет собой термограмму гемитри(1,5)гидрата тиоцианата эритромицина.
Конкретные способы осуществления изобретения
Следующие примеры предлагаются для дополнительной иллюстрации настоящего изобретения, но подразумевается, что эти примеры ни в коей мере не ограничивают настоящее изобретение.
Пример 1. Получение ундекагидрата лактобионата эритромицина
B трехгорлую колбу добавляли 50 мл ацетона и 8 г эритромицина, встряхивали, добавляли лактобионовую кислоту или ее водный раствор и встряхивали при 5-35°C. После завершения реакции медленно добавляли безводный ацетон и смесь охлаждали до около -30-5°C. После выпадения осадка и его фильтрации осадок промывали с помощью безводного ацетона и фильтровали под пониженным давлением с получением грязно-белого кристаллического порошка, который был очень легко растворим в воде. ВЭЖХ: главный пик образца демонстрирует время удерживания, соответствующее времени удерживания контрольного эритромицина, в котором содержание эритромицина составило 56,79% (56,88%); температура плавления: 95,1-116,3°C (не корректировали), содержание воды по методу Карла Фишера составило 15,53% (теоретическое значение: 15,36%), ТГ: потеря массы на плато перед 200°C составила около 15,56% (см. фиг.1), MS(ESI) m/z: 1092, 734, 358. Элементный анализ: обнаружили: C 45,73, H 8,54, N 1,15; теоретические значения: C 45,61, H 8,67, N 1,09.
Пример 2. Получение гексагидрата лактобионата эритромицина
B трехгорлую колбу добавляли 50 мл ацетона и 10 г эритромицина, встряхивали, добавляли эквимолярное количество лактобионовой кислоты или ее раствора в смеси ацетон-вода при 10-40°C с встряхиванием, и реакцию проводили в течение 0,2-4 ч. После завершения реакции медленно добавляли ацетон за 1-8 раз. Смесь охлаждали до комнатной температуры -45°C - -10°C, фильтровали, полученный осадок промывали ацетоном, фильтровали под пониженным давлением и сушили при температуре около 80°C до получения грязно-белого порошка, который был очень легко растворим в воде. ВЭЖХ: главный пик образца имел время удерживания, соответствующее времени удерживания контрольного эритромицина, в котором содержание эритромицина составило 1,91% (теоретическое значение: 62,08%); температура плавления: 132,6-137,7°C (не корректировали); содержание воды (по методу Карла Фишера): 9,16%, ТГ: потеря массы на плато перед 200°C составила около 9,09% (теоретическое значение: 9,01%) (см. фиг.2), MS(ESI, FAB) m/z: 1092, 1091, 734, 733, 358, 357. Элементный анализ: обнаружили: C 49,11, H 8,55, N 1,21; расчетные: C 49,03, H 8,48, N 1,17. Полученный образец растворяли в воде, добавляли насыщенный раствор Na2CO3 до получения осадка, осадок отфильтровывали, промывали водой, перекристаллизовывали из воды-этанола, и продукт соответствовал исходцому эритромицину по части удельного оптического вращения и MS-данных.
Пример 3. Получение тригидрата лактобионата эритромицина
Лактобионовую кислоту и эритромицин 10 г в молярном соотношении (1:1) добавляли в реакционную колбу, добавляли воду, встряхивали и растворяли, поддерживая температуру на уровне 5-40°C. После завершения реакции 1 мл полученной смеси заполняли в каждую из 20 мл колб и охлаждали до -50°C в течение 0,5-6 ч. Температуру в холодильнике снижали до -55°C, вакуумировали, а затем повышали температуру до уровня около -16°C. Смесь выдерживали в течение около 28 ч при температуре около -16°C, и температуру дополнительно повышали до около 30°C и поддерживали в течение около 10 ч до получения грязно-белого порошка с выходом 99%. Полученный образец был очень легко растворим в воде. ВЭЖХ: главный пик имел время удерживания, соответствующее времени удерживания контрольного эритромицина; температура плавления: 137,2-138,7°C (не корректировали); содержание воды по методу Карла Фишера составило 4,67% (теоретическое значение: 4,72%), ТГ-ДТА