Способ введения sirna в клетки фотохимической интернализацией
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к способу введения молекулы siRNA в цитозоль клетки, и может быть использовано в медицине. Способ включает контактирование указанной клетки с молекулой siRNA, носителем и фотосенсибилизирующим веществом и облучение клетки светом с длиной волны, эффективной для активации фотосенсибилизирующего вещества. Носитель содержит катионный полиамин, выбранный из липополиамина в нелипосомальном составе, разветвленного полиэтиленимина (PEI), полимера бетациклодекстринамина, молекулы дендримера PAMAM и катионного пептида, выбранного из полиаргинина или сополимеры L- или D-аргинина. Способ используют для ингибирования экспрессии гена-мишени, получения клетки или популяции клеток, содержащей молекулы siRNA, а также для лечения или профилактики заболевания, в случае которого может быть полезным подавление одного или нескольких генов, в том числе для лечения злокачественной опухоли. Изобретение позволяет осуществить PCI-опосредованную сайт-специфическую доставку миРНК в цитозоль клетки. 9 н. и 18 з.п. ф-лы, 15 ил., 1 табл., 13 пр.
Реферат
Настоящее изобретение относится к способу введения короткой интерферирующей РНК (siRNA) в клетки, предпочтительно в цитозоль клеток, с использованием фотосенсибилизирующего вещества и молекулы носителя и облучения клеток светом с длиной волны, эффективной для активации фотосенсибилизирующего вещества, и к применению этого способа для изменения активности генов, например, для подавления генов in vitro или in vivo.
Процесс РНК-интерференции протекает во многих организмах и в этом процессе двухцепочечная некодирующая РНК посттрансляционно со специфичностью к последовательности подавляет экспрессию гена. В природе этот феномен защищает геном организма от чужеродных внедряющихся нуклеиновых кислот, таких как транспозоны, трансгены и вирусные гены.
Введение двухцепочечной РНК (dsRNA) в клетку запускает этот процесс подавления РНК, и любая мРНК в клетке с последовательностью, соответствующей введенной dsRNA, подвергается деградации. Каскады подавления РНК вовлекают превращение dsRNA в короткие интерферирующие РНК (siRNA), которые направляют рибонуклеазы на гомологичные мРНК-мишени. Фермент Dicer преобразуют dsRNA в siRNA, длина которых, как правило, составляет 20-25 нуклеотидов. Затем siRNA собираются в содержащие эндорибонуклеазу комплексы, известные как РНК-индуцированные комплексы подавления (RISC), которые направляются к комплементарным молекулам РНК, где они расщепляют и уничтожают мРНК-мишень. Небольшие количества dsRNA могут подавлять большое количество мРНК-мишени благодаря усиливающему компоненту подавления РНК (рассмотрено в Hannon and Rossi (2004), Nature 431, 371-378).
Знание о том, что молекулы siRNA являются ключевыми компонентами каскада, привело к тестированию химически синтезированных молекул siRNA длиной приблизительно от 20 до 22 пар оснований, соответствующих РНК- или ДНК-последовательностям-мишеням. Было показано, что эти молекулы действуют, нарушая экспрессию последовательностей-мишеней в клетках млекопитающих (Elbashir S.M. et al., (2001) Nature 411, 494-498). Как правило, siRNA длиной 20 нуклеотидов является достаточно длинной для индукции ген-специфичного подавления, но достаточно короткой для уклонения от ответа хозяина. Снижение экспрессии продуктов генов-мишеней может быть значительным с 90% подавлением, индуцированным несколькими молекулами siRNA.
Таким образом, технология siRNA была разработана в качестве общего способа, специфичного к последовательности подавления генов. Подавление генов имеет множество применений, как in vitro, так и in vivo, как в качестве инструмента исследования, так и в качестве терапевтической стратегии. Высокая эффективность и специфичность, которые можно наблюдать при применении технологии siRNA, делает эту технологию особенно привлекательной.
Во всех случаях, доставка молекул siRNA в клетки является большой проблемой, поскольку для того, чтобы произошло подавление гена, необходимо, чтобы молекулы siRNA проникли в клетку в достаточных концентрациях, чтобы они были пригодными. На силу подавляющего ответа и его длительность влияет количество siRNA, которое доставляют в клетку, и было показано, что посредством предоставления siRNA в достаточно высоких концентрациях, даже относительно слабая молекула siRNA молекула может подавлять свою мишень. Однако противовесом этого является тот факт, что известно, что введение больших количеств siRNA в клетку может приводить к нежелательным эффектам, таким как "не намеченные" эффекты (т.е. нежелательные изменения уровней экспрессии белка) или активация врожденных каскадов иммунной системы.
Как правило, siRNA доставляют в клетки с использованием стандартных протоколов трансфекции для нуклеиновых кислот, таких как протоколы с применением липосом, катионных липидов, анионных липидов и микроинъекции. siRNA представляет собой двухцепочечную молекулу и, по существу, доставка и клеточный захват молекулы являются более сложными, чем в случае антисмысловой молекулы, которая связывается с сывороточными белками для захвата клетками. Используют различные стратегии, и для этой цели существуют коммерчески доступные наборы. Как указано выше, эффективная трансфекция является высоко желательной, поскольку эффективность подавления гена по меньшей мере частично зависит от концентрации siRNA в клетке, однако введение в клетки в высоких концентрациях также может вызывать нежелательные побочные эффекты.
Введение на высоких уровнях часто требует высокой концентрации реагентов для трансфекции, и это может оказывать неблагоприятные эффекты на клетки, включающие сниженную жизнеспособность клеток и различные другие побочные эффекты, как фенотипические, так и нефенотипические. Более того, когда используют высокие концентрации реагентов, не достигают специфичной доставки.
Нацеленная доставка молекул нуклеиновых кислот, таких как siRNA, как правило, не является достаточно надежной. Для этой цели можно использовать вирусы, однако в случае этого подхода существует проблема безопасности, и системную вирусную доставку трудно достигнуть.
siRNA действует в цитозоле клеток, и для того, чтобы молекула действовала, необходимо, чтобы молекула достигала цитозоля. С учетом указанных выше соображений, может быть желательной разработка усовершенствованного способа доставки siRNA в цитозоль клетки. Желательные свойства такого усовершенствованного способа включают i) способность обеспечивать специфичную по времени и месту доставку молекул siRNA в место их действия, ii) избегание применения высоких концентраций реагента для трансфекции и/или siRNA и/или iii) усиленное siRNA-подавление в клеточных линиях. В частности, такие способы могут снизить общее количество комплексов siRNA:липид, требуемых для достижения определенного уровня подавления генов или его улучшения. В таких способах соотношение siRNA:реагент для трансфекции может быть изменено при сохранении определенной степени подавления гена или его улучшения. Повышение соотношения siRNA:липид является полезным, поскольку оно может минимизировать ингибиторные эффекты, которые наблюдают при применении высоких концентраций реагентов для трансфекции.
В целом, целью улучшенного способа альтернативно можно назвать желание сбалансировать необходимость в эффективной и контролируемой доставке siRNA в цитозоль со снижением неблагоприятных побочных эффектов, вызванных либо высокими концентрациями реагентов для трансфекции, либо неспецифичными эффектами, например, в конкретных типах клеток. Как указано выше, снижение общего количества комплексов siRNA:липид и/или повышение соотношения siRNA:липид может привести к достижению этой цели.
Для достижения этих целей, авторы изобретения объединили применение носителя (реагента для трансфекции) со способом фотохимической интернализации (PCI). Конкретный выбранный носитель доставляет молекулу siRNA во внутриклеточные компартменты клетки, например, эндоцитарные везикулы, такие как эндосома и/или лизосома клетки. Альтернативные внутриклеточные компартменты, в которые может захватываться комплекс siRNA:липид, включают аппарат Гольджи и эндоплазматическую сеть.
В результате способа PCI происходит высвобождение молекулы siRNA из внутриклеточной везикулы. Это зависит от воздействия на клетку фотосенсибилизирующего соединения и последующего облучения, и можно наблюдать, что высвобождение молекулы siRNA происходит только после облучения клетки и, по существу, это высвобождение в цитозоль, где опосредуются ее эффекты, можно подвергать пространственному или временному контролю. Только клетки, которые i) содержат siRNA в их внутриклеточных везикулах, ii) подвергнуты воздействию фотохимического интернализующего вещества и iii) подвергнуты облучению, будут высвобождать молекулу siRNA в цитозоль клетки, чтобы она действовала на мРНК в этой клетке.
Как правило, для оптимизации доставки siRNA в цитозоль реагенты для трансфекции необходимо использовать в высоких концентрациях. Авторы изобретения неожиданно обнаружили, что с использованием низких концентраций реагентов для трансфекции (и фотохимического интернализующего вещества), для направления siRNA во внутриклеточные везикулы, такие как эндосома, где она содержится до запуска ее высвобождения посредством применения облучения, можно использовать стадию трансфекции. Таким образом, способ позволяет siRNA достигать ее области действия без необходимости применения высоких концентраций реагента для трансфекции или siRNA. Более того, с использованием способа PCI можно контролировать время и место высвобождения молекулы siRNA из внутриклеточных везикул, таких как эндосома.
Таким образом, в первом аспекте, это изобретение относится к способу введения молекулы siRNA в цитозоль клетки, включающему контактирование указанной клетки с молекулой siRNA, носителем и фотосенсибилизирующим веществом и облучение клетки светом с длиной волны, эффективной для активации фотосенсибилизирующего вещества. После активации, внутриклеточные компартменты в указанной клетке, содержащие указанное фотосенсибилизирующее вещество, высвобождают siRNA, содержащуюся в этих компартментах, в цитозоль.
PCI представляет собой способ, в котором используется фотосенсибилизирующее вещество в сочетании со стадией облучения для активации этого вещества, и он обеспечивает высвобождение молекул, совместно введенных в клетку, в цитозоль клетки. Способ позволяет молекулам, которые захватываются в органеллы клетки, такие как эндосомы, после облучения высвобождаться из этих органелл в цитозоль.
Этот основной способ фотохимической интернализации (PCI) описан в WO 96/07432 и WO 00/54802, которые включены в настоящий документ в качестве ссылок. Как указано выше, молекула, подлежащая интернализации (которая для применения в соответствии с настоящим изобретением представляет собой молекулу siRNA), в этом случае с молекулой носителя, и фотосенсибилизирующее вещество подвергают контактированию с клеткой. Фотосенсибилизирующее вещество, молекула носителя и молекула, подлежащая интернализации, захватываются клеточным мембраносвязанным субкомпартментом в клетке. При воздействии на клетку света с соответствующей длиной волны активируется фотосенсибилизирующее вещество, которое прямо или непрямо создает активные частицы, которые разрушают мембраны внутриклеточного компартмента. Это позволяет интернализованной молекуле высвобождаться в цитозоль.
В этих способах используется фотохимический эффект в качестве механизма введения молекул, в ином случае не проникающих (или плохо проникающих) через мембрану в цитозоль клетки, который, таким образом, не приводит к распространенному разрушению клеток или гибели клеток, если способ пригодным образом скорректирован для избежания избыточной продукции токсичных частиц, например, посредством снижения времени освещения или дозы фотосенсибилизирующего вещества.
Этот способ является особенно преимущественным для введения siRNA в клетки, поскольку он позволяет применение более низких концентраций носителя или реагента для трансфекции и/или siRNA, чем необходимо в случае общепринятой трансфекции siRNA, достигая при этом ингибирования гена. Более того, время и место облучения для высвобождения молекулы siRNA можно контролировать так, чтобы она высвобождалась только в то время и в том месте, которые являются желательными для достижения требуемых эффектов. По существу, воздействие на клетки siRNA и носителя минимизируется, и минимизируются нежелательные побочные эффекты. Это является противоположностью стандартным способам введения siRNA в клетки, где невозможно контролировать время и место высвобождения siRNA и требуются высокие концентрации реагента для трансфекции. Посредством уменьшения количества носителя (изменения соотношения siRNA:носитель) по сравнению с количеством, которое принято применять, или посредством снижения общего количества комплексов siRNA:носитель, которые применяют для клетки, также можно минимизировать выход siRNA из внутриклеточных компартментов до облучения PCI.
Далее, было показано, что с использованием для доставки siRNA носителей, как определено в настоящем документе, с PCI, можно достигать существенных эффектов в отношении подавления гена, не вызывая одновременно с этим цитотоксичность. Например, при использовании PEI (ММ 25000) в количестве 1 мкг/мл с 100 нМ siRNA и доз света вплоть до 40 секунд, не было выявлено цитотоксических эффектов (см. фиг.11B). В этих условиях были выявлены значительные эффекты в отношении подавления гена (см. фиг.10).
РНК представляет собой полимер из рибонуклеотидов, каждый из которых содержит сахар рибозу совместно с фосфатной группой и азотистым основанием (как правило, аденином, гуанином, цитозином или урацилом). Как и в случае ДНК, РНК может образовывать комплементарные водородные связи, и РНК может быть двухцепочечной (dsRNA), одноцепочечной (ssRNA) или двухцепочечной с одноцепочечным выступающим концом. "Малые интерферирующие РНК" (siRNA) относятся к двухцепочечным молекулам РНК длиной от приблизительно 10 до приблизительно 30 нуклеотидов, которые специфично препятствуют экспрессии белка посредством связывания с молекулами мРНК. Предпочтительно, молекулы siRNA имеют длину 12-28 нуклеотидов, более предпочтительно 15-25 нуклеотидов, более предпочтительно 19-23 нуклеотидов и наиболее предпочтительно 21-23 нуклеотидов. Таким образом, длина предпочтительных молекул siRNA составляет 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28 или 29 нуклеотидов.
Длина одной цепи определяет длину молекулы siRNA. Например, siRNA, которая описана как siRNA длиной 21 рибонуклеотидов (21-мер), может содержать две противоположные цепи РНК, которые гибридизуются вместе с образованием 19 непрерывных пар. Два оставшихся рибонуклеотида на каждой цепи образуют выступающий конец. Когда siRNA содержит две цепи различной длины, длину siRNA определяет более длинная из цепей. Например, dsRNA, содержащая одну цепь длиной 21 нуклеотидов и вторую цепь длиной 20 нуклеотидов, составляет 21-мер.
Желательными являются siRNA, которые содержат выступающий конец. Выступающий конец может находиться на 5'- или 3'-конце цепи. Предпочтительно он находится на 3'-конце цепи РНК. Длина выступающего конца может варьировать, однако предпочтительно она составляет от приблизительно 1 до приблизительно 5 нуклеотидов, и более предпочтительно длина составляет приблизительно 2 нуклеотида. Предпочтительно, siRNA по настоящему изобретению будет содержать 3'-выступающий конец приблизительно из от 2 до 4 нуклеотидов. Более предпочтительно, 3'-выступающий конец имеет длину 2 рибонуклеотида. Более предпочтительно, 2 рибонуклеотида, содержащих 3'-выступающий конец, обладают урациловыми (U) основаниями.
siRNA конструируют для взаимодействия с рибонуклеотидной последовательностью-мишенью, иными словами они комплементарны последовательности-мишени, чтобы они связывались с последовательностью-мишенью, т.е. одна цепь siRNA комплементарна участку последовательности-мишени.
Также были созданы молекулы siRNA, имеющие модифицированные остовы для повышения их времени полужизни (например, как описано в Chiu et al., (2003), RNA. 9(9), 1034-48 и Czauderna et al., (2003), Nucleic Acids Research 31, 2705-2716). Таким образом, термин "siRNA" также включает такие модифицированные молекулы. Указание на siRNA, таким образом, охватывает производные или варианты siRNA, которые проявляют ту же функцию, т.е. взаимодействие с последовательностью мРНК-мишени. Предпочтительные варианты включают варианты, в которых используют модифицированный остов (как указано выше) или одно или несколько не встречающихся в природе оснований.
Способ можно использовать для внесения более чем одного типа молекулы siRNA в клетку. Иными словами, одновременно в клетку можно вводить молекулы siRNA, имеющие различные последовательности. Если введению подлежит множество молекул siRNA, его можно осуществлять одновременным связыванием более чем одной молекулы siRNA с носителем. Альтернативно, каждый тип молекулы siRNA можно отдельно связывать с носителем.
Существует несколько способов получения siRNA, таких как химический синтез, транскрипция in vitro, экспрессирующие siRNA векторы и экспрессирующие кассеты ПЦР. Такие способы хорошо известны в данной области. См., например, Pon et al., (2005) Nucleosides Nucleotides Nucleic Acids. 24(5-7): 777-81, Du et al., (2006), Biochem. Biophys. Res. Commun. 345(1):99-105 и Katoh et al., (2003), Nucleic Acids Res Suppl. (3): 249-50.
Аналогично способы конструирования молекул siRNA для достижения требуемого результата хорошо документированы. Сначала необходимо выбрать участок-мишень siRNA. Это можно сделать с использованием различных способов (см., например, Jagla et al., (2005), RNA. 11(6):864-72 и Takasaki et al., (2006), Comput. Biol. Chem. 30(3):169-78).
Способ по этому изобретению обеспечивает перемещение молекулы siRNA в цитозоль. Однако будет понятно, что захват каждой молекулы, контактирующей с клеткой, недостижим. Однако является достижимым значительный и повышенный захват относительно фоновых уровней, когда не используют PCI или носитель.
Предпочтительно способы по этому изобретению позволяют захват молекул siRNA на достаточных уровнях, так что их эффект очевиден в экспрессируемых продуктах этих клеток. Для достижения этой цели, можно корректировать соответствующую концентрацию siRNA, подлежащей контакту с клеткой, например, для достижения снижения экспрессии гена-мишени по меньшей мере на 10%, например, снижения по меньшей мере на 20, 30, 40, 50, 60, 70, 80 или 90% (например, в экспрессии одного или нескольких белков, кодируемых геном-мишенью) после инкубации с клетками в течение, например, 24, 48, 72 или 96 часов (например, от 24 до 48 часов). Аналогично, для достижения снижения, указанного выше, можно корректировать тип и/или концентрацию носителя, тип и/или концентрацию фотосенсибилизирующего вещества и время облучения.
Его можно измерять посредством определения уровня белка в клетке с использованием стандартных способов, известных в данной области, таких как Вестерн-блоттинг. Уровень снижения белка зависит от времени полужизни белка, т.е. ранее существующий белок будет удален в соответствии с его временем полужизни. Таким образом, достигают снижения экспрессии по меньшей мере на 10, 20, 30, 40, 50, 60, 70, 80 или 90% относительно экспрессии в тот же момент времени без siRNA с учетом времени полужизни.
Альтернативно его можно измерять с точки зрения эффекта молекулы siRNA на количество мРНК, которое присутствует в клетке, например, способ можно проводить для достижения снижения уровней мРНК по меньшей мере на 10%, например, снижения по меньшей мере на 20, 30, 40, 50, 60, 70, 80 или 90% после инкубации с клетками в течение, например, 24, 48, 72 или 96 часов, например, от 24 до 48 часов, относительно уровней мРНК последовательности-мишени в тот же момент времени без siRNA. Также его можно измерять с использованием стандартных способов, известных в данной области, таких как способы гибридизации или блоттинга и ОТ-ПЦР.
Поскольку настоящие способы требуют применения значительно меньшего количества носителя или вещества для трансфекции (и/или меньшего количества siRNA, в зависимости от того, подлежит ли снижению общее количество комплексов, или подлежит модификации соотношение siRNA:носитель или вещество для трансфекции, или оба из них), чем в стандартных способах трансфекции молекул siRNA, также улучшение трансфекции можно выражать с использованием способа по этому изобретению с точки зрения количества носителя или вещества для трансфекции, которые требуются для достижения определенной степени снижения экспрессии белка или уровней мРНК. Например, способ по этому изобретению предпочтительно позволяет определенное снижение экспрессии белка-мишени или уровней мРНК (например, по меньшей мере на 10%, например, по меньшей мере на 20, 30, 40, 50, 60, 70, 80 или 90%, как описано выше) с использованием концентрации носителя и/или концентрации siRNA, которые, например, по меньшей мере на 10, 20, 30, 40, 50 или 60% ниже количества носителя, которое требуется для достижения того же уровня снижения экспрессии белка-мишени или уровней мРНК без PCI.
Сравнения также можно проводить между уровнями снижения экспрессии белка или уровнями мРНК, которые наблюдают при определенной концентрации siRNA и носителя, в присутствии и отсутствие PCI. Например, способ по этому изобретению предпочтительно позволяет снижение экспрессии белка-мишени или уровней мРНК по меньшей мере на 10%, например, по меньшей мере на 20, 30, 40, 50, 60, 70, 80 или 90%, как описано выше, по сравнению с экспрессией белка или уровнями мРНК, обеспечиваемыми проведением способа в отсутствие стадии облучения технологии PCI.
Термин "клетка" используют в настоящем документе с включением всех эукариотических клеток (в том числе клеток насекомых и клеток грибов). Таким образом, репрезентативные "клетки" включают все типы относящихся и не относящихся к млекопитающим клеток животных, клеток растений, клеток насекомых, клеток грибов и простейших. Однако предпочтительно клетки представляют собой клетки млекопитающих, например, клетки кошек, собак, лошадей, ослов, овец, свиней, коз, коров, мышей, крыс, кроликов, морских свинок, но наиболее предпочтительно человека.
Как используют в настоящем документе, "контактирование" относится к осуществлению физического контакта клеток и фотосенсибилизирующего вещества и/или siRNA и носителя друг с другом в условиях, пригодных для интернализации в клетки, например, предпочтительно при 37ºC в соответствующей питательной среде, например, при 25-39ºC.
Фотосенсибилизирующее вещество представляет собой вещество, которое активируется при освещении с соответствующей длиной волны и интенсивностью с образованием активированных частиц. Удобно, чтобы такое вещество могло представлять собой вещество, которое локализуется во внутриклеточных компартментах, в частности, в эндосомах или лизосомах. Ряд таких фотосенсибилизирующих веществ известен в данной области, и они описаны в литературе, в том числе в WO 96/07432, которая включена в настоящий документ в качестве ссылки. В этом отношении можно упомянуть ди- и тетрасульфонированный фталоцианин алюминия (например, AlPcS2a), сульфонированные тетрафенилпорфины (TPPSn), "нильский голубой", производные хлорина e6, уропорфирин I, филлоэритрин, гематопорфирин и метиленовый синий, которые, как было показано, локализуются в эндосомах и лизосомах клеток в культуре. В большинстве случаев это является следствием эндоцитарного захвата фотосенсибилизирующего вещества. Таким образом, фотосенсибилизирующее вещество предпочтительно представляет собой вещество, которое захватывается во внутренние компартменты клетки, например, лизосомы и/или эндосомы. Дальнейшие соответствующие фотосенсибилизирующие вещества для применения в этом изобретении описаны в WO 03/020309, которая также включена в настоящий документ в качестве ссылки, а именно сульфурированные мезотетрафенилхлорины, предпочтительно TPCS2a.
Однако также можно использовать другие фотосенсибилизирующие вещества, которые расположены в других внутриклеточных компартментах, например, в эндоплазматической сети или аппарате Гольджи. Также удобно, чтобы могли функционировать механизмы, в которых эффекты фотохимической обработки оказываются на другие компоненты клетки (т.е. на компоненты, отличные от ограниченных мембраной, т.е. заключенных в мембрану компартментов). Таким образом, например, одна возможность может состоять в том, чтобы фотохимическая обработка разрушала молекулы, важные для внутриклеточного транспорта или слияния везикул. Такие молекулы необязательно могут быть расположены в ограниченных мембраной компартментах, однако фотохимическое повреждение таких молекул, тем не менее, может привести к фотохимической интернализации комплексов носитель:siRNA, например, посредством механизма, в котором фотохимические эффекты на такие молекулы приводят к сниженному транспорту молекулы, подлежащей интернализации (т.е. молекулы siRNA), в деградирующие везикулы, такие как лизосомы, так что молекула, подлежащая интернализации, может быть выделена в цитозоль до деградации.
Примерами молекул, необязательно расположенных в ограниченных мембраной компартментах, являются несколько молекул системы транспорта микротрубочек, такие как динеины и компоненты динактина; и, например, rab5, rab7, чувствительный к N-этилмалеинимиду фактор (NSF), растворимый белок присоединения NSF (SNAP) и т.д.
Классы пригодных фотосенсибилизирующих веществ, которые можно упомянуть, таким образом, включают порфирины, фталоцианины, пурпурины, хлорины (в частности, производные хлорина с порфиринами, описанные ниже), бензопорфирины, лизосомотропные слабые основания, нафталоцианины, катионные красители и тетрациклины или их производные (Berg et al., (1997), J. Photochemistry and Photobiology, 65, 403-409). Другие пригодные фотосенсибилизирующие вещества включают тексафирины, феофорбиды, порфицены, бактериохлорины, кетохлорины, производные гематопорфирина и их производные, эндогенные фотосенсибилизирующие вещества, индуцируемые 5-аминолевулиновой кислотой и их производные, димеры или другие конъюгаты между фотосенсибилизирующими веществами.
Предпочтительные фотосенсибилизирующие вещества включают TPPS4, TPPS2а, AlPcS2а, TPCS2a и другие амфофильные фотосенсибилизирующие вещества. Другие пригодные фотосенсибилизирующие вещества включают соединение 5-аминолевулиновой кислоты или сложные эфиры 5-аминолевулиновых кислот или их фармацевтически приемлемые соли.
"Облучение" клетки для активации фотосенсибилизирующего вещества относится к применению света прямо или непрямо, как описано в настоящем документе далее. Таким образом, клетки можно освещать с помощью источника света, например, прямо (например, на отдельных клетках in vitro) или непрямо, например, in vivo, когда клетки расположены под поверхностью кожи или находятся в форме слоя клеток, не все из которых прямо освещаются, т.е. без экрана из других клеток.
В этом способе, молекулу siRNA, подлежащую введению в клетку, связывают или ассоциируют или конъюгируют с одной или несколькими молекулами носителя или веществами для трансфекции, которые действуют, облегчая или повышая захват фотосенсибилизирующего вещества или молекулы siRNA в клетку. Это присоединение, ассоциацию или конъюгацию можно проводить перед контактированием молекулы siRNA и ее носителя с клеткой или во время указанного контакта посредством контактирования этих молекул.
Термины носитель и вещество для трансфекции используют в настоящем документе взаимозаменяемо.
Молекула носителя может быть ассоциирована, связана или конъюгирована с молекулой siRNA или как с siRNA, так и с фотосенсибилизирующим веществом. Таким образом, например, siRNA может быть присоединена к носителю посредством заряд-зарядных взаимодействий. Как упоминалось выше, одновременно можно использовать более одного носителя, и носитель может быть ассоциирован, связан или конъюгирован более чем с одной молекулой siRNA, или более чем с одним типом молекулы siRNA.
Предпочтительно носитель содержит соединение, предпочтительно в нелипосомальном составе, которое содержит две или более групп аминов, т.е. является полиамином и которое является катионным и предпочтительно протонируемым (т.е. может быть протонировано, чтобы оно имело один или несколько дополнительных атомов водорода в пригодных условиях реакции) при различных значениях pH. Различные значения pH приводят к различным величинам протонируемых атомов в отдельных молекулах и/или в различных молекулах.
Термин "протонируемый" используют в настоящем документе для обозначения того, что группа способна акцептировать атом водорода, т.е. протонируемая группа представляет собой акцептирующую водород группу. Очевидно, что способность группы акцептировать водород зависит не только от структуры группы, но и также от значения pH, которое воздействует на группу. Предпочтительно, указанная протонируемая группа содержит атом азота и он представляет собой атом, который акцептирует атом водорода.
Как обозначают в настоящем документе, "катионный" означает, что общий, или суммарный, заряд молекулы составляет +1 или более. Его предпочтительно измеряют при физиологическом значении pH, т.е. при pH 7,2. Молекула может иметь более высокий заряд, например, +2 или более, +3 или более, +4 или более, +5 или более, +6 или более, +7 или более, +8 или более, +9 или более, +10 или более, +11 или более, +12 или более, +13 или более, +14 или более, +15 или более, +20 или более, +25 или более, +50 или более, +75 или более, +100 или более, +150 или более, +200 или более, +250 или более, +300 или более, +400 или более, +500 или более, +750 или более, или +1000 или более.
Катионные полиамины для применения в соответствии со способами по этому изобретению являются такими, как определено ниже, и они включают
(a) липополиамин в нелипосомальном составе,
(b) полиэтиленимин (PEI), имеющий значение Mn 500-20000 по GPC,
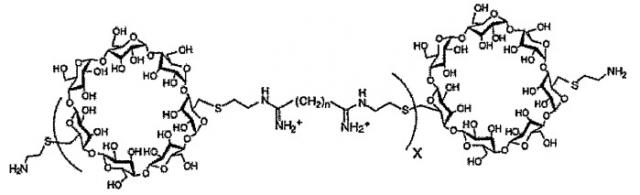
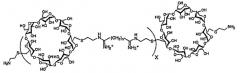
(c) полимер бетациклодекстринамина формулы
где X представляет собой целое число от 1 до 100, включительно, и n представляет собой целое число от 4 до 10, включительно,
(d) дендример, содержащий группу амина, и
(e) катионный пептид.
Предпочтительно, полиамин, как обозначают в настоящем документе, содержит группы первичных или вторичных аминов, или их смесь (например, по меньшей мере две группы первичных аминов). Предпочтительно, участок полиамина имеет по меньшей мере 2, 3, 4, 5 или 6 атомов азота и заряд по меньшей мере +1, +2, +3, +4 или +5 (или по меньшей мере +6, +7, +8, +9, +10, +11, +12, +13, +14, +15, +20, +25, +50, +75, +100, +150, +200, +250, +300, +400, +500, +750 или +1000) при физиологических значениях pH, например, некоторые или все из аминогрупп являются заряженными. Предпочтительно по меньшей мере одна (например, по меньшей мере 2, 3 или 4) азотсодержащая группа, например, NH, является незаряженной при физиологических значениях pH. Значение pKa, при котором последний амин полиамина является протонированным, например, липополиамина, предпочтительно составляет приблизительно 5,5, т.е. при снижении pH, или добавлении кислых соединений, последний амин, подлежащий протонированию, протонируется при pH, меньшем или равном 5,5.
В одном варианте осуществления носитель содержит липополиамин в нелипосомальном составе. Под липополиамином подразумевают амфифильную молекулу, содержащую по меньшей мере одну гидрофильную область полиамина (т.е. которая содержит две или более групп аминов) и одну липофильную область. Липофильная область может содержать одну или несколько липофильных цепей.
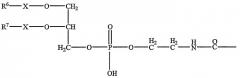
Область полиамина в липополиамине предпочтительно имеет формулу (I)
в которой m представляет собой целое число, превышающее или равное 2, и n представляет собой целое число, превышающее или равное 1, возможно, чтобы m варьировало между различными углеродсодержащими группами, включенными между двумя аминами, т.е. каждая группа (CH)m-NH может иметь отличающуюся величину m, и m может быть одинаковым или может отличаться, когда оно встречается в указанной формуле. В каждом положении R1 представляет собой водород или соединительную группу для липо-части липополиамина или саму липо-часть, как описано в настоящем документе далее, и он может быть одинаковым или может отличаться у каждого атома углерода. R2 представляет собой водород или соединительную группу для липо-части липополиамина или саму липо-часть, как описано в настоящем документе далее. Предпочтительно, m составляет между 2 и 6, включительно, более предпочтительно 3 или 4, и n составляет между 1 и 5, включительно, более предпочтительно 3.
Предпочтительно только один из R1 и R2 является соединительной группой, соединительной группой, присоединенной к липо-части полиамина, или липо-частью полиамина. Предпочтительно только одна группа R1 представляет собой соединительную группу, соединительную группу, присоединенную к липо-части полиамина, или липо-часть полиамина. R2 предпочтительно представляет собой H.
Когда R1 или R2 представляет собой саму липо-часть или представляет собой соединительную группу, которая присоединена к липо-части полиамина, формула (I) представляет собой липополиамин. Таким образом формула (I) представляет собой область полиамина, только когда R1 или R2 представляют собой не липо-часть или не соединительную группу, к которой присоединена липо-часть.
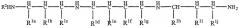
Более предпочтительно, область полиамина соответствует следующей формуле
где R2 и от R1a до R1j являются такими, как R1, определенный выше, и предпочтительно R1a представляет собой соединительную группу и остальные группы R1 и R2 представляют собой водород.
Соединительная группа содержит связи, которые стабильны при нормальных условиях.
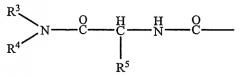
Предпочтительно R1 или R2 представляют собой атом водорода или радикал общей формулы II:
в которой каждый R3 и R4, которые могут быть идентичными или могут отличаться, представляет собой насыщенный алифатический радикал Cp H2p+2 или ненасыщенный алифатический радикал Cp H2p или Cp H2p-2, причем p представляет собой целое число между 12 и 22, включительно, и R5 представляет собой атом водорода или алкильный радикал, содержащий от 1 до 4 атомов углерода, необязательно замещенных фенильным радикалом.
Альтернативно каждый R1 или R2 может представлять собой радикал общей формулы III:
в которой X представляет собой группу метилена (-CH2-) или карбонильную группу (-CO-), и каждый R6 и R7, которые могут быть идентичными или могут отличаться, представляет собой насыщенный алифатический радикал Cp' H2p'+2 или ненасыщенный алифатический радикал Cp' H2p' или Cp' H2p'-2, причем p' представляет собой целое число между 11 и 21, включительно.
Независимо от величин m и n, только один из символов R1 и R2 может представлять собой радикал общей формулы (II) или (III).
Когда n составляет между 2 и 5, значения m в различных фрагментах
могут быть идентичными или могут отличаться.
В предпочтительном варианте осуществления формулы (I) n равно 3, и значения m во фрагментах
являются идентичными или отличаются и составляют 3 или 4, и либо R1, либо R2 представляет собой: либо радикал общей формулы (II), в котором каждый R3 и R4 представляет собой алкильный радикал, содержащий от 12 до 22 атомов углерода, и R5 представляет собой атом водорода, или либо R1, либо R2 представляет собой радикал общей формулы (III), в котором каждый R6-X- и R7-X- представляет собой алканоильный радикал, содержащий от 12 до 22 атомов углерода.
Особенно предпочтительными являются 5-карбоксиспермилглициндиоктадециламид (DOGS) и 5-карбоксиспермиламид дипальмитоилфосфатидилэтаноламина (DPPES).
Синтез указанных выше липополиаминов описан в US 5476962.
Следующие примеры липополиаминов для применения в соответствии с этим изобретением включают трифторацетат 2,3-диолеилокси-N-[2-сперминкарбоксииламидо]этил-N,N-диметил-1-пропанаминия (DOSPA), 1,3-диолеилокси-2-(6-карбоксиспермин) пропиламида (DOSPER) и RPR-120535 (Ahmed et al. (2005) Pharmaceutical Research 22 (6), 972-980). Структуры предпочтительных липополиаминов указаны на фиг.7.
В DOSPA соединительная группа представляет собой
В DOSPER соединительная группа представляет собой
И указанные выше структуры, таким образом, представляют собой дальнейшие пригодные примеры соединительных групп.
Липофильная область может быть такой, как определено выше для R3, R4, R5 или R6, или она может представлять собой любую насыщенную или ненасыщенную углеводородную цепь, холестерин или другой стероид, природный липид или синтетический липид, способный образовывать ламеллярную или гексагональную фазы. Длина углеводородной цепи может составлять от 10 до 30 атомов углерода, например, 12-28, 14-26, 16-24, 18-22 атомов углерода.
Носитель предпочтительно представляет собой JetSITM или JetSI-ENDOTM, оба из которых доступны от Polyplus transfection. Альтернативно, носитель может представлять собой Transfectam®, доступный от Promega.