Способ получения раствора, содержащего высокомолекулярные изолированные капсульные полисахариды streptococcus pneumoniae серотипа 19а (варианты)
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и касается способов получения раствора, содержащего высокомолекулярные изолированные капсульные полисахариды Streptococcus pneumoniae серотипа 19А. Представленные способы включают получение ферментационной культуры бактериальных клеток Streptococcus pneumoniae; ферментирование упомянутой ферментационной культуры не более 6 часов; лизис бактериальных клеток с получением раствора капсульных полисахаридов Streptococcus pneumoniae серотипа 19А, имеющих молекулярную массу, по крайней мере, 480 кДа, в клеточном лизате; и выделение таких капсульных полисахаридов из клеточного лизата с получением раствора капсульных полисахаридов Streptococcus pneumoniae серотипа 19А. В другом способе в ферментационную культуру дополнительно вводится СO2. Представленные изобретения позволяют выделять из клеточных лизатов Streptococcus pneumoniae серотипа 19А капсульные полисахариды определенного размера. 2 н. и 12 з.п. ф-лы, 6 ил.,7 табл., 1 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к способам получения изолированных капсульных полисахаридов Streptococcus pneumoniae серотипа 19А путем контроля времени сбора.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Для получения поливалентных конъюгированных пневмококковых вакцин, направленных на профилактику инвазивных заболеваний, вызванных микроорганизмом Streptococcus pneumoniae (также известный как пневмококк), выращивали выбранные серотипы Streptococcus pneumoniae, чтобы получить полисахариды, необходимые для производства вакцины. Клетки выращивали в ферментаторе с лизисом индуцированным в конце ферментации прибавлением деоксихолата натрия или альтернативного лизирующего агента. Бульон лизата потом собирали для очистки выходного потока и восстановления капсульных полисахаридов, которые окружают бактериальные клетки. После конъюгации с белком-носителем полисахарид был включен в заключительный продукт вакцины и обладал иммуногенными свойствами в вакцинируемой популяции в отношении выбранных серотипов Streptococcus pneumoniae.
Размер полисахарида - качественный признак, который оценивается в каждой партии препарата и должен соответственно контролироваться. Относительно полисахарида серотипа 19А Streptococcus pneumoniae размер полисахарида может зависеть от параметров, таких как рН ферментации, температура ферментации и поддерживаемая температура. Кроме того, тепловая деградация 19А полисахаридов происходит вследствие ферментации/восстановления и процессов очистки, которые обеспечивают дополнительный вызов успешной адресации и управление различными параметрами, которые прогрессивно увеличивают процессы крупномасштабного производства 19А полисахаридов.
Соответственно необходимы улучшенные способы выделения высокомолекулярных капсульных полисахаридов серотипа 19А из клеточных лизатов Streptococcus pneumoniae.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Обеспечиваются способы получения растворов высокомолекулярных капсульных полисахаридов серотипа 19А из клеточных лизатов Streptococcus pneumoniae. В одном способе ферментационная культура бактериальных клеток Streptococcus pneumoniae, которая продуцирует капсульные полисахариды серотипа 19А, ферментируется не более 6 часов перед лизисом бактериальных клеток, и капсульные полисахариды собирают. Соответственно в одном варианте реализации изобретения способ включает стадии: 1) получение ферментационной культуры бактериальных клеток Streptococcus pneumoniae, которые продуцируют капсульные полисахариды серотипа 19А; 2) ферментирование ферментационной культуры не более 6 часов; 3) лизис бактериальных клеток в ферментационной культуре и 4) выделение капсульных полисахаридов Streptococcus pneumoniae серотипа 19А из ферментационной культуры; посредством чего был получен раствор, содержащий изолированные высокомолекулярные капсульные полисахариды Streptococcus pneumoniae cepoтипа 19А. В специфическом варианте реализации ферментационная культура ферментирована не более 5 часов. В дополнительном варианте реализации ферментационная культура ферментирована не более 4 часов. В другом варианте реализации ферментационная культура ферментирована 3-6 часов. В другом варианте реализации молекулярная масса изолированных капсульных полисахаридов Streptococcus pneumoniae составляет, по крайней мере, 480 кДа.
В другом варианте реализации данного изобретения способ также включает введение CO2 в ферментационную культуру бактериальных клеток, которые продуцируют полисахариды Streptococcus pneumoniae серотипа 19А. Соответственно в одном варианте реализации способ данного изобретения включает стадии: 1) получение ферментационной культуры бактериальных клеток Streptococcus pneumoniae, которые продуцируют капсульные полисахариды серотипа 19А; 2) введение CO2 в ферментационную культуру; 3) ферментирование ферментационной культуры не более 6 часов; 4) лизис бактериальных клеток в ферментационной культуре и 5) выделение капсульных полисахаридов Streptococcus pneumoniae серотипа 19А из ферментационной культуры; посредством чего был получен раствор, содержащий изолированные высокомолекулярные капсульные полисахариды Streptococcus pneumoniae серотипа 19А. В специфическом варианте реализации введение CO2 в ферментационную культуру включает прибавление бикарбонатного иона (HCO3 -) к ферментационной культуре, например прибавление NaHCO3 (бикарбонат натрия) к ферментационной культуре. В дополнительном варианте реализации введение CO2 в ферментационную культуру включает прибавление карбонатного иона (CO3 2-) к ферментационной культуре, например прибавление Na2CO3 (карбонат натрия) к ферментационной культуре. В другом варианте реализации введение CO2 в ферментационную культуру включает первое прибавление NaHCO3 и второе прибавление Na2CO3. В еще одном варианте реализации введение CO2 в ферментационную культуру включает покрытие ферментационной культуры CO2. В другом варианте реализации молекулярная масса изолированных капсульных полисахаридов Streptococcus pneumoniae составляет, по крайней мере, 480 кДа.
КРАТКОЕ ОПИСАНИЕ ФИГУР
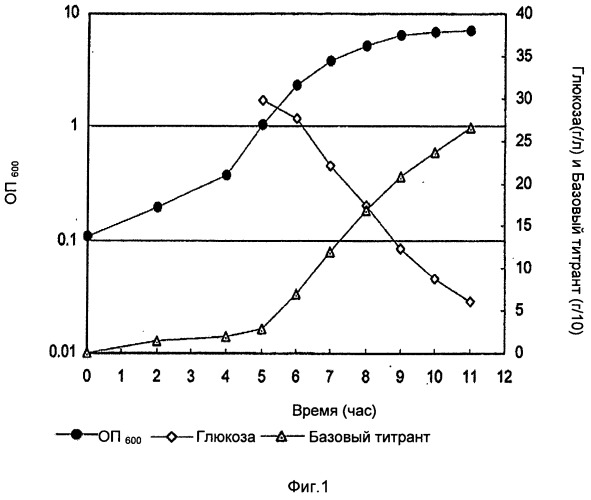
Фигура 1 показывает оптическую плотность (ОП), базовый уровень и уровень глюкозы во время фазы ферментации с Na2CO3, в качестве базового титранта, из лабораторных исследований до 3 л масштаба. Базовый титрант в граммах разделен на 10 для построения графика.
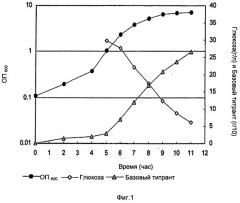
Фигура 2 показывает оптическую плотность (ОП), базовый уровень и уровень глюкозы во время фазы ферментации с NaOH, в качестве базового титранта, из лабораторных исследований до 3 л масштаба. Базовый титрант в граммах разделен на 10 для построения графика.
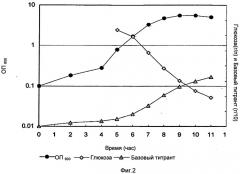
Фигура 3 показывает общий уровень белка и полисахарида при различных корректировках рН к дополнительной основной подаче Na2CO3 или NaOH.
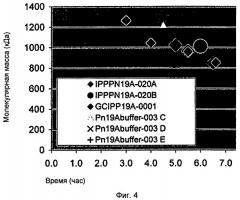
Фигура 4 показывает молекулярную массу как функцию времени сбора в производстве 19А полисахаридов.
Фигура 5 показывает определенный базовый расход от времени на оптическую плотность (ОП) как функцию времени сбора в производстве 19А полисахаридов. Базовый титрант в граммах разделен на 10 для построения графика.
Фигура 6 показывает молекулярную массу как функцию использования определенного базового титранта в производстве 19А полисахаридов.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Streptococcus pneumoniae - грамположительные, ланцетоподобные кокки, которые обычно находятся в парах (диплококки), но также и в коротких цепях или как отдельные клетки. Они легко растут на чашке с кровяным агаром блестящими колониями и показывают альфа-гемолиз, если только выращены анаэробно, где они показывают бета-гемолиз. Клетки большинства серотипов пневмококков имеют капсулу, которая покрывает каждую клетку. Эта капсула - детерминанта вирулентности у людей, поскольку интерферирует с фагоцитозом, препятствуя антителам присоединяться к бактериальным клеткам. В настоящее время идентифицировано более чем 90 известных серотипов капсульных полисахаридов, с 23 самыми общими серотипами, составляющими приблизительно 90% инвазивных заболеваний во всем мире.
Как вакцина, полисахаридная оболочка пневмококков может предоставить необходимую степень иммунности к Streptococcus pneumoniae у людей с развитой или неослабленной иммунной системой, но конъюгированный белок с полисахаридом допускает иммунную реакцию у детей и пожилых, которые имеют риск пневмококковой инфекции. Пневмококковые клетки выращивали в ферментаторе с индуцированным лизисом в конце ферментации. Бульон лизата потом собирали для очистки выходного потока и восстановления капсульных полисахаридов.
Размер полисахарида - качественный признак, оцененный для каждой партии препарата, и должен соответственно контролироваться. Молекулярная масса капсульных полисахаридов серотипа 19А зависит от параметров процесса ферментации. Способы данного изобретения позволяют восстановлению капсульных полисахаридов высокой молекулярной массы серотипа 19А от клеточных лизатов Streptococcus pneumoniae.
В развитии настоящих способов концентрация HySoy и выбор базового титранта были модифицированы в попытке изменить заключительный выход полисахаридов и молекулярные массы. Были проверены четыре схемы ферментации. В первой использовался базовый NaOH процесс с 28 г/л HySoy. Во второй использовался 20% карбонат натрия в качестве базового титранта и 20 г/л HySoy. В третьей скомбинированы преимущества первых двух подходов введением карбоната путем порционирования бикарбоната натрия и используя смешанный NaOH/карбонат в качестве базового титранта. В четвертом подходе использовался карбонат в качестве базового титранта с прибавлением 10 мМ бикарбоната, чтобы поддержать рост.
Использование NaOH как базового титранта во время ферментации давало возможность снизить деоксихолат лизата до рН 5,0, без вспенивания, чтобы удалить белок и улучшить фильтрацию, но привело к более низкой молекулярной массе полисахарида (<450 кДа). Na2CO3 обеспечил более высокую молекулярную массу, но имел результатом вспенивание, если рН деоксихолата лизата был снижен. На стадии удержания более высокого рН-6,6 ферментация с использованием Na2CO3 привела к образованию гелеподобного материала с последующими проблемами фильтрации. Минимизация количества Na2CO3 при использовании смеси NaOH и Na2CO3 в качестве рН титранта обеспечила преимущества величины молекулярной массы при Na2CO3, устраняя вспенивание и проблемы фильтрации из-за непредвиденного высвобождения большого количества CO2. Использование 20% Na2CO3 (масс./об.) в качестве базового титранта с прибавлением 10 мМ NaHCO3, чтобы поддержать рост (четвертый подход), привело к выходу однородных высокомолекулярных полисахаридов.
В дополнение к концентрации HySoy и базовому титранту был также изучен эффект времени сбора на молекулярную массу капсульного полисахарида Streptococcus pneumoniae серотипа 19А. Было найдено, что обеспечение ферментирования ферментационной культуры не более 6 часов перед лизисом бактериальных клеток привело к высокой молекулярной массе капсульных полисахаридов серотипа 19А в клеточных лизатах Streptococcus pneumoniae.
Данное изобретение, таким образом, обеспечивает улучшенные способы выделения высокомолекулярных капсульных полисахаридов серотипа 19А из клеточных лизатов Streptococcus pneumoniae. В одном из способов предоставлен способ получения раствора, содержащего изолированные капсульные полисахариды с высокой молекулярной массой Streptococcus pneumoniae серотипа 19А, который включает стадии: 1) получение ферментационной культуры бактериальных клеток Streptococcus pneumoniae, которые продуцируют капсульные полисахариды серотипа 19А; 2) ферментирование ферментационной культуры не более 6 часов; 3) лизис бактериальных клеток в ферментационной культуре; и 4) выделение капсульных полисахаридов Streptococcus pneumoniae серотипа 19А из ферментационной культуры; посредством чего был получен раствор, содержащий изолированные высокомолекулярные капсульные полисахариды Streptococcus pneumoniae серотипа 19А.
В определенных вариантах реализации изобретения ферментационная культура ферментирована в течение приблизительно не более 7 часов, приблизительно не более 6,5 часов, приблизительно не более 6 часов, приблизительно не более 5,5 часов, приблизительно не более 5 часов, приблизительно не более 4,5 часов, приблизительно не более 4 часов или приблизительно не более 3,5 часов. В другом варианте реализации ферментационная культура ферментирована между 3 часами и 7 часами, между 3 часами и 6,5 часами, между 3 часами и 6 часами, между 3 часами и 5,5 часами, между 3 часами и 5 часами, между 3 часами и 4,5 часами, между 3 часами и 4 часами, или между 3 часами и 3,5 часами. В другом варианте реализации данное изобретение относится к раствору, содержащему капсульные полисахариды высокой молекулярной массы Streptococcus pneumoniae серотипа 19А, где раствор получен способом, описанным выше.
В другом варианте реализации способ данного изобретения также включает введение CO2 в ферментационную культуру бактериальных клеток, которые продуцируют полисахариды Streptococcus pneumoniae серотипа 19А, который включает стадии: 1) получение ферментационной культуры бактериальных клеток Streptococcus pneumoniae, которые продуцируют капсульные полисахариды серотипа 19А; 2) поставку CO2 ферментационной культуре; 3) ферментирование ферментационной культуры не более 6 часов; 4) лизис бактериальных клеток в ферментационной культуре и 5) выделение капсульных полисахаридов Streptococcus pneumoniae серотипа 19А из ферментационной культуры; посредством чего был получен раствор, содержащий изолированные высокомолекулярные капсульные полисахариды Streptococcus pneumoniae серотипа 19А.
В другом варианте реализации данное изобретение относится к раствору, содержащему капсульные полисахариды с высокой молекулярной массой Streptococcus pneumoniae серотипа 19А, где раствор получен способом, описанным выше.
Способы изобретения приводят к капсульным полисахаридам с высокой молекулярной массой Streptococcus pneumoniae серотипа 19А. Как используется здесь, "высокая молекулярная масса" относится к молекулярным массам, которые составляют по крайней мере приблизительно 480 кДа, приблизительно 490 кДа, приблизительно 500 кДа, приблизительно 510 кДа, приблизительно 520 кДа, приблизительно 525 кДа, приблизительно 550 кДа, приблизительно 575 кДа, приблизительно 600 кДа, приблизительно 625 кДа, приблизительно 650 кДа, приблизительно 675 кДа, приблизительно 700 кДа, приблизительно 725 кДа, приблизительно 750 кДа, приблизительно 775 кДа, приблизительно 800 кДа, приблизительно 825 кДа, приблизительно 850 кДа, приблизительно 875 кДа, приблизительно 900 кДа, приблизительно 925 кДа, приблизительно 950 кДа, приблизительно 975 кДа или приблизительно 1000 кДа.
В определенных способах введение CO2 в ферментационную культуру включает прибавление бикарбонатного иона (HCO3 -) к ферментационной культуре, например прибавление NaHCO3 к ферментационной культуре. Прибавление NaHCO3 5-50 мМ может использоваться, такое как 5 мМ, 10 мМ, 15 мМ, 20 мМ, 25 мМ, 30 мМ, 35 мМ, 40 мМ, 45 мМ или 50 мМ. В других способах введение CO2 в ферментационную культуру включает прибавление карбонатного иона (CO3 2-) к ферментационной культуре, например прибавление Na2CO3 к ферментационной культуре.
Добавления Na2CO3 0,1-2,0 М могут использоваться, такие как 0,1 М, 0,2 М, 0,4 М, 0,6 М, 0,7 М, 0,9 М, 1,0 М, 1,5 М, 1,8 М или 2,0 М. Массообъемный (мас./об.) эквивалент может также использоваться, такой как 5% (масс./об.) Na2CO3, 10% (масс./об.) Na2CO3 или 20% (масс./об.) Na2CO3. В остальных других способах введение CO2 в ферментационную культуру включает первое прибавление NaHCO3 и второе прибавление Na2CO3 к ферментационной культуре. В дальнейших способах введение CO2 в ферментационную культуру включает покрытие ферментационной культуры CO2. Покрытие CO2 5-100% может использоваться, например 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100%.
В пределах способов данного изобретения бактериальные клетки могут быть подвергнуты лизису, используя любой литический агент. "Литический агент" является любым агентом, который способствует деструкции клеточной оболочки и высвобождению автолизина, который вызывает клеточный лизис, включая, например, детергенты. Как используется здесь, термин "детергент" относится к любому анионному или катионному детергенту, способному индуцировать лизис бактериальных клеток. Примеры таких детергентов для использования в пределах способов данного изобретения включают деоксихолат натрия (DOC), N-лаурил саркозин (NLS), хенодеоксихолат натрия и сапонины.
В одном варианте реализации данного изобретения литическим агентом, используемым для лизиса бактериальных клеток, является DOC. DOC - натриевая соль желчной кислоты - деоксихолевой кислоты, которую обычно получают из биологических источников, таких как коровы или волы. DOC активизирует LytA протеин, который является автолизином, который вовлечен в рост клеточной оболочки и деление Streptococcus pneumoniae. LytA протеин имеет холин связывающие домены в его части С-терминала, и мутации lytA гена, как известно, приводят к LytA мутантам, которые являются резистентными к лизису DOC.
Хотя нет никакого свидетельства, что использование DOC во время очистки полисахарида Streptococcus pneumoniae представляет риск для здоровья, использование таких биологических реагентов может затронуть потенциальные регулирующие вопросы. Соответственно в одном варианте реализации данного изобретения литический агент, используемый для лизиса бактериальных клеток, является литическим агентом неживотного происхождения. Литические агенты неживотного происхождения для использования в пределах способов данного изобретения включают агенты от неживотных источников с механизмом активности, подобным DOC (т.е. влияние LytA функции, приводящее к лизису клеток Streptococcus pneumoniae).
Такие литические агенты неживотного происхождения включают, но не ограничиваются следующими: аналоги DOC, сурфактанты, детергенты и структурные аналоги холина и могут быть определены, используя процедуры, как описано в Экспериментальной секции здесь ниже. В одном варианте реализации литический агент неживотного происхождения выбран из группы, состоящей из следующих: декансульфоновая кислота, трет-октилфеноксиполи(оксиетилен)этанолы (например Igepal® CA-630.CAS #: 9002-93-1, доступный от Sigma Aldrich, St. Louis, МО), конденсаты октилфенолэтиленоксида (например Triton® Х-100, доступный от Sigma Aldrich, St. Louis, МО), N-лаурилсаркозиннатрий (NLS), лаурилиминодипропионат, додецилсульфат натрия, хенодеоксихолат, гиодеоксихолат, гликодеоксихолат, тауродеоксихолат, таурохенодеоксихолат и холат. В другом варианте реализации литический агент неживотного происхождения - NLS.
В пределах способов данного изобретения - выделение капсульных полисахаридов Streptococcus pneumoniae, используя стандартные способы, известные специалистам в данной области. Например, после ферментации бактериальных клеток, которые продуцируют капсульные полисахариды Streptococcus pneumoniae серотипа 19А, бактериальные клетки подвергали лизису, чтобы получить клеточный лизат. Капсульные полисахариды могут быть потом изолированы от клеточного лизата, используя способы очистки, известные в данной области, включая центрифугирование, осаждение, ультрафильтрацию и колоночную хроматографию (см., например, опубликованные патентные заявки US №20060228380, 20060228381, 20070184071, 20070184072, 20070231340 и 20080102498).
Изменения процесса, описанные выше, позволяют выделение капсульных полисахаридов с высокой молекулярной массой серотипа 19А из клеточных лизатов Streptococcus pneumoniae. Это существенное усовершенствование процесса ферментации/восстановления, который может значительно увеличить производство пневмококковых полисахаридов.
Следующие примеры предлагаются как иллюстративные, а не ограничительные.
ПРИМЕРЫ
Выращивали бактериальные клетки Streptococcus pneumoniae, которые продуцируют серотип 19А, чтобы получить полисахариды, необходимые для производства вакцины для активной иммунизации против инвазивных заболеваний, вызванных Streptococcus pneumonia, благодаря капсульным серотипам, включенным в вакцину. Клетки выращивали в ферментаторе с индуцированным лизисом в конце ферментации. Бульон лизата потом собирали для очистки выходного потока и выделения капсульных полисахаридов. Поскольку размер полисахарида - качественный признак, оцененный для каждой партии препарата, размер полисахарида должен контролироваться. Молекулярная масса капсульных полисахаридов серотипа 19А, как установили, зависела от параметров процесса ферментации. Следующий пример описывает исследования, касающиеся времени сбора и введения CO2 во время ферментации Streptococcus pneumoniae серотипа 19А.
Пример 1: Влияние введения диоксида углерода на молекулярную массу полисахарида
Ферментация
Лабораторные работы были выполнены в 3 л ферментаторах Braun Biostat В (В. Braun Biotech, Allentown, РА). Они были наполнены средой HYS 1,8 л (20 г/л HySoy, 2,5 г/л NaCl, 0,5 г/л KH2PO4, 0,013 г/л CaCl2-2H2O, 0,15 г/л L-цистеина HCl). Ферменторы потом автоклавировали в течение 60 мин при 121°C. После охлаждения добавляли 40 или 60 мл/л раствора 50% Глюкозы +1% Сульфата Магния (масс./об.) (DMS) к каждой единице. Если необходимо, бикарбонат натрия добавляли перед инокуляцией.
Две 2 л колбы для посева, содержащие 1 л HYS среды, были инокулированы Типом 19А семенного фонда и инкубированы при 36°C, без встряхивания в течение приблизительно 6-8 часов. Инокуляцию ферментатора выполняли с объемом 100 мл (~5,2% об./об.), аликвотированного от колбы с ОП600 между 0,3-0,9 и рН между 4,75-5,60. Температуру ферментации и рН контролировали при заданных значениях. Использовались стандартные условия - 36°C, воздушный поток 1 л/мин, контролированный рН до 7 и взбалтывание 75 об/мин. Два импеллера были помещены в низкие и средние положения на вал мешалки. Колба, содержащая соответствующий базовый титрант (3 N NaOH, 3 N NaOH, смешанный с различными концентрациями NaHCO3, 3 N NaOH, смешанный с различными концентрациями Na2CO3 и NaHCO3, и 20% Na2CO3), была присоединена для автоматического контроля за рН. Образцы взымали в различные периоды времени для определения рН, ОП600, глюкозы, полисахарида и белка. Процесс был закончен, когда концентрация глюкозы была близка к истощению, или никакое увеличение ОП в течение долгого времени не было отмечено.
Измерение оптической плотности (ОП600)
Определяли клеточную плотность бульона ферментации, считывая абсорбцию образцов при 600 нм, используя Shimadzu (Columbia, MD) UV-1601 (полоса пропускания 2 нм) или Spectronics (Westbury, NY) Genesys 5 спектрофотометр (полоса пропускания на 5 нм). Единица была заполнена средой HYS, разбавленной деионизированной водой (ДИ) в количестве, необходимом для растворения образца. Образец был разведен для поддержания абсорбции считывания 0,4, который в пределах линейного диапазона спектрофотометра.
Концентрация Глюкозы
Определяли уровни глюкозы, центрифугируя клетки и используя супернатант непосредственно или 3× разведенный ДИ водой. Образцы анализировали на Nova Biomedical (Waltham, MA) BioProfile 400.
Анализ Полисахарида
Отбирали образцы при снятии показаний по окончании ферментации и обрабатывали 12% деоксихолатом натрия (DOC) до концентрации 0,13% (масс./об.) и осторожно перемешивали. Их выдерживали 8-24 час при 5°С, потом рН доводили до 5,0 50% уксусной кислотой, чтобы осадить большую часть DOC и белка. После другого интервала выдержки 12-24 часов при 5°С образцы центрифугировали (14000 об/мин, Sorvall (Thermo Fisher Scientific, Waltham, MA) ротор SS34, 10 минут при 15°С). рН супернатанта доводили до 6,0. Супернатант потом фильтровали через 0,45 мкм Pall (East Hills, NY) HT Tuffryn Membrane шприц-фильтр (низкое связывание белка). Фильтрованный продукт анализировали высокоэффективной эксклюзионной хроматографией (HPLC-SEC), используя стандартную методику, известную в данной области (см., например, Aquilar, М. «HPLC of Peptides and Proteins: Methods and Protocols" Totowa, NJ: Humana Press (2004)).
Анализ Белка
Уровни белка анализировали электрофорезом на полиакриламидном геле натрий додецилсульфата (SDS-PAGE), способом, известным в данной области (see, e.g., Walker, J.M. "The Protein Protocols Handbook" Totowa, NJ: Humana Press (2002)). Фильтрованный клеточный лизат (супернатант), как был получен выше, помещали аликвотами в пробирки микроцентрифуги 65 мкл/пробирку. Добавки восстанавливающего агента (10 мкл дитиотреитола (DTT)) и NuPAGE® (Invitrogen, Carlsbad, СА) 4× литий додецилсульфат (LDS) буфер для образца (25 мкл) были сделаны к каждому образцу. Образцы встряхивали и нагревали в течение 10 минут перед выгрузкой 10 мкл/ряд на 4-12% NuPAGE® Bis-Tris 12 лунки с гелем. Гели запускали в буфер NuPAGE® MES-SDS при 150 V, ограничиваясь примерно 60 минутами и впоследствии окрашивали, используя протокол окрашивания Zoion ((Zoion Biotech, Worcester, MA)). Анализ образцов выполняли, используя визуализатор UVP (UVP Inc, Upland, СА) с LabWorks™ (UVP Inc) с программным обеспечением V.3, чтобы получить приблизительные концентрации определенных полос интересующего белка. Бычий сывороточный альбумин (BSA), Фракция V использовался, чтобы построить калибровочную кривую белка, чтобы вычислить приблизительные значения белка в образцах (в бульоне клеточного лизата).
Анализ Молекулярной массы
Ферментированные образцы 1-2 л обрабатывали 12% натрий DOC до концентрации 0,13% (масс./об.) при встряхивании 200 об/мин. Образцы выдерживали 8-24 час или при 5°С, или при 20°С рН образцов потом доводили до 5,0 или 6,6 50% уксусной кислотой, чтобы осадить большую часть DOC и белка. После другого интервала выдержки 12-24 часов при 5°С образцы центрифугировались (11000 об/мин, Sorvall (Thermo Fisher Scientific, Waltham, MA) ротор SLA-3000, 15 минут при 10°С). РН образцов супернатантов потом корректировали до 6,0 3 N NaOH и фильтровали, используя фильтры МР60 0,45 мкм Millipore (Billerica, MA). Образцы затем подвергали модифицированному процессу очистки, состоящему из диафильтрации обрезанной молекулярной массы 100 К (MWCO) (5× концентрация, с последующей 7,5× диафильтрацией ДИ водой), 0,1% НВ осаждения, углеродной фильтрации. Очищенный материал затем подвергали анализу Multi Angle Laser Light Scattering (MALLS).
Исследование Процесса Ферментации
Базируясь на предыдущих исследованиях, процесс ферментации был оптимизирован, заменяя Na2CO3 на NaOH, в качестве базового титранта. Использование NaOH позволило восстановить рН до сниженного 5,0, что привело к существенному осаждению белка. Na2CO3 высвобождает CO2 при низком рН (<6,6), создавая пенообразование. Воздействие базового титранта на Тип 19А полисахарида и уровни белка было исследовано. Два 3 л ферментатора устанавливали с одним ферментатором, служащим в качестве контроля над процессом, используя 20% раствор Na2CO3 (масс./об.) как основную подачу. В другом ферментаторе использовался 3 N NaOH как основная подача.
Во время фазы восстановления клетки были лизированы в ферментаторе с DOC (конечная концентрация 0,13% (масс./об.)), ферментатор выдерживали при 36°С в течение 30 минут. После этой стадии лизат оставляли на ночь при встряхивании при температуре окружающей среды (22°С). После выдержки лизата рН лизата титровали в диапазоне от неоткорректированного до 4,5 с образцами, взятыми при различных заданных значениях рН. Эти образцы выдерживали ночь при температуре окружающей среды перед обработкой и анализом полисахаридов и концентраций белка. ОП, базовый и уровень глюкозы во время фазы ферментации показаны на Фиг.1 и Фиг.2. Главным различием была более высокая заключительная ОП в случае использования карбоната.
Эффект пост-регулирования рН DOC лизата на общие уровни белка был также исследован и показан на Фиг.3. Более низкие уровни рН уменьшали белковую нагрузку в клетке, свободной от бульона и при использовании NaOH, и при использовании Na2C03. Более низкий рН (<6,6) не оказывал негативного воздействия на выход полисахаридов. Результаты анализа ферментации служили признаком, что основная подача NaOH была приемлемой альтернативой процессу, использующему основную подачу Na2CO3 во время ферментации, но привела к более низким выходам, чем при подаче Na2CO3.
Эффект базового титранта на молекулярную массу 19А
Выполняли ряд ферментаций при 3 л процессе, чтобы определить влияние базового титранта, концентрации HySoy и рН стадии выдержки на молекулярную массу серотипа 19 А. Определение молекулярной массы осуществляли, используя исследование MALLS с последующим модифицированным процессом очистки. Результаты показаны в Таблице 1.
| Таблица 1Эффект базового титранта на молекулярную массу серотипа 19А (L29331-94) | |||||
| N цикла | РН /температура | HySoy | Удержание pН | Базовый титрант | MALLS (кДа) |
| D | 7,0/36°С | 28 г/л | 5,0 | 3 N NaOH | 340 |
| Е | 7,0/36°С | 20 г/л | 5,0 | 3 N NaOH | 350 |
| F | 7,0/36°С | 20 г/л | 5,0 | 20% Na2CO3 | 713 |
| Н | 7,0/36°С | 20 г/л | 6,6 | 20% Na2CO3 | 713 |
Влияние бикарбонатого и смешанного базового рН титранта
В первом исследовании (Процессы L29331-122 и -139), переменные уровни начального бикарбоната натрия и базовых смесей гидроксида натрия и карбоната натрия использовались в связи с рН 5,0 стадии выдержки после стадии выдержки DOC.
Начальные добавления бикарбоната колебались 10-50 мМ, и карбонат натрия, добавленный к 3N гидроксиду натрия в качестве базового титранта, колебался 0,2-1,8 мМ. Один процесс включал 50 мМ начального бикарбоната, и NaOH использовался в качестве базового титранта. Уровни карбоната в конце ферментации колебались в интервале 14-111 мМ. Молекулярная масса серотипа 19А колебалась от 520 до 713 кДа. Параметры ферментационного процесса и результаты показаны в Таблице 2.
| Таблица 2Na2CO3 против смешанного базового титранта рН | ||||||
| N цикла | NaHCO3 (мМ) | Базовый титрант | MALLS (кДа) | Выход полисахарида (мг/мл) | ||
| Na2CO3 | NaOH | |||||
| Часть I L29331-122 20 г/л HySoy | Е | 0 | 20% | 0 | 759 | 0,836 |
| F | 10 | 0,2 М | 3N | 520 | 0,308 | |
| G | 10 | 0,4 М | 3 N | 648 | 0,538 | |
| Н | 10 | 0,9 М | 3 N | 563 | 0,334 | |
| Часть II L29331-139 28 г/л HySoy | С | 20 | 0,9 М | 3N | 662 | 1,027 |
| D | 20 | 1,8 М | 3N | 611 | 0,903 | |
| G | 50 | 0,9 М | 3N | 713 | 0,924 | |
| Н | 50 | ОМ | 3N | 713 | 1,051 |
Во втором исследовании (L29331-159 и-185) использовали начальные добавления бикарбоната 15-30 мМ и базовые смеси, используя 0,4-1,0 М Na2CO3. Уровни карбоната в конце ферментации колебались от 24-62 мМ. Молекулярная масса серотипа 19А колебалась от 502 до 763 кДа. Параметры ферментационного процесса и результаты показаны в Таблице 3.
| Таблица 3NaHCO3 со смешанным базовым рН титрантом | |||||
| N цикла | HySoy/DMS | NaHCO3 (мМ) | Na2CO3/NaOH | MALLS (кДа) | Выход полисахарида (мг/мл) |
| G2 | 28 г/л/60 мл/л | 15 | 1,0 M/3N | 657 | 0,853 |
| Н2 | 28 г/л/60 мл/л | 15 | 0,4 М/3 N | 605 | 0,755 |
| С | 20 г/л/60 мл/л | 20 | 0,4 М/3 N | 571 | 0,386 |
| Е | 20 г/л/60 мл/л | 20 | 1,0 М/3 N | 763 | 0,439 |
| F | 20 г/л/60 мл/л | 25 | 0,7 М/3 N | 462 | 0,382 |
| G | 20 г/л/60 мл/л | 30 | 0,4 М/3 N | 502 | 0,355 |
| Н | 20 г/л/60 мл/л | 30 | 1,0 М/3 N | 594 | 0,415 |
Сравнение смешанного и чистого процессов ферментации карбонатного базового титрования
Проводили эксперимент для того, чтобы сравнить процесс при базовой смеси (0,7 М Na2CO3 /3 N NaOH) и процесс карбонатного титрования (20% раствор Na2CO3, масс./об.). Результаты (Таблица 4) подтвердили, что молекулярная масса от процесса карбонатного титрования была выше и более однородной (778, 781 кДа), чем молекулярная масса от процесса титрования базовой смесью (561-671 кДа). Выход полисахарида был также выше при процессе Na2CO3.
| Таблица 4Процесс L29399-1 Na2CO3 против базовой смеси | |||||
| N цикла | NaHCO3 (мМ) | Базовый титрант | ММ (кДа) | Выход полисахарида (мг/мл) | |
| Na2CO3 | NaOH | ||||
| С | 25 | 0,7 М | 3 N | 565 | 1,106 |
| D | 25 | 0,7 М | 3 N | 561 | 0,908 |
| Е | 25 | 0,7 М | 3 N | 612 | 0,894 |
| G | 25 | 0,7 М | 3 N | 671 | 0,873 |
| F | 0 | 20% | 0 | 778 | 1,282 |
| Н | 0 | 20% | 0 | 781 | 1,249 |
Пилотное производство
Осуществляли несколько экспериментальных процессов (100 л) с серотипом 19А с различными базовыми титрантами. Определение молекулярной массы осуществляли, используя исследование MALLS после полного процесса очистки, и данные предоставляли для очищенной заключительной партии. Результаты показаны в Таблице 5.
| Таблица 5Влияние базового титранта на молекулярную массу серотипа 19А в экспериментальном процессе | |||
| Партия Ферментации | Базовое титрование | Партия Очистки | MALLS FBC (кДа) |
| RRP19A-0008 | 3 N NaOH | L26563-10 | 390 |
| RRP19A-0009 | 3 N NaOH | L26563-11 | 380 |
| IPPPN19A-005 | 3 N NaOH/0,6 М Na2CO3 | L26260-37 | 492 |
| IPPPN19A-006 | 3 N NaOH/0,6 M Na2CO3 | L26260-38 | 480 |
| IPPPN19A-007 | 3 N NaOH/0,6 M Na2CO3 | L26260-39 | 490 |
| IPPPN19A-014 | 20% Na2CO3 | L26260-49 | 580 |
| IPPPN19A-016 | 20% Na2CO3 | L26260-50 | 559 |
| IPPPN19A-017 | 20% Na2CO3 | L26260-51 | 599 |
Влияние базового титранта и покрытия на молекулярную массу серотипа 19А
Выполняли ряд ферментаций при 3 л процессе, чтобы определить, влияет ли базовый титрант и атмосферное покрытие на молекулярную массу. Определение молекулярной массы осуществляли, используя исследование MALLS с последующим модифицированным процессом очистки. Результаты показаны в Таблице 6.
| Таблица 6Влияние базового титранта и покрытия на молекулярную массу серотипа 19А | |||
| N цикла | Базовый титрант | Покрытие | MALLS (кДа) |
| Контроль | 3 N NaOH | Воздух | 350 |
| С | 0,7 M Na2CO3 | Воздух | 855 |
| D | 1,5M Na2CO3/ 1,5 N NaOH | Воздух | 710 |
| Е | 3 N NaOH | 100% CO2 | 634 |
| F | 3 N NaOH | 50% CO2 | 646 |
| G | 3 N NaOH | 20% CO2 | 567 |
| Н | 3 N NaOH | 10% CO2 | 547 |
Влияние времени сбора на молекулярную массу 19А
Было также изучено влияние времени сбора на молекулярную массу полисахаридов серотипа 19А. Таблица 7 суммирует данные от одного цикла, показывая уменьшение ММ как функции ОП ферментации и времени сбора.
| Таблица 7Молекулярная масса (MW) как Функция ОП Ферментации и Времени сбора | |
| ОП (время) | MALLS |
| 2,2 (3 часа) | 1065 |
| 4,2 (4 часа) | 845 |
| 5,5 (5,5 часов) | 756 |
| 5,9 (6,6 часов) | 653 |
Дальнейшие исследования с несколькими экспериментальными процессами также показали уменьшение ММ как функции ОП ферментации и времени сбора. Фигура 4 показывает молекулярную массу как функцию оптической плотности ферментации (ОП) и время сбора в производстве 19А полисахаридов. Фигура 5 показывает определенный базовый расход на время на оптическую плотность (ОП) как функцию времени сбора в производстве 19А полисахаридов. Фигура 6 показывает молекулярную массу как функцию использования определенного базового титранта в производстве 19А полисахаридов.
Все публикации и заявки на патент, упомянутые в описании, являются показательными, исходя из уровня специалистов в данной области, которым принадлежит это изобретение. Все публикации и заявки на патент здесь включены в отношении той же самой степени, как каждая индивидуальная публикация или заявка на патент были определенно и индивидуально указаны, чтобы быть включенными ссылкой.
Хотя предшествующее изобретение было описано в некоторых деталях посредством иллюстрации и примеров в целях ясности понимания, определенные изменения и модификации могут быть осуществлены в рамках прилагаемой формулы изобретения.
1. Способ получения раствора, содержащего высокомолекулярные изолированные капсульные полисахариды Streptococcus pneumoniae серотипа 19А, в котором:a) получают ферментационную культуру бактериальных клеток Streptococcus pneumoniae, которые продуцируют капсульные полисахариды серотипа 19А;b) ферментируют упомянутую ферментационную культуру не более 6 часов;c) лизируют бактериальные клетки в упомянутой ферментационной культуре с получением раствора капсульных полисахаридов Streptococcus pneumoniae серотипа 19А, имеющих молекулярную массу, по крайней мере, 480 кДа, в клеточном лизате; d) выделяют капсульные полисахариды Streptococcus pneumoniae серотипа 19А из клеточного лизата, полученного на стадии с), с получением раствора капсульных полисахаридов Streptococcus pneumoniae серотипа 19А.
2. Способ по пункту 1, где стадия b) включает ферментирование упомянутой ферментационной культуры не более 5 часов.
3. Способ по пункту 1 или 2, где стадия b) включает ферментирование упомянутой ферментационной культуры не более 4 часов.
4. Способ по пункту 1 или 2, где стадия b) включает ферментирование упомянутой ферментационной культуры 3-6 часов.
5. Способ получения раствора, содержащего высокомолекулярные изолированные капсульные полисахариды Streptococcus pneumoniae серотипа 19А, в котором:a) получают ферментационную культуру бактериальных клеток Streptococcus pneumoniae, которые продуцируют капсульные полисахарид