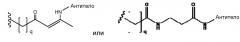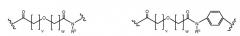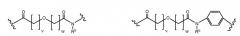Анти-ангиогенные соединения
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и касается новых соединений, которые обладают анти-ангиогенной активностью. Охарактеризованное изобретение представляет собой пептид, связывающий эндотелиальный клеточный фактор роста (VEGF), а также пептид, связывающий VEGF, конъюгированный с молекулами антител отдельно и в сопряженной связи с другими анти-ангиогенными молекулами. Представленное решение может быть использовано для ингибирования или снижения ангиогенеза. 28 з.п. ф-лы, 14 табл., 17 пр.
Реферат
Область, к которой относится изобретение
Настоящее изобретение относится к новым соединениям, которые обладают анти-ангиогенной активностью, и к способам получения и применения этих соединений. В частности, настоящее изобретение относится к пептидам, которые связываются с сосудистым эндотелиальным клеточным фактором роста (VEGF), и к макромолекулам, включающим эти пептиды, и к связанным с ними способам и применениям.
Предшествующий уровень техники
Ангиогенез представляет собой фундаментальный процесс, посредством которого образуются кровеносные сосуды, и он играет существенную роль при разнообразных видах нормальной активности организма, таких как репродукция, развитие и заживление ран. Хотя ангиогенез в нормальных условиях представляет собой высоко регулируемый процесс, многие заболевания (характеризуемые как «ангиогенные заболевания») вызываются или обостряются нерегулируемым ангиогенезом. Например, неоваскуляризация глаз считалась наиболее частой причиной слепоты. В определенных существующих состояниях, таких как артрит, вновь образованные капиллярные кровеносные сосуды внедряются в суставы и разрушают хрящ. При диабете новые капилляры, образованные в сетчатке, внедряются в стекловидное тело, кровоточат и вызывают слепоту. Рост и метастазирования солидных опухолей также зависимы от ангиогенеза (J. Folkman, Cancer Res., 46:467-473 (1986), J. Folkman, J. Natl. Cancer Inst., 82:4-6 (1989)). Было, например, показано, что опухоли, которые увеличиваются до размера более 2 мм, получают свое собственное кровоснабжение индукцией роста новых капиллярных кровеносных сосудов. После того как эти новые кровеносные сосуды становятся внедренными в опухоль, они становятся средством для поступления опухолевых клеток в кровообращение и метастазирования в отдаленные участки, такие как печень, легкие и кости (N. Weidner, et. al., N. Engl. J. Med., 324:1-8 (1991)).
Сосудистый эндотелиальный клеточный фактор роста (VEGF) был идентифицирован как крайне мощный ангиогенный фактор, и он требуется для роста и метастазирования многих опухолей человека. Много исследований были сосредоточены на попытке ингибировать путь VEGF с тем, чтобы ограничить или предотвратить ангиогенез или метастазирование. В публикации Fairbrother et al: 'Novel peptides selected to bind vascular endothelial growth factor targetthe receptor-binding site' (Biochemistry, 1998, 37, 17754-17764) описаны пептиды с различной способностью связывания с VEGF. Были идентифицированы различные пептиды, которые связываются со связанным с ангиогенезом фактором ангиопоэтином-2 ("Ang-2") (Oliner, J. et al, Cancer Cell, 204(6), 507-516 (2004)). Было показано, что пептиды, связывающие Ang-2, обладают анти-ангиогенной активностью.
Было бы желательно получить соединения, которые проявляют улучшенные характеристики по сравнению с известными соединениями, такие как, например, улучшенное связывание с VEGF. Было бы, кроме того, желательно получить соединения, демонстрирующие связывание с VEGF и Ang2.
Ссылка на любые источники информации в настоящем описании не должна восприниматься как признание любой формы предположения, что приведенная ссылка составляет часть общеизвестных положений.
Краткое описание сущности изобретения
[VEGF-пептиды] по изобретению
Изобретение относится к пептидам, соединениям и фармацевтическим композициям, способным связываться с VEGF человека (как иллюстрируется SEQ ID NO:3). Соответственно, в некоторых аспектах настоящее изобретение относится к пептиду, включающему последовательность, по существу гомологичную последовательности:
V1-E2-P3-N4-C5-D6-I7-H8-V9-M10-W11-V12-W13-X14-C15-F16-E17-R18-X19 (SEQ ID NO:122), где X14 представляет E или V, а X19 представляет натуральную или ненатуральную гидрофобную аминокислоту или ее D-изомеры.
К удивлению, было обнаружено, что этот класс пептидов и их производные (как будет детально описан ниже) демонстрируют улучшенное связывание с VEGF относительно пептидов родственной структуры. В частности, мутирование положения 12 в нейтральный гидрофобный остаток, в частности валин, обеспечивает характеристику улучшенного связывания относительно пептидов с отрицательно заряженными группами в этом положении, такими как глутамат. В некоторых вариантах осуществления настоящее изобретение относится к пептиду, включающему последовательность, по существу гомологичную SEQ ID NO:122, при условии, что V12 не замещен E. В некоторых вариантах осуществления, X19 представляет L. X19 может представлять D-Leu. X19 может представлять консервативное замещение L, такое как I, или другой гидрофобный остаток, такой как A или V, или D-изомеры любого из предыдущих остатков.
Кроме того, производные по настоящему изобретению включают добавление по меньшей мере 1-4 остатка на C-конце. Некоторые варианты осуществления включают добавление 2-4 остатков на C-конце. Некоторые варианты осуществления включают добавление 2 остатков на C-конце. Некоторые варианты осуществления включают добавление 3 остатков на C-конце. Некоторые варианты осуществления включают добавление 4 остатков на C-конце.
Соответственно, изобретение также относится к пептиду, включающему последовательность, по существу гомологичную последовательности:
V1-E2-P3-N4-C5-D6-I7-H8-V9-M10-W11-V12-W13-X14-C15-F16-E17-R18-X19-X20 (SEQ ID NO:123)
где X20 представляет любую нейтральную, гидрофобную или ароматическую аминокислоту. X20 может представлять любую ароматическую аминокислоту, такую как Y, F, W, или их D-изоформы. X20 может представлять любую нейтральную гидрофобную аминокислоту, такую как M, I, L, NIe, A, или их D-изоформы.
В некоторых аспектах изобретение относится к пептиду, включающему последовательность, по существу гомологичную последовательности:
V1-E2-P3-N4-C5-D6-I7-H8-V9-M1O-W11-V12-W13-X14-C15-F16-E17-R18-X19-X2°-X21 (SEQ ID NO:124)
где X21 представляет любую аминокислоту. В некоторых аспектах X21 может представлять любую нейтральную или положительно заряженную аминокислоту, такую как G, A, I, L, K, R, или K(ac), или их D-изоформы. Например, X21 может представлять D-Ala.
В некоторых аспектах изобретение относится к пептиду, включающему последовательность, по существу гомологичную последовательности:
V1-E2-P3-N4-C5-D6-I7-H8-V9-M10-W11-V12-W13-X14-C15-F16-E17-R18-X19-X20-X21-X22 (SEQ ID NO:125),
где X22 представляет любую алифатическую, полярную или отрицательно заряженную аминокислоту, такую как V, L, P, E, G, I, S, T, W, F, E, или их D-изомеры.
В некоторых аспектах изобретение относится к пептиду, включающему последовательность, по существу гомологичную последовательности:
V1-E2-P3-N4-C5-D6-I7-H8-V9-M10-W11-V12-W13-X14-C15-F16-E17-R18-X19-X20X21-X22-X23 (SEQ ID NO:126), где X23 представляет любую аминокислоту. X23 может быть выбран из группы, состоящей из G, A, I, L, Q, E, F, T, W, S, и Y, и их D-изомеров. X23 может быть выбран из группы, состоящей из G, A, I, L, Q, E, F, T, S, и Y, и их D-изомеров. В некоторых аспектах X23 не содержит боковую цепь с двойным кольцом. В некоторых аспектах X23 не представляет W. В некоторых аспектах X23 может представлять E, T, S, L, или F, или их D-изомеры.
В некоторых вариантах осуществления было обнаружено, что может быть предпочтительным, чтобы по меньшей мере один из 5 остатков на карбоксильном конце представлял собой D-изомер. В некоторых аспектах по меньшей мере два из пяти остатков, расположенных на С-конце, представляют собой D-изомеры. В некоторых аспектах не более чем три из пяти остатков, расположенных на С-конце, представляют собой D-изомеры. В некоторых аспектах от одного до трех из пяти остатков, расположенных на С-конце, представляют собой D-изомеры. В некоторых аспектах по меньшей мере один из четырех остатков на карбоксильном конце представляет собой D-изомер. В некоторых аспектах по меньшей мере два из четырех остатков, расположенных на С-конце, представляют собой D-изомеры. В некоторых аспектах не более чем три из четырех остатков, расположенных на С-конце, представляют собой D-изомеры. В некоторых аспектах от одного до трех из четырех остатков, расположенных на С-конце, представляют собой D-изомеры. Для каждого из них предпочтительно, чтобы было по меньшей мере два или, предпочтительно по меньшей мере три дополнительных остатка после X19. Было обнаружено, что получение оптимизированного числа D-изомеров на C-конце обеспечивает преимущество повышенной устойчивости к ферментному разрушению на C-конце, особенно ферментное разрушение между остатками E17 и R18, и ферментное разрушение между остатками R18 и X19.
В некоторых аспектах изобретения X19 может представлять L, X20 присутствует и может представлять Y, X21 присутствует и может представлять алифатическую гидрофобную аминокислоту (и может быть выбран из A, L, I, V, G), и X22 присутствует и представляет гидрофобную аминокислоту (и может быть выбран из L, P, V). В определенных вариантах осуществления два из X19, X21 и X22 представляют D-изомеры. В некоторых вариантах осуществления X23 может присутствовать или не присутствовать.
В некоторых аспектах определенные пептиды и соединения по изобретению могут включать пептидную последовательность, по существу гомологичную одной или более SEQ ID NOs:36-106.
В другом аспекте настоящее изобретение относится к пептиду, включающему последовательность, по существу гомологичную последовательности:
V1-E2-P3-N4-C5-D6-I7-H8-V9-M10-W11-E12-W13-E14-C15-F16-E17-R18-X19-X20-X21-X22-X23 (SEQ ID NO:127), где X19 представляет натуральную или ненатуральную гидрофобную аминокислоту или ее D-изомеры, и X20 представляет ароматическую аминокислоту, нейтральную аминокислоту, гидрофобную аминокислоту, или полярную аминокислоту, или ее D-изомеры, и X21 представляет гидрофобную аминокислоту, или положительно заряженную аминокислоту, или ее D-изомеры, и X22 отсутствует или представляет гидрофобную аминокислоту, ароматическую аминокислоту, отрицательно заряженную аминокислоту или ее D-изомеры, и X23 отсутствует или представляет ароматическую аминокислоту, нейтральную аминокислоту, гидрофобную аминокислоту или ее D-изомеры. X19 может представлять L. В альтернативных вариантах осуществления X19 представляет D-Leu. X19 может представлять консервативное замещение L, такое как I, или другой гидрофильный остаток, такой как A или V, или D-изомеры любого из предыдущих остатков. X20 может быть выбран из группы, состоящей из A, V, I, L, Y, W, F, M, S, и T или их D-изомера. X20 может быть выбран из группы, состоящей из A, Y, F, M, и S или их D-изомера. X21 может быть выбран из группы, состоящей из K, R, H, орнитина, Dap, Dab, G, A, V, I, и L или их D-изомеров. X21 может быть выбран из группы, состоящей из K, R, и G или их D-изомера. Когда X20 представляет гидрофобную или ароматическую аминокислоту, то X21 может представлять положительно заряженную аминокислоту. Когда X20 представляет одну из A, F или Y, то X21 может представлять одну из K или R или их D-изомер. Когда X21 представляет гидрофобную аминокислоту, то X20 может представлять полярную аминокислоту. X22 в случае его присутствия может быть выбран из группы, состоящей из E, D, G, A, L, I, V, M, W, Y, и F или их D-изомеров. X22 в случае его присутствия может быть выбран из группы, состоящей из E, G и W или их D-изомеров. Когда X21 представляет положительно заряженный остаток, то X22 в случае его присутствия может представлять отрицательно заряженный остаток. Когда X21 представляет K, то X22 может представлять E. X23 в случае присутствия может быть выбран из группы, состоящей из W, Y, F, G, A, I, L, V, и M или их D-изомеров. X в случае присутствия может быть выбран из группы, состоящей из W, F, G, A, L, и M, или их D-изомеров.
В некоторых аспектах определенные пептиды, соединения и фармацевтические композиции по изобретению могут включать пептидную последовательность, по существу гомологичную одной или более из следующих: SEQ ID NO:108, SEQ ID NO:109, SEQ ID NO:110, SEQ ID NO:111, SEQ ID NO:112, SEQ ID NO:113, SEQ ID NO:114, SEQ ID NO:115, SEQ ID NO:116, SEQ ID NO:117, SEQ ID NO:118, SEQ ID NO:119, SEQ ID NO:120, SEQ ID NO:121.
Пептиды по изобретению могут использоваться в различных применениях, включая диагностику, скрининг и лечение. Пептиды и композиции по изобретению могут использоваться непосредственно при лечении или могут найти применение при ковалентном и не ковалентном сопряженном связывании с более крупными молекулами, которые обеспечивают дополнительную терапевтическую ценность, такую как увеличенный период полувыведения (фармакокинетика, PK). Примеры молекул, которые могут обеспечить увеличенный период полувыведения, включают белки, полипептиды, антитела, фрагменты антител, в частности домен Fc антител.
Изобретение относится к соединению формулы R1-[VEGF-Пептид]-R2
где [VEGF-Пептид] представляет пептид, включающий последовательность, по существу гомологичную последовательности: X 1-X 2-P3N4-C5-X 6-X 7-X 8-V9-X 10-X 11-X 12-W13-X 14-C15-F16-E17-R18-X 19-X 20-X 21-X 22-X 23 (SEQ ID NO:131), где R1 отсутствует или представляет CH3, C(O)CH3, C(O)CH3, C(O)CH2CH3, C(O)CH2CH2CH3, C(O)CH(CH3)CH3, C(O)CH2CH2CH2CH3, C(O)CH(CH3)CH2CH3, C(O)C6H5, C(O)CH2CH2(CH2CH2O)1-5Me, амидо-2-PEG, N-ацил и N-алкил, амино-защитную группу, группу жирной кислоты липида или углеводород; и R2 отсутствует или представляет OH, NH2, NH(CH3), NHCH2CH3, NHCH2CH2CH3, NHCH(CH3)CH3, NHCH2CH2CH2CH3, NHCH(CH3)CH2CH3, NHC6H5, NHCH2CH2OCH3, NHOCH3, NHOCH2CH3, карбокси-защитную группу, группу жирной кислоты липида или углеводород, и X1 представляет остаток гидрофобной аминокислоты, X2 представляет отрицательно заряженный остаток, X6 представляет отрицательно заряженный остаток, X7 представляет остаток гидрофобной аминокислоты, X8 представляет остаток, содержащий кольцевую структуру, X10 может представлять M или любую гидрофобную аминокислоту, X11 представляет ароматическую аминокислоту, X12 выбран из группы, состоящей из V, E и Kac, X14 представляет E или V, X19 может представлять любой остаток гидрофобной аминокислоты или ее D-изомер, X20 может отсутствовать, или может представлять любую нейтральную, гидрофобную или ароматическую аминокислоту или ее D-изомер, X21 может отсутствовать или может представлять любой положительно заряженный остаток, или любой алифатический неполярный остаток, или его D-изоформу, X22 может отсутствовать или может быть выбран из группы, состоящей из G, V, L, I, P, S, T, W, F, E, Kac, или их D-изомеров, X23 может отсутствовать или выбран из группы, состоящей из G, A, I, L, Q, E, F, T, W, S, Y, и Kac и их D-изомеров.
X1 может представлять V. X2 может представлять E. X6 может представлять D. X7 может представлять I. X8 может представлять H. X11 может представлять W. [VEGF-Peptide] может представлять пептид, включающий последовательность, по существу гомологичную последовательности:
V1-E2-P3-N4-C5-D6-I7-H8-V9-X 10-W11-X 12-W13-X 14-C15-F16-E17-R18-X 19-X 20-X 21-X 22-X 23 (SEQ ID NO:132), где X10 может представлять M или любую гидрофобную аминокислоту, X12 выбран из группы, состоящей из V, E и Kac, X14 представляет E или V, X19 может представлять остаток любой гидрофобной аминокислоты или ее D-изомер, X20 может отсутствовать или может представлять любую нейтральную, гидрофобную или ароматическую аминокислоту или ее D-изомер, X21 может отсутствовать или может представлять любой положительно заряженный остаток, или любой алифатический неполярный остаток, или его D-изоформу, X22 может отсутствовать или может быть выбран из группы, состоящей из G, V, L, I, P, S, T, W, F, E, Kac, или их D-изомеров, X23 может отсутствовать или может быть выбран из группы, состоящей из G, A, I, L, Q, E, F, T, W, S, Y, Kac и их D-изомеров.
[VEGF-Пептид] включает последовательность, по существу гомологичную одной или более из следующих:
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L (SEQ ID NO:34)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-G-W (SEQ ID NO:35)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-F-R-E-A (SEQ ID NO:36)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-F-K-E-A (SEQ ID NO:37)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-M-K (SEQ ID NO:38)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-R-E-L (SEQ ID NO:39)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-I-F (SEQ ID NO:40)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y (SEQ ID NO:41)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-W-G (SEQ ID NO:42)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-Y-G-G-G (SEQ ID NO:43)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-L-Y (SEQ ID NO:44)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-S-G-G-G (SEQ ID NO:45)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-M-R-L-T (SEQ ID NO:46)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G (SEQ ID NO:47)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-V-K (SEQ ID NO:48)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-M-R (SEQ ID NO:49)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-I-L (SEQ ID NO:50)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-(Yome)-G-L-T (SEQ ID NO:51)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-G (SEQ ID NO:52)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-F-K-E-A (SEQ ID NO:53)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-(NIe)-K (SEQ ID NO:54)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-L-T (SEQ ID NO:55)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-G-F (SEQ ID NO:56)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-I-K (SEQ ID NO:57)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-K (SEQ ID NO:58)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-M-G-L-T (SEQ ID NO:59)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-(D-Leu)-(Kac) (SEQ ID NO:60)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-G-G (SEQ ID NO:61)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-M-K (SEQ ID NO:62)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-M-R-E-L (SEQ ID NO:63)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L- (SEQ ID NO:64)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-M-K-E-L (SEQ ID NO:65)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-P-W (SEQ ID NO:66)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-L-K (SEQ ID NO:67)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-L-(Kac) (SEQ ID NO:68)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-L-T (SEQ ID NO:69)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-E-F (SEQ ID NO:70)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-L-S (SEQ ID NO:71)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-L (SEQ ID NO:72)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-(D-Leu)-T (SEQ ID NO:73)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-V-Q (SEQ ID NO:74)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-L-E (SEQ ID NO:75)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-P-L (SEQ ID NO:76)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-P-F (SEQ ID NO:77)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-(D-Ala)-(D-Leu) (SEQ ID NO:78)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-R-(D-Leu)-(Kac) (SEQ ID NO:79)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-(D-Tyr)-G-(D-Pro)-L (SEQ ID NO:80)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-(D-Tyr)-G-(D-Fτo)-(D-Leu) (SEQ ID NO:81)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-(D-Tyr)-G-(D-Leu)-(Kac) (SEQ ID NO:82)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-(D-Leu)-Y-(Aib)-L-T (SEQ ID NO:83)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-(D-Leu)-Y-(D-Ala)-V-(D-Gln)(SEQ ID NO:84)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-(D-Leu)-Y-(D-Ala)-L-(D-Thr)(SEQ ID NO:85)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-(Cha)-G-(DLeu)-T (SEQ ID NO:86)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-(AiD)-L-(D-ThT) (SEQ ID NO:87)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-(Sar)-(D-Leu)-T (SEQ ID NO:88)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-(D-Pro)-L(SEQ ID NO:89)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-(D-AIa)-V-(D-GIn) (SEQ ID NO:90)
V-E-P-N-C-D-I-H- V-M- W-V-W-E-C-F-E-R-L- Y-(Aib)-L-T (SEQ ID NO:91)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-(D-Tyr)-G-(D-Leu)-T (SEQ ID NO:92)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-(D-Tyr)-G-L-T (SEQ ID NO:93)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-(D-Tyr)-D-L-(D-Thr) (SEQ ID NO:94)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-(D-Leu)-(Aib) (SEQ ID NO:95)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-(D-Leu)-(D-Thr) (SEQ ID NO:96)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L (SEQ ID NO:97)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-Y-G-P-F (SEQ ID NO:98)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-Y-G-P-(SEQ ID NO:99)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-Y-G-P-E (SEQ ID NO:100)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-Y-G-P-Q (SEQ ID NO:101)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-Y-G-(D-Leu)-T (SEQ ID NO:102)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-Y-G-L ((SEQ ID NO:103)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-(D-Leu)-Kac (SEQ ID NO:104)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-Y-G-L-T (SEQ ID NO:105)
V-E-P-N-C-D-I-H-V-M-W-V-W-V-C-F-E-R-L-Y-(D-Ala)-(D-Leu) (SEQ ID NO:106)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-A-K (SEQ ID NO:108)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-F-K-E-W (SEQ ID NO:109)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-A-R (SEQ ID NO:110)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-F-K (SEQ ID NO:111)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-A-K-E-F (SEQ ID NO:112)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-S-G-W-G (SEQ ID NO:113)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-S-G-W-F (SEQ ID NO:114)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-A-K-E-A (SEQ ID NO:115)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-A-K-E-M (SEQ ID NO:116)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-A-K-E-L (SEQ ID NO:117)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-F-K-E-L (SEQ ID NO:118)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-F-K-E-A (SEQ ID NO:119)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-Y-G-G-G (SEQ ID NO:120)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-E-R-L-Y-M-K (SEQ ID NO:121)
V-E-P-N-C-D-I-H-V-(NIe)-W-V-W-E-C-F-E-R-L-Y-(Aib)-L-T (SEQ ID NO:128)
V-E-P-N-C-D-I-H-V-L-W-V-W-E-C-F-E-R-L-Y-(Aib)-L-T (SEQ ID NO:129)
V-E-P-N-C-D-I-H-V-V-W-V-W-E-C-F-E-R-L-Y-(Aib)-L-T (SEQ ID NO:130)
V-E-P-N-C-D-I-H-V-M-W-(Kac)-W-E-C-F-E-R-L-Y-(D-Ala)-V-(D-Gln) (SEQ ID NO:136)
V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-R-L-(D-Leu)-(Kac) (SEQ ID NO:192)
V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-R-L-Y-G-(D-Leu)-T (SEQ ID NO:193)
V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-R-L-Y-G-P-L (SEQ ID NO:194)
V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-R-L-Y-(D-Ala)-(D-Leu) (SEQ ID NO:195)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L(-D-Leu)-K (SEQ ID NO:196)
V-E-P-N-C-D-I-H-V-M-W-V-W-E-C-F-E-R-L-Y-G-(D-Leu)-K (SEQ ID NO:197)
V-E-P-N-C-D-I-H-V-M-W-E-W-E-C-F-K-R-(D-Leu) (SEQ ID NO:198)
V-E-P-N-C-D-I-H-V-KW-E-W-E-C-F-(N-метилглутамат)-R-L (SEQ ID NO:199)
V-E-P-N-C-D-I-H-V-KW-V-E-E-C-F-(D-Glu)-R-L (SEQ ID NO:200)
V-E-P-N-C-D-I-H-V-KW-E-W-E-C-F-E-R(N-метиларгинин) (SEQ ID NO:201)
V-E-P-N-C-D-I-H-V-KW-E-W-E-C-F-E-R-(D-Asn) (SEQ ID NO:202)
V-E-P-N-C-D-I-H-V-KW-E-W-E-C-F-E-R-(Aib) (SEQ ID NO:203)
V-E-P-N-C-D-I-H-V-KW-E-W-E-C-F-(Aib)-R-L (SEQ ID NO:204)
V-E-P-N-C-D-I-H-V-KW-E-W-E-C-(нафталин)-E-R-L (SEQ ID NO:205)
V-E-P-N-C-D-I-H-V-M-W-V-E-C-F-K-R-L-Y-G-L-T (SEQ ID NO:206)
V-E-P-N-C-D-I-H-V-M-W-V-E-C-F-E-R-L-Y-K-L-E (SEQ ID NO:207)
V-E-P-N-C-D-I-H-V-M- W-E- W-E-C-F-E-R-(D-Leu) (SEQ ID NO:208)
V-E-P-N-C-D-I-H-V-E-W-E-W-E-C-F-K-R-L (SEQ ID NO:209)
V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-(гомоаргинин)-L-Y-(D-Ala)-(D-Leu) (SEQ ID NO:210)
V-E-P-N-C-D-I-H-V-M-W-K-W-E-C-F-E-R-Y-G-(D-Leu)-E (SEQ ID NO:211)
V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-R-L-Y-G-(D-Leu)-E (SEQ ID NO:212)
V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-R-L-Y-(Aib)-L-E (SEQ ID NO:213)
V-E-P-N-C-D-I-H-V-M-W-K-W-E-C-F-E-R-L-Y-(Aib)-L-E (SEQ ID NO:214)
V-E-P-N-C-D-I-H-V-M-W-K-W-E-C-F-E-R-(D-Leu)-K (SEQ ID NO:215)
V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-(Kac)-L-Y-(D-Ala)-(D-Leu) (SEQ ID NO:216)
V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-(Kac)-(цикло-Leu)-Y-(D-Ala)-(D-Leu) (SEQ ID NO:217)
V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-(Kac)-(Tle)-Y-(D-Ala)-(D-Leu) (SEQ ID NO:218)
В некоторых вариантах осуществления [VEGF-Пептид] по изобретению выбран из группы, состоящей из SEQ ID NOs: 60, 73, 76, 78, 192, 193, 194 или 195.
X10 может представлять M. [VEGF-Пептид] может представлять пептид, включающий последовательность, по существу гомологичную последовательности:
V1-E2-P3-N4-C5-D6-I7-H8-V9-M10-W11-X12-W13-X14-C15-F16-E17-R18-X19-X20X21-X22-X23 (SEQ ID NO:133), где X12 выбран из группы, состоящей из V, E и Kac, X14 представляет E или V, X19 может представлять любой остаток гидрофобной аминокислоты или ее D-изомер, X20 может отсутствовать или может представлять любую нейтральную, гидрофобную или ароматическую аминокислоту или ее D-изомер, X21 может отсутствовать или может представлять любой положительно заряженный остаток, или любой алифатический неполярный остаток, или его D-изоформу, X22 может отсутствовать или может быть выбран из группы, состоящей из G, V, L, I, P, S, T, W, F, E, Kac или их D-изомеров, X23 может отсутствовать или может быть выбран из группы, состоящей из G, A, I, L, Q, E, F, T, W, S, Y, Kac и их D-изомеров.
X12 может представлять E. [VEGF-Пептид] может представлять пептид, включающий последовательность, по существу гомологичную последовательности:
V1-E2-P3-N4-C5-D6-I7-H8-V9-M10-W11-E12-W13-X14-C15-F16-E17-R18-X19-X20-X21-X22-X23 (SEQ ID NO:134), где X14 представляет E или V, X19 может представлять остаток любой гидрофобной аминокислоты или ее D-изомер, X20 может отсутствовать или может представлять любую нейтральную, гидрофобную или ароматическую аминокислоту или ее D-изомер, X21 может отсутствовать или может представлять любой положительно заряженный остаток, или любой алифатический неполярный остаток, или его D-изоформу, X22 может отсутствовать или может быть выбран из группы, состоящей из G, V, L, I, P, S, T, W, F, E, Kac или их D-изомеров, X23 может отсутствовать или быть выбран из группы, состоящей из G, A, I, L, Q, E, F, T, W, S, Y, Kac и их D-изомеров.
[VEGF-Пептид] может включать последовательность, по существу гомологичную одной из следующих: SEQ ID NO:34, SEQ ID NO:108, SEQ ID NO:109, SEQ ID NO:110, SEQ ID NO:111, SEQ ID NO:112, SEQ ID NO:113, SEQ ID NO:114, SEQ ID NO:115, SEQ ID NO:116, SEQ ID NO:117, ID NO:118, SEQ ID NO:119, SEQ ID NO:120, SEQ ID NO:121.
X12 может представлять V. [VEGF-Пептид] может представлять пептид, включающий последовательность, по существу гомологичную последовательности:
V1-E2-P3-N4-C5-D6-I7-H8-V9-M10-W11-V12-W13-X14-C15-F16-E17-R18-X19-X20-X21-X22-X23 (SEQ ID NO:135), где X14 представляет E или V, X19 может представлять любой остаток гидрофобной аминокислоты или ее D-изомер, X20 может отсутствовать или может представлять любую нейтральную, гидрофобную или ароматическую аминокислоту или ее D-изомер, X21 может отсутствовать или может представлять любой положительно заряженный остаток или его D-изоформу, X22 может отсутствовать или может быть выбран из группы, состоящей из G, V, L, I, P, S, T, W, F, E, Kac или их D-изомеров, X23 может отсутствовать или может быть выбран из группы, состоящей из G, A, I, L, Q, E, F, T, W, S, Y, Kac и их D-изомеров.
[VEGF-Пептид] может включать последовательность, по существу гомологичную одной или более из следующих: SEQ ID NO:35, SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:38, SEQ ID NO:39, SEQ ID NO:40, SEQ ID NO:41, SEQ ID NO:42, SEQ ID NO:43, SEQ ID NO:44, SEQ ID NO:45, ID NO:46, SEQ ID NO:47, SEQ ID NO:48, SEQ ID NO:49, SEQ ID NO:50, SEQ ID NO:51, SEQ ID NO:52, SEQ ID NO:53, SEQ ID NO:54, SEQ ID NO:55, SEQ ID NO:56, ID NO:57, SEQ ID NO:58, SEQ ID NO:59, SEQ ID NO:60, SEQ ID NO:61, SEQ ID NO:62, SEQ ID NO:63, SEQ ID NO:64, SEQ ID NO:65, SEQ ID NO:66, SEQ ID NO:67, SEQ ID NO:68, SEQ ID NO:69, SEQ ID NO:70, ID NO:71, SEQ ID NO:72), SEQ ID NO:73, SEQ ID NO:74, SEQ ID NO:75, SEQ ID NO:76, SEQ ID NO:77, SEQ ID NO:78, SEQ ID NO:79, SEQ ID NO:80, SEQ ID NO:81, SEQ ID NO:82, ID NO:83, SEQ ID NO:84, SEQ ID NO:85, SEQ ID NO:86, SEQ ID NO:87, ID NO:88, SEQ ID NO:89, SEQ ID NO:90, SEQ ID NO:91, SEQ ID NO:92, SEQ ID NO:93, SEQ ID NO:94, SEQ ID NO:95, SEQ ID NO:96, ID NO:97, SEQ ID NO:98, SEQ ID NO:99, SEQ ID NO:100, SEQ ID NO:101, SEQ ID NO:102, SEQ ID NO:103, SEQ ID NO:104, SEQ ID NO:105, SEQ ID NO:106, SEQ ID NO:128, SEQ ID NO:129, SEQ ID NO:130.
В отношении различных вариантов осуществления [VEGF-Пептида], описанного в настоящей заявке, в некоторых аспектах изобретения R1 может представлять C(O)CH3. В некоторых аспектах изобретения R2 представляет NH2. R1 и/или R2 может отсутствовать. X19 может быть выбран из группы, состоящей из L, I, A, V, G или их D-изомеров. X19 может представлять L. X19 может представлять D-Leu. X20 может представлять Y. X20 может представлять D-Tyr. X21 может быть выбран из группы, состоящей из D-Ala, G, Aib и Kac. X21 может представлять D-Ala. X21 может представлять G. X22 может быть выбран из группы, состоящей из L, V, P, D-Leu, D-Pro. X22 может представлять D-Leu. X22 может представлять D-Pro. X22 может представлять L. X23 может отсутствовать.
В некоторых вариантах осуществления изобретения [VEGF-пептид] представляет (SEQ ID NO:78). В некоторых вариантах осуществления R1-[VEGF-пептид]-R2 представляет {C(O)CH3}-V-E-P-N-C-D-I-H-V-K-W-V-W-E-C-F-E-R-L-Y-(D-Ala)-(D-Leu)-{NH2} (SEQ ID NO:188) и K11 представляет связывающий остаток.
Связывание
Присутствие связывающего остатка (соответственно, и остатка, связывающего VEGF и остатка, связывающего Ang2) обеспечивает получение соединений по изобретению с большой гибкостью для связей с каркасами, макромолекулами и другими частями. В частности, соединения по изобретению могут быть надежно, прочно и эффективно ковалентно связаны с каркасами, такими как антитела, фрагменты антител, молекулы PEG, альбумин и т.д. К удивлению, было обнаружено, что расположение связывающего остатка в определенных ключевых положениях в соответствующем пептиде ведет к повышенной устойчивости и/или связыванию пептида. Связывающий остаток может быть выбран так, чтобы обеспечить образование боковой цепи, химические характеристики которой обеспечивают возможность специфических, надежных, направленных и эффективных химических ковалентных связей в этом положении. В некоторых аспектах изобретения, связывающий остаток ковалентно связан со связывающим участком антитела непосредственно или через промежуточный линкер. Связь может быть необратимой.
Соединения по изобретению могут быть ковалентно связаны с линкерной частью, L (или L', как описано ниже) посредством связывающего остатка. Возможны многочисленные линкеры; многие подходящие линкеры раскрыты в US2006205670, содержание которого включено в настоящее описание путем ссылки. В частности, аспекты US2006205670, относящиеся к общим формулам, описывающим линкеры, структуру определенных линкеров, синтез линкеров и комбинации различных элементов групп X, Y и Z, как конкретно и в целом описано в указанном документе, включены в настоящую заявку. Линкер может быть линейным или разветвленным и, возможно, включает одну или более карбоциклических или гетероциклических групп. Длину линкера можно рассматривать с точки зрения числа линейных атомов при подсчете циклических частей, таких как ароматические кольца и тому подобные самым коротким путем вокруг кольца. В некоторых вариантах осуществления линкер имеет линейный фрагмент секвенирования от 5 до 15 атомов, в других вариантах осуществления от 15 до 30 атомов, в еще одних вариантах осуществления - от 30 до 50 атомов, в еще одних вариантах осуществления - от 50 до 100 атомов и в еще одних вариантах осуществления - от 100 до 200 атомов. Другие учитываемые характеристики линкеров включают воздействие на физические или фармакокинетические свойства полученного соединения, такие как растворимость, липофильность, гидрофильность, гидрофобность, устойчивость (более или менее устойчив, а также планируемое разрушение), ригидность, гибкость, иммуногенность, модуляция связывания антител, способность быть включенным в мицеллу или липосому и тому подобные.
В некоторых аспектах изобретения соединение содержит линкер (L) или (L'), ковалентно связанный с боковой цепью связывающего остатка. Линкер может иметь формулу: -[Соединитель]-X-Y-Z; -[Соединитель]-X-Y-Z'; -X-Y-Z-; или -X-Y-Z'-; где: [Соединитель] присутствует, когда линкер является разветвленным, и, в случае присутствия, он ковалентно связан со связывающим остатком, и одной или более дополнительных Активных Молекул, X представляет биологически совместимую соединяющую цепь, включающую любой атом, выбранный из группы, состоящей из C, H, N, O, P, S, F, Cl, Br и I, и может содержать полимер или блок-сополимер и ковалентно связан со связывающим остатком, где линкер является линейным, Y представляет возможно присутствующую группу распознавания, содержащую по меньшей мере кольцевую структуру, и Z представляет реактивную группу, которая способна образовывать ковалентную связь с боковой цепью аминокислоты и связывающим участком антитела, и Z' представляет часть присоединения, содержащую ковалентную связь с боковой цепью аминокислоты в связывающем участке антитела.
В случае присутствия Y может иметь возможно замещенную структуру:
где a, b, c, d, и e независимо представляют углерод или азот; f представляет углерод, азот, кислород или серу; Y независимо присоединен к X и Z в любом из положений двух колец с достаточной валентностью; и не более чем четыре из a, b, c, d, e или f представляют одновременно азот, и предпочтительно каждый из a, b, c, d, и e в кольцевой структуре представляет углерод. В некоторых аспектах Y может представлять фенил. Без намерения быть связанными с какой-либо теорией, считают, что группа Y может содействовать расположению реактивной группы в связывающем участке антитела с тем, чтобы группа Z могла взаимодействовать с боковой цепью реактивной аминокислоты.
Линкер может быть сконструирован так, чтобы он содержал реактивную группу, способную ковалентно или не ковалентно образовывать связь с макромолекулой, такой как антитело, белок или его фрагмент. Реактивная группа выбирается для использования с реактивным остатком в определенном связывающем участке. Например, химическая часть для модификации антителом к альдолазе может представлять собой кетон, дикетон, бета-лактам, активный сложный эфир, галоидкетон, лактон, ангидрид, малеимид, альфа-галоидацетамид, циклогексилдикетон, эпоксид, альдегид, амидин, гуанидин, имин, энеамин, фосфат, фосфонат, эпоксид, азиридин, тиоэпоксид, маскированный или защищенный дикетон (например, кеталь), лактам, галоидкетон, альдегид и тому подобные. В вариантах осуществления настоящего изобретения связывание пептида по изобретению с линкером L или L', частями Z (или Z' при присоединении к макромолекуле) представляет собой реактивную группу.
В некоторых вариантах осуществления Z включает одну или более групп C=O, расположенных для образования азитидинона, дикетона, и ацил бета-лактама, активного сложного эфира, галоидкетона, группы циклогексил дикетона, альдегида, малеимида, активированного алкена, активированного алкина или, в целом, молекулы, содержащей уходящую группу, восприимчивую к нуклеофильному или электрофильному замещению. Другие группы могут включать лактон, ангидрид, альфа-галоидацетамид, имин, гидразид или эпоксид. Иллюстративные линкерные электрофильные реактивные группы, которые могут ковалентно связываться с реактивной нуклеофильной группой (например, боковой цепью лизина или цистеина) в связывающем участке антитела, включают ацил бета-лактам, простой дикетон, активный сложный эфир сукцинимида, малеимид, галоидацетимид с линкером, галоидкетон, циклогексилдикетон, альдегид, амидин, гуанидин, имин, энеамин, фосфат, фосфонат, эпоксид, азиридин, тиоэпоксид, маскироовный или защищенный дикетон (например, кеталь), лактам, сульфонат и тому подобные, маскированные группы C=O, такие как имины, кетали, ацетали и любую другую известную электрофильную группу. В определенных вариантах осуществления реактивная группа включает одну или более групп C=O, расположенных для образования ацил бета-лактама, простого дикетона, активного сложного эфира сукцинимида, малеимида, галоидацетамида с линкером, галоидкетона, циклогексил дикетона или альдегида. Z или Z', в случае их присутствия, могут представлять замещенный алкил, замещенный циклоалкил, замещенный арил, замещенный арилалкил, замещенный гетероциклил или замещенный гетероциклоалкил, где по меньшей мере один заместитель представляет 1,3-дикетоновую часть, ацил бета-лактам, активный сложный эфир, альфа-галоидкетон, альдегид, малеимид, лактон, ангидрид, альфа-галоидацетимид, амин, гидразид или эпоксид. В некоторых аспектах группа Z, в случае ее присутствия, ковалентно связана со связывающим участком антитела. В других аспектах группа Z ковалентно связана с каркасом макромолекулы, который может обеспечить пептидам по изобретению увеличенный период полувыведения.
В некоторых аспектах Z, в случае присутствия, имеет структуру:
где q=0-5. q может быть = 1 или 2. q может быть = 1. В других аспектах q может быть = 2.
Z', в случае присутствия, может иметь структуру:
где q=0-5, и Антитело-N- представляет ковалентную связь с боковой цепью в связывающем участке антитела.
q может быть = 1 или 2. q может быть = 1. В других аспектах q может быть = 2.
X может представлять группу, содержащую три компонента; Xp-Xs-Xy, где Xp представляет группу, специфически адаптированную для возможности объединения с боковой цепью связывающего остатка, Xs представляет спейсерную область группы X, и Xy представляет группу, адаптированную связываться с группой Y. В некоторых аспектах Xy выбран из амидной связи, эинимидной связи или гуаниновой связи. Xy может быть выбран с тем, чтобы обеспечить молекулу водорода вблизи (в пределах двух атомов) к группе Y. Хотя и не желая быть связанными с теорией, считают, что атом H может содействовать распознаванию группы Y гидрофобного кармана посредством взаимодействия с H-связью, в частности, в отношении гидрофобного кармана щели связывания каталитического антитела, такого как h38C2 (например, фиг. 2A). Так, например, амидная связь может быть ориентирована так, чтобы группа NH была непосредственно связана с группой Y, обеспечивая H группы NH для связывания водорода. Альтернативно, группа C=O амида может быть связана с группой Y, при H группы NH без 2 атомов, примыкающих к группе Y, но все же доступных для связывания H. В некоторых аспектах Xs выбран так, что Xs не обеспечивает каких-либо чрезмерно реактивных групп. Xs может быть выбран так, чтобы обеспечить общую длину групп X от 2 до 15 атомов. Xs может быть выбран так, чтобы общая длина группы X составляла от 2 до 10 атомов. Xs может быть выбран так, чтобы общая длина группы X составляла от 4 до 8 атомов. Xs может быть выбран так, чтобы общая длина группы X составляла 5 атомов. Xs может быть выбран так, чтобы общая длина группы X составляла 6 атомов. Xp в идеале выбран так, чтобы обеспечить возможность стратегии специфического, направленного, к