Гены и способы обеспечения устойчивости к фитофторозу пасленовых
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к генам устойчивости Rpi для повышения устойчивости к фитофторозу пасленовых у растений семейства пасленовых, а также к белкам, способным опосредовать ответ против Р.infestans. Раскрыты трансгенные растения семейства пасленовых, обладающие повышенной устойчивостью к фитофторозу пасленовых, содержащие вышеуказанные гены, а также способ получения таких растений. Описаны векторы для экспрессии белка, содержащие вышеуказанные гены. Также раскрыты способы обеспечения длительной устойчивости к заболеванию у картофеля с использованием вышеуказанных генов. Использование изобретения позволяет получить растения семейства пасленовых, обладающие повышенной устойчивостью к фитофторозу пасленовых по сравнению с растением семейства пасленовых дикого типа. 9 н. и 6 з.п. ф-лы, 12 ил., 6 табл., 7 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Новые гены, композиции и способы повышения устойчивости сельскохозяйственной культуры к фитофторозу пасленовых.
УРОВЕНЬ ТЕХНИКИ
Картофель (Solatium tuberosum L.) является четвертой по важности сельскохозяйственной культурой и наиболее важной незерновой сельскохозяйственной культурой в мире. При выращивании картофеля основным природным фактором, ограничивающим урожайность, является фитофтороз пасленовых, вызываемый патогеном Phytophthora infestans (Mont.) группы оомицетов, обнаруженным деБари. В отсутствие контроля это разрушительное заболевание может привести к полной потере урожая сельскохозяйственной культуры (Świeżyński и Zimnoch-Guzowska 2001). Обработка фунгицидом на сегодняшний день является наиболее распространенным способом контролирования фитофтороза пасленовых. Тем не менее, высокая стоимость применения фунгицида является проблемой, поскольку применение фунгицида может отрицательно сказываться на здоровьи и экологической безопасности, применение химических препаратов начинают ограничивать. Кроме того, данный патоген быстро эволюционирует, и некоторые из новых его вариантов нечувствительны к распространенным фунгицидам (Day и Shattock 1997; Goodwin и др. 1996). Следовательно, придание генетической устойчивости культивируемому картофелю рассматривают как важный способ достижения длительной устойчивости к фитофторозу пасленовых.
Описано два основных типа устойчивости к фитофторозу картофеля (Umaerus и Umaerus 1994). Первый, общий вид устойчивости часто основан на мажорных локусах количественных признаков (QTL) и нескольких минорных QTL и обеспечивает частичную устойчивость. Второй, специфичный вид устойчивости основан на мажорных доминантных генах устойчивости (R-генов). В ранних программах по разведению в первой половине прошлого века было идентифицировано 11 R-генов (R1-R11), полученных из S. demissum. Девять R-генов, R3 (в настоящее время разделены на R3a и R3b) и R5-R11 локализованы на хромосоме 11 (Bradshaw и др. 2006; EI-Kharbotly 1994, 1996; Huang и др. 2004; Huang 2005). Другие R-гены, происходящие из S. demissum, были картированы в различных положениях, включая R1 на хромосоме 5 (EI-Kharbotly и др. 1994; Leonards-Schippers и др. 1992) и R2 на хромосоме 4 (Li и др., 1998). Все R-гены из S. demissum, внедренные в культивируемый картофель, были преодолены патогеном, поскольку новые штаммы быстро эволюционировали и приобретали вирулентность в отношении ранее устойчивых хозяев (Umaerus и Umaerus 1994). Соответственно, частичная устойчивость, обеспечиваемая QTL, считалась более длительной, чем устойчивость, придаваемая отдельными R-генами (Turkensteen 1993). Тем не менее, частичная устойчивость в значительной степени коррелировала с типом созревания, что усложняло сохранение устойчивости при разведении (Wastie 1991). Также положения QTL в геноме часто соответствовали участку кластеров R-генов (Gebhart и Valkonen 2001; Grube и др. 2000).
Таким образом, недавние усилия, направленные на идентификацию устойчивости к фитофторозу пасленовых, были сосредоточены на мажорных R-генах, обуславливающих широкий спектр устойчивости, полученных из различных диких видов Solarium. Сообщалось, что помимо S. demissum другие дикие виды Solarium, такие как S. acaule, S. chacoense, S. berthaultii, S. brevidens, S. bulbocastanum, S. microdontum, S. sparsipilum, S. spegazzinii, S. stoloniferum, S. sucrense, S. toralapanum, S. vernei и S. verrucosum, являются новыми источниками устойчивости к фитофторозу пасленовых (обзор подготовлен Jansky 2000; Hawkes 1990). На сегодняшний день три R-гена, RB/Rpi-blb1, Rpi-blb2 и Rpi-blb3 из S. bulbocastanum были картированы на хромосомах 8, 6 и 4, соответственно (Nasess и др. 2000; Park и др. 2005а; van der Vossen и др. 2003, 2005). Другой R-ген, Rpi-abpt, вероятно, из S. bulbocastanum, был локализован на хромосоме 4 (Park и др. 2005b). Rpi1 из S. pinnatisectum на хромосоме 7 (Kuhl и др. 2001), Rpi-mcq1 из S. mochiquense (Smilde и др. 2005) и Rpi-phu1 из S. phureja на хромосоме 9 (Śliwka и др. 2006), о чем также сообщалось.
Как следует из обзора уровня техники в этой области, существует значительная потребность в новых генах, композициях и способах придания устойчивости к фитофторозу пасленовых. Описанное в настоящем документе изобретение удовлетворяет эту потребность путем скрининга диких видов Solanum и путем клонирования, а также введения и экспрессирования новых генов устойчивости Rpi в картофеле.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения выделили, идентифицировали и описали несколько различных R-генов фитофтороза пасленовых, полученных из диких видов картофеля S. okadae, а также из S. mochiquense и S. neorossii.
Согласно настоящему изобретению предложены новые последовательности генов, композиции и способы повышения устойчивости сельскохозяйственных культур, в частности, но не ограничиваясь, картофеля, к фитофторозу пасленовых, вызванному патогенным оомицетом Phytophthora infestans.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг.1 Происхождение генотипов, используемых для создания ВАС-библиотек. (а): К39 и (b): K182.
Фиг.2 Анализ размера вставки отобранных случайным образом ВАС-клонов из двух ВАС-библиотек, К39 (а) и K182 (b), с помощью гель-электрофореза в пульсирующем поле. ВАС-клоны расщепляли рестриктазой NotI. Получали полосы, соответствующие 7.5 т.п.н., из вектора клонирования plndigoBAC-5. Значения молекулярных масс по маркерам фага лямбда (Sigma Chemical) показаны на фигурах справа.
Фиг.3 Положения генов устойчивости к фитофторозу пасленовых Rpi-oka1, Rpi-oka2 и Rpi-oka3 из S. okadae u Rpi-nrs1 из S. neorossii.
Фиг.4 Изображения SCAR-маркеров, использовавшихся для скрининга двух ВАС-библиотек. TG551, расщепленный рестриктазой TaqI (a), связан с Rpi-oka1, TG551, расщепленным рестриктазой MwoI (b), и TG35 (с) связаны с Rpi-oka1, и U296361 (d) и TG591 (е) связаны с Rpi-mcq1. Указаны маркер размера 1 т.п.н. и исходные генотипы (А624, А613, А618 и А988), а остальные представляют собой ВАС-пулы, положительные по некоторым маркерам, идентифицированным с помощью ПЦР с последующим расщеплением рестриктазой. Устойчивая аллель помечена '<<' справа на каждой фигуре.
Фиг.5 Контиг ВАС-клонов, идентифицированный из ВАС-библиотеки К39 и покрывающий участок генома, содержащий Rpi-oka1 и Rpi-oka2.
Фиг.6 Картирование генов Rpi, полученных из Solarium okadae и S. neorossiic высоким разрежением и на малом участке.
Фиг.7 Выравнивание выявленных последовательностей белков Rpi-oka1, Rpi-oka2 и Tm-22. Показана полная последовательность аминокислот Rpi-oka1, точками отмечены идентичные остатки в двух других белках. В тех случаях, где остатки из Rpi-oka2 и Tm-22 отличаются от Rpi-oka1, показаны остатки в этих белках. Два различия в аминокислотах между Rpi-oka1 и Rpi-oka2 указаны жирным шрифтом. Предсказанные спиральные домены подчеркнуты, первый и четвертый гидрофобные остатки каждого повтора группы из семи остатков подчеркнуты двойной чертой. Консервативные мотивы в домене NB-ARC отмечены курсивными строчными буквами. Предполагаемые лейцин-богатые повторы (LRR) показаны над последовательностью.
Фиг.8 Выравнивание последовательностей белков Rpi-oka1, Rpi-nrs1 и Tm-22. Домены СС, NB-ARC и LRR выделены красным, зеленым и оранжевым, соответственно. Консервативные мотивы в домене NB-ARC подчеркнуты и выделены курсивом.
Фиг.9 Карты генетических связей на хромосоме IX локусов Rpi-oka1 (а) и Rpi-nrs1 (b), картированные в популяциях 7698 и 7663, соответственно. Числа слева показывают расстояния между генами в сантиморганах (сМ). Относительные положения картированных локусов обозначены горизонтальными линиями. Буква п обозначает размер каждой популяции.
Фиг.10 Расположение на карте гена устойчивости к фитофторозу пасленовых Rpi-mcq1 из S. mochiquense.
Фиг.11 Контиг ВАС-клонов, идентифицированный в ВАС-библиотеке К182 и покрывающий участок генома, содержащий Rpi-mcq1.
ПОДРОБНОЕ ПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Следующие последовательности приложены к данной заявке на Фиг.12:
| Sea ID | Последовательность Rpi |
| 1а | oka1 пн |
| 1b | oka2 пн |
| 1с | oka1 трансген, включая промотор и терминатор из pSLJ21152 |
| нт | |
| 2а | mcq1.1 пн |
| 2b | mcq1.2 пн |
| 2с | mcq1.1 трансген, включая промотор и терминатор из |
| pSLJ21153HT | |
| 2d | mcq1.2 трансген, включая промотор и терминатор из |
| pSLJ21148HT | |
| 3 | nrs1 нт |
| 4а | oka1 АК |
| 4b | oka2 АК |
| 5а | mcq1.1 АК |
| 5b | mcq1.2AK |
| 6 | nrs1 АК |
| (нт = последовательность нуклеотидов, АК = полипептидная последовательность) |
Приведенные выше последовательности представляют собой последовательности, удлиненные по сравнению с описанными в GB 714241.7, по которой заявлен приоритет настоящей заявки. В частности, они были удлинены, как указано далее:
SEQ ID 1a - удлинена на 99 дополнительных оснований в начале
SEQ ID 1b - удлинена на 141 дополнительное основание в начале
SEQ ID 3 - удлинена на те же 141 дополнительное основание в начале
SEQ ID 4a - удлинена на 33 дополнительных аминокислоты в начале
SEQ ID 4b - удлинена на 47 дополнительных аминокислот в начале
SEQ ID 6 - удлинена на те же 47 дополнительных аминокислот в начале.
Тем не менее, более не отказываются от приятзаний на более раннее изобретение. Таким образом, в тех случаях, когда какой-либо аспект или вариант реализации настоящего изобретения описан в отношении удлиненных последовательностей, описанных выше, следует понимать, что с соответствующими изменениями то же самое применимо к описанной ранее более короткой последовательности. Таким образом, все аспекты или варианты реализации настоящего изобретения по отдельности и в совокупности также будут с соответствующими изменениями охватывают:
SEQ ID 1а - нуклеотиды 100-2676
SEQ ID 1b - нуклеотиды 142-2718
SEQ ID 3 - нуклеотиды 142-2718
SEQ ID 4a - аминокислоты 34-891
SEQ ID 4b - аминокислоты 48-905
SEQ ID 6 - аминокислоты 48-905.
Следующие последовательности представляют собой кассеты экспрессии, включающие некоторые из описанных выше последовательностей:
В SEQ ID 1с (Rpi-oka1) - промотор Rpi-oka1 включен в участок, содержащий основания 1-709, включая нетранслируемую 5'-область (НТО), состоящую из оснований 627-709. Открытая рамка считывания (OPC) Rpi-oka1 присутствует на участке, содержащем основания 710-3382, а терминатор располагается от основания 3383 и далее. Эту последовательность клонировали в pSLJ21152 и затем использовали для трансформирования S. tuberosum и S. lycopersicum, чтобы придать устойчивость к Р. infestans.
В SEQ ID 2b (Rpi-mcq1.1) - промотор Rpi-mcq1.1 включен в участок, содержащий основания 1-2262, открытая рамка считывания (OPC) Rpi-mcq1.1 присутствует на участке, содержащем основания 2263-4848, а терминатор располагается от основания 4849 и далее. Эту последовательность клонировали в pSLJ21153 и затем применяли для трансформирования S. tuberosum и S. lycopersicum, чтобы придать устойчивость к Р. infestans.
В SEQ ID 2d (Rpi-mcq1.2) - промотор Rpi-mcq1.2 включен в участок, содержащий основания 1-1999, открытая рамка считывания (OPC) Rpi-mcq1.2 присутствует на участке, содержащем основания 2000-4567, и терминатор располагается от основания 4568 и далее. Эту последовательность клонировали в pSLJ21148 и затем применяли для трансформирования S. tuberosum и S. lycopersicum, чтобы придать устойчивость к Р. infestans.
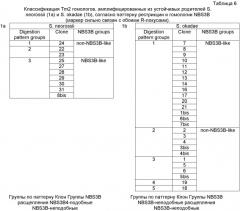
На Фигуре 8 показано, что последовательности Rpi-oka1 и Rpi-nrs1 очень близки.
Как описано ниже, полагают, что последовательности Rpi-oka2 фактически идентичны Rpi-nrs1, но для полноты описания приведены обе.
Тем не менее, последовательности Rpi-oka3, описанные ниже в данной заявке, идентичны Rpi-oka2, и, соответсвенно, не описаны в явной форме.
Наконец, различные кандидатные гены Rpi были идентифицированы у S. mochiquense и они оба приведены в указанных последовательностях. Полагают, что они оба являются функциональными R-генами с различными специфичностями узнавания.
Таким образом, в первом аспекте настоящего изобретения описаны изолированные молекулы нуклеиновых кислот, кодирующие функциональный ген Rpi, который, возможно, может быть выбран из S. okadae, S. mochiquense и S. neorossii.
В частности, варианты реализации настоящего изобретения обеспечивают изолированный ген устойчивости Rpi, имеющий последовательность, обозначенную в списке последовательностей SEQ. ID. 1a, 1b, 2а, 2b или 3.
Молекулы нуклеиновых кислот согласно настоящему изобретению могут быть изолированными и/или очищенными от их природного окружения, в по существу чистой или гомогенной форме, или свободными или по существу свободными от других нуклеиновых кислот видов, из которых они получены. В данной заявке в объем термина "изолированные" входят все указанные возможности.
Молекулы нуклеиновых кислот могут быть полностью или частично синтетическими. В частности, они могут быть рекомбинантными в том смысле, что последовательности нуклеиновых кислот, которые не встречаются вместе в природе (не прилегают друг к другу), были лигированы или объединены другим искусственным способом.
В качестве альтернативы они могли быть синтезированы непосредственно, например, с применением автоматизированного устройства для синтеза.
Предпочтительные нуклеиновые кислоты состоят по существу из обсуждаемого гена, возможно в векторе экспрессии, описанном более подробно ниже.
Нуклеиновая кислота согласно настоящему изобретению может включать кДНК, РНК, геномную ДНК и модифицированные нуклеиновые кислоты или аналоги нуклеиновых кислот. Во всех случаях, когда описана последовательность ДНК, например, со ссылкой на фигуру, если в контексте не указано другое, эквивалентная РНК с заменой Т на U везде, где он встречается, входит в объем настоящего изобретения. Во всех случаях, когда нуклеиновая кислота согласно настоящему изобретению описана в данной заявке, комплементарная нуклеиновая кислота будет также входить в объем настоящего изобретения. Комплементарной к данной нуклеиновой кислоте (последовательности) называют нуклеиновую кислоту(последовательность) такой же длины, что и данная нуклеиновая кислота (последовательность), но на 100% комплементарную ей.
Если описаны геномные последовательности нуклеиновых кислот согласно настоящему изобретению, нуклеиновые кислоты, включающие любой один или более (например, 2) интронов или экзонов из любой из этих последовательностей, также включены.
Ген устойчивости в контексте настоящего изобретения представляет собой ген, который контролирует устойчивость к фитофторозу пасленовых, вызванную Р. infestans. Такой ген может кодировать полипептид, способный узнавать и активировать защитный ответ у растения, в ответ на введение указанного патогена, или раздражителем, или его продуктом гена Avr.
Нуклеиновые кислоты согласно первому аспекту можно успешно использовать, например, для картофеля.
Нуклеиновая кислота согласно настоящему изобретению может кодировать одну из последовательностей аминокислот, описанных выше (4а, 4b, 5a, 5b, 6), например может быть вырожденным эквивалентом соответствующих последовательностей нуклеотидов.
В дополнительном аспекте настоящего изобретения описаны нуклеиновые кислоты, которые представляют собой варианты последовательностей согласно первому аспекту.
Вариант молекулы нуклеиновой кислоты гомологичен или идентичен части кодирующей последовательности или целой кодирующей последовательности, описанной выше. В целом, варианты могут кодировать полипептиды или их можно применять для выделения или амплификации нуклеиновых кислот, которые кодируют полипептиды, способные опосредовать ответ на Р. infestans, и/или которые будут специфично связываться с антителом, которое образуется в ответ на полипептиды, описанные выше (4a, 4b, 5a, 5b, 6).
Вариантами согласно настоящему изобретению могут быть искуссвенные нуклеиновые кислоты (т.е. содержащие последовательности, которые имеют неприродное происхождение), которые специалист сможет получить, руководствуясь описанием настоящего изобретения. В качестве альтернативы они могут быть новыми, встречающимися в природе, нуклеиновыми кислотами, которые были выделены или могут быть выделены с применением последовательностей согласно настоящему изобретению, например, из S. mochiquense, S. okadae и S. neorossii.
Таким образом, вариант может быть отличительной частью или фрагментом (полученным любым способом), соответствующим части приведенной последовательности. Указанные фрагменты могут кодировать определенные функциональные части полипептида, например LRR-участки, или сайты терминации.
В равной мере фрагменты могут найти применение при зондировании или амплификации приведенных последовательностей, или близких им последовательностей. Подходящие длины фрагментов и условия для таких процессов обсуждаются более подробно ниже.
Также включены нуклеиновые кислоты, которые были удлинены с 3'- или 5'-конца.
Варианты последовательности, которые встречаются в природе, могут включать аллели или другие гомологи (которые могут включать полиморфизмы или мутации по одному или более основаниям).
Искусственные варианты (производные) могут получить специалисты в данной области, например, с помощью сайт-направленного или неспецифического мутагенеза, или путем непосредственного синтеза. Предпочтительно, вариант нуклеиновой кислоты получают либо непосредственно либо опосредованно (например, с помощью одного или более этапов амплификации или репликации) из исходной нуклеиновой кислоты, включающей часть или всю последовательность согласно первому аспекту. Предпочтительно, она кодирует ген устойчивости к Р. infestans.
В объем термина "вариант" нуклеиновой кислоты в данном описании входят все указанные возможности. Когда термин используется применительно к полипептидам или белкам, он указывает на кодируемый вариантом нуклеиновой кислоты продукт экспрессии.
Некоторые из аспектов настоящего изобретения, относящиеся к указанным вариантам, далее будут описаны более подробно.
Вычисленные идентичности нуклеотидов были такими, как указано далее:
| Rpi-oka1 | Rpi-oka2 | Rpi-nrs1 | Rpi-mcq1.1 | Rpi-mcq1.2 | |
| Rpi-oka1 | |||||
| Rpi-oka2 | 98% | ||||
| Rpi-nrs1 | 98% | 100% |
| Rpi-mcq1.1 | 84% | 83% | 83% | ||
| Rpi-mcq1.2 | 83% | 82% | 82% | 87% | |
| Tm2-2 | 80% | 79% | 79% | 85% | 84% |
Расчет идентичности аминокислот были такими, как указано далее:
| Rpi-oka1 | Rpi-oka2 | Rpi-nrs1 | Rpi-mcq1.1 | Rpi-mcq1.2 | |
| Rpi-oka1 | |||||
| Rpi-oka2 | 98% | ||||
| Rpi-nrs1 | 98% | 100% | |||
| Rpi-mcq1.1 | 76% | 75% | 75% | ||
| Rpi-mcq1.2 | 76% | 75% | 75% | 81% | |
| Tm2-2 | 72% | 71% | 71% | 77% | 75% |
Указанные выше множественные сравнения выполняли, применяя AlignX (Vector NTI Suite Invitrogen) с ядром на основе матрицы CLUSTAL.
В более общем смысле, гомологию (т.е. близость или идентичность) можно определить, сравнивая последовательности с помощью программ BestFit и GAP из пакета программного обеспечения GCG, Wisconsin Package 10.0 от Genetics Computer Group, Мэдисон, Висконсин. CLUSTAL также представляет собой матрицу, используемую в BestFit. Параметры предпочтительно устанавливают на значения по умолчания, как указано далее: штраф за открытие гэпа (пробела): 9; штраф за продление гэпа: 2. Гомологию можно определить на уровне последовательности нуклеотидов и/или кодируемой последовательности аминокислот. Предпочтительно, последовательность нуклеиновой кислоты и/или аминокислот имеет по меньшей мере приблизительно 50%, или 60%, или 70%, или 80% гомологии, наиболее предпочтительно по меньшей мере приблизительно 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% гомологии с последовательностью SEQ. ID. 1a, 1b, 2a, 2b или 3, или 4а, 4b, 5a, 5b, или 6 в соответствующих случаях.
В частности, настоящее изобретение обеспечивает изолированный ген устойчивости Rpi, имеющий последовательность, которая на по меньшей мере приблизительно 80% гомологична последовательности нуклеиновой кислоты, обозначенной в списке последовательностей SEQ. ID. 1a, 1b, 2a, 2b или 3.
Настоящее изобретение дополнительно обеспечивает изолированный белок, включающий последовательность аминокислот, которая на по меньшей мере 80% гомологична последовательности аминокислот, обозначенной в списке последовательностей SEQ. ID. 4а, 4b, 5a, 5b, или 6. Таким образом, вариант полипептида в соответствии с настоящим изобретением может включать в пределах последовательностей, представленных в данной заявке, одно изменение аминокислоты или 2, 3, 4, 5, б, 7, 8, или 9 изменений, приблизительно 10, 15, 20, 30, 40 или 50 изменений, или больше, чем приблизительно 50, 60, 70, 80, 90, 100, 200, 400 изменений. Вдобавок к одному или более изменениям в представленной последовательности аминокислот вариант полипептида может включать дополнительные аминокислоты на С-конце и/или N-конце.
Таким образом, в дополнительном аспекте настоящего изобретения описан способ получения производного нуклеиновой кислоты, включающий этап модифицирования кодирующей последовательности нуклеиновой кислоты согласно настоящему изобретению, например SEQ. ID. 1a, 1b, 2a, 2b или 3.
Для получения производного в последовательность можно внести изменения с помощью одного или более присоединений, вставок, делеций или замен одного или более нуклеотидов в нуклеиновой кислоте, что приводит к присоединению, вставке, делеций или замене одной или более аминокислот в кодируемом полипептиде. Изменения могут быть желательны для ряда причин, включая включение или удаление следующих свойств: последовательности сайтов для эндонуклеаз рестрикции; использование кодона; другие сайты, необходимые для посттрансляционной модификации; сайты расщепления в кодируемом полипептиде; мотивы в кодируемом полипептиде (например, сайты связывания). Лидерные или другие нацеливающие последовательности могут быть удалены из экспрессирующегося белка, чтобы определить его положение после экспрессии. Все это может способствовать эффективному клонированию и экспрессированию активного полипептида в рекомбинантной форме (описано ниже).
Другой желательной мутацией может быть неспецифический или сайт-направленный мутагенез, позволяющий измененить активность (например, специфичности) или стабильность кодируемого полипептида. Изменения могут представлять собой консервативное изменение, т.е. замену одного гидрофобного остатка, такого как изолейцин, валин, лейцин или метионин, на другой, или замену одного полярного остатка на другой, как, например, аргинина на лизин, глутаминовой кислоты на аспарагиновую кислоту, или глутамина на аспарагин. Специалистам в данной области хорошо известно, изменение первичной структуры полипептида путем консервативной замены не может значительно изменить активность этого пептида, так как боковая цепь аминокислоты, выстраиваемой в последовательность, сможет образовывать связи и контакты, аналогичные тем, которые образовывала боковая цепь аминокислоты, которая была замещена. Это в равной степени справедливо в отношении участка, имеющего критическое значение для определения конформации пептида.
Также включены варианты, включающие неконсервативные замены. Что хорошо известно специалистам в данной области, замены на участках пептида, которые не важны для определения его конформации, не могут сильно влиять на его активность, так как они сильно не изменяют трехмерную структуру пептида.
На участках, которые важны для определения конформации пептидов или их активности, такие изменения могут придать полипептиду полезные свойства. В действительности, изменения, такие как изменения, описанные выше, могут придать несколько полезных свойств пептиду, например измененную стабильность или специфичность. Например, манипуляции с LRR-участками полипептидов, кодируемых нуклеиновыми кислотами согласно настоящему изобретению, могут позволить получить новую избирательность устойчивости, например, по отношению к культурам Р. infestans.
LRR-участки также можно привить на другие NBS-участки (например, из других генов устойчивости). Таким образом, способы получения новой избирательности могут включать смешивание или введение последовательностей из родственных генов устойчивости в последовательности Rpi, описанные в данной заявке. В альтернативной стратегии модификации последовательностей Rpi используют ПЦР, описанную ниже (Но и др., 1989, Gene 77, 51-59) или перетасовка ДНК (Crameri и др., 1998, Nature 391).
Подробный анализ некоторых ОРС согласно настоящему изобретению приведен в Примерах ниже, включая обозначение вариантов, включающих замены, и обозначение интересующих участков.
В дополнительном аспекте настоящего изобретения предусмотрен способ идентификации и/или клонирования варианта нуклеиновой кислоты из растения, в указанном способе используют отличную последовательность нуклеотидов Rpi (например, которая представлена в последовательности SEQ. ID. 1А, 1В, 2А, 2В или 3, или комплементарную ей, или вырожденные праймеры, основанные на ней).
Олигонуклеотид для применения в реакциях зондирования или амплификации включает или состоит из приблизительно 30 или менее нуклеотидов в длину (например 18, 21 или 24). Как правило, специфичные праймеры состоят из не менее чем 14 нуклеотидов в длину. Для оптимальной специфичности и экономической эффективности могут быть предпочтительными праймеры, состоящие из 16-24 нуклеотидов в длину. Специалисты в данной области имеют достаточный опыт в разработке праймеров для применения в таких процессах, как ПЦР. В случае необходимости, зондирование можно осуществить с целыми рестрикционными фрагментами гена, описанного в данной заявке, которые могут состоять из сотен или даже тысяч нуклеотидов в длину.
Предпочтительно зонд/праймер отличается в том смысле, что он присутствует во всех или некоторых из последовательностей Rpi, описанных в данной заявке, но не в последовательности гена устойчивости из известного уровня техники.
Например, результаты относительно функциональных аллелей, представленные в настоящем описании (см., например, Фиг.10 или Фиг. 11), позволяют идентифицировать функциональные аллели Rpi, как указано далее.
В дополнительном варианте реализации вариант в соответствии с настоящим изобретением также возможно получен способом, который включает:
(а) обеспечение препарата нуклеиновой кислоты, например, из растительных клеток,
(b) обеспечение молекулы нуклеиновой кислоты, которая представляет собой зонд, описанный выше,
(c) приведение во взаимодействие нуклеиновой кислоты в указанном препарате с указанной молекулой нуклеиновой кислоты в условиях, подходящих для гибридизации указанной молекулы нуклеиновой кислоты с любым указанным геном или гомологом в указанном препарате, и идентификацию указанного гена или гомолога, если таковой присутствует, по его гибридизации с указанной молекулой нуклеиновой кислоты.
При зондировании можно применять стандартную методику саузерн-блоттинга. Например, ДНК можно экстрагировать из клеток и расщепить различными рестриктазами. Фрагменты рестрикции затем можно разделить с помощью электрофореза в агарозном геле, с последующей денатурацией и переносом на нитроцеллюлозный фильтр или нейлон. Меченый зонд можно гибридизировать с фрагментами ДНК на фильтре и определить связывание. ДНК для зондирования возможно получен из препаратов РНК из клеток.
Тестируемая нуклеиновая кислота может быть получена из клетки в виде геномной ДНК, кДНК или РНК, или смеси любых из перечисленных молекул, предпочтительно в виде библиотеки в подходящем векторе. При использовании геномной ДНК можно применять зонд для идентифицирования нетранскрибируемых участков указанного гена (например, промоторов и т.д.), как описано далее в данной заявке. Зондирование, возможно, можно осуществить с использованием так называемых чипов нуклеиновых кислот (для обзора см. Marshall & Hodgson (1998) Nature Biotechnology 16: 27-31).
Предварительные эксперименты можно осуществить путем гибридизации в условиях низкой жесткости. Для зондирования предпочтительными условиями являются достаточно строгие условия для получения простого паттерна с небольшим количеством гибридизаций, идентифицированных как положительные, которые можно исследовать далее.
Например, скрининг первоначально можно вести в условиях, которые включают температуру, равную приблизительно 37°С или менее, концентрацию формамида, равную менее чем приблизительно 50%, и от средней до низкой концентрации соли (например, стандартный раствор хлорида и цитрата натрия ("SSC")=0.15 М хлорид натрия; 0.15 М натрия цитрат; pH 7).
В качестве альтернативы условия могут включать температуру, равную приблизительно 50°С или менее, и высокую концентрацию соли (например, "SSPE" 0.180 мМ хлорид натрия; 9 мМ вторичный кислый фосфат натрия; 9 мМ первичный кислый фосфат натрия; 1 мМ натрия EDTA; pH 7.4). Предпочтительно, скрининг проводят при приблизительно 37°С, концентрации формамида, равной приблизительно 20%, и концентрации соли, равной приблизительно 5×SSC, или температуре, равной приблизительно 50°С, и концентрации соли, равной приблизительно 2×SSPE. Эти условия позволяют идентифицировать последовательности, которые имеют существенную степень гомологии (схожести, идентичности) с последовательностью зонда, не требуя идеальной гомологии для идентификации стабильного гибрида.
Подходящие условия включают, например, для обнаружения последовательностей, которые приблизительно на 80-90% идентичны, гибридизацию в течение ночи при 42°С в 0.25 М Na2HPO4, pH 7.2, 6.5% ДСН, 10% сульфате декстрана и окончательную промывку при 55°С в 0.1× SSC, 0.1% ДСН. Для обнаружения последовательностей, которые более чем приблизительно на 90% идентичны, подходящие условия включают гибридизацию в течение ночи при 65°С в 0.25 М Na2HPO4, pH 7.2, 6.5% ДСН, 10% сульфате декстрана и окончательную промывку при 60°С в 0.1× SSC, 0.1% ДСН.
В данной области хорошо известно, что следует постепенно повышать жесткость условий гибридизации до тех пор, пока не останется лишь несколько положительных клонов. Когда получают большое число гибридизующихся фрагментов при низкой фоновой гибридизации, считают, что подходящие условия достигнуты.
Используя эти условия, можно проводить поиск в библиотеках нуклеиновых кислот, например в библиотеках кДНК, типичных для экспрессированых последовательностей. Специалисты в данной области смогут легко применить подходящие условия желательной жесткости для избирательной гибридизации, принимая во внимание такие факторы, как длина олигонуклеотида и состав оснований, температура и т.п. Одна общая формула для расчета жесткости условий, необходимых для достижения гибридизации между молекулами нуклеиновых кислот с определенной гомологией последовательностей, представляет собой (Sambrook и др., 1989):
Tm = 81.5°C + 16.6Log [Na+] + 0.41 (% G+C) - 0.63 (% формамида) - 600/#п.о. в дуплексе.
В качестве иллюстрации приведенной выше формулы: если использовать [Na+] = [0.368] и 50-% формамид, при содержании GC, равном 42%, и среднем размере зонда, равном 200 оснований, Тт будет равна 57°С. Tm дуплекса ДНК уменьшается на 1-1.5°С с каждый снижением гомологии на 1%. Таким образом, мишени с более чем приблизительно 75% идентичностью последовательностей можно будет наблюдать при температуре гибридизации, равной 42°С. Такая последовательность будет считаться по существу гомологичной последовательности нуклеиновых кислот согласно настоящему изобретению.
Связывание зонда с целевой нуклеиновой кислотой (например, ДНК) можно измерить, используя любую из множества методик, которые доступны специалистам в данной области. Например, зонды можно снабдить радиоактивной, флуоресцентной или ферментативной меткой. Другие способы, в которых не используется мечение зонда, включают амплификацию с использованием ПЦР (см. ниже) или расщепление РНКазой. После идентификации успешной гибридизации осуществляют выделение гибридизированной нуклеиновой кислоты, которое может включать один или более этапов ПЦР или амплификации вектора в подходящем хозяине.
Таким образом, один вариант реализации данного аспекта настоящего изобретения представляет собой нуклеиновую кислоту, которая включает или состоит по существу из последовательности нуклеотидов, комплементарных последовательности нуклеотидов, гибридизующихся с любой кодирующей последовательностью, приведенной в данной заявке. В качестве альтернативы нуклеиновая кислота согласно данному аспекту может представлять собой нуклеиновую кислоту, гибридизующуюся с последовательностью нуклеотидов, комплементарной любой кодирующей последовательности, приведенной в данной заявке. Разумеется, ДНК, как правило, двунитевая, и методики блоттинга, такие как гибридизация по Саузерну, часто осуществляют после разделения нитей, вне зависимости от того, которая из нитей гибридизируется. Предпочтительно гибридизируемая нуклеиновая кислота или комплементарная ей кодирует продукт, способный влиять на свойство устойчивости растения, в частности на реакцию устойчивости, связанную с Rpi.
В дополнительном варианте реализации гибридизацию молекулы нуклеиновой кислоты с вариантом можно определить или идентифицировать опосредованно, например, применяя реакцию амплификации нуклеиновых кислот, в частности, полимеразную цепную реакцию (ПЦР) (см. "PCR protocols; A Guide to Methods and Applications", ред. Innis и др., Academic Press, Нью-Йорк, (1990)).
Способы, описанные выше, также можно применять для определения присутствия одной из последовательностей нуклеотидов согласно настоящему изобретению в рамках генетического контекста отдельного растения. Это может оказаться полезным для программ разведения растений, например, для непосредственного выбора растений, содержащих аллели, которые отвечают за желательные признаки в этих видах растения либо в родительских растениях, либо в потомстве (например, гибриды, F1, F2 и т.д.).
В данной заявке, если по контексту не требуется иное, термин "нуклеиновая кислота Ppi" включает любую из нуклеиновых кислот согласно настоящему изобретению, описанных выше, включая функциональные варианты.
В одном аспекте настоящего изобретения нуклеиновая кислота Rpi, описанная выше, представлена в виде рекомбинантного и предпочтительно реплицируемого вектора. "Вектор" включает, среди прочего, любую плазмиду, космиду, фаг или бинарный вектор Agrobacterium в дву- или однонитевой линейной или кольцевой форме, который обладает или не обладает способностью самостоеятельно передаваться или активироваться и который обладает способностью трансформировать прокариотического или эукариотического хозяина либо путем встраивания в геном клетки, либо путем внехромосомного присутствия (например, автономно реплицирующаяся плазмида с сайтом начала репликации). В частности, включены челночные векторы, под которыми подразумевается ДНК-носитель, способный, благодаря своей природе или конструкции, реплицироваться в двух различных организмах-хозяевах, которые могут быть выбраны из актиномицетов, и родственных видов, бактерий и эукариот (например, высшего растения, дрожжей или клеток грибка).
Вектор, включающий нуклеиновую кислоту согласно настоящему изобретению, не обязательно включает промотор или другую регуляторную последовательность, в частности, если вектор используется для введения нуклеиновой кислоты в клетки для рекомбинации в геном.
Предпочтительно, нуклеиновая кислота в векторе находится под контролем и функционально связана с подходящим промотором или другими регуляторными элементами, что обеспечивает транскрипцию в клетке-хозяине, такой как микробная, например, бактериальная или растительная клетка. Вектор может представлять собой бифункциональный экспрессионный вектор, который функционирует во множестве хозяев. В случае геномной ДНК нуклеиновая кислота может содержать собственный промотор или другие регуляторные элементы, а в случае кДНК она может находиться под контролем подходящего промотора или других регуляторных элементов для экспрессии в клетке-хозяине.
Под "промотором" подразумевают последовательность нуклеотидов, с которых может инициироваться транскрипция функционально связанной ДНК, находящейся по ходу транскрипции (т.е. в 3'-направлении на смысловой нити двунитевой ДНК). "Функционально связанный" обозначает фрагмент, присоединенный в виде части той же молекулы нуклеиновой кислоты, соответствующим образом расположенный и ориентированный для инициирования транскрипции с указанного промотора. ДНК, функционально связанная с промотором, "находится под регуляцией инициирования транскрипции" указанного промотора