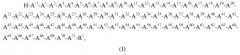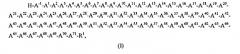Аналоги инсулиноподобного фактора роста-1 (igf-1), содержащие аминокислотную замену в положении 59
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии, конкретно к новому пептидному аналогу инсулиноподобного фактора роста-1 (IGF-1), содержащему аминокислотную замену метионина в положении 59 на Asn, Leu, Nle, Ile, Arg, A6c, Glu, Trp или Tyr, а также другие дополнительные замены, вставки и делеции. Указанный пептид или его фармацевтически приемлемую соль используют в составе фармацевтической композиции для лечения IGF-1-опосредованных заболеваний, а также в способе лечения низкорослости. Изобретение позволяет получить аналог-агонист IGF-1, обладающий повышенной биологической активностью по сравнению с нативным IGF-1. 3 н. и 14 з.п. ф-лы, 2 табл.
Реферат
Область изобретения
Настоящее изобретение относится к новым аналогам инсулиноподобного фактора роста-1 (IGF-1), к фармацевтическим композициям, содержащим указанные аналоги, и к применению указанных аналогов для лечения состояний, опосредованных IGF-1-рецептором, таких как низкорослость, терапии диабета, лечения нейродегенеративных заболеваний и для восстановления хряща. Более конкретно, настоящее изобретение относится к новым аналогам IGF-1, содержащим аминокислотную замену в положении 59, например (Asn59)hIGF-1(1-70)-OH и другую(ие) замену(ы), как это определено в описании.
Предшествующий уровень техники
IGF-1 представляет собой полипептидный гормон длиной 70 аминокислот, характеризующийся инсулиноподобной и митогенной ростовой биологической активностью. Данный гормон усиливает рост клеток в различных тканях, включая мышечно-скелетные системы, печень, почки, кишечник, ткани нервной системы, сердце и легкие.
IGF-1 дикого типа имеет следующую аминокислотную последовательность с тремя межцепочечными дисульфидными мостиками, где боковые цепи каждой пары остатков A6 и A48, A47 и A52 и A18 и A61 образуют дисульфидную связь (SEQ ID NO:50):
Хотя IGF-1 присутствует в разнообразных тканях организма, обычно он находится в неактивной форме, в которой он связан с IGF-связывающим белком (IGFBP). Известны шесть родственных IGFBP, и их обозначают IGFBP1-IGFBP6. См., например, Holly and Martin, "Insulin-like Growth Factor Binding Proteins: A Review of Methodological Aspects of Their Purification, Analysis and Regulation," Growth Regul., 4(Suppl 1):20-30 (1994). IGFBP играют важную роль в регуляции IGF-1 за счет наличия ингибиторного и/или стимулирующего эффектов на действие IGF-1. Например, примерно 90% циркулирующего IGF-1 присутствует в тримолекулярном комплексе, содержащем IGFBP-3 и чувствительную к кислотности дополнительную молекулу. IGF-1 в составе таких комплексов не может связываться с поверхностными рецепторами, и поэтому он не активен биологически. IGF-1, присутствующий в составе тримолекулярного комплекса, также характеризуется существенно более продолжительным периодом полужизни, чем не входящий в комплекс IGF-1.
Нарушение действия IGF-1 может вносить вклад в некоторые физиологические нарушения, включая нейродегенеративные заболевания, такие как болезнь двигательного нейрона (т.е. боковой амиотрофический склероз (ALS)), мышечная дистрофия и рассеянный склероз, заболевания хрящей, такие как остеоартрит, костные заболевания, такие как остеопороз, воспалительные заболевания, такие как ревматоидный артрит, ишемические повреждения органов, таких как сердце, головной мозг или печень, и так далее.
Как хорошо известно специалистам в данной области, известные и потенциальные варианты применения IGF-1 разнообразны и многочисленны. Например, в ряде исследований сообщается о применении IGF-1 в качестве потенциального терапевтического средства для лечения нейродегенеративных состояний. См., например, Kanje et al., Brain Res., 486:396-398 (1989); Hantai et al., J. Neurol. Sci., 129:122-126 (1995); Contreras et al., Pharmac. Exp. Therap., 274:1443-1499 (1995); Di Giulio et al., Society for Neuroscience, 22:1960 (1996); Di Giulio et al., Society for Neuroscience, 23:894 (1997); Hsu et al., Biochem. Mol. Med., 60(2):142-148 (1997); Gorio et al., Neuroscience, 82:1029-1037 (1998). Терапия IGF-1 показана при многих неврологических состояниях, включая ALS, инсульт, эпилепсию, болезнь Паркинсона, болезнь Альцгеймера, острое травматическое повреждение и другие нарушения, ассоциированные с травмой, старением, заболеванием или повреждением. См., например, патенты США № 5093137; 5652214; 5703045; международные публикации WO 90/1483 и WO 93/02695.
Применение терапии IGF-1 при различных других состояниях упоминается в ряде публикаций. См. например, Schalch et al., "Modern Concepts of Insulin-Like Growth Factors," ed. Spencer (Elsevier, New York), p. 705-714 (1991); Clemmons and Underwood, J. Clin. Endocrinol. Metab., 79(1):4-6 (1994); и Langford et al., Eur. J. Clin. Invest., 23(9):503-516 (1993) (относящиеся, например, к резистентным к инсулину состояниям и диабету); и O'Shea et al., Am. J. Physiol., 264:F917-F922 (1993) (относящаяся, например, к почечной недостаточности). Также см. патент США № 7258864 (относящийся к низкорослости); патенты США № 5110604 и 5427778 (относящиеся, например, к заживлению ран); патент США № 5126324 (относящийся, например, к сердечным заболеваниям и задержке роста); патент США № 5368858 (относящийся, например, к дефектам или повреждениям хряща); патенты США № 5543441 и 5550188 (относящиеся, например, к косметической пересадке ткани); патент № 5686425 (относящийся, например, к ткани шрамов, локализованной мышечной дисфункции и недержанию мочи); и патент США № 5656598 (относящийся, например, к росту кости). Также см. международные публикации WO 91/12018 (относящуюся, например, к заболеваниям кишечника); WO 92/09301 и WO 92/14480 (относящиеся, например, к заживлению ран); WO 93/08828 (относящуюся, например, к повреждению нейронов, ассоциированному с ишемией, гипоксией или нейродегенерацией); WO 94/16722 (относящуюся, например, к устойчивости к инсулину); WO 96/02565A1 (относящуюся, например, к комплексу IGF/IGFBP для стимуляции образования кости и для регуляции реструктурирования кости); публикацию заявки на выдачу патента США 2003/0100505 (относящуюся, например, к остеопорозу) и публикацию заявки на выдачу патента США 2005/0043240 (относящуюся к ожирению).
Хотя терапию IGF-1 используют для ряда физиологических показаний, результаты иногда непредсказуемы. Краткосрочные благоприятные эффекты иногда не сохраняются (см., например, Miller et al., Kidney International, 46:201-207 (1994)), и могут возникать неблагоприятные побочные эффекты, в частности, от введения высоких доз и/или длительного введения (см., например, Jabri et al., Diabetes, 43:369-374 (1994); Wilton, Acta Paediatr., 393:137-141 (1992)). Также сообщалось, что высокие концентрации IGF-1 повышают риск рака предстательной железы (Chan et al., Science, 278:563-566 (1998)).
В соответствии с этим в данной области существует потребность в лучших путях лечения состояний, которые реагируют на IGF-1 и/или другие белки, которые связываются с белками, связывающими инсулиноподобный фактор роста. Настоящее изобретение удовлетворяет данные потребности и дополнительно предоставляет другие связанные с ними преимущества.
Сущность изобретения
Как обнаружено авторами настоящего изобретения, за счет замены остатка метионина в положении 59 IGF-1 дикого типа, который является химически нестабильным и может легко окисляться другой аминокислотой, как описано в настоящем документе, например, (Asn59)hIGF-1(1-70)-OH, полученные в результате аналоги IGF-1 становятся химически более стабильными и как таковые менее чувствительными к окислению во время продукции, очистки, хранения и т.д.
В одном из аспектов настоящее изобретение относится к пептидным вариантам (т.е. аналогам) IGF-1 следующей формулы (I):
в которой:
A-1 представляет собой Met, Ser или делетирована;
A1 представляет собой Gly, Ala, Asn, Asp, Gln, Glu или делетирована;
A2 представляет собой Pro, Ala, Arg, Asp, Gln, Glu, Lys или делетирована;
A3 представляет собой Glu, Ala, Asp, Gln или делетирована;
A4 представляет собой Thr, Ala, Asn, Asp, Gln, Glu, Ser;
A5 представляет собой Leu, Acc, Ala, Ile или Val;
A6 представляет собой Cys, D-Cys, hCys, D-hCys, β-Me-Cys, D-β-Me-Cys, N-Me-Cys, D-N-Me-Cys, Ala, Pen или D-Pen;
A7 представляет собой Gly, Ala, Asn, Asp, Gln или Glu;
A8 представляет собой Ala, Arg, Asn, Asp, Gln, Glu или Lys;
A9 представляет собой Glu, Ala, Asp или Gln;
A10 представляет собой Leu, Acc, Ala, Ile или Val;
A11 представляет собой Val, Ala, Ile или Leu;
A12 представляет собой Asp, Ala, Arg, Asn, Gln, Glu или Lys;
A13 представляет собой Ala, Asn, Asp, Gln, Glu, Ile, Leu или Val;
A14 представляет собой Leu, Acc, Ala, Ile или Val;
A15 представляет собой Gln, Ala, Asn, Asp или Glu;
A16 представляет собой Phe, Ala, Asn, Asp, Gln, Glu, Trp или Tyr;
A17 представляет собой Val, Ala, Ile или Leu;
A18 представляет собой Cys, D-Cys, hCys, D-hCys, β-Me-Cys, D-β-Me-Cys, N-Me-Cys, D-N-Me-Cys, Ala, Pen или D-Pen;
A19 представляет собой Gly, Ala, Asn, Asp, Gln или Glu;
A20 представляет собой Asp, Ala, Asn, Gln или Glu;
A21 представляет собой Arg, Ala, Asn, Asp, Gln, Glu или Lys;
A22 представляет собой Gly, Ala, Asn, Asp, Gln или Glu;
A23 представляет собой Phe, Ala, Trp или Tyr;
A24 представляет собой Tyr, Ala, Phe или Trp;
A25 представляет собой Phe, Ala, Trp или Tyr;
A26 представляет собой Asn, Ala, Asp, Gln, Glu, Ser или Thr;
A27 представляет собой Lys, Ala, Arg, Asn, Asp, Gln, Glu или Pro;
A28 представляет собой Pro, Ala, Arg или Lys;
A29 представляет собой Thr, Ala, Asn, Asp, Gln, Glu или Ser;
A30 представляет собой Gly, Ala, Asn, Asp, Gln или Glu;
A31 представляет собой Tyr, Ala, Phe или Trp;
A32 представляет собой Gly, Ala, Asn, Asp, Gln или Glu;
A33 представляет собой Ser, Ala, Thr или Val;
A34 представляет собой Ser, Ala, Asn, Asp, Gln, Glu или Thr;
A35 представляет собой Ser, Ala, Asn, Asp, Gln, Glu или Thr;
A36 представляет собой Arg, Ala, Asn, Asp, Gln, Glu или Lys;
A37 представляет собой Arg, Ala, Asn, Asp, Gln, Glu или Lys;
A38 представляет собой Ala, Asn, Asp, Gln или Glu;
A39 представляет собой Pro, Ala, Arg или Glu;
A40 представляет собой Gln, Ala, Asn, Asp или Glu;
A41 представляет собой Thr, Ala, Asn, Asp, Gln, Glu или Ser;
A42 представляет собой Gly, Ala, Arg, Asn, Asp, Gln, Glu или Lys;
A43 представляет собой Ile, Ala, Arg, Asn, Asp, Gln, Glu или Lys;
A44 представляет собой Val, Ala, Arg, Asn, Asp, Gln, Glu, Ile, Leu или Lys;
A45 представляет собой Asp, Ala, Arg, Asn, Gln, Glu или Lys;
A46 представляет собой Glu, Ala, Arg, Asn, Asp, Gln или Lys;
A47 представляет собой Cys, D-Cys, hCys, D-hCys, β-Me-Cys, D-β-Me-Cys, N-Me-Cys, D-N-Me-Cys, Ala, Pen или D-Pen;
A48 представляет собой Cys, D-Cys, hCys, D-hCys, β-Me-Cys, D-β-Me-Cys, N-Me-Cys, D-N-Me-Cys, Ala, Pen или D-Pen;
A49 представляет собой Phe, Ala, Arg, Ile, Leu, Lys, Ser, Thr, Trp, Tyr или Val;
A50 представляет собой Arg, Ala, Lys, Ser или Thr;
A51 представляет собой Ser, Aib, Ala, Arg, Lys или Thr;
A52 представляет собой Cys, D-Cys, hCys, D-hCys, β-Me-Cys, D-β-Me-Cys, N-Me-Cys, D-N-Me-Cys, Ala, Pen или D-Pen;
A53 представляет собой Asp, Ala, Arg, Asn, Gln, Glu, Lys, Ser или Thr;
A54 представляет собой Leu, Acc, Ala, Ile или Val;
A55 представляет собой Arg, Ala, Ile, Leu, Lys, Phe, Trp, Tyr или Val;
A56 представляет собой Arg, Ala, Asn, Asp, Gln, Glu или Lys;
A57 представляет собой Leu, Acc, Ala, Ile или Val;
A58 представляет собой Glu, Acc, Ala, Arg, Asn, Asp, Gln или Lys;
A59 представляет собой Acc, Ala, Arg, Asn, Asp, Gln, Glu, Ile, Leu, Lys, Nle, Ser, D-Ser, Thr, Trp, Tyr или Val;
A60 представляет собой Tyr, Ala, Phe или Trp;
A61 представляет собой Cys, D-Cys, hCys, D-hCys, β-Me-Cys, D-β-Me-Cys, N-Me-Cys, D-N-Me-Cys, Ala, Pen или D-Pen;
A62 представляет собой Ala, Asn, Asp, Gln, Glu, Ile, Leu или Val;
A63 представляет собой Pro, D-Pro, Ala, Ser, Thr или делетирована;
A64 представляет собой Leu, D-Leu, des-Leu, Ala, Ile, Val или делетирована;
A65 представляет собой Lys, D-Lys, des-Lys, Ala, Arg, Ile, Leu, Val или делетирована;
A66 представляет собой Pro, D-Pro, Ala или делетирована;
A67 представляет собой Ala, D-Ala, Aib или делетирована;
A68 представляет собой Lys, D-Lys, Ala, Arg, Ile, Leu, Val или делетирована;
A69 представляет собой Ser, D-Ser, Aib, Ala, Thr или делетирована;
A70 представляет собой Ala, D-Ala, Asn, Asp, Gln, Glu или делетирована;
A71 представляет собой Asn, Ala, Asp, Gln, Glu, Lys, Ser, Thr или делетирована; и
R1 представляет собой OH или NH2;
при условии, что боковые цепи каждой пары остатков A6 и A48, A47 и A52 и A18 и A61 образуют дисульфидную связь; и
также при условии, что, когда A59 представляет собой Leu, Ile, Nle, Thr или Val, аналог содержит по меньшей мере одну дополнительную аминокислотную замену или вставку, определенную в настоящем документе.
В формуле (I) предпочтительные аминокислотные замены и дополнения определены следующим образом:
A-1 представляет собой Met, Ser или делетирована;
A1 представляет собой Gly или делетирована;
A2 представляет собой Pro, Lys или делетирована;
A3 представляет собой Glu или делетирована;
A4 представляет собой Thr;
A5 представляет собой Leu;
A6 представляет собой Cys, hCys, β Me-Cys, N-Me-Cys или Pen;
A7 представляет собой Gly;
A8 представляет собой Ala;
A9 представляет собой Glu;
A10 представляет собой Leu;
A11 представляет собой Val;
A12 представляет собой Asp;
A13 представляет собой Ala;
A14 представляет собой Leu;
A15 представляет собой Gln;
A16 представляет собой Phe;
A17 представляет собой Val;
A18 представляет собой Cys, hCys, β-Me-Cys, N-Me-Cys или Pen;
A19 представляет собой Gly;
A20 представляет собой Asp;
A21 представляет собой Arg;
A22 представляет собой Gly;
A23 представляет собой Phe;
A24 представляет собой Tyr;
A25 представляет собой Phe;
A26 представляет собой Asn;
A27 представляет собой Lys, Arg или Pro;
A28 представляет собой Pro или Lys;
A29 представляет собой Thr;
A30 представляет собой Gly;
A31 представляет собой Tyr;
A32 представляет собой Gly;
A33 представляет собой Ser;
A34 представляет собой Ser;
A35 представляет собой Ser;
A36 представляет собой Arg;
A37 представляет собой Arg;
A38 представляет собой Ala;
A39 представляет собой Pro;
A40 представляет собой Gln;
A41 представляет собой Thr;
A42 представляет собой Gly;
A43 представляет собой Ile;
A44 представляет собой Val;
A45 представляет собой Asp;
A46 представляет собой Glu;
A47 представляет собой Cys, hCys, β-Me-Cys, N-Me-Cys или Pen;
A48 представляет собой Cys, hCys, β-Me-Cys, N-Me-Cys или Pen;
A49 представляет собой Phe, Arg, Leu или Thr;
A50 представляет собой Arg или Ser;
A51 представляет собой Ser, Aib, Arg или Thr;
A52 представляет собой Cys, hCys, β-Me-Cys, N-Me-Cys или Pen;
A53 представляет собой Asp, Arg или Ser;
A54 представляет собой Leu или A6c;
A55 представляет собой Arg или Tyr;
A56 представляет собой Arg или Gln;
A57 представляет собой Leu;
A58 представляет собой Glu или Arg;
A59 представляет собой A6c, Arg, Asn, Asp, Gln, Glu, Ile, Leu, Nle, Ser, D-Ser, Trp или Tyr;
A60 представляет собой Tyr или Phe;
A61 представляет собой Cys, hCys, β-Me-Cys, N-Me-Cys или Pen;
A62 представляет собой Ala или Asn;
A63 представляет собой Pro, D-Pro, Thr или делетирована;
A64 представляет собой Leu, D-Leu, des-Leu или делетирована;
A65 представляет собой Lys, D-Lys, des-Lys, Arg или делетирована;
A66 представляет собой Pro, D-Pro или делетирована;
A67 представляет собой Ala, D-Ala, Aib или делетирована;
A68 представляет собой Lys, D-Lys, Arg или делетирована;
A69 представляет собой Ser, D-Ser, Aib, Thr или делетирована;
A70 представляет собой Ala, D-Ala, Glu или делетирована; и
A71 представляет собой Asp, Glu, Lys, Ser или делетирована.
Подмножество соединений, охватываемое формулой (I), включает соединения, в которых A59 представляет собой Asn.
Другое подмножество соединений, охватываемое формулой (I), включает соединения, в которых A59 представляет собой Leu, где указанные соединения содержат по меньшей мере одну дополнительную аминокислотную замену или вставку, выбранную из группы, состоящей из Arg27, Arg65, Arg68, Leu49, β-Me-Cys47, β-Me-Cys52, Thr51, Thr69, Asp71, Glu71, Lys71 и Ser71.
Еще одно подмножество соединений, охватываемое формулой (I), включает соединения, в которых A59 представляет собой Nle, где указанные соединения содержат по меньшей мере одну дополнительную аминокислотную замену, выбранную из группы, состоящей из Aib51, Aib67, Aib69, A6c54, N-Me-Cys47, N-Me-Cys48, Pen52 и Pen61.
Еще одно подмножество соединений, охватываемое формулой (I), включает соединения, в которых A59 представляет собой Ile, где указанные соединения содержат по меньшей мере одну аминокислотную замену, выбранную из группы, состоящей из Arg58, Arg49, Arg51 и Arg53.
Еще одно подмножество соединений, охватываемое формулой (I), включает соединения, в которых A59 представляет собой Arg, Asp, A6c, Gln, Glu, Ser, Trp или Tyr.
Предпочтительные соединения формулы (I) представляют собой:
Пример 1: (Asn59)hIGF-1(1-70)-OH; (SEQ ID NO:1)
Пример 2: (Asn59)hIGF-1(1-62)-OH; (SEQ ID NO:2)
Пример 3: (Asn59)hIGF-1(4-70)-OH; (SEQ ID NO:3)
Пример 4: (Pro27, Lys28, Asn59)hIGF-1(1-70)-OH; (SEQ ID NO:4)
Пример 5: (Pro27, Lys28, Asn59)hIGF-1(1-62)-OH; (SEQ ID NO:5)
Пример 6: (Ser53, Asn59)hIGF-1(1-70)-OH; (SEQ ID NO:6)
Пример 7: (Ser-Gly1, Asn59)hIGF-1(1-70)-OH; (SEQ ID NO:7)
Пример 8: (Asn59, Thr63, des-Leu64, des-Lys65, Glu70)hIGF-1(1-70)-OH; (SEQ ID NO:8)
Пример 9: (Tyr55, Asn59)hIGF-1(1-70)-OH; (SEQ ID NO:9)
Пример 10: (Thr49, Asn59)hIGF-1(1-70)-OH; (SEQ ID NO:10)
Пример 11: (Asn59,62)hIGF-1(1-70)-OH; (SEQ ID NO:11)
Пример 12: (Asn59, Phe60)hIGF-1(1-70)-OH; (SEQ ID NO:12)
Пример 13: (Ser50, Asn59)hIGF-1(1-70)-OH; (SEQ ID NO:13)
Пример 14: (Gln56, Asn59)hIGF-1(1-70)-OH; (SEQ ID NO:14)
Пример 15: (Asn59, D-Pro63)hIGF-1(1-70)-OH;
Пример 16: (Asn59, D-Leu64)hIGF-1(1-70)-OH;
Пример 17: (Asn59, D-Lys65)hIGF-1(1-70)-OH;
Пример 18: (Asn59, D-Pro66)hIGF-1(1-70)-OH;
Пример 19: (Asn59, D-Ala67)hIGF-1(1-70)-OH;
Пример 20: (Asn59, D-Lys68)hIGF-1(1-70)-OH;
Пример 21: (Asn59, D-Ser69)hIGF-1(1-70)-OH;
Пример 22: (Asn59, D-Ala70)hIGF-1(1-70)-OH;
Пример 23: (Arg27,65,68, Leu59)hIGF-1(1-70)-OH; (SEQ ID NO:15)
Пример 24: (Leu59, Arg65,68)hIGF-1(1-70)-OH; (SEQ ID NO:16)
Пример 25: (Leu49,59)hIGF-1(1-70)-OH; (SEQ ID NO:17)
Пример 26: (β-Me-Cys52, Leu59)hIGF-1(1-70)-OH; (SEQ ID NO:18)
Пример 27: (β-Me-Cys47, Leu59)hIGF-1(1-70)-OH; (SEQ ID NO:19)
Пример 28: (Leu59, Glu71)hIGF-1(1-71)-OH; (SEQ ID N0:20)
Пример 29: (Leu59, Asp71)hIGF-1(1-71)-OH; (SEQ ID NO:21)
Пример 30: (Leu59, Lys71)hIGF-1(1-71)-OH; (SEQ ID NO:22)
Пример 31: (Leu59, Ser71)hIGF-1(1-71)-OH; (SEQ ID NO:23)
Пример 32: (Leu59, Thr69)hIGF-1(1-70)-OH; (SEQ ID NO:24)
Пример 33: (Thr51, Leu59)hIGF-1(1-70)-OH; (SEQ ID NO:25)
Пример 34: (N-Me-Cys47, Nle59)hIGF-1(1-70)-OH; (SEQ ID NO:26)
Пример 35: (Nle59, Aib69)hIGF-1(1-70)-OH; (SEQ ID NO:27)
Пример 36: (N-Me-Cys48, Nle59)hIGF-1(1-70)-OH; (SEQ ID NO:28)
Пример 37: (Nle59, Aib67)hIGF-1(1-70)-OH; (SEQ ID NO:29)
Пример 38: (hCys52, Nle59)hIGF-1(1-70)-OH; (SEQIDNO:30)
Пример 39: (Aib51, Nle59)hIGF-1(1-70)-OH; (SEQ ID N0:31)
Пример 40: (Pen52, Nle59)hIGF-1(1-70)-OH; (SEQ ID NO:32)
Пример 41: (Nle59, Pen61)hIGF-1(1-70)-OH; (SEQ ID NO:33)
Пример 42: (A6c54, Nle59)hIGF-1(1-70)-OH; (SEQ ID NO:34)
Пример 43: (Arg53, Ile59)hIGF-1(1-70)-OH; (SEQ ID NO:35)
Пример 44: (Arg49, Ile59)hIGF-1(1-70)-OH; (SEQ ID NO:36)
Пример 45: (Arg51, Ile59)hIGF-1(1-70)-OH; (SEQ ID NO:37)
Пример 46: (Arg58, Ile59)hIGF-1(1-70)-OH; (SEQ ID NO:38)
Пример 47: (A6c59)hIGF-1(1-70)-OH; (SEQ ID NO:39)
Пример 48: (Asp59)hIGF-1(1-70)-OH; (SEQ ID NO:40)
Пример 49: (Trp59)hIGF-1(1-70)-OH; (SEQ ID NO:41)
Пример 50: (Ser59)hIGF-1(1-70)-OH; (SEQ ID NO:42)
Пример 51: (Tyr59)hIGF-1(1-70)-OH; (SEQ ID NO:43)
Пример 52: (Glu59)hIGF-1(1-70)-OH; (SEQ ID NO:44)
Пример 53: (Gln59)hIGF-1(1-70)-OH; (SEQ ID NO:45)
Пример 54: (Arg59)hIGF-1(1-70)-OH; (SEQ ID NO:46) и
Пример 55: (Met-Gly1, Asn59)hIGF-1(1-70)-OH. (SEQ ID NO:47)
Подробное описание изобретения
В заявке используются следующие общепринятые сокращения:
Acc: 1-амино-1-цикло(C3-C9)алкилкарбоновая кислота
Acc включает:
A3c: 1-амино-1-циклопропанкарбоновую кислоту
A4c: 1-амино-1-циклобутанкарбоновую кислоту
A5c: 1-амино-1-циклопентанкарбоновую кислоту
A6c: 1-амино-1-циклогексанкарбоновую кислоту
Aib: α-аминоизомасляная кислота
Ala или A: аланин
Arg или R: аргинин
Asn или N: аспарагин
Asp или D: аспарагиновая кислота
Cys или C: цистеин
цистин: дисульфидный димер цистеина
hCys: гомоцистеин
β-Me-Cys: бета-метилцистеин, т.е.
(2S,3S)-2-амино-3-меркаптомасляная кислота
N-Me-Cys: N-метилцистеин
Gln или Q: глутамин
Glu или E: глутаминовая кислота
Gly или G: глицин
Ile или I: изолейцин
Leu или L: лейцин
des-Leu: делетированный Leu
Lys или K: лизин
des-Lys: делетированный Lys
Met или M: метионин
Nle: норлейцин
Pen: пеницилламин
Phe или F: фенилаланин
Pro или P: пролин
Ser или S: серин
Thr или T: треонин
Trp или W: триптофан
Tyr или Y: тирозин
Val или V: валин
Все сокращения (например, Ala) аминокислот в данном описании обозначают структуру -NR-CR'(R”)-CO-, в которой каждый из R' и R” независимо представляет собой водород или боковую цепь аминокислоты (например, R'=H и R”=CH3 для аланина) и в которой R=H или CH3, кроме пролина, т.е.
Пептид по данному изобретению также обозначают в настоящем документе в другом формате, например (Asn59)hIGF-1(1-70)-OH (SEQ ID NO:1), с аминокислотами, замещенными по сравнению с природной последовательностью, размещенными между скобками (т.е. Asn вместо Met в положении 59 IGF-1 дикого типа). Интервал, находящийся в скобках, относится к тем аминокислотам, которые находятся в аналоге. Например, “IGF-1(4-68)-OH” (SEQ ID NO:48) указывает, что аналог содержит аминокислоты от 4 до 68, которые соответствуют пептидной последовательности IGF-1 дикого типа. “NH2” в “IGF-1(1-70)-NH2” (SEQ ID NO:49) указывает на то, что C-конец пептида амидирован. “IGF-1(1-70)” или “IGF-1(1-70)-OH” указывает на то, что C-конец представляет собой свободную кислоту (SEQ ID NO:50).
Некоторые другие сокращения, применяемые в настоящем документе, определены следующим образом:
Act: ацетонитрил
Boc: трет-бутилоксикарбонил
BSA: бычий сывороточный альбумин
DCM: дихлорметан
DIPEA: диизопропилэтиламин
DMEM: модифицированная по способу Дульбекко среда Игла
ДМФА: диметилформамид
DTT: дитиотреитол
ESI: ионизация электрораспылением
FCS: эмбриональная телячья сыворотка
Fmoc: 9-флуоренилметилоксикарбонил
HBTU: гексафторфосфат 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония
HOBt: N-гидроксибензотриазол
ВЭЖХ: высокоэффективная жидкостная хроматография
LC-MS: жидкостная хроматография-масс-спектрометрия
MPAA: 4-меркаптофенилуксусная кислота
NMP: N-метилпирролидинон
OtBu: O-трет-бутиловый сложный эфир
Pbf: 2,2,4,6,7-пентаметилдигидробензофуран-5-сульфонил
QC: контроль качества
tBu: трет-бутил
TCA: трихлоруксусная кислота
TCEP: трис-2-карбоксиэтилфосфин
TIS: триизопропилсилан
ТФУК: трифторуксусная кислота
Tris: 2-амино-2-(гидроксиметил)-1,3-пропандиол
Trt: тритил
УФ-спектроскопия: ультрафиолетовая спектроскопия
«Алкил» относится к углеводородной группе, содержащей один или несколько атомов углерода, где множественные атомы углерода, если они присутствуют, соединены одинарными связями. Примеры этой группы включают, но не ограничиваются ими, метил, этил, пропил и бутил. Алкильная углеводородная группа может быть линейной или может содержать одну или несколько ветвей или циклических групп, примеры которых включают, но не ограничиваются ими, изопропил и трет-бутил.
«Замещенный алкил» относится к алкилу, в котором один или несколько водородных атомов углеводородной группы заменены одним или несколькими заместителями, выбранными из группы, состоящей из галогена, OH, CN, SH, NH2, NHCH3, NO2, (C1-2)-алкила, замещенного 1-6 галогенами, CF3, OCH3, OCF3 и (CH2)0-4-COOH. В других вариантах осуществления присутствуют 1, 2, 3 или 4 заместителя.
«Арил» относится к необязательно замещенной ароматической группе, по меньшей мере с одним кольцом, имеющим конъюгированную систему пи-электронов, содержащей до трех конъюгированных или конденсированных кольцевых систем. Арил включает карбоциклический арил, гетероциклический арил и биарильные группы. Предпочтительно, арил представляет собой 5- или 6-членное кольцо. Предпочтительные атомы для гетероциклического арила представляют собой один или несколько атомов серы, кислорода и/или азота. Примеры арила включают фенил, 1-нафтил, 2-нафтил, индол, хинолин, 2-имидазол и 9-антрацен. Арильные заместители выбирают из группы, состоящей из -C1-20-алкила, -C1-20-алкокси, галогена, -OH, -CN, -SH, -NH2, -NO2, -C1-20-алкила, замещенного галогенами, -CF3, -OCF3 и -(CH2)0-20-COOH. В других вариантах осуществления арил содержит 0, 1, 2, 3 или 4 заместителя.
«Алкиларил» относится к «алкилу», присоединенному к «арилу».
Процедуры синтеза
Представленные в качестве примера аналоги IGF-1 по настоящему изобретению получали посредством первой стадии синтеза пептидных фрагментов, второй стадии сшивания (лигирования) и третьей стадии фолдинга. Следующие процедуры синтеза иллюстрируют, как специалист-химик может обеспечить получение любого из представленных в качестве примера аналогов IGF-1 по настоящему изобретению.
A) Синтез пептидного фрагмента (Gln 56 , Asn 59 )hIGF-1(48-70)-OH, т.е. Cys-Phe-Arg-Ser-Cys-Asp-Leu-Arg-Gln-Leu-Glu-Asn-Tyr-Cys-Ala-Pro-Leu-Lys-Pro-Ala-Lys-Ser-Ala-OH_(SEQ ID NO:51)
Основанный на Fmoc твердофазный пептидный синтез применяли для сборки указанного в заголовке пептидного фрагмента с использованием вспомогательной микроволновой обработки на пептидном синтезаторе Liberty (CEM; Matthews, NC, USA). Первый фрагмент из 14 остатков, например остатков 57-70 hIGF-1, или пептид из C-концевых кислот синтезировали в масштабе 1,0 ммоль с использованием Fmoc-Ala-смолы Ванга (0,72 мг-экв./г). Полученный в результате пептидный фрагмент затем разделяли на четыре партии по 0,25 ммоль для удлинения и разделения. Образец смолы массой 1,36 г помещали в коническую пробирку на 50 мл вместе с 15 мл раствора 1:1 ДМФА и DCM, которую загружали в заданное положение в синтезатор. Затем смолу переносили в реакционный сосуд посредством автоматического процесса синтезатора. Использовали стандартный протокол Liberty для масштаба 1,0 ммоль. Протокол включал удаление N-концевой защитной группы Fmoc путем обработки 20 мл 20% пиперидина, содержащего 0,1 M HOBt в ДМФА. Исходная стадия снятия защиты с помощью микроволновой энергии (45 ватт, максимальная температура 75°C) и барботирования азотом (3 секунды включено, 7 секунд выключено) продолжалась в течение 30 секунд. Из реакционного сосуда удаляли раствор и смолу тщательно промывали ДМФА несколько раз. Затем добавляли следующую аминокислоту (цикл 1), которую следовало присоединить к растущему пептиду (Fmoc-Ser(tBu)-OH), полученную в виде маточного раствора 0,2 M в ДМФА (15 мл, 3 эквивалента). Добавляли 6,0 мл 0,45 M (3 эквивалента) HBTU в ДМФА, после чего вносили 3,0 мл 2 M (6 эквивалентов) DIPEA в NMP. Стадию присоединения проводили с использованием микроволновой энергии (20 ватт, максимальная температура 75°C) с барботированием азотом в том же отношении, как на стадии снятия защиты, в течение периода 5 минут. Затем из реакционного сосуда удаляли раствор в слив и повторяли стадию присоединения.
Протокол присоединения для Fmoc-Cys(Trt)-OH представлял собой слегка модифицированную версию стандартного протокола. Для остатков Cys в течение первых 2 минут не использовали микроволновую энергию.
Затем следовал 4-минутный отрезок использования микроволновой энергии (20 ватт, максимальная температура 50°C). Все аминокислоты вводили одинаковым путем, используя стратегию двойного присоединения на всем протяжении целой последовательности. Циклы синтеза для указанного в заголовке пептидного фрагмента после первого Ser были следующими: цикл 2, Fmoc-Lys(Boc)-OH; цикл 3, Fmoc-Ala-OH; цикл 4, Fmoc-Pro-OH; цикл 5, Fmoc-Lys(Boc)-OH; цикл 6, Fmoc-Leu-OH; цикл 7, Fmoc-Pro-OH; цикл 8, Fmoc-Ala-OH; цикл 9, Fmoc-Cys(Trt)-OH; цикл 10, Fmoc-Tyr(tBu)-OH; цикл 11, Fmoc-Asn(Trt)-OH; цикл 12, Fmoc-Glu(OtBu)-OH; и цикл 13, Fmoc-Leu-OH.
Как только исходный пептидный фрагмент был завершен, смолу переносили обратно в коническую пробирку на 50 мл с использованием ДМФА в качестве растворителя. Смолу вручную равномерно разделяли на четыре образца, которые помещали в четыре конические пробирки на 50 мл, которые затем устанавливали обратно в синтезатор. Оставшуюся часть указанного в заголовке пептида синтезировали в масштабе 0,25 ммоль. Используемый протокол был тем же самым, как тот, который использовали для синтеза в большем масштабе, однако использовали меньшие количества реагентов. Удаление N-концевой защитной группы Fmoc состояло из обработки раствором, содержащим 10 мл 20% пиперидина и 0,1 M HOBt в ДМФА. Исходная стадия снятия защиты с помощью микроволновой энергии (45 ватт, максимальная температура 75°C) и барботирования азотом (3 секунды включено, 7 секунд выключено) продолжалась в течение 30 секунд. Затем из реакционного сосуда удаляли раствор и смолу тщательно промывали несколько раз ДМФА. Затем вводили следующую аминокислоту (цикл 14), полученную в виде 0,2 M маточного раствора в ДМФА (5,0 мл, 4 эквивалента), в растущий пептид (Fmoc-Gln(tBu)-OH). Затем добавляли 2,0 мл 0,45 M раствора (4 эквивалента) HBTU в ДМФА, после чего вносили 1,0 мл 2 M раствора (8 эквивалентов) DIPEA в NMP.
Протоколы присоединения для Fmoc-Cys(Trt)-OH и Fmoc-Arg(Pbf)-OH представляли собой слегка модифицированные версии стандартного протокола. Для присоединения остатков Cys микроволновую энергию вначале выключали на первые 2 минуты, затем включали на 4 минуты (20 ватт, максимальная температура 50°C). Для присоединения остатков Arg микроволновую энергию не использовали при первом присоединении, однако требовалась вторая стадия стандартного присоединения. В циклах 14, 16 и 21 использовали процедуру кэппинга, которая следовала непосредственно за стадией присоединения, включающей добавление 7 мл 0,5 M уксусного ангидрида, содержащего 0,015 M HOBt и 2 мл 2 M DIPEA, причем оба соединения были растворены в NMP, используя при этом многостадийный протокол микроволновой обработки (50 ватт в течение 30 секунд с максимальной температурой 65°C, затем без обработки в течение 30 секунд, 50 ватт в течение 30 секунд с максимальной температурой 65°C, затем без обработки в течение 30 секунд). Циклы синтеза для указанного в заголовке пептидного фрагмента после Gln были следующими: цикл 15, Fmoc-Arg(Pbf)-OH; цикл 16, Leu-OH; цикл 17, Fmoc-Asp(OtBu)-OH; цикл 18, Fmoc-Cys(Trt)-OH; цикл 19, Fmoc-Ser(tBu)-OH; цикл 20, Fmoc-Arg(Pbf)-OH; цикл 21, Fmoc-Phe-OH; и цикл 22, Fmoc-Cys(Trt)-OH.
После завершения пептидного остова удаляли N-концевую защитную группу Fmoc, а смолу вновь промывали ДМФА. Затем смолу переносили обратно в коническую пробирку на 50 мл с использованием ДМФА в качестве растворителя для переноса.
Смолу переносили в реакционный сосуд с фильтром из пористого стекла. Удаляли ДМФА и смолу интенсивно промывали DCM. Пептидный фрагмент отщепляли и освобождали от защиты обработкой следующим реагентом: 5% TIS : 5% вода : 90% ТФУК. Реакционную смесь оставляли инкубироваться в течение 3 часов при комнатной температуре и постоянном перемешивании. Затем раствор фильтровали в коническую пробирку на 50 мл. Уровень ТФУК снижали упариванием в потоке газообразного азота. Пептидный фрагмент осаждали добавлением 40 мл холодного простого этилового эфира с последующим центрифугированием при 3000 об/мин в течение 30 минут при 4°C в центрифуге с охлаждением (Sorvall Legend RT; Thermo Fisher, San Jose, CA, USA). Полученный в результате осадок растворяли в 0,1% ТФУК в воде перед очисткой путем препаративной ВЭЖХ, укомплектованной колонкой с обращенной фазой C18 (Luna, 10 мкм, колонка 250×21,2 мм), с использованием градиента 0-60% ацетонитрила (0,1% ТФУК) в течение 50 минут при скорости потока 10 мл/мин. Очищенный пептидный фрагмент анализировали путем ВЭЖХ (Luna C18, 3 мкм, колонка 4,6×100 мм) с градиентом 5-80% ацетонитрила (0,08% ТФУК) в течение 30 минут со скоростью потока 1 мл/мин и путем масс-спектрометрии (LCQ Advantage; Thermo Fisher, San Jose, CA, USA). Пептидный фрагмент затем лиофилизировали и хранили при -50°C для дальнейшего применения.
B) Синтез пептидного фрагмента hIGF-1(1-47)-тиоэфир, т.е. Gly-Pro-Glu-Thr-Leu-Cys-Gly-Ala-Glu-Leu-Val-Asp-Ala-Leu-Gln-Phe-Val-Cys-Gly-Asp-Arg-Gly-Phe-Tyr-Phe-Asn-Lys-Pro-Thr-Gly-Tyr-Gly-Ser-Ser-Ser-Arg-Arg-Ala-Pro-Gln-Thr-Gly-Ile-Val-Asp-Glu-Cys-тиоэфирпропионил-Leu-NH 2 (SEQ ID NO:52)
N-концевой пептидный фрагмент, например остатки 1-47 hIGF-1, объединяли с использованием основанного на Boc-химии твердофазного пептидного синтеза. Для синтеза в масштабе 0,5 ммоль использовали пептидный синтезатор ABI 433A (Applied Biosystems; Foster City, CA, USA), модифицированный для запуска стандартного протокола FastBoc. Реакционный сосуд, содержащий 0,645 мг 0,77 мг-экв./г смолы Tampal, помещали на синтезатор. Для набухания смолы вводили ДМФА. Протокол ABI FastBoc 0,5 использовали для получения фрагмента. Каждый цикл состоял из деблокирования N-концевой защитной группы Boc с помощью чистой ТФУК с последующей обильной промывкой ДМФА. Предварительно упакованные картриджи на 2,0 ммоль (4 эквивалента) каждой аминокислоты затем растворяли в 0,40 M HBTU и ДМФА. После полного растворения каждой аминокислоты раствор автоматически перемещали в емкость для активации. Раствор DIPEA (чистого) вводили в сосуд для активации и подвергали воздействию смолы в течение длительного периода. Реакционный сосуд опорожняли и смолу промывали ДМФА. Для картриджей Arg/Asn требовалось продолжительное время активации, чтобы гарантировать растворимость. Кроме того, любую аминокислоту, добавленную непосредственно после присоединения остатка Gln, промывали DCM до и после выполнения протокола деблокирования. Время присоединения составляло 30 минут. Следующие аминокислоты использовали для указанного в заголовке пептидного фрагмента: Boc-Arg(Tos)-OH, Boc-Asp(cHex)-OH, Boc-Glu(cHex)-OH, Boc-Asn(Xan)-OH, Boc-Cys(4Me-Bzl)-OH, Boc-Lys(ClZ)-OH, Boc-Gln-OH, Boc-Ser(OBzl)-OH, Boc-Thr(OBzl)-OH и Boc-Tyr(BrZ)-OH.
После последнего цикла присоединения смолу промывали DCM и сушили. С пептидного фрагмента снимали защиту и отщепляли его от смолы с использованием обработки 10 мл фтороводорода и анизола. Реакции давали проходить в течение 70 минут, причем к этому моменту фтороводород вымывали струей азота. Остаток промывали простым эфиром и затем пептид растворяли в 10-15 мл ТФУК. Пептидный фрагмент осаждали путем фильтрования ТФУК в 40 мл холодного простого этилового эфира с последующим центрифугированием при 3000 об/мин в течение 30 минут при 4°C в центрифуге с охлаждением (Sorvall Legend RT; Thermo Fisher, San Jose, CA, USA). Полученный в результате осадок растворяли в 0,1% ТФУК в воде и очищали путем препаративной ВЭЖХ, укомплектованной колонкой с обращенной фазой C18 (Luna, 10 мкм, колонка 250×21,2 мм), с использованием градиента 20-40% ацетонитрила (0,1% ТФУК) в течение 120 минут со скоростью потока 10 мл/мин. Очищенный пептидный фрагмент анализировали путем ВЭЖХ (Luna C18, 3 мкм, колонка 4,6×100 мм) с градиентом 5-80% ацетонитрила (0,08% ТФУК) в течение 30 минут со скоростью потока 1 мл/мин и путем масс-спектрометрии (LCQ Advantage; Thermo Fisher, San Jose, CA, USA). Затем пептидный фрагмент лиофилизировали и хранили при -50°C для дальнейшего использования.
C) Общая процедура сшивания
Полноразмерные аналоги hIGF-1 конструировали способом химического сшивания, которое происходит в природе между N-концевым фрагментом со сложным тиоэфиром, например hIGF-1(1-47)-S-(CH2)2C(0)-Leu-NH2 (SEQ ID NO:52), и C-концевым фрагментом, например (Gln56, Asn59)hIGF-1(48-70)-OH (SEQ ID NO:51), который содержит на своем N-конце остаток цистеина.
Для начала способа получения указанного в заголовке пептида 5,5 мг C-концевого фрагмента hIGF-1 растворяли в 0,5 мл буфера для сшивания (200 мМ фосфат натрия, pH 8,5, 6M гидрохлорид гуанидина) в пробирке Эппендорфа на 1,5 мл. К данному раствору добавляли 100 мкл раствора TCEP (40 мг/мл) и смесь встряхивали. Смесь переносили во вторую пробирку Эппендорфа, содержащую 6,5 мг N-концевого фрагмента hIGF-1 со сложным тиоэфиром. Реагенты тщательно смешивали. Небольшой образец (5 мкл) удаляли и анализировали путем LC-MS (LCQ Deca XP; Thermo Fisher, San Jose, CA, USA). К реакционной смеси добавляли 100 мкл раствора MPAA (20 мг/мл) с последующим перемешиванием. Образцы (5 мкл) периодически извлекали, чтобы следить за процессом реакции с использованием LC-MS. Приблизительно через 3,5 часа, когда реакция была близка к завершению, смесь гасили и разбавляли добавлением 9,5 мл 0,1% ТФУК в воде. Продукт сшивания очищали путем полупрепаративной ВЭЖХ (Vydac 218TP101510, C18, 10-15 мкм, 10×250 мм) в градиенте 5-80% ацетонитрила (0,1% ТФУК) в течение 40 минут со скоростью потока 5 мл/мин. Пик продукта лиофилизировали и хранили при -50°C. Массу не подвергшегося фолдингу продукта сшивания определяли путем физического измерения.
D) Общая процедура фолдинга (окислительно-восстановительная пара глутатиона) для примера 14, т.е. (Gln 56 , Asn 59 )hIGF-1 (1-70)-OH (SEQ ID NO:14)
Белок, полученный в процессе сшивания на стадии C), как описано выше, растворяли в буфере для сшивания (200 мМ фосфат натрия, pH 8,5, 6M гидрохлорид гуанидина) до концентрации 1 мг/мл. Затем добавляли буфер для фолдинга (100 мМ Tris, pH 8,5, 1 мМ окисленный глутатион, 10 мМ восстановленный глутатион) до достижения конечной концентрации белка 0,25 мг/мл. Обеспечивали осуществление процесса фолдинга в течение 3 часов. После этого реакцию гасили путем добавления по каплям ТФУК до достижения в реакционной смеси pH ≤3. Затем продукт очищали путем полупрепаративной ВЭЖХ (Vydac 218TP101510, C18, 10-15 мкм, колонка 10×250 мм) в градиенте 5-60% ацетонитрила (0,1% ТФУК) в течение 40 минут со скоростью потока 5 мл/мин. Продукт лиофилизировали. Содержание белка определяли путем повторного растворения продукта в 0,1% ТФУК в воде, измеряя затем оптическую плотность при 280 нм (спектрофотометр NanoDrop ND1000). Затем белок анализировали для QC (ВЭЖХ и MS).
E) Процедура окисления для получения (глиоксилил-Gly 1 , Asn 59 )hIGF-1(1-70)-OH (SEO ID NO:53) из примера 7, т.е. (Ser-Gly 1 , Asn 59 )hIGF-1(1-70)OH (SEQ ID NO:7)