Композиция для контроля развития растений
Иллюстрации
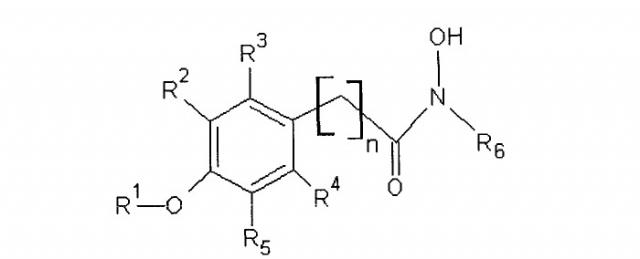
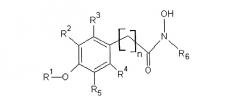
Показать всеИзобретение относится к сельскому хозяйству. Проводят стимуляцию прорастания семян растений и/или выведение тканей растений или органов растений из состояния покоя путем обработки семян, растений, органов или тканей растений соединением формулы I:
где:
R1 обозначает алкил или H, R2, R3, R4 и R5 независимо выбирают из группы, включающей H, галоген, -NO2, -SO2R', -OH, -O-алкил, где R' обозначает алкил или аминоалкил, и/или R1 и R5 вместе образуют -O(CH2)m-, где m равен 1, 2, 3 или 4, R6 обозначает замещенный или незамещенный алкил, и/или замещенный или незамещенный арил, и n равен целому числу от 1 до 4. Обработке подвергают также клубни, луковицы. Изобретение позволяет реализовать указанное назначение. 6 н. и 16 з.п. ф-лы, 2 табл., 9 ил.
Реферат
Настоящее изобретение относится к новым соединениям, новым композициям, а также способам их применения для стимуляции прорастания семян и выведения из покоя семян растений, тканей растений и растений.
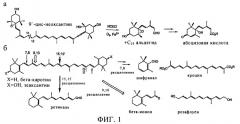
Каротиноиды, фотозащитные молекулы, синтезируются растениями и микроорганизмами и являются важными компонентами корма животных, примером которых, прежде всего, является β-каротин (провитамин А). Окислительное расщепление происходит в растениях, организме животных и микроорганизмах, в результате происходит высвобождение ряда каротиноидов, выполняющих функцию сигнальных молекул, а также и другие функции (1). Первым геном, кодирующим расщепляющий каротиноиды фермент каротиндиоксигеназу (CCD)1, является ген кукурузы Vp14, который требуется для синтеза абсцизовой кислоты (АБК), важного гормона, который опосредует ответ на засуху и некоторые стадии развития растений, такие как состояния покоя семян и почек (2). Ферментом VP14, который расщепляет эпоксикаротиноиды, 9'-цис-неоксантин и/или 9-цис-виолаксантин, в положении 11, 12 (фиг.1), является 9-цис-эпоксикаротиндиоксигеназа (NCED) (3), которая относится к подклассу многочисленного семейства CCD.
После открытия гена Vp14, также было установлено участие и других CCD в синтезе ряда апокаротиноидов (фиг.1). У насекомых, зрительный пигмент ретиналь образуется в результате окислительного расщепления β-каротина под действием β-каротин-15,15'-диоксигеназы (4). У позвоночных ретиналь образуется под действием ортологических ферментов и впоследствии превращается в ретиноевую кислоту, регулятор дифференциации в процессе эмбриогенеза (5). Предполагают, что различные CCD млекопитающих расщепляют каротиноиды асимметрично в положении 9, 10 (6) и хотя данный механизм расщепления до конца не выяснен, последние опубликованные данные свидетельствуют об их участии в метаболизме из пищевых продуктов ликопена (7). Летучие вещества растений, β-ионон и геранилацетон, образуются при расщеплении молекулы каротиноида ферментами в положении 9, 10 (8) и при расщеплении в положении 7, 8 образуется пигмент α-кроцин, обнаруженный в специи шафрана (9).
Идентифицированы и другие CCD, биологическая активность которых на сегодняшний день еще недостаточно исследована, например, в цианобактериях, для которых известна различная специфичность расщепления (10-12). В других случаях описаны апокаротиноиды с известными функциями, но их идентичность и участие ферментов CCD еще не описаны: кетон из тканей кузнечиков выполняет защитную функцию кобылки бескрылой (Romalea microptera) (13), микоррадицин продуцируется в корнях растений во время симбиоза с древовидной микоризой (14), а стриголактоны (15) являются метаболитами растений и выполняют сигнальную функцию для начала прорастания растений-паразитов, таких как Striga (стрига) и Orobanche (заразиха) (16).
Недавно было установлено, что стриголактоны также являются растительными гормонами, оказывающими влияние на ветвление растений (17, 18). Существование указанного гормона известно уже давно, но до сих пор он недостаточно изучен. Однако известно, что указанный гормон образуется в результате действия по крайней мере двух CCD, max3 и max4 (more axillary growth, предпочтительно аксиллярный рост) (19), так как делеция любого из этих двух генов у арабидопсиса (Arabidopsis thaliana) приводит к формированию фенотипа с повышенной ветвистостью (20,21). По данным анализа Е.coli установлено, что AtCCD7 (max3) расщепляет β-каротин в положении 9,10 и полученный в результате продукт апокаротиноид (10-апо-β-каротин) в дальнейшем расщепляется в положении 13, 14 диоксигеназой AtCCDS (max4) с образованием 13-апо-β-каротина (22). Кроме того, последние данные свидетельствуют о том, что AtCCD8 является высокоспецифичным ферментом и расщепляет только 10-апо-β-каротин (23). Однако неизвестен механизм образования 13-апо-β-каротина, который приводит к синтезу комплексов стриголактонов. Не исключено, что ферменты могут обладать различной специфичностью и активностью расщепления в полевых условиях. Установлено также, что фермент цитохром Р450 (24) принимает участие в синтезе стриголактона и проявляет активность в пути, расположенном за генами CCD. Предполагают, что стриголактон влияет на ветвление растений за счет регуляции транспорта ауксина (25). Так как CCD принимает участие в синтезе стриголактона, существует вероятность того, что активность CCD влияет на структуру растения и на взаимодействие с растениями-паразитами и микоризой.
Несмотря на значительные успехи, достигнутые в исследовании природной функции и субстратной специфичности CCD с использованием генной инженерии, прежде всего из различных видов растений с простыми генетическими системами или с генетической системой, подверженной трансгенезу, существует множество систем, в отношении которых применение генетических подходов затруднено или невозможно. Кроме того, при исследовании рекомбинантных CCD в условиях in vitro или в гетерологичных методах анализа in vivo, таких как рекомбинантные штаммы Е.Coli, были сконструированы, например, штаммы, в которых накапливаются каротиноиды (26), в большинстве случаев активные в отношении широкого круга субстратов (5, 21, 27), но истинный субстрат in vivo для конкретной CCD остается неизвестным. Следовательно, существует необходимость в разработке дополнительных экспериментальных инструментов для исследования функций как апокаротина, так и CCD в их естественном клеточном окружении.
Методами обратной генетики идентифицированы низкомолекулярные соединения, которые проявляют активность по отношению к известным белкам-мишеням, и их используют в биологических системах для исследования функции белков в условиях in vivo (28, 29). Такой подход сопоставим с общепринятыми генетическими методами, основанными на использовании низкомолекулярных соединений, так как такие низкомолекулярные соединения можно использовать простым способом для исследования множества видов, и их использование можно контролировать по концентрации, времени и распределению в пространстве, чтобы обеспечить подробное исследование биологических свойств, а, изменяя специфичность низкомолекулярных соединений, можно исследовать свойства, как индивидуальных белков, так и классов белков. Необходимо отметить, что функции таких растительных гормонов, как гиббереллин, брассиностероид и абсцизовая кислота, успешно исследованы с использованием такого подхода при модификации адаптирования триазолов для ингибирования цитохром Р450 монооксигеназ, принимающих участие в метаболизме указанных гормонов (30).
Установлено, что, в случае семейства CCD, третичные амины абамин (31) и более активный абамин SG (32) являются специфичными ингибиторами NCED, причем абамин использовали для исследования новых функций абсцизовой кислоты в образовании клубеньков на корнях бобовых (33).
В настоящем изобретении предлагается группа соединений, которые стимулируют прорастание и выведение тканей или органов растений из состояния покоя.
В настоящем изобретении предлагается способ стимуляции прорастания семян растений и/или выведения тканей растений из состояния покоя, который включает обработку семян, тканей, органов растений или растений соединением формулы I.
где:
R1 обозначает алкил или Н,
R2, R3, R4 и R5 независимо выбирают из H, галогена, -NO2, -SO2R', -OH, -O-алкил, где R' обозначает алкил или аминоалкил, и/или R1 и R5 вместе образуют
-O(CH2)m-группу (то есть группой, присоединенной к арилу, является
-O(CH2)mO-группа, где m равно 1, 2, 3 или 4, предпочтительно 1, присоединенную к арильной группе, где,
R6 обозначает гидрофобную группу, такую как, например, замещенный или незамещенный алкил, и/или замещенный или незамещенный арил, и n равен целому числу 1, 2, 3 или 4 и n, например, равен 1. Группа, связывающая арильную группу с карбонильной группой гидроксамовой кислоты, то есть группа -(CH2)n-, может также содержать заместители, например -OH, галоген или метил.
R1 предпочтительно обозначает C1-C4алкил, такой как метил, этил, пропил или бутил. R1 может обозначать H. R2, R3, R4 и R5 все могут обозначать H. В другом варианте, одна, две или три указанных боковых групп могут обозначать H, а остальные боковые группы обозначают другие боковые группы. Алкильный остаток в составе -O-алкильной группы предпочтительно обозначает C1-C4алкил, такой как метил, этил, пропил или бутил.
R5 обозначает O-метил. Остальные заместители, R2, R3 и R4, обозначают H, а R5 обозначает -O-метил.
R6 предпочтительно обозначает гидрофобную группу. R6 может обозначать C1-C12алкил, наиболее предпочтительно C5-C10алкил. R6 может обозначать любой из алкилов C1, C2, C3, C4, C5, C6, C7, C8, C9, C10, C11 или C12алкил. R6 может также обозначать арильную группу или -(CH2)pарил, где p равен целому числу от 1 до 4, а арил является замещенным или незамещенным, и n предпочтительно равен 1.
R6 может обозначать замещенный алкил или замещенный арил. Указанные алкильные или арильные группы могут содержать один и более заместителей, например галоген, -OH, -NO2; или -SO2R'.
Указанное соединение предпочтительно включает группу R6 формулы II
где R7 обозначает -H, -OH, -NO2, -SO2R' или галоген.
Используемый в данном контексте термин «галоген» включает фтор, хлор, бром или йод, наиболее предпочтительно фтор.
Установлено, что длина линкера, соединяющего гидроксамовую кислоту с гидрофобной группой, имеет важное значение и влияет на активность указанных соединений.
Указанные способы могут включать обработку указанным соединением одного или более семян до посева, причем в другом варианте семена можно обрабатывать in situ после посева в среде, такой как почва, компост или перегной.
Указанную композицию можно использовать для обработки семян сорняков для стимуляции прорастания, с тем чтобы затем их уничтожить при обработке гербицидами и очистить почву от сорняков перед посевом сельскохозяйственных культур. Сорняки также можно уничтожить при подготовке к посеву.
Другой растительный материал, такой как клубни, зерно или луковицы, также можно обработать для стимуляции роста до или после посадки.
Указанный способ может включать обработку тканей и органов растений, или растений для стимуляции плодоношения или цветения.
Применение указанных соединений характеризуется рядом преимуществ:
(1) Рост растений начинается раньше, так как ткани или органы растений выведены из состояния покоя раньше обычного, и при этом не оказывается влияния на синтез каротиноидов, как наблюдается в случае использования некоторых известных соединений.
(2) Можно стимулировать или равномерно контролировать развитие почек декоративных цветов и цветов плодовых деревьев.
(3) Можно стимулировать прорастание и рост семян, клубней, зерна, луковиц и других посадочных материалов. Такой подход можно использовать для выведения семян из периода первичного покоя и сокращения продолжительности периода вторичного покоя, который вызван неблагоприятными условиями, такими как повышенная температура или недостаточная влажность почвы.
(4) Равномерность прорастания увеличивает урожайность и однородность сельскохозяйственной культуры. Совершенствование системы полива наряду с увеличением урожайности повышает эффективность потребления воды за счет предотвращения потерь воды на полив оголенной почвы и подавления роста сорняков.
(5) Применение указанных соединений может влиять на селекцию растений.
Глубокий покой является недостатком при необходимости быстрой и однородной приживаемости и развития культуры. Однако продолжительный период покоя является положительным признаком для хранения заготовленного урожая, так как прорастание урожая влечет за собой мобилизацию резервов и метаболические изменения, что приводит к ухудшению качества и ценности продукции.
Селекционные работы часто направлены на сокращение естественного периода покоя (для ускорения смены циклов между поколениями), и впоследствии химические препараты используют для предотвращения прерывания периода покоя урожая при хранении. Например, длительное хранение клубней картофеля и лука требует более низкой температуры хранения и/или использования ингибиторов митотического роста с целью предотвращения прорастания. Семена зерновых в определенных условиях окружающей среды начинают прорастать в колосьях до сбора урожая (прорастание до сбора урожая), что приводит к снижению качества сельскохозяйственной культуры.
Указанные соединения можно применять для профилактики таких ситуаций, а длительный период покоя обеспечивает хранение в удовлетворительных условиях без использования химических препаратов, причем указанными соединениями необходимо обработать и растительные ткани в состоянии покоя (семена, клубнелуковицы, луковицы, почки) для того, чтобы повысить урожайность и рост растений. Указанный способ описан на примере семян томатов SP12 (модифицированные семена с повышенным содержанием АБК, см. ниже), характеризующихся продолжительным периодом покоя, который сокращали с использованием вышеуказанных соединений. Химическая обработка культуры на стадии развития, а не хранения, позволит снизить воздействие агрохимикатов на потребителя.
Растения генетически модифицируют (и получают стандартным методом селекции) с целью увеличения содержания АБК, что приводит к повышению эффективности потребления воды и/или повышению устойчивости к засухе (Thompson A.J. и др., Over-production of abscisic acid increases water-use efficiency and root hydraulic conductance and influences leaf expansion, Plant Physiology, T.143, cc.1905-1917,7, (2007)). Однако такие растения могут характеризоваться длительным периодом покоя. Использование указанных соединений позволит оптимизировать длительность периода покоя у растений, что повысит их ценность.
При селекции сельскохозяйственных культур с длительным периодом покоя указанные соединения могут ускорить селекционный процесс за счет их способности прерывать период покоя и таким образом сокращать время генерации (например, время от посева до посева) в процессе селекции.
В настоящем изобретении также предлагаются композиции для растений, включающие соединения формулы I, а также индивидуальные соединения формулы I, где указанное соединение обозначает соединение, представленное выше.
Указанные композиции и составы по настоящему изобретению дополнительно включают одно или более вспомогательных веществ. Вспомогательные вещества для использования в гербицидных композициях известны в данной области техники. Указанные вспомогательные вещества включают вспомогательные вещества и их смеси на масляной основе, кремнийорганические вспомогательные вещества и их смеси, неионогенные вспомогательные вещества и их смеси, вспомогательные вещества на полимерной основе и их смеси, вспомогательные вещества на основе жирных кислот и их смеси, а также их комбинации. Минеральное масло также можно использовать в качестве вспомогательных веществ. Указанные вспомогательные вещества добавляют в количестве 1 мас.%-95 мас.% в расчете на массу активного ингредиента.
Гербицидная композиция может включать или дополнительно включать твердый материал, такой как глина, кремнезем или другой инертный твердый носитель, общеизвестный в данной области техники.
Гербицидную композицию можно использовать в твердой или жидкой форме. Жидкая форма может включать, например, керосин, ксилен или спирт, такой как этанол, а также их смеси. Для усиления смачиваемости семян или растений указанные смеси можно использовать в смеси с ПАВ.
Указанная композиция может включать один или более инкапсулирующих агентов или пленкообразующих агентов. Такие агенты являются известными в данной области техники и их можно смешивать с указанным соединением формулы I или их можно использовать после обработки семян.
Семена можно обрабатывать указанным соединением при замачивании в барабанном смесителе при нанесении на семена покрытия известными методами.
Инкапсулирующие и пленкообразующие агенты включают гипс, диатомитовую землю и бертонитовый глинопорошок в смеси со связующими агентами. В качестве таких агентов известны полимеры и гели, такие как альгинаты и сополимеры поливинилпирролидона и винилацетата или нуклеиновой кислоты и алкилвинилового эфира.
Можно также проводить дражирование семян в матрицу наполнителя и связующего компонента. Известные дражирующие материалы включают суглинок, крахмал и сополимеры полиакрилата и полиакриламила. Можно также добавлять фунгициды, пестициды и/или наполнители.
В настоящем изобретении также предлагаются семена, ткани растений, органы растений и растения, обработанные композицией по настоящему изобретению.
Указанное растение может представлять собой однодольное или двудольное растение и предпочтительно выбрано из группы, включающей томаты, картофель, лук, пшеницу, ячмень, овес, сорго, кукурузу, рис, кочанную капусту семейства Brassicaceae, семена овощей и салатов, включающие пастернак, латук, шпинат, цикорий и лук-порей, а также любые виды деревьев и кустарников.
Гербицидный состав можно наносить непосредственно на растение или добавлять в почву.
Установлено, что композиции проявляют эффективность при концентрации, например, 1 мМ. Предпочтительно не следует использовать композиции при концентрации более 2 мМ, так как при этом может снизиться эффективность композиции.
Другим объектом настоящего изобретения является индивидуальное соединение формулы I, как представлено выше.
Настоящее изобретение описано в виде примеров со ссылкой на следующие фигуры.
Подписи на фигурах
Фигура 1
Реакции, катализируемые каротиндиоксигеназой: а, 11,12-окислительное расщепление 9'-цис-неоксантина ферментом NCED, б, реакции окислительного расщепления β-каротина и зеаксантина.
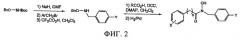
Фигура 2
Схема синтеза гидроксамовых кислот и ингибиторов.
Фигура 3
Структура ингибиторов. Протонированный абамин (а), промежуточный карбокатион каротиноидов (б) и ингибитор гидроксамовой кислоты (в) присоединены к атому железа (II) в составе кофермента CCD.
Фигура 4
Относительное ингибирование четырех CCD в Е.coli. Гены CCD экспрессировали в штаммы Е.coli., продуцирующие β-каротин. Указанные штаммы культивировали в присутствии или отсутствии ингибиторов (концентрация 100 мМ) в течение 16 ч. Указанная концентрация ингибитора находится в линейном диапазоне ответной реакции Е.coli. Относительное ингибирование CCD каждого типа определяли по увеличению накопления β-каротина в присутствии ингибитора, значение 0 обозначает уровень β-каротина в отсутствие ингибитора, а значение 100 обозначает максимальный уровень β-каротина, как в случае штаммов, не продуцирующих CCD (см. Экспериментальные методы, уравнение). Отрезки на диаграмме соответствуют стандартной средней ошибке, n=4. Сплошная черная линия в верхней части диаграммы обозначает наименьшее значимое различие (P<0,05) по результатам сравнения любых двух средних значений.
Фигура 5
Влияние ингибиторов на разрастание почек, вырезанных из узлов арабидопсиса в присутствии 1 мМ нафтилуксусной кислоты (НУК). На графике представлено время задержки до начала зарождения бутона для штамма Соl-0 (дикого типа, ДТ) в отсутствие или присутствии ингибитора при концентрации 100 мкМ. В качестве контроля использовали нулевой мутант AtCCD71 (max3) в отсутствие ингибитора. Средние значения получены по результатам пяти независимых экспериментов, n=35 (ДТ), n=18 (max3), n=14-16 (ДТ в присутствии ингибиторов). Сплошная черная линия в верхней части диаграммы обозначает наименьшее значимое различие при сравнении любых двух значений, и звездочками показаны значения, значительно отличающиеся от ДТ (P<0,05).
Фигура 6
Растения арабидопсис, с фенотипом обильного ветвления, выращивали в агаре в течение 45 сут с добавлением ингибитора D6. На фотографиях показаны:
(а) Соl-0 (ДТ) в отсутствие ингибитора, (б) мутант max3-9 в отсутствие ингибитора, (в) Соl-0 с добавлением D6 при концентрации 100 мкМ. Рассчитанное число (г) ветвей-розеток. Отрезки на диаграмме соответствуют стандартной средней ошибке, n=от 6 до 12.
Фигура 7
Количество β-каротина обозначает (в мкг/мл культуры) количество β-каротина в штаммах E.Coli, накапливающих β-каротин и экспрессирующих CCD, в присутствии ингибитора. Указанные штаммы культивировали в отсутствие или присутствии ингибиторов (100 мкМ) в течение 16 ч (см. раздел Методы). Отрезки на диаграмме соответствуют стандартной средней ошибке, n=4. (A) AtCCD7 (В) LeCCDl (С) MMBCO2 (D) MMBCO1.
Фигура 8
Влияние соединения D4 при концентрации 100 мкМ на прорастание семян томатов, сверхэкспрессирующих NCED (линия SP12). Во время некоторых обработок добавляли норфлуразон при концентрации 3,3 мкМ. На верхнем и нижнем графике представлены два независимых эксперимента. Для каждого анализа в чашку Петри помещали по 20 семян. Отрезки на диаграмме обозначают диапазон различий между двумя чашками с одинаковыми образцами (два повтора). Раствор соединения D4 также включает 1% ДМСО, растворитель для исходного раствора D4. Контрольную обработку проводили 1% раствором ДМСО.
Фигура 9
Прорастание семян дикого типа (ДТ, Ailsa Craig Tm2a) или SP12 при различных концентрациях соединения D4. Для исследования прорастания в каждую чашку Петри помещали по 20 семян. Отрезки на диаграмме обозначают диапазон различий между двумя чашками с одинаковыми образцами. Все растворы D4 для обработки семян также содержали 1% раствор ДМСО. Контрольную обработку проводили 1% раствором ДМСО, не содержащем D4.
Экспериментальные методы
Синтез третичных аминов-ингибиторов
Абамин синтезировали согласно известным описанным методикам (31, 34).
Синтез ингибиторов на основе гидроксамовой кислоты.
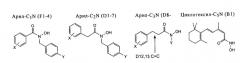
Схема синтеза представлена на фиг.2, структура полученных продуктов представлена в таблице 1. В N-Вос,O-бензилгидроксиламин добавляли раствор гидрида натрия в ДМФА, затем в полученную смесь добавляли соответствующий бензил- или алкилбромид (35). Удаление защитной группы осуществляли при обработке 1% раствором трифторуксусной кислоты в дихлорметане, при этом получали N-замещенный гидроксиламин. Гидроксамовую кислоту получали в присутствии ДКК (1,1 экв.), 4-диметиламинопиридина (0,2 экв.) и раствора соответствующей карбоновой кислоты в дихлорметане. Неочищенный продукт, гидроксамовую кислоту, очищали хроматографией на колонке с силикагелем. Соединения B1, D12 и D13 получали после активации соответствующей кислоты смесью, содержащей метилхлорформиат и триэтиламин в ТГФ, и проводили реакцию с гидрохлоридом гидроксиламина. Промежуточный продукт для синтеза B1 синтезировали с использованием β-ионона (36), при этом B1 выделяли в виде смеси E/Z изомеров в соотношении 2:1. Спектроскопические данные и выход соединений D1-D13, F1-4, и B1 представлены в разделе Дополнительные материалы.
Определение ферментативной активности NCED в условиях in vitro Сверхэкспрессию LeNCED1 в Е.coli проводили в виде гибридного белка, содержащего N-концевой гистидиновый пептид His6 (дополнительные материалы). Бесклеточный экстракт, содержащий рекомбинантную LeNCED1, готовили в 100 мМ буферном растворе бис-трис (pH 6,7). Непосредственно перед использованием экстракт (объемом 15 мкл) предварительно активировали при добавлении сульфата железа (II) (20 мМ, 1 мкл) и аскорбиновой кислоты (20 мМ, 1 мкл) на ледяной бане в течение 2 мин. Затем аликвотную часть указанного фермента добавляли к анализируемому образцу (общий объем 150 мкл), содержащему 100 мМ буферный раствор бис-трис (pH 6,7), 0,05% об./об. тритон Х-100, 1,0 мг/мл каталазы и 3 мкг 9'-цис-неоксантина. Субстрат 9'-цис-неоксантин получали, как описано в разделе Дополнительные материалы. Реакционную смесь инкубировали в течение 15 мин в темноте при температуре 20°С, затем в реакционную смесь добавляли воду (700 мкл). Полученные продукты экстрагировали этилацетатом (3×1 мл). Органический растворитель удаляли при пониженном давлении, полученный остаток растворяли в метаноле (200 мкл), отбирали 100 мкл, которые анализировали обращено-фазовой ВЭЖХ на колонке с Phenomenex С18, градиент 5-10% метанол в смеси ацетонитрил/0,05% триэтиламин, скорость потока 0,5 мл/мин в течение 20 мин, детектирование проводили при длине волны 440 нм. Ингибирование фермента NCED определяли в присутствии 1-100 мкМ ингибитора, ингибирующую активность рассчитывали по образованию продукта через 15 мин, в качестве контроля использовали реакционную смесь в отсутствие ингибитора. Время удерживания: 9'-цис-неоксантин, 10,2 мин, C25 продукт, 6,5 мин.
Определение ферментативной активности LeCCD1a в условиях in vitro
Сверхэкспрессию LeCCD1a проводили в Е.coli в виде GST-гибридного белка (Дополнительные материалы). Метод определения активности LeCCD1a в условиях in vitro основан на известной методике (37). Общий объем реакционной смеси составлял 200 мкл в лунках 96-луночного микропланшета, сигнал регистрировали при длине волны 485 нм. Для получения раствора субстрата для каждой реакционной смеси, 5 мкл 4% раствора апо-8'-каротиналя (мас./об. в этаноле) (Sigma) добавляли в 25 мкл 4% раствора маc./об. в этаноле) β-октилглюкозида (Sigma), затем этанол упаривали в атмосфере азота и полученный остаток растворяли в 150 мкл фосфатного солевого буферного раствора (ФСБ), содержащего 10 мМ аскорбат натрия при температуре 20°С в течение 30 мин. Затем в полученный раствор добавляли 50 мкл бесклеточного экстракта, содержащего рекомбинантную LeCCD1a, и проводили реакцию при температуре 20°С в течение 30 мин.
Определение ферментативной активности в E.coli в условиях in vivo
Исследуемые гены (Дополнительные материалы, таблица S1) клонировали в векторе рЕТ30с (Novagen), встроенном непосредственно в исходный кодон ATG без маркерной последовательности, или в векторе pGEX-4T, содержащем маркерный N-концевой фрагмент GST. Все гены использовали в виде полноразмерной последовательности, за исключением AtCCD7, у которого удалена сигнальная последовательность хлоропластов (Дополнительные материалы). Было установлено, что указанный ген после встраивания в GST в векторе pGEX-4t (GE Healthcare) проявляет большую активность по сравнению с CCD, экспрессируемой в рЕТ векторе, не содержащем маркерную последовательность. Таким образом, в дальнейших исследованиях использовали указанную конструкцию. Плазмиды трансформировали в Е.Coli, штамм BL21(DE3), содержащий рАС-ВЕТА (38), таким образом клетки продуцировали β-каротин.
Для определения ингибирующей активности готовили среду LB объемом 2,5 мл, содержащую соответствующие антибиотики (25 мкг/мл хлорамфеникола и 50 мкг/мл канамицина или 100 мкг/мл ампицилина) и 2,5 мМ ИПТГ. Ингибиторы (0,1 М в 100% этаноле) добавляли в среду до конечной концентрации 100 мкМ. В питательную среду высевали 0,25 мл суточной культуры (культивировали при температуре 37°C с добавлением соответствующих антибиотиков) и инкубировали при встряхивании (200 об/мин) при 28°С в течение 16 ч. Затем отбирали 1 мл культуральной среды, центрифугировали на микроцентрифуге и осадок ресуспендировали в 1 мл этанола, содержащем 0,2% Тритон Х-100. Полученный раствор интенсивно встряхивали на мешалке Вортекс и полученный экстракт инкубировали при комнатной температуре в течение 3 ч в темноте, затем снова интенсивно встряхивали на мешалке Вортекс и центрифугировали на микроцентрифуге в течение 5 мин при 13000 об/мин. Супернатант отбирали и измеряли оптическую плотность при 453-550 нм. Количество β-каротина рассчитывали по калибровочной кривой, построенной с использованием серийных разведений стандартного раствора β-каротина (Sigma) в этаноле, содержащем 0,2% тритон Х-100, абсолютные значения β-каротина представлены на фиг.8. Относительное ингибирование рассчитывали по уравнению: (Ci-Cc)/(C1-Cc)×100, где Ci обозначает концентрацию каротиноида в присутствии ингибитора и CCD, Cc обозначает концентрацию каротиноида в присутствии CCD и отсутствии ингибитора, a C1 обозначает концентрацию каротиноида в штамме, в котором ген lacZ экспрессируется вместо CCD в отсутствие ингибитора. Таким образом, увеличение содержания β-каротина благодаря ингибированию CCD (Ci-Cc) рассчитывают относительно максимально возможного содержания β-каротина в отсутствие CCD (Ci-Cc).
Оценка разрастания пазушных почек в стеблях арабидопсиса
Анализ проводили в основном по описанной методике (40) с некоторыми модификациями. В чашки Петри малого размера (диаметр 50 мм, глубина 20 мм) помещали по 10 мл раствора ATS (39), содержащего 1% агар и 1% сахарозу. Предварительно в агар добавляли ингибиторы и β-нафталинуксусную кислоту (НУК) до конечных концентраций 100 мкМ и 1 мкМ, соответственно. Затем вырезали полоску агара из центральной части, содержащей как апикальную, так и базальную среды, содержащие НУК и ингибитор. Любые узлы, в которых апикальные участки выступали из среды или длина которых менее 2 мм, в эксперименте не учитывались. Длину побега измеряли каждые 24 ч, логистическую функцию строили для каждого анализа с использованием программного обеспечения Genstat (10-ая версия, международный серийный номер тома), аппроксимирующую кривую и продолжительность лаг-фазы рассчитывали при экстраполяции линейной части кривой и начального плато (см. Дополнительные материалы). Значение x, в котором пересекаются две линии, означало продолжительность лаг-фазы.
Статистический анализ. Результаты анализа, представленные на фиг.4 и 5, оценивали по ограниченному критерию максимального правдоподобия (ОКМП) с использованием программного обеспечения Genstat10, в обоих случаях F-критерий указывал на суммарный эффект обработки (P<0,001). Максимальное значение критерия наименьшей достоверной разницы рассчитывали при умножении максимальной среднеквадратичной ошибки событий на t-значение (P=0,05), как представлено на графиках. Прирост значения критерия наименьшей достоверной разницы (степень свободы) составлял 105 и 157% на фиг.4 и 5, соответственно. Использовали максимальное значение критерия наименьшей достоверной разности, так как индивидуальные критерии наименьшей достоверной разницы различались, однако если в данном случае различия между средними значениями были значительными, то они также отличались от индивидуальных значений для любого из двух выбранных средних значений в выборке.
Посадочный материал
Использовали семена томатов "дикого типа" (Solanum lycopersicum cv. Ailsa craig почти изогенной линии, содержащей ген Tm2a устойчивости к вирусу табачной мозаики). Кроме того, использовали трансгенные семена томатов (Solanum lycopersicum cv. Ailsa craig), трансформированные конструктом для сверхэкспрессии гена LeNCEDl, кодирующим 9-цис-эпоксикаротиндиоксигеназу. Такие трансгенные семена называются D9 (Thompson A.J. и др., Ectopic expression of a tomato 9-cis-epoxycarotenoid dioxygenase gene causes over-production of abscisic acid. Plant Journal, т.23(3), cc.363-74.5 (2000)), однако впоследствии были переименованы в SP12 (Thompson, A.J. и др., Regulation and manipulation of ABA biosynthesis in roots, Plant Cell and Environment, т.30, cc.67-78.6 (2007)), и, как было установлено, характеризовались замедленным, с низкой всхожестью, прорастанием по причине сверхэкспрессии абсцизовой кислоты, связанной со сверхэкспрессией LeNCEDl (Thompson A.J. и др., Ectopic expression of a tomato 9-cis-epoxycarotenoid dioxygenase gene causes over-production of abscisic acid. Plant Journal, т.23(3), cc. 363-74.5 (2000)).
Анализ на прорастание
Каждый анализ проводили в чашке Петри с диаметром 10 см, с отверстиями, в которую помещали диск фильтровальной бумаги диаметром 8,5 см (Whatman 1), фирма Whatman International Ltd, Maidstone, Великобритания), предварительно пропитанный 1 мл исследуемого раствора. Семена стерилизовали вымачиванием в 30% растворе хозяйственного отбеливателя в течение 30 мин, промывали дистиллированной водой, и затем семена по 20 штук помещали на диск фильтровальной бумаги в каждую чашку Петри. Чашки Петри инкубировали в условиях высокой относительной влажности (>95%) при температуре 25°C в темноте. Ежедневно проверяли прорастание семян, которое определяли визуально при появлении первичного корешка. Для каждой химической обработки использовали идентичные чашки.
Гидроксамовую кислоту растворяли в ДМСО, а водные растворы получали при конечной концентрации ДМСО 1% об./об. Контрольные растворы представляли собой 1% об./об. раствор ДМСО в воде. Готовили также исходный раствор норфлуразона в этаноле при концентрации 20 мг/мл и затем разбавляли водой до конечной концентрации 5 мг/л, содержание этанола в растворе составляло 0,025% об./об.
Дополнительные методы
Конструирование штамма
Плазмиды получали, используя набор (mini spin) для выделения плазмид фирмы Qiaprep, Продукты ПЦР и фрагменты вектора очищали на колонках QiaQuick (фирма Qiagen) по инструкциям фирмы-производителя. ПЦР проводили, используя ПЦР-систему HiFi Expand (фирма Roche) и ДНК полимеразу по инструкциям фирмы-производителя. Лигирование проводили с участием фермента ДНК лигазы фага Т4 (фирма Invitrogen) в течение 1 ч при температуре 25°С. Плазмидные конструкты трансформировали в клетки Е.coli штамма DH10B (фирма Stratagene) и секвинировали для того, чтобы исключить ошибки метода ПЦР.
Ген LeCCDla (AY576001) амплифицировали из cLET29I6 (предоставлен Институтом Геномных Исследований (TIGR), классификация гена томата TIGR) с использованием праймеров LeCCD1a-FC1:-TACGAATTCCATATGGGGAGAAAAGAAGATG и LeCCD1a-RC1:-TAGTCTCGAGTCACAGTTTGGCTTGTTC. Полученный продукт расщепляли рестриктазами NdeI и Xhol и лигировали с вектором рЕТ30с (фирма Novagen, VWR International, Ltd), расщепленным аналогичным методом. Кроме того, полученный продукт расщепляли рестриктазами EcoRl и Xhol и лигировали с вектором pGEX-4T (фирма GE Healthcare), расщепленным аналогичным методом.
Ген AtCCD7 амплифицировали из ПЦР2.1-AtCCD7, любезно предоставленной Ottoline Leyser (Университет г.Йорка), с использованием праймеров AtCCD7-FC3 TATGCTCGAGGAGATCTGGATTAATGGCCGCAATATCAATATC и AtCCD7-RC1 TAGTCTCGAGTCAGTCGCTAGCCCATAAAC. Полученный продукт ПЦР расщепляли рестриктазами Bg1II и Xho1 и трансформировали в BamHI/Sa1I-фрагмент pGEX-4T.
The MMBCO1 (AF294899) амплифицировали из клона IMGCLO2192191, предоставленного Geneservice Ltd. (Кембридж, Великобритания) с использованием праймеров MMBCO1-FC1 TACTGAATTCCATATGGAGATAATATTTGGC и MMBCO1-RC1 TACTCTCGAGTGAGTGTTAGGATTAAAG. Полученный продукт ПЦР расщепляли рестриктазами NdeI/XhoI и клонировали в расщепленный аналогичным образом вектор рЕТ30с.
Ген ММВСO2 (AJ290392) амплифицировали из клона IMGCLO2536812 (фирма Geneservice Ltd.) с использованием праймеров MMBCO2-FC1 TATCGGATCCCATATGTTGGGACCGAAGCAGAG и MMBCO2-RC1 TATCCTCGAG TCAGATAGGCACAAAGGT. Полученный продукт расщепляли рестриктазами NdeI/XhoI и клонировали в расщепленный аналогичным образом вектор рЕТ30с.
кДНК LeNCED1 (Z97215) была предоставлена Ian Taylor (Университет Ноттингема) и клонирована в участки NdeI и Bpu1102 вектора pET14b (фирма Novagen, VWR International, Ltd) для получения гибридного белка, содержащего N-концевой His6. Полученную плазмиду экпрессировали в клетки Е.coli Rosetta.
(DE3) (фирма Novagen, VWR International, Ltd).
Подробная информация о штаммах, использованных для оценки ингибирующей активности в E.coli также представлена в Дополнительных материалах в таблице S1, ниже.
Получение бесклеточных экстрактов
Для получения бесклеточных экстрактов LeCCD1a и LeNCED1 культуры выращивали до оптической плотности 0,6 при 37°С, затем добавляли 0,2 мМ изопропил-β-D-1-тиогалактопиранозид (ИПТГ) и культуральную среду выращивали в течение ночи при 20°С. Клетки (200 мл культуральной среды) собирали центрифугированием (5000 об/мин, 10 мин) и полученный осадок ресуспендировали в 4 мл ФСБ, 0,1% Тритон X 100. В полученный раствор добавляли лизоцим до конечной концентрации 25 мкг/мл, и раствор инкубировали при комнатной температуре в течение 15 мин на ледяной бане, а затем обрабатывали ультразвуком (3×30 с при 18 Ω). Затем полученный лизат центрифугировали (13000 об./мин, 15 мин, температура 4°С) и супернатант использовали для проведения анализа.
Расчет величины лаг-фазы для оценки эффективности роста побегов
Логистическую кривую, y=A+C/(1+e-B(t-m)), строили по данным для каждого побега с использованием программного обеспечения GenStat (10-ая версия). Затем рассчитывали лаг-фазу по формуле m-(2/B) и определяли значение t (время) по отрезку, отсекаемому экстраполированными линиями линейного участка кривой и начального плато.
Получение 9'-цис-неоксантина
Свежий шпинат (20 г) промывали и измельчали с помощью пестика и ступки с добавлением бутилгидрокситолуола (0,03 г) и бикарбоната натрия (0,3 г) в ледяном метаноле (30 мл) в течение 3 мин в темноте, затем полученную смесь фильтровали в вакууме. Процедуру повторяли 6 раз до получения практически бесцветного фильт