Производные индола, подходящие для визуализации нейровоспаления
Иллюстрации
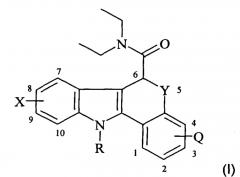
Показать всеИзобретение относится к соединению Формулы I, которое представляет собой агент визуализации in vivo периферического бензодиазепинового рецептора (PBR):
где Q представляет собой водород или фтор; Х представляет собой водород или С1-4алкокси; Y представляет собой S; и R представляет собой C1-6фторалкил; и где по меньшей мере один атом указанного агента визуализации in vivo Формулы I представляет собой радиоизотоп, подходящий для визуализации in vivo, представляющий собой либо гамма-излучающий радиоактивный галоген, либо позитрон-излучающий радиоактивный неметалл; и где если указанный радиоизотоп является радиоизотопом углерода, то он является карбонильным углеродом. 7 н. и 8 з.п. ф-лы, 2 ил., 1 табл., 12 пр.
Реферат
Область изобретения
Настоящее изобретение относится к визуализации in vivo и, в частности, к визуализации in vivo периферического бензодиазепинового рецептора (PBR). Предлагается тетрациклический индольный агент визуализации in vivo, который связывается с PBR с высокой аффинностью, хорошо поглощается в головном мозге после введения и который предпочтительно связывается с тканями, экспрессирующими более высокие уровни PBR. В настоящем изобретении также предлагается соединение-предшественник, полезное в синтезе агента визуализации in vivo no изобретению, а также способ синтеза указанного агента визуализации in vivo, включающий применение указанного соединения-предшественника, и набор для выполнения указанного способа. Также предлагается кассета для автоматизированного синтеза агента визуализации in vivo. Кроме того, в изобретении предлагается радиофармацевтическая композиция, содержащая агент визуализации in vivo по изобретению, а также способы применения указанного агента визуализации in vivo.
Описание уровня техники
Периферический бензодиазепиновый рецептор (PBR), который также известен как транслокаторный белок (TSPO), как известно, главным образом локализован в периферических тканях и глиальных клетках, но его физиологическая функция ясно не истолкована. Известно, что внутриклеточно PBR локализуется на внешней митохондриальной мембране, что указывает на потенциальную роль в модулировании митохондриальной функции и в иммунной системе. Кроме того, предполагалось, что PBR вовлечен в клеточную пролиферацию, стероидогенез, ток кальция и клеточное дыхание. PBR ассоциируется с множеством состояний, включая острый и хронический стресс, тревогу, депрессию, болезнь Паркинсона, болезнь Альцгеймера, повреждение головного мозга, рак (Gavish et al. Pharm. Rev. 1999; 51:629), болезнь Хантингтона (Meβmer and Reynolds Neurosci. Lett. 1998; 241:53-6), астму (Pelaia et al. Gen. Pharmacol. 1997; 28(4):495-8), ревматоидный артрит (Bribes et al. Eur. J.Pharmacol. 2002; 452(1):111-22), атеросклероз (Davies et al. J.Nucl. Med. 2004; 45:1898-1907) и рассеянный склероз (Banati et al. 2000 Brain; 123:2321). PBR также может быть связан с невропатической болью. Tsuda et al. наблюдали активированную микроглию у субъектов с невропатической болью (2005 TINS 28(2) р.101-7).
Лиганды, имеющие высокую аффинность к PBR, известны в данной области техники. Класс индольных соединений, обладающих аффинностью к PBR (значения IC50 для наиболее активных соединений от 0,2 нМ и до 5,0 нМ), раскрыт в US 6451795. Утверждается, что соединения, раскрытые там, являются полезными для предупреждения или лечения периферических невропатий и для лечения нейродегенеративных заболеваний центральной нервной системы. Okubu et al. (Bioorganic & Medicinal Chemistry 2004; 12:3569-80) описывают разработку, синтез и структуру группы тетрациклических индольных соединений, обладающих аффинностью к PBR (низкие значения IC50 составляют примерно 0,4 нМ). В данной публикации Okubu et al. отсутствует обсуждение конкретных применений данных соединений.
In vivo визуализация PBR также известна в данной области техники. Визуализация посредством позитрон-эмиссионной томографии (PET) с использованием селективного лиганда PBR, (R)-[11C]PK11195, обеспечивает общий индикатор воспаления центральной нервной системы (ЦНС). Несмотря на успешное применение (R)-[11C]PK11195, он имеет ограничения. Известно, что он обладает высоким связыванием с белком и связыванием от низкоспецифичного до неспецифичного (Lockhart et al. Nucl Med Biol. 30(2):199-206). Роль его меченных радиоизотопами метаболитов не известна, и для количественного определения связывания требуется сложное моделирование. Были попытки предложить соединения, обладающие высокой аффинностью и селективностью к PBR, чтобы обеспечить возможность улучшенного измерения PBR в ЦНС. [11C]DAA1106 и [18F]FЕОАА1106 представляют собой радиолиганды для PET на основе арилоксианилиновых соединений и были исследованы на людях (Ikomo et al. J.Cereb. Blood Flow Metab. 2007; 27:173-84 и Fujimura et al. J.Nuc. Med. 2006; 47:43-50). Однако кинетические свойства таких соединений не идеальны и могут ограничить их применение в количественных исследованиях. В попытке дополнительно улучшить такие радиолиганды Briard et al. (J.Med. Chem. 2008; 51:17-30) сообщили о другом арилоксианилиновом производном, PBR28. 11C-меченый вариант PBR28 инъецировали обезьянам для оценки его кинетики в головном мозге с использованием PET. [11C]PBR28 показал высокое поглощение головным мозгом, хорошее специфическое связывание с PBR-экспрессирующими тканями и кинетические свойства, более подходящие для визуализации in vivo. PBR-связывающие пиразолопиримидиновые соединения также оценивали в качестве РЕТ-радиолигандов для нацеливания на PBR. В James et al. (J. Nuc. Med. 2008; 49(5):814-22) сообщалось, что радиолиганд для PET, [18F]-DPA-714, обладает высокой аффинностью к PBR и селективным поглощением посредством PBR в головном мозге павиана после внутривенного введения. Сообщалось, что кинетика поглощения головным мозгом [18F]-DPA-714 медленнее чем, но подобна по характеру [11С]DAA1106 и [18F]FEDAA1106. В WO 2007/057705 раскрыты тетрациклические индольные соединения, меченные визуализирующей группировкой, которые являются подходящими для визуализации in vivo. Показано, что агенты визуализации in vivo, приведенные в примерах в WO 2007/057705, обладают хорошей аффинностью к PBR, со значениями K1 в конкурентном анализе с [3H]-PK-11195 от 1,0 нМ до 0,1 нМ. Однако в настоящее время авторы данного изобретения обнаружили, что селективность таких соединений в отношении PBR-экспрессирующих тканей не является идеальной для визуализации in vivo экспрессии PBR в центральной нервной системе.
Существуют пределы улучшения известных тетрациклических индольных соединений с целью получения альтернативных агентов визуализации in vivo для оценки экспрессии PBR в центральной нервной системе.
Краткое изложение сущности изобретения
В настоящем изобретении предлагаются агенты визуализации in vivo на основе тетрациклических индольных соединений. По сравнению с известными агентами визуализации in vivo на основе тетрациклических индольных соединений агенты визуализации in vivo по настоящему изобретению обладают лучшими свойствами для визуализации in vivo. Агенты визуализации in vivo по настоящему изобретению обладают подходящими свойствами связывания с периферическим бензодиазепиновым рецептором, а также хорошим поглощением в головном мозге и кинетикой in vivo после введения субъекту.
Краткое описание графических материалов
Фиг 1: Типичные ауторадиограммы, показывающие связывание агента 1 визуализации in vivo в поврежденном (справа) ядре лицевого нерва крысы с FNA (аксотомия лицевого нерва).
Фиг.2. Относительная эффективность связывания агента визуализации in vivo в ядре лицевого нерва крысы через семь дней после FNA. Данные представлены как среднее ±50 (стандартное отклонение) от 24 отдельных срезов у 1 животного.
Подробное описание изобретения
Агент визуализации in vivo
В одном аспекте настоящего изобретения предлагается агент визуализации in vivo Формулы I:
или его соль или сольват, где:
Q представляет собой водород или фтор;
Х представляет собой водород, фтор, бром, йод, гидрокси, C1-6алкил, C1-6галогеноалкил, C1-6алкокси или C1-6алкиламид;
Y представляет собой S, SO или SO2; и,
R представляет собой водород, C1-6алкил или C1-6фторалкил;
и где по меньшей мере один атом указанного агента визуализации in vivo Формулы I представляет собой радиоизотоп, подходящий для визуализации in vivo; где если указанный радиоизотоп представляет собой радиоизотоп углерода, то он является карбонильным углеродом;
при условии, что если Y представляет собой S, то Q или Х не являются оба водородом.
Термин "визуализация in vivo" при использовании в данном описании изобретения относится к тем способам, которые неинвазивно создают изображения всего или части внутреннего аспекта субъекта изобретения. Предпочтительные способы визуализации in vivo для использования в настоящем изобретении представляют собой однофотонную эмиссионную компьютерную томографию (SPECT) и позитрон-эмиссионную томографию (PET), причем PET является особенно предпочтительной. Преимущество для PET в способе по изобретению обусловлено ее превосходной чувствительностью и разрешением, так что даже относительно небольшие изменения в повреждении можно наблюдать в динамике по времени. Сканеры PET в плановом порядке измеряют концентрации радиоактивности в пикомолярном диапазоне. Сканеры микро-РЕТ в настоящее время приближаются к пространственному разрешению примерно 1 мм, а клинические сканеры - примерно 4-5 мм.
"Агент визуализации in vivo" Формулы I содержит радиоизотоп, подходящий для визуализации in vivo. Такой "радиоизотоп, подходящий для визуализации in vivo" представляет собой радиоизотопную форму одного из атомов, определенных выше, для агента визуализации in vivo Формулы I. Чтобы быть подходящим для визуализации in vivo, как определено в данном описании изобретения, радиоизотоп предпочтительно представляет собой гамма- или позитронный излучатель, тем самым делая возможным обнаружение агента визуализации in vivo снаружи от субъекта после введения.
Подходящие соли согласно изобретению включают (1) физиологически приемлемые соли присоединения кислоты, например полученные из неорганических кислот, например соляной, бромистоводородной, фосфорной, метафосфорной, азотной и серной кислот, и произведенные из органических кислот, например винной, трифторуксусной, лимонной, яблочной, молочной, фумаровой, бензойной, гликолевой, глюконовой, янтарной, метансульфоновой и пара-толуолсульфоновой кислот; и (2) физиологически приемлемые соли оснований, такие как соли аммония, соли щелочных металлов (например, соли натрия и калия), соли щелочноземельных металлов (например, соли кальция и магния), соли с органическими основаниями, такими как триэтаноламин, N-метил-D-глюкамин, пиперидин, пиридин, пиперазин и морфолин, и соли с аминокислотами, такими как аргинин и лизин.
Подходящие сольваты согласно изобретению включают сольваты, образованные с этанолом, водой, солевым раствором, физиологического буфера и гликоля.
Если не указано иное, термин "алкил" сам по себе или в комбинации означает алкильный радикал с прямой или разветвленной цепью, предпочтительно содержащий от 1 до 6 атомов углерода, наиболее предпочтительно от 1 до 4 атомов углерода. Примеры таких радикалов включают, без ограничения ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, изоамил, гексил.
Если не указано иное, термин "алкокси" сам по себе или в комбинации означает алкилэфирный радикал, где термин алкил такой, как определено выше. Примеры подходящих алкилэфирных радикалов включают, без ограничения ими, метокси, этокси, н-пропокси, изопропокси, н-бутокси, изо-бутокси, втор-бутокси, трет-бутокси.
"Алкиламид" представляет собой алкильную группу, как определено выше, связанную с амидом, где амид представляет собой группу -C(=O)-NR'R” где R' и R” представляют собой независимо водород или углеводородный радикал.
Термин "галоген" или "галогено-" означает заместитель, выбранный из фтора, хлора, брома или йода. "Галогеноалкил" представляет собой алкильную группу, как определено выше, замещенную одним или более галогеном.
Термин "гидрокси" относится к радикалу -ОН.
В предпочтительном воплощении Q представляет собой водород.
Х предпочтительно представляет собой водород, фтор, бром, йод, гидрокси, С1-4алкил, C1-4галогеноалкил, C1-4алкокси или C1-4алкиламид. Х наиболее предпочтительно представляет собой водород или С1-4алкокси.
Y предпочтительно представляет собой S или SO2. Y наиболее предпочтительно представляет собой S.
R предпочтительно представляет собой водород, С1-4алкил или C1-4фторалкил. R наиболее предпочтительно представляет собой С1-4фторалкил.
В предпочтительном воплощении Формулы I:
Х представляет собой водород, фтор, бром, йод, гидрокси, С1-4алкил, C1-4галогеноалкил, C1-4алкокси или C1-4алкиламид;
Y представляет собой S или SO2; и
R представляет собой водород, С1-4алкил или С1-4фторалкил.
В наиболее предпочтительном воплощении Формулы I:
Q представляет собой водород;
Х представляет собой С1-4алкокси;
Y представляет собой S; и
R представляет собой С1-4фторалкил.
В альтернативном предпочтительном воплощении Формулы I:
Q представляет собой фтор;
Х представляет собой водород;
Y представляет собой S; и
R представляет собой С1-4фторалкил.
Предпочтительные радиоизотопы, подходящие для визуализации in vivo по настоящему изобретению, представляют собой гамма-излучающие радиоактивные галогены и позитрон-излучающие радиоактивные неметаллы.
Примерами гамма-излучающих радиоактивных галогенов, подходящих для применения в настоящем изобретении, являются 123I, 131I и 77Br. Предпочтительным гамма-излучающим радиоактивным галогеном является 123I.
Примерами позитрон-излучающего радиоактивного неметалла, подходящего для применения в настоящем изобретении, являются 11С, 13N, 18F и 124I. Предпочтительным позитрон-излучающим радиоактивным неметаллом является 18F. 18F является наиболее предпочтительным радиоизотопом, подходящим для визуализации in vivo по настоящему изобретению.
В предпочтительном воплощении для агента визуализации in vivo Формулы I Х представляет собой 123I, 124I или 131I, 18F или C1-4[18F]-фторалкил.
В альтернативном предпочтительном воплощении для агента визуализации in vivo Формулы I R представляет собой C1-4[18F]-фторалкил.
В еще одном альтернативном предпочтительном воплощении для агента визуализации in vivo Формулы I карбонильный углерод представляет собой 11С.
Неограничивающими примерами некоторых предпочтительных агентов визуализации in vivo по настоящему изобретению являются следующие:
Из рассмотренных выше агентов визуализации in vivo агент визуализации 2 является наиболее предпочтительным.
Способы синтеза, используемые для получения этих агентов визуализации in vivo, описаны в экспериментальном разделе ниже. Эффективность этих нерадиоактивных вариантов агентов визуализации in vivo по настоящему изобретению измеряли в анализе in vitro, как описано в Примере 10.
В Примерах 7-9 описано, как получить радиофторированные агенты визуализации in vivo 1-7. Специалисту известно, что при обращении с 18F масштаб и используемые условия являются различными исходя из безопасности и практических соображений. Обзор получения 18F PET индикаторов см. в главах 1 и 2 of "Principles and Practice of Positron Emission Tomography" (2002 Lippincott Williams & Wilkins; Wahl and Buchanan, Eds.). Агенты визуализации in vivo испытывали на животной модели биораспределения (Пример 11) и их биораспределение сравнивали с биораспределением соединения [18F]FE-PBR из уровня техники (полученного согласно Примеру 14 в WO 2007/057705):
В Таблице 1 ниже представлены данные, полученные в анализе аффинности in vitro, а также в изучении биораспределения in vivo. Нерадиоактивные аналоги испытывали в анализе аффинности in vitro, и меченные радиоизотопом варианты оценивали в анализе биораспределения.
| Таблица 1 | ||
| Данные по аффинности in vitro и данные по специфическому in vivo поглощению агентов визуализации in vivo 1-7 по настоящему изобретению по сравнению с соединением [^FjFE-PBR из уровня техники. OB = обонятельная луковица | ||
| Агент визуализации in vivo | Ki нМ | ОВ: Полосатое тело в 30 мин |
| [18F]FE-PBR | 0,68 | 1,42 |
| 1 | 0,37 | 2,07 |
| 2 | 0,40 | 3,50 |
| 3 | 0,93 | 2,00 |
| 4 | 0,31 | 2,92 |
| 5 | 0,32 | 2,26 |
| 6 | 0,52 | 2,67 |
| 7 | 1,09 | 2,42 |
Данные иллюстрируют, что эффективность нерадиоактивных вариантов агентов визуализации in vivo 1-7 выгодно отличается от соединения из уровня техники, [18F]FE-PBR. Кроме того, данные показывают, что агенты визуализации in vivo 1-7 по изобретению удерживаются значительно дольше в 0 В по сравнению с полосатым телом через 30 минут после инъекции по сравнению с [18F]FE-PBR]. Известно, что PBR в значительных количествах экспрессируется в OB по сравнению с другими областями головного мозга крыс (см. "Handbook of Substance Abuse", Tarter, Ammerman and Ott; Springer 1998:398-99), эти данные неожиданно демонстрируют, что агенты визуализации in vivo 1-7 обладают улучшенной селективностью в отношении PBR, чем ранее приведенный в качестве примера агента визуализации in vivo [18F]FE-PBR.
Агент визуализации in vivo 1 дополнительно анализировали в ауторадиографической модели, как описано в Примере 12 ниже. Значительно более высокие уровни радиоактивности были обнаружены на поврежденной области ядра лицевого нерва (см. Фиг.1 и 2). Средняя интенсивность в поврежденной области составляла 7,75±0,95 по сравнению с 3,73±0,36 в неповрежденной области. Соотношение между двумя областями составляло 8,23±2,36. Так как повреждение имело более высокую экспрессию PBR по сравнению с нормой, эти данные подтверждают вывод, сделанный из данных по биораспределению, что агент визуализации in vivo 1 обладает хорошей селективностью в отношении PBR.
Следовательно, агенты визуализации in vivo по настоящему изобретению обладают неожиданно лучшими свойствами в отношении визуализации in vivo PBR по сравнению с известными PBR-связывающими агентами визуализации in vivo на основе тетрациклического индола.
Соединение-предшественник
В другом аспекте настоящего изобретения предлагается соединение-предшественник Формулы II:
где один из R1, X1 или Z1 содержит химическую группу, которая взаимодействует с подходящим источником радиоизотопа, где указанный радиоизотоп является таким, как это целесообразно и предпочтительно определено в данном описании изобретения, так что агент визуализации in vivo, как целесообразно и предпочтительно определено в данном описании изобретения, образуется при взаимодействии указанного соединения-предшественника с указанным подходящим источником указанного радиоизотопа;
и где:
если R1 не содержит указанную химическую группу, то он является таким, как целесообразно и предпочтительно определено в данном описании изобретения для R в Формуле I, и, возможно, дополнительно содержит защитную группу;
если X1 не содержит указанную химическую группу, то он является таким, как целесообразно и предпочтительно определено в данном описании изобретения для Х Формулы I, и, возможно, дополнительно содержит защитную группу;
если Z1 не содержит указанную химическую группу, то он представляет собой -С(=O)-N-(СН2-СН3)2 и, возможно, дополнительно содержит защитную группу;
Q1 является таким, как целесообразно и предпочтительно определено в данном описании изобретения для Q в Формуле I; и
Y1 является таким, как целесообразно и предпочтительно определено в данном описании изобретения для Y в Формуле I, и, возможно, дополнительно содержит защитную группу.
"Соединение-предшественник" содержит производное меченного радиоизотопом соединения, сконструированное так, что химическое взаимодействие с подходящей химической формой детектируемой метки происходит сайт-специфически; может быть проведено с минимальным количеством стадий (идеально в одну стадию); и без необходимости в значительной очистке (идеально без дополнительной очистки), с получением целевого агента визуализации in vivo. Такие соединения-предшественники являются синтетическими и могут быть легко получены с хорошей химической чистотой. Соединение-предшественник, возможно, может содержать защитную группу для некоторых функциональных групп соединения-предшественника.
Термин "защитная группа" означает группу, которая ингибирует или сдерживает нежелательные химические взаимодействия, но которую конструируют достаточно реакционноспособной, чтобы ее можно было отщеплять от функциональной группы, о которой идет речь, при достаточно мягких условиях, чтобы не модифицировать остальную часть молекулы. После снятия защиты получают целевой продукт. Защитные группы хорошо известны специалисту в данной области техники и подходящим образом выбираются из: для аминогрупп - Вос (где Вос представляет собой трет-бутилоксикарбонил), Fmoc (где Fmoc представляет собой флуоренилметоксикарбонил), трифторацетил, аллилоксикарбонил, Dde [то есть 1-(4,4-диметил-2,6-диоксоциклогексилиден)этил] или Npys (то есть 3-нитро-2-пиридинсульфенил); и для карбоксильных групп - метиловый эфир, трет-бутиловый эфир или бензиловый эфир. Для гидроксильных групп подходящие защитные группы представляют собой: метил, этил или трет-бутил; алкоксиметил или алкоксиэтил; бензил; ацетил; бензоил; тритил (Trt) или триалкилсилил, такой как тетрабутилдиметилсилил. Применение дополнительных защитных групп описано в «Protective Groups in Organic Synthesis», Theorodora W. Greene and Peter G.M. Wuts (Third Edition, John Wiley & Sons, 1999).
Термин "подходящий источник радиоизотопа" означает радиоизотоп в химической форме, которая вступает в реакцию с заместителем соединения-предшественника, так что радиоизотоп ковалентно присоединяется к соединению-предшественнику.
Для каждого конкретного радиоизотопа, присутствующего в следующем разделе, обсуждается один или более подходящих источников этого радиоизотопа. Специалист в области агентов визуализации in vivo знаком с этими и другими источниками радиоизотопов, которые подходят для применения в настоящем изобретении.
Когда радиоизотоп агента визуализации in vivo представляет собой 18F, атом радиофтора может образовывать часть фторалкильной или фторалкоксигруппы, так как алкилфториды устойчивы к метаболизму in vivo. Альтернативно, атом радиофтора может присоединяться с помощью прямой ковалентной связи с ароматическим кольцом, таким как бензольное кольцо.
Радиофторирование можно выполнять с помощью прямого введения метки, используя взаимодействие 18F-фторида с подходящей химической группой в соединении-предшественнике, имеющем подходящую уходящую группу, такую как алкилбромид, алкилмезилат или алкилтозилат.
18F также может быть введен посредством О-алкилирования гидроксильных групп с помощью 18F(CH2)3OMs или 18F(CH2)3Br.
Для арильных систем 18F-фторидное нуклеофильное замещение из соли арилдиазония, арильного нитросоединения и/или арильной четвертичной аммониевой соли являются подходящими путями к арил-18F производным. Такая стратегия является подходящей, например, для введения 18F в положения 1-4 или 7-10 Формулы I.
Альтернативно, введение метки 18F может быть достигнуто посредством нуклеофильного замещения уходящей группы из производного Формулы I. Подходящие уходящие группы включают Cl, Br, I, тозилат (OTs), мезилат (OMs) и трифлат (OTf). Такие производные являются соединениями-предшественниками для получения соединений для визуализации in vivo no изобретению.
Другой стратегией будет иметь подходящую уходящую группу, как определено выше, на месте алкиламидной группы, присутствующей в соединении-предшественнике. В данном способе можно вводить метку в соединение-предшественник в одну стадию посредством взаимодействия с подходящим источником [18F]фторид-иона (18F-), который обычно получают в виде водного раствора из ядерной реакции 18O(p,n)18F и делают реакционно-способным путем добавления катионного противоиона и последующего удаления воды. Для данного способа соединения-предшественники обычно избирательно защищают химически так, чтобы радиофторирование имело место в конкретном месте соединения. Подходящие защитные группы уже упоминались ранее.
Если радиоизотоп представляет собой 18F, то предпочтительно, чтобы или X1, или R1 содержал или:
(1) алкилгалогенид или алкилсульфонат (такой, как алкилбромид, алкилмезилат или алкилтозилат) для нуклеофильного замещения; или
(2) гидроксил (для введения 18F посредством O-алкилирования гидроксильных групп с помощью, например, 18F(CH2)3OMs или 18F(CH2)3Br).
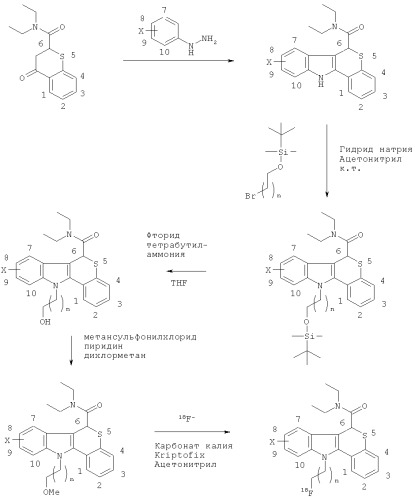
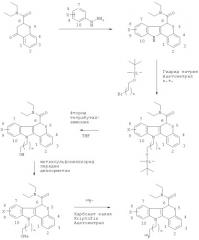
Типичная схема взаимодействия для получения некоторых 18F-агентов визуализации in vivo по изобретению проиллюстрирована ниже:
где Х такой, как определено для Формулы I, и n равен от 0 и до 5. К.т. означает комнатную температуру, и OMs означает мезилат.
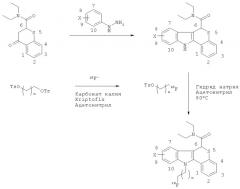
Альтернативная общая схема взаимодействия для получения некоторых 18F-агентов визуализации in vivo по изобретению проиллюстрирована ниже:
где X такой, как определено для Формулы I, и n равен от 0 и до 5, и OTs означает тозилат.
11C-меченые индикаторные соединения для PET можно синтезировать путем взаимодействия соединения-предшественника с 11C-метилйодидом. Так как период полураспада 11С составляет только 20,4 минут, важно, чтобы промежуточный 11C-метилйодид имел высокую удельную активность и, следовательно, чтобы его получали, используя способ взаимодействия, который является настолько быстрым, насколько это возможно. Детальное рассмотрение таких способов введения метки 11С можно найти в Antoni et al. "Aspects on the Synthesis of 11C-Labelled Compounds" в Handbook of Radiopharmaceuticals, Ed.M.J.Welch and C.S.Redvanly (2003, John Wiley and Sons).
Если агент визуализации in vivo по настоящему изобретению помечен при помощи 11С, то 11С представляет собой карбонильный углерод. Следовательно, это означает, что 11С может присутствовать на месте карбонильного углерода в Формуле I или альтернативно в X, когда Х представляет собой C1-6алкиламид.
11C-меченый агент визуализации in vivo Формулы I может быть получен с использованием следующей схемы взаимодействия:
где R3, X3 и Y3 в Формуле IIb и Формуле Id такие, как описано для R, Х и Y из Формулы I; и
Z3 представляет собой субстрат, подходящий для катализаторов - переходных металлов, например водород, галогенид, бороновую кислоту, OTf, оловоорганическое соединение.
Способы синтеза 13N-меченых соединений описаны в Clark and Aigbirhio ("Chemistry of Nitrogen-13 and Oxygen-15" в "Handbook of Radiopharmaceuticals"; 2003 Wiley: Welch and Redvanly, Eds.). Например, агент визуализации in vivo Формулы I может быть получен посредством нуклеофильного замещения галогена в подходящем соединении-предшественнике с 13N-меченым диэтиловым амином с получением целевого амида.
Если визуализирующая группировка представляет собой радиойод, предпочтительными соединениями-предшественниками являются такие, которые содержат производное, которое либо подвергается электрофильному или нуклеофильному йодированию, либо подвергается конденсации с меченым альдегидом или кетоном. Примерами первой категории являются:
а) металлорганические производные, такие как триалкилстаннан (например, триметилстаннил или трибутилстаннил), или триалкилсилан (например, триметилсилил), или борорганическое соединение (например, боронатные эфиры или органотрифторбораты);
б) ароматические кольца, активированные в отношении электрофильного йодирования (например, фенолы) и ароматические кольца, активированные в отношении нуклеофильного йодирования (например, соль арил-йодония, арил-диазония, соли арил-триалкиламмония или нитроарильные производные).
Для радиойодирования соединение-предшественник предпочтительно содержит: арилйодид или -бромид (для разрешения обмена радиойода); арильное кольцо активированного соединения-предшественника (например, фенольную группу); металлорганическое соединение-предшественник (например, триалкилолово, триалкилсилил или борорганическое соединение); или органическое соединение-предшественник, такое как триазены, или подходящую уходящую группу для нуклеофильного замещения, такую как соль йодония. Соединения-предшественники и способы введения радиойода в органические молекулы описаны в Bolton (J.Lab.Comp. Radiopharm. 2002; 45:485-528). Соединения-предшественники и способы введения радиойода в белки описаны в Wilbur (Bioconj. Chem. 1992; 3(6):433-470). Подходящие борорганические соединения боронатных эфиров и их получение описаны в Kabalaka et al. (Nucl. Med. Biol., 2002; 29:841-843 и 2003; 30:369-373). Подходящие органотрифторбораты и их получение описаны в Kabalaka et al. (Nucl. Med. Biol., 2004; 31:935-938). Предпочтительные соединения-предшественники для радиойодирования содержат металлорганическое соединение-предшественник, наиболее предпочтительно триалкилолово.
Примеры арильных групп, к которым может быть присоединен радиоактивный йод, представлены ниже:
Обе группы содержат заместители, которые обеспечивают возможность легкого замещения радиойодом на ароматическом кольце. Альтернативные заместители, содержащие радиоактивный йод, можно синтезировать путем непосредственного йодирования с помощью обмена радиогалогена, например
Если радиоизотоп представляет собой радиойод, то X1 в Формуле II вместе с ароматической группой, к которой он присоединен, образует:
1) ароматическое кольцо, замещенное или металлорганическим производным, или борорганическим соединением;
2) ароматическое кольцо, активированное в отношении электрофильного радиойодирования (например, фенолы); или
3) ароматическое кольцо, активированное в отношении нуклеофильного радиойодирования (например, соль арилйодония, арилдиазоний, соли арилтриалкиламмония или нитроарильные производные).
Такие соединения-предшественники легко превращаются в радиойодированные агенты визуализации in vivo по изобретению посредством замещения радиойодом.
Радиобромирование может быть достигнуто способами, аналогичными описанным выше для радиойодирования. Kabalka и Varma сделали обзор различных способов синтеза радиогалогенированных соединений, включая радиобромированные соединения (Tetrahedron 1989; 45(21): 6601-21).
Соединение-предшественник по изобретению в идеале предлагается в стерильной, апирогенной форме. Соединение-предшественник, таким образом, можно использовать для получения фармацевтической композиции, содержащей агент визуализации in vivo вместе с биосовместимым носителем, подходящим для введения млекопитающему. Соединение-предшественник также является подходящим для включения в качестве компонента в набор для получения такой фармацевтической композиции.
В предпочтительном воплощении соединение-предшественник предлагается в растворе и в виде части набора или кассеты, сконструированной для применения в приборе для автоматизированного синтеза. Эти аспекты обсуждаются более подробно ниже по отношению к дополнительным аспектам изобретения.
В другом предпочтительном воплощении соединение-предшественник связано с твердой фазой. Соединение-предшественник предпочтительно поставляют ковалентно соединенным с твердой матрицей-подложкой. Таким способом целевой продукт образуется в растворе, в то время как исходные вещества и примеси остаются связанными с твердой фазой. В качестве примера такой системы в WO 03/002489 описаны соединения-предшественники для твердофазного электрофильного фторирования 18F-фтором, и в WO 03/002157 описаны соединения-предшественники для твердофазного нуклеофильного фторирования 18F-фтором.
Способ получения агента визуализации in vivo
В еще одном аспекте настоящего изобретения предлагается способ получения агента визуализации in vivo по изобретению, где указанный способ включает:
1) получение соединения-предшественника Формулы II, как определено выше;
2) получение подходящего источника указанного радиоизотопа, как определено выше;
3) взаимодействие соединения-предшественника со стадии (1) с радиоизотопом со стадии (2) с получением агента визуализации in vivo по изобретению.
На стадии (1) соединение-предшественник может быть представлено в растворе в наборе или в кассете, подходящих для использования с прибором для автоматизированного синтеза, или, альтернативно, присоединенным к твердой подложке, как описано выше в описании соединения-предшественника. Набор и кассета образуют дополнительные аспекты изобретения и подробно обсуждаются ниже.
Подходящими источниками радиоизотопа являются такие, как описано выше в отношении соединения-предшественника по изобретению.
Стадия "взаимодействия" соединения-предшественника с радиоизотопом охватывает объединение вместе двух реагентов в условиях взаимодействия, подходящих для образования целевого агента визуализации in vivo с насколько возможно высоким радиохимическим выходом (RCY). Конкретные пути синтеза для получения агентов визуализации in vivo по настоящему изобретению представлены в экспериментальном разделе ниже.
Набор для получения агента визуализации in vivo
В еще одном аспекте настоящего изобретения предлагается набор для получения агента визуализации in vivo по изобретению, где указанный набор содержит соединение-предшественник Формулы II, как описано выше, такой, что взаимодействие со стерильным источником радиоизотопа дает целевой агент визуализации in vivo с минимальным количеством манипуляций. Такие соображения особенно важны, когда радиоизотоп имеет относительно короткий период полураспада и для облегчения обработки и, следовательно, пониженной дозы радиации для радиофармацевта. Соединение-предшественник предпочтительно присутствует в наборе в лиофилизированной форме, и реакционная среда для восстановления в таких наборах предпочтительно представляет собой биосовместимый носитель.
"Биосовместимый носитель" представляет собой жидкую среду, в частности жидкость, в которой суспендируют или растворяют агент визуализации in vivo, так что композиция является физиологически переносимой, то есть может быть введена в организм млекопитающего без токсичности или чрезмерного дискомфорта. Биосовместимый носитель является подходящей инъецируемой жидкостью-носителем, такой как стерильная апирогенная вода для инъекций; водный раствор, такой как солевой раствор (который можно успешно уравновешивать так, чтобы конечный продукт для инъекции являлся или изотоническим, или негипотоническим); водный раствор одного или более регулирующих тоничность веществ (например, солей катионов плазмы с биосовместимыми противоионами), сахара (например, глюкоза или сахароза), сахарные спирты (например, сорбитол или маннитол), гликоли (например, глицерин) или другие неионные полиоловые вещества (например, полиэтиленгликоли, пропиленгликоли и тому подобное). Биосовместимый носитель может также содержать биосовместимые органические растворители, такие как этанол. Такие органические растворители являются полезными для солюбилизации более липофильных соединений или композиций. Предпочтительно биосовместимый носитель представляет собой апирогенную воду для инъекций, изотонический солевой раствор или водный раствор этанола. рН биосовместимого носителя для внутривенной инъекции подходящим образом находится в диапазоне от 4,0 до 10,5.
В наборе по изобретению соединение-предшественник предпочтительно присутствует в герметично закрытом контейнере, что позволяет сохранять стерильность и/или радиоактивную безопасность плюс, возможно, инертный газ (например, азот или аргон) в свободном пространстве над продуктом, в то же время обеспечивая возможность добавления и извлечения растворов с помощью шприца. Предпочтительный герметично закрытый контейнер представляет собой запечатанный мембраной флакон, где газонепроницаемую крышку обжимают дополнительным укупорочным средством (обычно из алюминия). Дополнительным преимуществом таких герметично закрытых контейнеров состоит в том, что крышка может выдерживать вакуум, если это желательно, например, для замены г