Способ получения раствора ферроцианида лития
Иллюстрации
Показать всеИзобретение может быть использовано для получения растворов ферроцианида лития, который применяется в синтезе нормальных ферроцианидов переходных металлов (Cu2+, Ni2+, Co2+, Zn2+, Fe3+ и др.) общей формулы Ме2[Fe(CN)6]. Способ получения раствора ферроцианида лития заключается в использовании сильнокислого катионита, который из Н+-формы переводят в Li+-форму, а затем через него пропускают раствор ферроцианида щелочного металла. В качестве сильнокислого катионита используют катионит КУ-2-8 в Н+-форме. Изобретение позволяет получать чистые растворы ферроцианида лития различной концентрации, упростить технологию и уменьшить время получения готового продукта. 5 з.п. ф-лы, 3 ил., 3 пр.
Реферат
Изобретение относится к области химической технологии, а именно к получению новых химических соединений, в частности ферроцианида лития, который применяется в синтезе нормальных ферроцианидов переходных металлов.
При синтезе нормальных ферроцианидов переходных металлов (Cu2+, Ni2+, Со2+, Zn2+, Fe3+ и др.) чаще всего используются ферроцианиды легких металлов (Li+, Na+), аммония, иногда кальция. Наиболее пригоден для этой цели ферроцианид лития, поскольку ион лития имеет наименьший радиус (0,78 Å) и обладает наименьшей тенденцией к внедрению в осадок нормального ферроцианида (Г.Б.Сойфер, З.А.Макарова, Ж.Н.Х. Том IX, вып.12, с.2782, 1964 г.). При использовании ферроцианида калия чаще всего образуются смешанные ферроцианиды из-за склонности нормальных ферроцианидов присоединять молекулы ферроцианида щелочного металла, например:
Cu2[Fe(CN)6]+K4[Fe(CN)6]=2K2Cu[Fe(CN)6].
В случае Ni2+ нормальный ферроцианид образуется лишь при большом избытке соли металла, либо при использовании в качестве осадителя железистосинеродистой кислоты Н4[Fe(CN)6] или ее литиевой соли (И.В.Тананаев, М.И.Левина. Журнал аналитической химии. №1, 224, 1946 г.). Растворы нормальных ферроцианидов Li+, Na+, K+ и Cs+ могут быть получены различными путями. Например, при нагревании чистой берлинской лазури с соответствующими гидроокисями:
Fe4[Fe(CN)6]3+12LiOH=3Li4[Fe(CN)6]+4Fe(ОН)3.
Образующийся гидрооксид железа (III) отфильтровывается.
Другой способ основан на обменном разложении ферроцианида серебра соответствующим хлоридом или бромидом:
Ag4[Fe(CN)6]+4LiCl=Li4[Fe(CN)6]+4 AgCl.
(J.Meyer, Z.Anorg. Chem. 115, 203, 1921 г. Цитировано по И.В.Тананаев, Г.Б.Сейфер, Ю.Я.Харитонов и др. Химия ферроцианидов, изд. «Наука», М., 1971).
Использование бромида лития предпочтительно, т.к. растворимость бромида серебра значительно меньше. Выпавший в осадок галогенид серебра также отфильтровывается.
Наиболее распространенным способом получения ферроцианидов легких щелочных металлов является нейтрализация свободной железистосинеродистой кислоты гидратами окисей или карбонатами этих катионов:
H4[Fe(CN)6]+2Li2CO3=Li4[Fe(CN)6]+2Н2О+2СО2.
(И.В.Тананаев, Г.Б.Сейфер, Ю.Я.Харитонов и др. Химия ферроцианидов, изд. «Наука», M., 1971).
Однако все описанные методы трудоемки, требуют тщательного соблюдения условий проведения процесса, применения других операций, например, переосаждения из спирта или ацетона. В случае ферроцианида лития эта операция невозможна из-за высокой растворимости последнего в органических растворителях.
Задачей данного изобретения является упрощение технологии получения раствора ферроцианида лития.
При использовании заявляемого способа достигается следующий технический результат:
- упрощение способа за счет отнотипности проводимых операций;
- сокращение времени синтеза (не менее чем в 2 раза);
- повышение чистоты продукта (практически 100%).
Для решения указанной задачи и достижения технического результата предложен способ получения раствора ферроцианида лития, заключающийся в использовании сильнокислого катионита, переводе его из Н+ формы в литиевую форму, с последующим пропусканием через него раствора ферроцианида щелочного металла.
В качестве раствора ферроцианида щелочного металла может использоваться раствор желтой кровяной соли.
Способ может характеризоваться также тем, что в качестве катионита используют сильнокислый катионит КУ-2-8 в H+-форме, а перевод катионита в Li+-форму осуществляют пропусканием через него раствора гидрооксида лития с концентрацией 1-1,5 моль/л или пропусканием через него раствора ацетата лития с концентрацией 1-1,5 моль/л.
Концентрацию раствора желтой кровяной соли поддерживают в интервале 0,1-0,25 моль/л и пропускают раствор желтой кровяной соли через колонну катионита в Li+-форме со скоростью 2÷5 мл/мин.
Перевод H+ формы сильнокислого катионита, например, КУ-2-8 осложняется тем, что в лиотропном ряду сродство катионита к ионам Li+ минимальное, т.е. константа обмена K H + / L i + < 1 ; поэтому использование неорганических солей, например LiCl, LiNO3, малоэффективно.
Превращение водородной формы КУ-2-8 в литиевую форму удобнее всего осуществлять, смещая равновесие процесса RH+Li+=RLi+H+ вправо. Это возможно двумя способами:
промывкой колонны, заполненной сильнокислым катионитом КУ-2-8 в Н+ форме раствором гидрооксида лития, или раствором органической соли лития, например, ацетатом лития.
При этом происходят следующие процессы:
Реакция идет до конца из-за малой константы диссоциации воды.
Эта реакция тоже практически проходит до конца из-за малой константы диссоциации уксусной кислоты (Кдисс.=1,75*10-5).
О степени насыщения катионита ионами лития (реакция 1) судят по анализу вытекающего элюата, пока концентрация LiOH в нем не достигнет его исходной концентрации. В случае уксуснокислого лития (реакция 2) сразу же за прохождением свободного объема в элюате появляется уксусная кислота. Процесс насыщения смолы ионами лития заканчивают, когда концентрация уксусной кислоты в вытекающем элюате сравняется с исходной концентрацией уксуснокислого лития.
После перевода ионита в литиевую форму колонна тщательно промывается дистиллированной водой до рН≈7÷8.
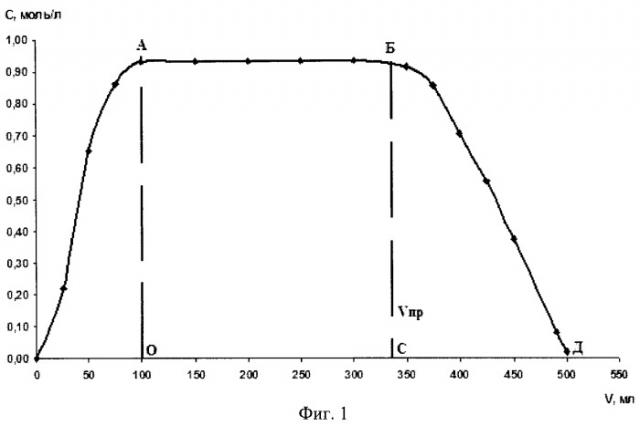
На фиг.1 представлена выходная кривая поглощения иона натрия на катионите КУ-2-8 в Н+-форме. Концентрация хлорида натрия - 1 моль/л, скорость элюирования 10 мл/мин. Объем набухшей смолы ~200 см3. Динамическая обменная емкость до проскока (площадь под кривой ОАВС) равна 280 мг-экв. Полная динамическая емкость (площадь под кривой ОАВД) равна 370 мг-экв. Отношение динамической емкости до проскока к полной динамической емкости равно ~0,76.
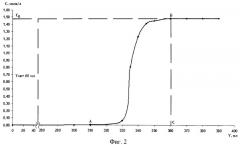
На фиг.2 представлена кривая насыщения катионита КУ-2-8 в Н+-форме ионами лития, полученная в режиме вытеснения. Объем набухшей смолы 200 см3. Полная динамическая обменная емкость катионита 440 мг-экв (точка Б на кривой).
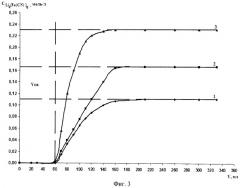
На фиг.3 представлены кривые получения ферроцианида лития.
1 - исходная концентрация К4[Fe(CN)6] - 0,1 моль/л. Скорость элюирования - 3,5 мл/мин. Проскок ионов калия отмечен после прохождения через колонку 675 мл раствора желтой кровяной соли. Количество полученного Li4[Fe(CN)6] - 74 мМоль или 296 мг-экв. Концентрация Li4[Fe(CN)6] в элюате 0,109 моль/л.
2 - исходная концентрация К4[Fe(CN)6] - 0,166 моль/л. Скорость элюирования - 3,5 мл/мин. Объем до проскока ионов калия отмечен после прохождения через колонку 474 мл раствора желтой кровяной соли, что соответствует получению Li4[Fe(CN)6] - 70 мМоль или 280 мг-экв. Концентрация Li4[Fe(CN)6] в элюате 0,154 моль/л.
3 - исходная концентрация К4[Fe(CN)6] - 0,23 моль/л. Скорость элюирования - 3,0 мл/мин. Объем до проскока ионов калия отмечен после прохождения через колонну 330 мл раствора желтой кровяной соли, что соответствует получению Li4[Fe(CN)6] - 74 мМоль или 296 мг-экв. Концентрация Li4[Fe(CN)6] в элюате 0,225 моль/л.
Практическая реализация предлагаемого изобретения осуществлялась следующим образом: стеклянная колонна внутренним диаметром 3,3 см заполнялась 200 см3 набухшего в дистиллированной воде сильнокислого катионита КУ-2-8 в H+-форме. Высота слоя смолы составила 23 см.
Для определения рабочих характеристик колонны (динамической емкости до проскока, полной динамической обменной емкости) через нее пропускался 1 литр 1 моль/л раствора хлорида натрия со скоростью ~10 мл/мин. Для построения кривой насыщения отбирались порции элюата объемом по 25 мл, в которых алкалиметрическим методом определяли содержание соляной кислоты, образующейся по реакции (3).
По экспериментальным данным строилась выходная кривая, приведенная на фиг.1. Динамическая обменная емкость до проскока (площадь под кривой ОАБС) составила - 280 мг-экв, полная динамическая обменная емкость (площадь под кривой ОАБД) - 370 мг-экв, а их отношение - 0,76. После снятия выходной кривой колонна тщательно отмывалась дистиллированной водой до отрицательной реакции на хлор ионы с нитратом серебра. Эта колонна в дальнейшем использовалась в синтезе ферроцианида лития.
Для перевода смолы из Na+-формы в Н+-форму колонна промывалась 1 литром 2 моль/л раствора соляной кислоты и отмывалась водой до рН≈7. Превращение смолы КУ-2-8 из H+-формы в Li+-форму проводили путем промывки смолы 1,5 моль/л раствором гидрооксида лития. Этот процесс изображен на фиг.2. Появление LiOH (точка А) в элюате свидетельствует о том, что реализована динамическая емкость до проскока. Зная объем пропущенного раствора LiOH и его концентрацию, легко определить ее значение. Полная динамическая обменная емкость достигается в точке Б, когда концентрация LiOH в элюате достигает его начальной концентрации, после чего колонна тщательной промывается дистиллированной водой.
Примеры осуществления заявляемого способа.
Пример №1
Готовился исходный раствор желтой кровяной соли концентрацией ~0,1 моль/л, для чего взвешивали ~42 грамма желтой кровяной соли и растворяли в дистиллированной воде, после чего раствор переносили в колбу емкостью 1000 мл и доводили до метки.
Точная концентрация этого раствора устанавливалась цериметрически с ферроином в качестве индикатора. Концентрация желтой кровяной соли найдена равной 0,11 моль/л или 0,44 г-экв/л.
Приготовленный раствор пропускался через колонну со смолой КУ-2-8 в Li+-форме со скоростью 3,5 мл/мин. Для определения проскока через 50 мл элюента проводили качественную пробу на содержание ионов К+ по исчезновению изумрудно-зеленой окраски золя Со2[Fe(CN)6] (И.В. Тананаев, М.И. Левина, Зав. лаб., т.15, с.887, 1949). При использовании желтой кровяной соли с исходной концентрацией 0,11 моль/л проскок ионов калия был отмечен после прохождения через колонку 675 мл, что соответствовало получению ~74 ммоль или 296 мг-экв Li4[Fe(CN)6].
Пример №2
Готовился исходный раствор желтой кровяной соли примерной концентрацией 0,15 моль/л, для чего взвешивали ~64 грамма и растворяли в дистиллированной воде, переносили в литровую колбу и доводили до метки. Определяли точную концентрацию желтой кровяной соли цериметрически, как указано в примере №1. Ее значение равно 0,166 моль/л или 0,664 г-экв/л. Приготовленный раствор пропускали через катионит КУ-2-8 в Li+-форме со скоростью 3,5 мл/мин. Объем до проскока ионов калия составил 474 мл. Концентрация Li4[Fe(CN)6] цериметрически найдена равной 0,154 моль/л или 0,616 г-экв/л, что соответствовало 73 мМоль или 292 мг-экв Li4[Fe(CN)6].
Пример №3
Готовился раствор желтой кровяной соли примерной концентрацией 0,25 моль/л, для чего взвешивали ~106 грамм и растворяли в дистиллированной воде. Раствор переносили в колбу объемом 1000 мл и доводили до метки.
Точную концентрацию желтой кровяной соли устанавливали цериметрически. Она оказалась равной 0,23 моль/л или 0,92 г-экв/л.
Приготовленный раствор пропускали через колонну со скоростью 3,0 мл/мин. Проскок ионов калия отмечен при прохождении 330 мл раствора, который содержал 73 мМоль или 288 мг-экв Li4[Fe(CN)6].
Во всех случаях отношение динамической обменной емкости до проскока к полной динамической обменной емкости близко к величине 0,75.
В графической форме результаты экспериментов представлены на фиг.3.
Данный способ позволяет получать чистые растворы ферроцианида лития различной концентрации, упростить технологию вследствие однотипности операций способа и уменьшить время получения готового продукта.
1. Способ получения раствора ферроцианида лития, заключающийся в использовании сильнокислого катионита, который из Н+-формы переводят в Li+-форму, затем через него пропускают раствор ферроцианида щелочного металла.
2. Способ по п.1, отличающийся тем, что в качестве раствора ферроцианида щелочного металла используют раствор желтой кровяной соли с концентрацией 0,1-0,25 моль/л.
3. Способ по п.1, отличающийся тем, что в качестве сильнокислого катионита в Н+-форме используют катионит КУ-2-8.
4. Способ по п.1, отличающийся тем, что перевод катионита в Li+-форму осуществляют пропусканием через него раствора гидрооксида лития с концентрацией 1-1,5 моль/л.
5. Способ по п.1, отличающийся тем, что перевод катионита в Li+-форму осуществляют пропусканием через него раствора ацетата лития концентрацией 1-1,5 моль/л.
6. Способ по п.2, отличающийся тем, что раствор желтой кровяной соли пропускают через колонну катионита в Li+-форме со скоростью 2÷5 мл/мин.