Эффективный синтез хелаторов для ядерной томографии и радиотерапии: составы и применение
Иллюстрации
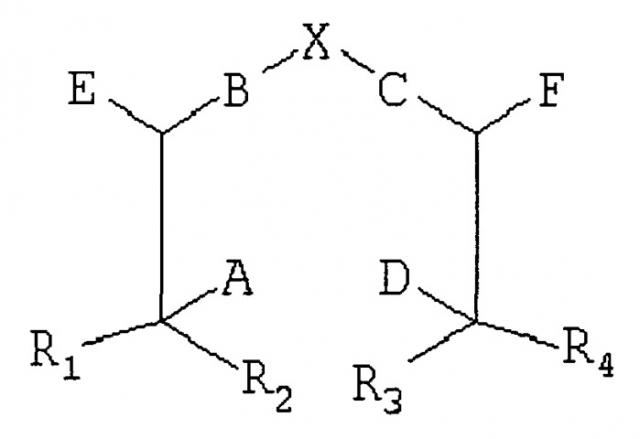
Показать всеИзобретение относится к новому способу синтеза сложных соединений хелатор-нацеливающий лиганд, которые могут быть использованы для лечения и диагностирования заболеваний, например, путем получения изображений новообразования или мио-кардиальной ишемии. Способ включает стадию:(а) конъюгирования в органической среде хелатора следующей формулы:
с по крайней мере одним незащищенным нацеливающим лигандом, представляющим собой глюкозамин, где А и D каждый представляет собой защищенный тиол, В и С каждый представляет собой защищенный вторичный амин; Е и F каждый представляет собой группу -СООН; R1, R2, R3 и R4 каждый представляет собой Н; Х означает -СН2-СН2-; и где конъюгирование происходит через образование амидной связи между Е или F хелатора и аминогруппой глюкозамина. В качестве органической среды используют обычно полярный или неполярный растворитель или их смесь. Способ может дополнительно включать (b) очистку конъюгата хелатор-нацеливающий лиганд; стадию:(c) хелатирования иона металла с конъюгатом хелатор-нацеливающий лиганд с образованием конъюгата меченый ион металла-хелатор-нацеливающий лиганд. При этом стадия с)включает стадии:(d) удаления по крайней мере одной защитной группы из конъюгата меченый ион металла-хелатор-нацеливающий лиганд или дополнительно (e) добавления восстанавливающего агента. Предпочтительными конъюгатами являются 99mTc-этилендицистеин (ЕС)-глюкозамин, 188Re-ЕС-глюкозамин или 187Re-ЕС-глюкозамин. Способы позволяет получить продукты высокой чистоты. 3 н. и 7 з.п.ф-лы, 13 ил.,4 табл., 18 пр.
Реферат
Это заявка базируется и имеет приоритеты американских заявок: предварительных патентных заявок серийный номер 60/828, 347, поданных 5 октября 2006, и серийный номер 11/770, 395, поданной 28 июня 2007, каждая из которых содержится здесь полностью.
Существующее изобретение имеет отношение в основном к областям химического синтеза, получению изображений, радиотерапии, введению меченых атомов, химиотерапии, медицинской терапии, лечению сердечно-сосудистых заболеваний и рака. Более подробно, изобретение касается новых способов синтезирования соединений хелатор-направленный лиганд. Органические методы синтеза, сформулированые здесь, позволяют производить соединения хелатор-направленный лиганд более высокой чистоты по сравнению с соединениями хелатор-направленный лиганд, приготовленными водными методами. Способы получения изображений участка, используя эти соединения, а также комплектов для приготовления этих соединений, также сформулированы здесь. Способы диагностики и лечения заболеваний (то есть раковых образований, сердечно-сосудистых заболеваний, инфекций и воспаления), используя составы, которые включают вышеупомянутые соединения, также здесь раскрыты.
Биомедицинское получение изображений включает различные способы, которые широко используются врачами и исследователями, чтобы помочь не только диагностировать заболевания, но также и получить большее понимание нормальной структуры и функции тела. Образцовые способы получения изображений включают PET (позитронно-эмиссионная томография), SPECT (однофотонная эмиссионная компьютерная томография), гамма камеры получения изображений, СТ (компьютерная томография), MRI (магнитно-резонансная томография), ультразвук, двойное изображение и оптическое изображение.
Во многих случаях, получение оптимального изображения специфического участка в пределах субъекта требует назначения специфического агента субъекту. Неорганические металлы, такие как технеций (99mТc), железо, гадолиний, рений, марганец, кобальт, индий, платина, медь, галлий или родий, оказываются подходящими компонентами многих агентов получения изображений.
Мечение молекул неорганическими металлами может быть достигнуто хелированием металла в комбинации кислорода, серы и атомов азота специфических соединений.
Хелаторы, такие как коллоид серы, диэтилентриаминпентауксусная кислота (DTPA, O4), этилендиаминтетрауксусная кислота (EDTA, O4) и 1,4,7,10-тетраазациклододекан-N,N',N'',N'''-тетрауксусная кислота (DOTA, N4), использовались с этой целью. Однако неорганические металлы, которые являются хелированными таким образом, имеют ограниченную полноценность для получения изображений из-за их быстрого выведения из тела.
Предпочтительным радиоактивным ярлыком для агентов получения изображений является технеций (99mТе) благодаря подходящему периоду его полураспада (6 часов), простоте производства, широкой пригодности, низкой энергии (140 кэВ) и низкой стоимости. Более длинный период полураспада изотопов, таких как 99mТе, облегчает доставку меченых радиоактивным изотопом аминокислот в больницы без локального циклотрона или специальной радиохимической лаборатории. Однако присоединение 99mТе к лекарственным препаратам с целью получения изображений является зачастую проблемой.
188Re имеет хорошие характеристики для получения изображений и для потенциального терапевтического использования из-за его высокой бета энергии (2.1 МэВ), короткого физического период полураспада (16.9 часов) и 155 кэВ эмиссии гамма лучей для дозиметрических целей и получения изображений. Короткий физический период полураспада 188Re позволяет использовать более высокие дозы по сравнению с долговечными радионуклидами. Кроме того, короткий период полураспада уменьшает проблемы с использованием и хранением радиоактивных отходов. В частности, 188Re является доступным от системы внутреннего генератора, подобной 99mТе генератору. 188Re может быть получен от 188W/188Re генератора, который делает это очень удобным для клинического использования. И 99mТе и 188Re испускают гамма-лучи, таким образом, дозиметрия, основанная на получении изображения 99mТе, как ожидают, будет более точной, чем дозиметрия, полученная с использованием потока стандартного радиоизотопа, Y-90.
При получении изображений, используя позитронно-эмиссионную томографию (PET), радиосинтез PET должен быть быстрым, потому что радиоизотоп распадется в течение длинного химического синтеза, и более высок риск облучения, которое может произойти в течение радиосинтеза. Трассирующие снаряды на основе циклотрона ограничены пригодностью локального циклотрона и его высокой стоимостью. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) разрешает производство радиоактивного медицинского препарата в центральной коммерческой установке в хорошо контролируемых условиях и распределяет их местным клиникам, где они назначаются. Точно так же системы генератора радионуклида, которые могут производиться в хорошо контролируемых условиях, контролируются соответствующими текущими процедурами FDA и имеют большую историю успешного клинического применения. Генератор использует пару родительско-дочернего нуклида, где относительно долговечный материнский изотоп распадается в недолговечный дочерний изотоп, который используется для получения изображений. Материнский изотоп, который произведен посредством циклотрона, может быть отправлен на клинический участок, и из которого дочерний изотоп может быть элюирован на участке для клинического использования.
68Ga имеет высокое количество излучаемых позитронов (89% от полного распада), поэтому главное, что рассматривают в связи этим радионуклидом, это его пространственная разрешающая способность, которая зависит от диапазона позитрона (энергии), неколинеарности уничтоженных фотонов, существенных свойств, размера и геометрии детектора и выбора алгоритма реконструкции. К аспектам конструкции детектора, физическим свойствам и их влиянию на систему пространственного разрешения обращалось много авторов, приводя к непрерывной оптимизации аппаратных средств. Хотя максимальная энергия позитрона 68Ga (макс = 1.90 МэВ, средняя = 0.89 МэВ) является выше, чем максимальная энергия позитрона 18F (Макс = 0.63 МэВ, средняя = 0.25 МэВ), исследование, использующее анализы Монте-Карло по пространственному разрешению, показало, что согласно предположению о пространственном разрешении 3 мм PET детекторов обычная полная ширина в половине максимума (FWHM) 18F и 68Ga неразличима в мягкой ткани (3.01 мм против 3.09 мм). Это означает, что с помощью 5-7 мм пространственной разрешающей способности клинических сканеров распада качество получения изображений, используя меченый атом на основе 68Ga, может быть столь же хорошим как агенты на основе 18F, и это стимулировало исследовать потенциал агентов получения изображений на основе 68Ga. Далее, агенты на основе 68Ga обладают существенным коммерческим потенциалом, потому что изотоп может быть произведен из генератора Германия (275-дневный период полураспада) на участке, и быть подходящей альтернативой базирующимся на основе циклотрона изотопам, таким как 18F или 13N.
Если рассматривать искусственное приготовление агентов получения изображений, то когда такие агенты готовятся в водных (влажных) условиях, очистка агентов может иногда представлять проблему. Очистка в водных условиях может быть достигнута, используя, например, хроматографию исключения размера, или диализ с мембранами специфических сокращений молекулярной массы; например, диализ является обычно самым эффективным, отделяя разновидности молекулярных масс для 1000 г/моль или выше. Однако этот метод очистки часто изолирует не только желательного агента, но также и любые другие разновидности, которые могут пройти через мембрану. Введение примесей в изображение агентов может быть проблематичным в будущих применениях агентов получения изображений, особенно это касается получения изображений и/или терапевтического использования. Например, если агент получения изображений, включающий радионуклид ("истинный" агент получения изображений), как думают, является чистым, но фактически содержит примеси, которые также включают радионуклид, надлежащее измерение или обнаружение "истинного" агента получения изображений могут быть затенены или быть ложными из-за присутствия примесей.
Способы синтезирования органических соединений в органической среде, когда применяют органические растворители и используют защитные группы, обычно предлагают усовершенствования очистки составов по сравнению с водной очисткой. Установка групп защиты позволяет различным функциональным группам посредников в течение синтеза быть защищенными и облегчает очистку этих посредников (промежуточных звеньев). Различные средства очистки, использующие органические растворители, позволяют разделять и изолировать желательные соединения, такие как агенты получения изображений, с очень небольшим количеством примесей. Далее разновидности молекулярных масс менее чем 1000 г/моль часто могут быть легко очищены, используя способы очистки органической химии. Ввиду выгод, предлагаемых органическим синтезом, и очисткой, используя водную очистку, способы органического синтезирования и очистки агентов получения изображений, вероятно, привели бы к получению агентов более высокой чистоты, чем агенты, полученные путем водной очистки.
До настоящего времени определенные агенты получения изображений приготавливались только путем водных средств. Примеси, представленные в этих агентах, могут ограничить их использование в качестве агентов получения изображения и/или терапевтических агентов. Таким образом, существует потребность приготовления этих и других агентов, используя синтетические органические методики, чтобы получить агенты более высокой чистоты.
В настоящем изобретении были идентифицированы новые способы синтезирования агентов, которые являются в определенных воплощениях сложными соединениями хелатора и направленного лиганда (также называемыми направленной частицей). Такие агенты могут использоваться, например, для получения изображений, в диагностических и/или терапевтических целях. И органический (растворитель) и влажный (водный) способы очистки здесь описаны, и показано, что органические синтетические способы очистки приводят к соединениям более высокой чистоты, чем соединения, приготовленные/очищенные влажной химией. Соединения высокой чистоты лучше подходят для клинического применения. Кроме того, определенные соединения и способы настоящего изобретения предлагают широкую гибкость и селективность, выражаясь в терминах этого изобретения: (1) подходящие участки присоединения хелатора к направленному лиганду и (2) атомы, подходящие для хелатообразования с ионом металла.
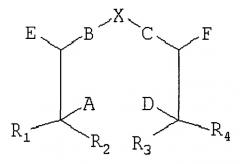
Соответственно, один общий аспект существующего изобретения рассматривает способ синтезирования сложного соединения хелатор-направленный лиганд, включающего:
по крайней мере один направленный лиганд, включающий по крайней мере одну функциональную группу, где:
A, D, Е и F каждый независимо являются Н, нижним алкилом, -СООН, защищенной карбоксильной кислотой, -NH2, защищенным амином, тиолом или защищенным тиолом, где по крайней мере в одной позиции есть -NH2 или тиол;
В и С каждый независимо являются вторичным амином, третичным амином, -S-, -S(O)- или - S(O)2-;
R1, R2, R3 и R4 каждый независимо являются Н или нижним алкилом;
Х выбран из группы, состоящей из -СН2-СН2-, -CH2-CH2-CH2-, -CH2-C(O)-, -С(O)-СН2-, -С(O)-СН2-СН2- и -СН2-СН2-С(O)-; и
Существует соединение между А, D, Е или F хелатора и по крайней мере одной незащищенной функциональной группой каждого направленного лиганда;
где по крайней мере один из А, D, Е, F или направленный лиганд включают защищенную функциональную группу, при условии, что по крайней мере одна функциональная группа направленного лиганда является незащищенной, и
при условии, что когда А и D являются каждый -NH2, то ни В, ни С не являются вторичным или третичным амином. Сложные соединения существующего изобретения могут включать один направленный лиганд или более, чем один направленный лиганд. В некоторых воплощениях сложное соединение включает два направленных лиганда. Направленные лиганды могут быть идентичными или могут быть разного типа. Типы направленных лигандов описаны подробно ниже.
Способы, описанные здесь, отличаются от способов, описанных в американской заявке №11/737, 694, поданной 19 апреля 2007, и отличаются от способов, описанных в международной заявке № PCT/US2006/016784, поданной 4 мая 2006.
Хелатор, изображенный выше, может также быть изображен как
Вообще, способы настоящего изобретения осуществляются в органической среде. Используемый здесь термин «органическая среда» относится к растворам и способам очистки, включающим один или более органических растворителей. Выбор растворителя для способов настоящего изобретения будет понятен специалисту в этой области. Выбор растворителей может зависеть от того, например, в каком растворителе(лях) будет легче происходить растворение всех реактивов, или, например, в каком растворителе(лях) будет легче всего происходить желательная реакция (особенно, если механизм реакции будет известен). Растворители могут включать, например, полярные растворители и/или неполярные растворители. Растворитель может быть полярным апротонным растворителем, таким как диметилсульфоксид. Выбор растворителей включает, но не ограничивается, диметилформамид, диметилсульфоксид, диоксан, метанол, этиловый спирт, гексан, хлорид метилена, тетрагидрофуран и/или ацетонитрил. В некоторых воплощениях, растворители включают этиловый спирт, диметилформамид и/или диоксан. Более одного растворителя может быть выбрано для любой специфической реакции или процедуры очистки. Также в любой растворитель можно добавить воду; это может быть сделано, например, для усиления растворимости одного или более реагентов.
В некоторых воплощениях только соединение между хелатором и направленным лигандом происходит через органический синтез (то есть в органической среде). В некоторых воплощениях только синтез хелатора имеет место через органический синтез. В некоторых воплощениях только хелатообразование иона валентного металла имеет место через органический синтез. В определенных воплощениях, любой или более одного из этих шагов имеют место через органический синтез.
Любой хелатор (то есть соединение, которое является способным к хелированию или связыванию одного или более ионов металла), известный специалистам, может быть применен, используя методологию настоящего изобретения, и образцы хелаторов детально описаны ниже. Хелаторы обычно связывают один или более ионов металла через ионную связь. В некоторых воплощениях, хелатор включает DTPA (диэтилентриамин-пентауксусную кислоту), одну или более одной аминокислот или любую комбинацию одной или более этих групп. В определенных воплощениях одну или более аминокислот выбирают из группы, состоящей из глицина и цистеина. В некоторых воплощениях хелатор выбран из группы, состоящей из дицистеина, триглицин цистеина и трицистеин глицина. Количество и выбор аминокислот могут быть ограничены их растворимостью в органической среде. В определенных воплощениях этилендицистеин (ЕС) является хелатором.
Направленные лиганды далее описаны детально. Хотя хелатор может соединен (то есть химически присоединен или связан) с направленным лигандом любым способом, известным специалистам (например, ковалентная связь, ионная связь, дативная связь, ионная пара), обычно соединение включает ковалентную связь.
Способы настоящего изобретения могут далее включать по крайней мере один шаг очистки. Любой состав настоящего изобретения может быть очищен любым способом, известным специалистам. Специалисты в данной области знакомы с такими способами, и им известно, когда эти способы могут использоваться. Например, в многошаговом синтезе, который нацелен на достижение специфического соединения, шаг очистки может быть выполнен после каждого синтетического шага, после каждых нескольких шагов, в различное время в течение синтеза и/или в самом конце синтеза. В некоторых способах один или более шагов очистки включают приемы, отобранные из группы, состоящей из колончатой хроматографии на силикагеле, HPLC (высокоэффективная жидкостная хроматография) и LC (жидкостная хроматография). В определенных воплощениях способы очистки определенно исключают вытеснительную по размеру хроматографию и/или диализ. Способы очистки описаны более подробно ниже.
В определенных воплощениях несоединенные хелаторы и/или сложное соединение хелатор-направленный лиганд получают синтетическими органическими способами с очень высокой чистотой по сравнению с составами, полученными водной методологией. Например, в некоторых воплощениях настоящего изобретения несоединенный хелатор, незащищенный хелатор, защищенный хелатор, сложное соединение хелатор-направленный лиганд или сложное соединение меченый ионом металла хелатор-направленный лиганд, полученные органическими средствами (или любой состав, включающий комбинацию хелатора, защитной группы, направленного лиганда и иона металла), являются чистыми от приблизительно 90% до приблизительно 99,9% по сравнению с составами, полученными водным способом, которые являются чистыми от приблизительно 50% до приблизительно 70%. В определенных воплощениях несоединенный хелатор, незащищенный хелатор, защищенный хелатор, сложное соединение хелатор-направленный лиганд или сложное соединение меченый ионом металла хелатор-направленный лиганд, полученные органическими средствами (или любой состав, включающий комбинацию хелатора, защитной группы, направленного лиганда и иона металла), являются чистыми приблизительно на или по крайней мере приблизительно на 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5%, 99,9% или выше или в любом другом получаемом диапазоне. В определенных воплощениях диапазон чистоты находится в пределах от приблизительно 70% до приблизительно 99,9%. В определенных воплощениях диапазон чистоты находится в пределах от приблизительно 75% до приблизительно 99,9%. В определенных воплощениях диапазон чистоты находится в пределах от приблизительно 80% до приблизительно 99,9%. В определенных воплощениях диапазон чистоты находится в пределах от приблизительно 85% до приблизительно 99,9%. В определенных воплощениях диапазон чистоты находится в пределах от приблизительно 90% до приблизительно 99,9%. В определенных воплощениях диапазон чистоты находится в пределах от приблизительно 95% до приблизительно 99,9%.
В определенных воплощениях настоящего изобретения по крайней мере один из A, D, Е или F является защищенным по крайней мере на одном шаге, используя по крайней мере один защитный агент, и по крайней мере одна функциональная группа направленного лиганда защищена по крайней мере на одном шаге, используя по крайней мере один защитный агент. Функциональные группы, описанные здесь, могут быть любого типа, известного специалистам. Термин «функциональная группа» главным образом относится к таким группам, которые специалисты в технологии классифицируют как химически реактивные группы. Неограничивающие примеры их включают алкен, алкин, арил (например, фенил, пиридинил), спирт, альдегид, кетон, азид, галоген, эстер, -СООН, -NH2, тиол, вторичный амин, третичный амин, -S-, -S(O)- и -S(O)2-. В некоторых воплощениях по крайней мере одна функциональная группа включает атом, выбранный из группы, состоящей из С, Н, О, N, Р и S. Позиции А, В, С, D, Е и/или F могут включать одну или более функциональные группы (например, -СООН, -NH2, тиол, вторичный амин, третичный амин, -S-, -S(O)-, или -S(O)2-). В определенных воплощениях по крайней мере одна функциональная группа направленного лиганда включает атом, выбранный из группы, состоящей из О, N, S и Р. Функциональная группа направленного лиганда может быть, например, выбрана из группы, состоящей из амино, амидо, тиола, гидроксила, эфира, сложного эфира, карбонила, карбоксильной кислоты, сульфонамидо, тио-эфира, тиосложного эфира и тиокарбонила.
И направленный лиганд, и хелатор будут обычно иметь одну или более функциональные группы. Здесь описаны функциональные группы и защитные агенты, которые могут использоваться, чтобы получить защищенную функциональную группу. Специалистам будет понятно, что любая функциональная группа может быть защищена, используя защитный агент по мере необходимости, как описано здесь. Мы видим, что функциональная группа может быть защищена (например, защищенный амин, такой как -NH-CH2) или не защищена, которая также называется «свободной» (такая как -NH2). Как известно специалистам, защитные группы используются в органическом синтезе и в неводных синтезах.
Далее в определенных воплощениях одна или более защитных групп могут быть удалены. Удаление защитной группы может быть сделано в любое время в течение способа или синтеза, описанного здесь, но обычно выполняется, когда защитная группа больше не необходима, а функциональная группа, которая защищается, желательно, чтобы стала «показанной». В любом способе, описанном здесь, любой состав, включающий хелатор, описанный здесь (например, сложное соединение хелатор-направленный лиганд, сложное соединение меченый ионом металла хелатор-направленный лиганд), может не содержать никаких защитных групп или может включать одну или более защитных групп. Например, участок может быть изображен, используя сложное соединение меченый ионом металла хелатор-направленный лиганд, которое не содержит никаких защитных групп или содержит одну или более защитные группы.
В определенных воплощениях направленный лиганд включает уходящую группу. Термин «уходящая группа» обычно относится к группам, с готовностью переносимым нуклеофилом, таким как амин, спирт или нуклеофил тиола. Такие уходящие группы известны и включают, например, карбоксилаты, N-гидроксисукцинимид, N-гидроксибензотриазол, галогениды, трифлаты, тозилаты, мезилаты, алкокси, тиоалкокси, сульфонилы и т.п.
В дальнейших воплощениях три или более функциональные группы хелатора вместе формируют хелат. Как правило, три или четыре атома вместе формируют хелат. В определенных воплощениях хелат выбирают из группы, состоящей из NS2, N2S, S4, N2S2, N3S и NS3. Например, три тиоэфира и один вторичный амин могут формировать хелат NS3. В некоторых воплощениях, таких как с этилендицистеином, хелатом является хелат N2S2. Хелаты могут быть хелатами любого типа, известного специалистам, и далее описаны здесь. Другие атомы, помимо N и S, могут включать хелат, такой как кислород.
Используемый здесь термин «хелат» может использоваться как существительное или глагол. Как существительное, «хелат» относится к одному или более атомам, которые способны к хелированию одного или более ионов металла или являются хелированными в один или более ионов металла. Ионы металла описаны более подробно здесь. В некоторых воплощениях только один ион металла координируется в хелат. Неограничивающий пример «хелата» включает «N2S2» хелат: это означает, что два атома азота и два атома серы хелатора являются или а) способными к хелированию одного или более ионов металла или b) быть координированными с (или хелированными с) одним или более ионами металла. Соответственно, в некоторых воплощениях хелат - это N2S2. Состав, включающий хелат, является хелатором. Как правило, только один ион металла хелирован в хелатор.
В определенных воплощениях по крайней мере одна позиция из A, D, Е и F 10 является тиолом. Тиол может быть защищен по крайней мере на одном шаге, используя по крайней мере один защитный агент тиола. Защитный агент тиола может быть любым из известных специалистам. Например, защитный агент тиола может быть выбран из 10 оплопы, состоящей из алкил-галогенида, бензил-галогенида, бензоил-галогенида, сульфонил-галогенида, трифенилметил-галогенида, метокситрифенилметил-галогенида и цис-теина.
В определенных воплощениях по крайней мере одна позиция из А, D, Е и F включает первичный амин, или по крайней мере одна позиция из В и С включает 10 опричный амин. В определенных воплощениях по крайней мере один амин может быть защищен на одном или более шагах, используя по крайней мере один защитный агент амина. Защитный агент амина может быть любым из известных специалистам. Например, защитный агент амина может быть выбран из группы, состоящей из бензилхлор-формиата, p-нитро-хлорбензилформиата, этилхлорформиата, ди-тер-бутил-дикарбоната, трифенилметил хлорида и метокситрифенилметил хлорида.
В определенных воплощениях хелатор - это этилендицистеин. При использовании этилендицистеина в качестве хелатора в синтезе соединения этилендицистеин-направленный лиганд, две тиольные группы этилендицистеина защищены, используя по крайней мере один защитный агент тиола (например, используя два или более эквивалента защитного агента тиола), а на другом шаге две аминные группы этилендицистеина защищены, используя по крайней мере один защитный агент амина (например, используя два или более эквивалента защитного агента амина). С этих пор тиольные группы являются более реактивными, чем аминные группы, обычно тиольные группы защищают после того, как будут защищены аминные группы, если обе группы первоначально были не защищены («свободны»).
Как было упомянуто, соединение между хелатором и направленным лигандом может происходить любым способом и с помощью любой химической связи, известной специалистам в этой области. Таким образом, направленный лиганд может быть соединен или связан с одним или более хелаторами любым способом, известным специалистам в этой области. В определенных воплощениях соединение между хелатором и направленным лигандом имеет место только на одном шаге (то есть реакция «с одним резервуаром»), Как известно специалистам, реакции в один шаг желательны, поскольку они экономят время, помогают минимизировать ненужные реактивы и минимизируют потерю получаемого вещества. Любая позиция из А, В, С, D, Е и/или F может участвовать в соединении с направленным лигандом. Кроме того, любая позиция из А, В, С, D, Е и/или F может участвовать в хелировании. Далее, любая позиция из А, В, С, D, Е и/или F может участвовать и в хелировании и в соединении. Такая гибкость позволяет хелаторам настоящего изобретения использоваться в разнообразных целях, в зависимости от, например, реактивности выбранного направленного лиганда, селективности желательного соединения, растворимости реактивов, иона металла, требуемого для хелирования и т.д. Как правило, но не всегда, соединение происходит до хелирования.
Обычно один тип направленного лиганда соединен с одним хелатором, но многочисленные направленные лиганды могут соединяться с единственным хелатором. Обычно, в течение органического синтеза сложных соединений хелатор- направленный лиганд, между хелатором и направленным лигандом один действует как нуклеофил, а другой действует как электрофил так, что соединение происходит посредством ковалентной связи. Ковалентная связь может быть любого типа, известного специалистам. В некоторых воплощениях, ковалентная связь выбрана из группы, состоящей из амидной связи, эфирной связи, сложноэфирной связи, тиоэфирной связи, тиосложноэфирной связи, сульфонамидной связи и углерод-углеродистой связи. Углерод-углеродистая связь обычно является единственной связью, но может также быть двойной или тройной связью. Действуя как электрофилы, хелаторы и направленные лиганды могут включать функциональные группы, такие как галогены и сульфонилы, которые действуют как уходящие группы в течение соединения. В некоторых воплощениях соединение имеет место в одной или более функциональных группах хелатора, выбранных из группы, состоящей из карбоксильной кислоты, амина и тиола. Направленные лиганды могут также включать нуклеофильные группы, такие как -NH2, которые могут участвовать в соединении с электрофильным хелатором. Способы соединения обсуждены подробно ниже.
В определенных воплощениях сложное соединение хелатор-направленный лиганд далее включает линкер между хелатором и направленным лигандом. Такой линкер может, например, обеспечить более легкое соединение между хелатором и направленным лигандом, обеспечивая реактивную группу, которая облегчает реакцию соединения. Линкер может быть любого типа, известного специалистам. Первоначально линкер может быть присоединен к хелатору или к направленному лиганду. Линкер может быть присоединен к хелатору, в то время как другой линкер присоединен к направленному лиганду так, что эти два линкера могут быть затем соединены. Специалисты в этой области знакомы с такими типами линкеров, подходящих для способов настоящего изобретения. В некоторых воплощениях линкер выбирают из группы, состоящей из пептида, глутаминовой кислоты, аспарагиновой кислоты, бромзамещенного этилацетата, диамина этилена, лизина и любой комбинации одной или более этих групп.
В определенных воплощениях и Е и F являются независимо выбранными из группы, состоящей из -СООН, -NH2 или тиола. В некоторых воплощениях и Е и F, каждое, являются -СООН. В определенных воплощениях соединение по крайней мере одного направленного лиганда присутствует в Е и/или F. В определенных воплощениях каждое из А и D являются защищенными по крайней мере одной защитной группой до соединения.
Специалисты оценят по достоинству то, что при соединении хелатора с направленным лигандом по крайней мере одна функциональная группа хелатора и по крайней мере одна функциональная группа направленного лиганда должны быть «свободными» (то есть незащищенными защитной группой), так что два соединения могут быть объединены.
Хелатор далее может включать спейсер, позиция X. В определенных аспектах использование спейсера позволяет для надлежащего количества и должной ориентации хелированных атомов хелировать ион металла. Специалисты в этой области знакомы с такими спейсерами, которые могут использоваться для способов настоящего изобретения, и примеры спейсеров раскрыты ниже. Например, может использоваться спейсер алкил, такой как (-CH2-)n, где n находится в пределах от 1 до 100. Один тип хелатора, подходящий для способов настоящего изобретения, включает спейсер этилен, то есть этилендицистеин (ЕС). В определенных воплощениях, позиция Х является -СН2-С(O)-, -С(O)-СН2-, -СН2-СН2-С(O)- или -С(O)-СН2-СН2-, а позиция В и/или С - это вторичный амин. В этом воплощении обычно одно, или В или С, являются менее нуклеофильным, чем другое. Например, если вместе В, С и L будут изображены как -NH-C(O)-CH2-CH2-NH-, то вторичный амин позиции С будет больше нуклеофильным, чем вторичный амин В. Таким образом, С будет более реактивным, приводя к тому, что в выбранном соединении направленный лиганд находится в положении С. В определенных воплощениях, оба положения А и D или Е и F являются каждое защищенным по крайней мере одной защитной группой до соединения в С.
Одна особенность использования амидных связей состоит в том, что когда В, С и L вместе формируют -NH-C(O)-CH2-CH2-NH-, неправильно полагают, что реакции, где ион металла хелируется в хелатор, часто имеют место в кислой среде. Амидные связи являются относительно стойкими к разложению в кислой среде и поэтому обеспечивают структурную стабильность в хелаторе в течение подобных реакций хелирования. Таким образом, Х вместе с В и/или С может включать амидную связь.
Соединения хелатор-направленный лиганд, хелированные с ионом металла, могут функционировать как, например, агенты получения изображения и/или диагностики, как описано здесь. Они могут также функционировать как терапевтические агенты, агенты для диагностики и терапии или агенты получения изображений и терапии. Соответственно, в определенных воплощениях способы настоящего изобретения далее включают хелирование иона металла хелатором, чтобы получить сложное соединение меченый ионом металла-хелатор-направленный лиганд. Ион металла может быть любым из известных специалистам. Ион металла может быть «холодным» (нерадиоактивным) ионом металла или радионуклидом. В неограничивающих примерах ион металла может быть выбран из группы, состоящей из иона технеция, иона меди, иона индия, иона таллия, иона галлия, иона мышьяка, иона рения, иона гольмия, иона иттрия, иона самария, иона селена, иона стронция, иона гадолиния, иона висмута, иона железа, иона марганца, иона лютеция, иона кобальта, иона платины, иона кальция и иона родия. Холодный ион металла может быть, например, выбран из группы, состоящей из Cu-62, As-72, Re-187, Gd-157, Bi-213, Fe-56, Mn-55, иона железа, иона марганца, иона кобальта, иона платины и иона родия.
Ион металла может быть радионуклидом, любым радионуклидом, известным специалистам. Радионуклид в некоторых воплощениях может быть выбран из группы, состоящей из 99mTc, 188Re, 186Re, 153Sm, 166Но, 90Y, 89Sr, 67Gа, 68Gа, 111In, 148Gd, 55Fe, 225Ac, 212Bi, 211At, 45Ti, 60Cu, 61Cu, 67Cu и 64Cu. В некоторых воплощениях, ионом металла 14 оплоется 99mТе.
Если выбран ион металла 99mТе, например, способ может далее включать добавление восстанавливающего агента. Восстанавливающий агент может быть любым агентом, известным специалистам. В некоторых воплощениях восстанавливающий агент включает ион, выбранный из группы, состоящей из иона дитионита, иона, содержащего двухвалентное олово, и железистого иона. В некоторых воплощениях ион металла - это 188Re. В других воплощениях, ион металла - это 68Ga.
Когда ион металла используется в способе настоящего изобретения, ион металла может быть хелирован в любой хелат, известный специалистам, как описано здесь. Специалисты в этой области признают, что ионы металла хелируются в различное число атомов в зависимости от, например, типа металла, его валентности и атомов, способных к хелатообразованию. Например, три или четыре атома хелатора могут хелировать один ион металла. В определенных воплощениях хелированным ионом металла может быть 99mТе. В определенных воплощениях хелированным ионом металла может быть 186Re. В определенных воплощениях хелированным ионом металла может быть 187Re.
В некоторых воплощениях хелат может быть выбран из группы, состоящей из NS2, N2S, S4, N2S2, N3S и NS3. В определенных воплощениях любой один или более из этих хелатов может не быть хелатом настоящего изобретения. В некоторых воплощениях N3S не является хелатом. В определенных воплощениях хелатом является N2S2, например, этилендицистеина. Способы настоящего изобретения могут далее включать синтез сложного соединения меченый ион металла-хелатор-направленный лиганд, где направленный лиганд участвует с А, В, С, D, Е, и/или F в хелировании иона металла. Ионы металла, хелирование и направленные лиганды описаны более подробно ниже. В некоторых воплощениях может быть получено изображение иона металла. Получение изображения может происходить любым способом, известным специалистам. Образцовые способы получения изображений обсуждены подробно в спецификации ниже и включают PET и SPECT.
Как говорилось выше, сложные соединения меченый ион металла-хелатор-направленный лиганд, полученные путем органического синтеза, обычно обладают более высокой чистотой, чем полученные водным способом приготовления. Например, в некоторых воплощениях настоящего изобретения сложное соединение меченый ион металла-хелатор-направленный лиганд, полученное органическим путем, имеет чистоту между приблизительно 90% и приблизительно 99,9% по сравнению с соедине