Кизельзоль-материал по меньшей мере с одним терапев-тически активным веществом для получения биологиче-ски разлагаемых и/или впитываемых кизельгель-материалов для медицины человека и/или медтехники
Иллюстрации
Показать всеИзобретение относится к новому кизельзоль-материалу по меньшей мере с одним терапевтически активным веществом для получения биологически разлагаемых и впитываемых кизельгель-материалов. Предложен кизельзоль-материал по меньшей мере с одним терапевтически активным веществом, полученный реакцией гидролиза-конденсации тетраэтоксисилана, катализируемой кислотами при начальном значении рН от 0 до ≤7 в присутствии водорастворимого растворителя в течение по меньшей мере 16 часов при температуре 0-80°С; последующим упариванием с получением однофазного раствора; охлаждением полученного раствора с последующим созреванием при температуре 2-4°С с образованием гомогенного однофазного золя. Добавление локального анестетика проводят на одной из описанных стадий. Предложены также варианты применения указанного кизельзоль-материала и получаемые из него биологически впитываемый или биоактивный порошок, монолит или покрытие и биологически разлагаемый или биологически впитываемый волокнистый материал. Технический результат - возможность получения кизельзоль-материалов с улучшенной биологической переносимостью и способностью к заживлению ран. 5 н. и 16 з.п. ф-лы, 4 ил., 2 табл., 5 пр.
Реферат
Изобретение относится к новому кизельзоль-материалу по меньшей мере с одним терапевтически активным веществом для получения биологически разлагаемых и/или впитываемых кизельгель-материалов для медицины человека и/или медтехники, а также к способу его получения и его применению. Изобретение, кроме того, относится к биологически разлагаемым и/или впитываемым кизельгель-волокнистым материалам по меньшей мере с одним терапевтически активным веществом.
Многочисленные стремления направлены на разработку биологически разлагаемых и/или биологически впитываемых материалов для различных применений в медицине человека и медтехнике. В этих областях устанавливаются постоянно повышающиеся требования, особенно к биологической совместимости, биологической эффективности и токсикологическим свойствам материалов.
Впитываемые кизельгели (силикагели) известны из уровня техники. В немецком патенте DE 19609551 C1 описаны биологически разлагаемые, биологически впитываемые волокнистые структуры. Эти волокна могут быть получены в золь-гель процессе таким образом, что из прядильной массы вытягивают нити и их, при необходимости, высушивают. Прядильная масса содержит одно или несколько частично или полностью гидролитически конденсированных соединений кремния, которые получают за счет гидролитической конденсации из мономеров общей формулы SiX4. Эти волокна имеют недостаток, состоящий в том, что они при разложении непосредственно после процесса прядения не показывают еще оптимальных результатов в тесте на цитотоксичность и частично должны быть оценены как цитотоксичные. Такая токсичность непосредственно при использовании в медицине человека или медтехнике, например, в области лечения ран, как правило, не желательна. Способ получения волокон согласно немецкому патенту 19609551 C1 имеет, кроме того, недостаток, состоящий в том, что полученная в итоге смесь после удаления растворителя на стадии гидролиза-конденсации уже являются многофазной смесью и для удаления образовавшегося твердого вещества должна быть обязательно подвергнута фильтрации. Кроме того, за счет образования твердой фазы и за счет неизбежной стадии фильтрации теряется большая часть способного к прядению золя. Согласно немецкому патенту 19609551 C1 во время созревания также незначительно подавляется образование доли твердой фазы, в частности образование геля, которой можно пренебречь. Это также снижает долю способной к прядению золь-массы.
Независимо от этого можно сказать, что заявляемые волокна и волокнистые массы (нетканое волокно) показывают улучшенные свойства в отношении заживления ран. Кроме того, заявляемые волокна и волокнистые массы особенно подходят для использования в качестве поддерживающих клеточных (ячеистых) структур.
Задачей настоящего изобретения является предоставление нового кизельзоль - материала по меньшей мере с одним терапевтически активным веществом для получения биологически разлагаемых и/или биологически впитывающих кизельгель-материалов. Кроме того, задачей изобретения является предоставление биологически разлагаемого и/или биологически впитываемого кизельгель-материала по меньшей мере с одним терапевтически активным веществом, которые проявляет улучшенные свойства в отношении цитотоксичности и заживления ран. Еще одну задачу можно видеть в том, чтобы предоставить в распоряжение улучшенные подерживающие клеточные структуры, например, для получения in vitro кожных имплантатов, хрящей и костей.
Задача решается с помощью кизельзоль-материала по пункту 1. Согласно этому пункту кизельзоль-материал по меньшей мере с одним терапевтически активным веществом получают таким образом, что
a) проводят реакцию гидролиза-конденсации одного или нескольких Si-соединений формулы (I)
S i X 4 ( I ) 2 ,
в которой остатки X являются одинаковыми или различными и означают гидрокси, водород, галоген, амино, алкокси, ацилокси, алкилкарбонил и/или алкоксикарбонил и происходят от алкильных остатков, которые представляют собой, при необходимости, замещенные, линейные, разветвленные или циклические остатки с 1-20 атомами углерода, предпочтительно с 1-10 атомами углерода, и могут быть прерваны атомами кислорода или серы или аминогруппами,
катализируемую кислотами при начальном значении pH от 0 до ≤7, при необходимости, в присутствии растворимого в воде растворителя, в течение по меньшей мере 16 часов, при температуре от 0°C до 80°C,
b) за счет последующего упаривания образуется однофазный раствор с вязкостью в диапазоне от 0,5 до 2 Па·с при скорости среза 10 с-1 при 4°C,
c) этот раствор затем охлаждают и
d) подвергают кинетически контролируемому созреванию, при этом образуется гомогенный однофазный золь и на одной или нескольких стадиях от a) до d), предпочтительно на одной или нескольких стадиях от a) до c), к нему добавляют по меньшей мере одно терапевтически активное вещество.
На стадии a) используют остаток X от одного или нескольких различных Si-соединений формулы (I):
S i X 4 ( I ) ,
в которой остатки X являются одинаковыми или различными и означают гидрокси, водород, галоген, амино, алкокси, ацилокси, алкилкарбонил и/или алкоксикарбонил и происходят от алкильных остатков, которые представляют собой, при необходимости, замещенные, линейные, разветвленные или циклические остатки с 1-20 атомами углерода, предпочтительно с 1-10 атомами углерода, и могут быть прерваны атомами кислорода или серы или аминогруппами.
В предпочтительной заявляемой форме исполнения X в формуле (I) представляет собой, при необходимости, замещенный, линейный, разветвленный или циклический алкокси-остаток с 1-20 атомами углерода, предпочтительно с 1-10 атомами углерода. Особенно предпочтительно X в формуле (I) представляет собой, при необходимости, замещенный, линейный и/или разветвленный алкокси-остаток с 1-5 атомами углерода. Еще более предпочтительными являются замещенные, но предпочтительно незамещенные линейные и/или разветвленные алкокси-остатки с 2-3 атомами углерода, как, например, этокси, н-пропокси и/или изопропокси.
Согласно изобретению в высшей степени предпочтительно в качестве Si-соединения в заявляемой реакции гидролиза-конденсации используют тетраэтоксисилан (TEOS). В качестве растворимого в воде растворителя может быть использован предпочтительно этанол или смесь вода/этанол. Si-соединение может быть использовано в отношении к этанолу>1.
Начальное pH от 0 до ≤7, предпочтительно от 2 до 5, в предпочтительной форме изобретения устанавливается азотнокислой водой. Другие кислые смеси и/или растворы, которые могут служить источником NO или NO2, также пригодны для исполнения изобретения. Это могут быть, например, кислые смеси или растворы, которые в физиологическом окружении с молекулярным кислородом ферментативно (с помощью нитроксид-синтазы, NOS) вырабатывают монооксид азота (NO), который снова организмом быстро превращается в NO2, или это могут быть также органические нитраты или эфиры нитратов (так называемые NO-донаторы), например этилнитрат, которые образуют NO с помощью органической нитратредуктазы. Для указанных ферментативных высвобождений NO необходимы тиольные группы (цистеин).
Наряду с разбавленной азотной кислотой поэтому согласно изобретению в качестве субстрата NOS пригодны также водный или спиртовый (особенно предпочтительно: водный разбавленный этанольный) раствор физиологически совместимой кислоты (например, лимонной, янтарной, винной, уксусной или аскорбиновой кислоты) и по меньшей мере одной незаменимой (например, L-аргинина, особенно предпочтительно: L-валина, L-лейцина, L-изолейцина, L-фенилаланина, L-тироксина, L-метионина, L-лицина или L-триптофана) или заменимой аминокислоты (например, L-глутамина, L-глутаминовой кислоты, L-аспарагина, L-аспарагиновой кислоты, L-цистеина, L-глицина, L-аланина, L-пролина, L-гистидина, L-тирозина), чтобы установить рН на желаемом значении от слабокислой области до области с кислотностью средней силы.
В предпочтительной форме реакцию гидролиза-конденсации проводят с Si-соединением и азотнокислой водой в молярном соотношении от 1:1,7 до 1:1,9, особенно предпочтительно в соотношении от 1:1,7 до 1:1,8.
Азотнокислая вода может быть использована в виде 0,01 N HNO3.
Гидролиз-конденсацию проводят в течение периода времени по меньшей мере 16 часов, предпочтительно по меньшей мере 18 часов, при температуре от 0°C до 80°C, предпочтительно от 0°C до 78°C, особенно предпочтительно при 20-60°C, еще более предпочтительно примерно от 20°C до примерно 50°C и, например, при использовании заявляемых материалов для обработки ран при комнатной температуре (примерно от 20 до примерно 25°C) или примерно при 37°C.
В предпочтительной форме исполнения изобретения гидролиз может быть проведен в течение периода времени по меньшей мере 16 часов, предпочтительно по меньшей мере от 18 часов до 4 недель. Предпочтительно время гидролиза измеряется от 24 часов до 18 дней, особенно предпочтительно от 3 до 8 дней. Неожиданно было установлено, что при увеличенном времени гидролиза-конденсации по отношению к обычным, используемым до сих пор, временам, равным нескольким часам, при комнатной температуре, после удаления растворителя на стадии b) может быть получен гомогенный однофазный раствор, который перед созреванием на стадии d) не нуждается больше в фильтрации.
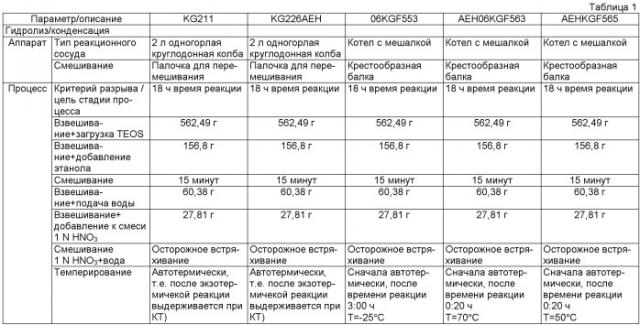
Первую реакцию гидролиза-конденсации проводят предпочтительно ступенчато в котле с мешалкой или в одногорлой круглодонной колбе с мешалкой. Si-соединение формулы (I) (например, TEOS) и растворитель (например, этанол) предпочтительно помещают предварительно в реакционный сосуд. Затем проводят обычную добавку кислоты, предпочтительно в виде 0,01 N HNO3 (например, 0,01 моль HNO3 на моль TEOS). За счет силы кислоты в реакционной смеси первая реакция гидролиза- конденсации протекает быстро, и содержимое сосуда нагревается примерно до 40°C, прежде чем температура еще в течение времени реакции (таким образом в стадии (а)) начнет снижаться (вследствие естественного охлаждения до температуры окружающей среды, или до температуры нагревательного средства).
Удаление водорастворимого растворителя (например, этанол, вода) на стадии (b) в предпочтительной форме исполнения изобретения проводится в закрытом аппарате, в котором возможно смешивание (предпочтительно ротационный испаритель и/или котел с мешалкой), при одновременном удалении растворителя (вода, этанол) за счет испарения при давлении от 1 до 1013 мбар, предпочтительно при давлении <600 бар, необязательно, с непрерывной подачей химически инертного газа-носителя для снижения парциального давления испаряющихся компонентов со скоростью 1-8 м3/ч (предпочтительно от 2,5 до 4,5 м3/ч), реакционной температуре от 30°C до 90°C, предпочтительно при 60-75°C, еще предпочтительнее при 60-70°C, и предпочтительно при осторожном перемешивании реакционной системы до 80 об/мин (предпочтительно от 20 об/мин до 60 об/мин) до вязкости смеси от 0,5 до 30 Па·с при скорости среза 10 с-1 при 4°C, предпочтительно от 0,5 до 2 Па·с при скорости среза 10 с-1 при 4°C, особенно предпочтительно примерно 1 Па·с (измерение при 4°C, скорость среза 10 с-1).
«Поток газа-носителя» обозначается согласно изобретению как газовый поток, который подводится к объему газа через жидкую фазу реакционной системы. Для сохранения изобарного соотношения в реакционном сосуде тем самым следует отводить газообразный объемный поток, который состоит как из «газа-носителя», так и из испаряемых компонента/компонентов. Образующиеся в результате снижения парциального давления доли испаряемого компонента или смеси компонентов в газовом пространстве повышают несущую силу для испарения растворителя на поверхности жидкости.
В особенно предпочтительной форме исполнения «поток газа-носителя» с помощью подходящего газового распределителя, расположенного в газовом пространстве аппарата, разделяется таким образом, что обеспечивается достаточный обмен газа-носителя чуть выше поверхности жидкости, без того, чтобы обдувать поверхность жидкости непосредственно конвективно. Последнее в экстремальном случае может привести к местному гелеобразованию, что является нежелательным. Газовые распределители, с помощью которых может быть осуществлена эта форма исполнения, известны специалисту.
За счет описанной выше реакции/полимеризации (определяемой по повышению вязкости) сдвигается фазовое равновесие, так что соответствующее равновесное давление растворителя в паровой фазе всегда становится ниже. Если равновесное давление падает до суммарного давления в газовой фазе, то испарение прекращается.
Для того, чтобы далее испарять растворитель, для этого оптимальным образом необходимо снизить давление, которое поток газа-носителя создает непостоянным, или необходимо повысить температуру.
В предпочтительной форме исполнения изобретения, по меньшей мере, один из параметров процесса - давление, поток газа-носителя и/или температура временно становятся переменными.
В предпочтительной форме исполнения изобретения испарение на стадии b) происходит при постоянной температуре и временно меняющемся давлении. В предпочтительной форме исполнения изобретения в качестве химически инертного потока газа-носителя для снижения парциального давления используют азот и/или воздух.
В предпочтительной форме исполнения изобретения водорастворимый растворитель удаляется с помощью комбинации из вакуума и потока газа-носителя. Общее давление и поток газа-носителя при этой форме исполнения изобретения могут быть отрегулированы независимо друг от друга постоянными или временно изменяющимися. В этой форме исполнения изобретения идеальным образом по меньшей мере один из параметров процесса - давление, поток газа-носителя и/или температура временно становится переменным. Тем самым возможно, например, достигнуть интегрально определенного времени реакции при желаемой степени испарения и/или подогнать скорость испарения к кинетике реакции.
В предпочтительной форме исполнения изобретения испарение на стадии b) происходит при постоянной температуре и временно непостоянном давлении, при этом давление к концу второй HKR (реакции гидролиза-конденсации), исходя из нормального давления или слегка пониженного давления, снижается до <600 мбар, предпочтительно <500 мбар, особенно предпочтительно <100 мбар.
При комбинированном способе проведения процесса (вакуум с потоком газа-носителя) предпочтительно постоянное или переменное пониженное давление <600 мбар.
Температуры выше 60°C особенно предпочтительны, для того чтобы при концентрациях HNO3, явно повышающихся обычно в остаточном растворителе, способствовать восстановительному превращению HNO3 в NO. Этот очень легко летучий газ (точка кипения при нормальных условиях примерно - 150°C) после удаления из жидкой фазы при контакте с воздухом окисляется в легко кипящий NО2 (Т.кип. примерно 21°C), который удаляется из системы с отходящим воздухом или газовым потоком. Таким путем концентрация кислоты в заявляемом материале ограничивается или снижается. Альтернативно сила кислоты может быть снижена на одной из последующих стадий, например, за счет обдувки твердого тела, например, в виде нетканого волокна.
В случае, если вместо азотной кислоты используют систему органическая кислота/аргинин, то повышение pH, соответственно снижение силы кислоты, если это желательно, происходит, например, с помощью растворов на основе трис-(гидроксиметил)-аминометана (поскольку кислота, например уксусная, не может быть удалена) (трис-раствор) незадолго перед применением за счет промывания в водном трис-растворе.
Неожиданно в сравнении с немецким патентом DE 19609551 C1 было установлено, что за счет осторожного перемешивания реакционной системы при скорости вращения от 20 об/мин до 80 об/мин образование градиента концентрации может быть снижено через высоту загрузки реакционного сосуда во время испарения реактивов (стадия b). Это, вместе с увеличенным временем гидролиза-конденсации по меньшей мере 16 часов, ведет к тому, что в случае заявляемого способа, по меньшей мере, 70%, предпочтительно, по меньшей мере, 80% и в высшей степени предпочтительно, по меньшей мере, 90% общей реакционной загрузки может быть спрядено.
Стадия (b) проводится до тех пор, пока не образуется однофазный раствор с вязкостью в диапазоне от 0,5 до 2 Па·с при скорости сдвига 10 c-1 при 4°C, предпочтительно примерно 1 Па·с (измерение при 4°C, скорость сдвига 10 с-1).
В предпочтительной форме исполнения изобретения контроль исполнения методики реакции на стадии b) осуществляется через вязкость.
Гомогенный и однофазный раствор, полученный в результате реакции гидролиза-конденсации, затем может быть охлажден и предпочтительным образом подвергнут количественно и оптимально без фильтрации кинетически контролируемому созреванию.
Созревание (стадия d) может быть проведено согласно изобретению при температуре от - 20°C до 10°C, предпочтительно от 2°C до 4°C (например, в холодильном шкафу). Особенно предпочтительно созревание проводится при 4°C. За счет низкой температуры во время созревания, кинетически контролируемого, исходя из Si-соединений, описанных выше в формуле (I), может протекать другая конденсация. В этой смеси могут образовываться олигомерные и/или полимерные силоксаны и/или силанолы. Олигомеры и/или полимеры могут также агрегировать через мостиковые водородные связи. После созревания согласно изобретению может быть получена структурно-вязкая, гомогенная однофазная золь-масса. Предпочтительным образом, согласно изобретению, поэтому конкурирующее образование трехмерного полимерного гелевого сетчатого материала может быть в значительной степени подавлено. Поэтому может быть получена гомогенная золь-масса, которая не содержит твердой второй фазы, в частности, не содержит в значительной степени гелевой фазы.
Время созревания на стадии d) может составлять согласно изобретению от 3 дней до 4 недель, предпочтительно, по меньшей мере, 10 дней, более предпочтительно между 14-40 днями, например между 14 и 28 днями, еще предпочтительнее, по меньшей мере, 25 дней и - специально при использовании заявляемых материалов для обработки ран - между 25 и 40 днями.
Согласно изобретению полученный на стадии d) золь имеет вязкость между 30 и 100 Па·с (скорость сдвига 10 с-1 при 4°C) с фактором потерь (при 4°C, 10 с-1, 1% деформации) от 2 до 5, предпочтительно от 2,5 до 3,5 (фактор потерь есть частное от деления вязкой и эластичной доли динамической вязкости). Эти условия для созревания являются особенно предпочтительными, если кизельзоль после стадии d) должен быть спряден в волокно.
Для получения кизельзоль-материала по меньшей мере с одним терапевтически активным веществом на одной или нескольких стадиях от a) до d), предпочтительно на одной или нескольких стадиях от a) до c), к нему добавляют, по меньшей мере, одно терапевтически активное вещество.
Заявляемые терапевтически активные вещества, используемые предпочтительно для получения кизельзоль-материала, в частности, выбраны из группы анальгетиков, анастезирующих веществ (анастетиков), антисептиков, соединений, останавливающих кровотечение (гемостатиков), соединений, ингибирующих свертывание крови, антигистаминных препаратов, противовоспалительных соединений, растительных веществ, способствующих заживлению ран, или смесей веществ, вакцинирующих веществ (например, против токсичных инфекций ран), факторов роста, поддерживающих регенерацию протеинов, например, таких как коллаген, ферментов, ингибиторов ферментов, в частности, ингибиторов протеазы, например, таких как альфа-1-антихимотрипсин и проластин, витаминов или провитаминов, каротиноидов, соединений для ухода за кожей, контрацептивов, а также комбинаций из них.
Как заявляемые анальгетики понимаются опиоидные анальгетики, основанные на прототипах, таких как Морфин, Фентанил и Метадон, например, такие как Бурпренорфин, и неопиоидные анальгетики (такие как никотиновые анальгетики, например Эпибатидин; чистые антивоспалительные и жаропонижающие анальгетики (NSAID - нестероидные жаропонижающие лекарства=нестероидные ингибиторы воспаления), такие как производные салициловой кислоты, как, например, ацетилсалициловая кислота (ASS), метилсалицилат или Дифлунизал, производные фенилуксусной кислоты, например такие, как Диклофенак, производные 2-фенилпропионовой кислоты, например такие, как Ибупрофен или Напроксен; не чистые анальгетики, такие как производные 4-аминофенола, например такие, как Парацетамол, пиразолоны, например такие, как Метамизол или Феназон, оксикамы, например такие, как Мелоксикам или Пироксикам; прочие неопиоидные анальгетики, например такие, как Флупиртин).
Согласно изобретению предпочтительными анастетиками являются локальные анастетики амидного или эфирного типа, в частности, Лидокаин, Тетракаин, Бупивакаин, Прилокаин, Мепивакаин, Этидокаин, а также Прокаин и Бензокаин.
Согласно изобретению предпочтительные антисептики выбраны из группы четвертичных аммониевых соединений, например таких, как бензалконий-цетримид, цетилпиридиний-хлорид и октенидин; йодсодержащие соединения, например такие, как йод, йод-повидон, галогенированные соединения, например такие, как триклозан и хлоргексидин; производные хинолина, например такие, как оксихинолин; производные фенола, например такие, как резорцин, триклозан, гексахлорофен; ртуть-содержащие соединения, такие как Мербромин и Тиомерсал; антимикробные металлы, например такие, как серебро, медь или цинк, а также их соли, оксиды или комплексы в комбинации или в отдельности; бензойная кислота, бензоилпероксид и/или бигуаниды, в частности, гидрохлорид гексаметиленбигуанида (РНМВ).
В качестве антисептика согласно изобретению могут быть использованы также такие соединения, которые проявляют гермицидное, бактерицидное (например, антибиотики), бактериостатическое (например, антибиотики), бактериолитическое (например, антибиотики), фунгицидное, вируцидное, вирустатическое, антипаразитарное и/или общее микробиоцидное действие.
Согласно изобретению предпочтительные вещества, останавливающие кровотечение, (гемостатики) выбраны из группы тромбина, фибрина, фибриногена, концентрата Фактора-VIII, Витамина K, PPSB, протамина, антифибринолитиков, например таких, как транексамовая кислота и аминокапроновая кислота.
Согласно изобретению предпочтительные соединения, препятствующие свертыванию крови, выбраны из группы гепарина, кумаринов, ингибиторов агрегации тромбоцитов, например таких, как ацетилсалициловая кислота, (СОХ)-ингибитор циклооксигеназы, Клопидогрел, Тирофибан; фибринолитиков, например таких, как стрептокиназа, урокиназа, и альтеплаза.
Заявляемые антигистаминные препараты выбраны из группы этилендиаминов, например таких, как Мепирамин (Пириламин), Трипеленнамин (Пирибензамин), Антазолин, Диметинден (Бамипин); этаноламинов, например таких, как Дифенгидрамин, Карбиноксамин, Доксиламин, Клемастин; алкиламинов, например таких, как Фенирамин, Хлорфенамин (Хлорфенирамин), Дексхлорфенамин, Бромфенирамин, Трипролидин; пиперазинов, например таких, как Гидроксизин, Меклозин; трициклических антигистаминных препаратов, например таких, как Прометазин, Алимемазин (Тримепразин), Ципрогептадин и Азатадин; Акривастина, Астемизола, Цетиризина, Эбастина, Фексофенадина, Лоратадина, Мизоластина, Терфенадина; Азеластина, Левокабастина, Олопатадина, Эпинастина, Левоцетиризина, Дезлоратадина, Фексофенадин тиоперамид и JNJ7777120.
Согласно изобретению предпочтительные антифлогистические (противовоспалительные) соединения выбраны из группы нестероидных антифло-гистиков/(антиревматических средств), например таких, как ацетилсалициловая кислота, Диклофенак, Дифлунизал, Флурбипрофен, Ибупрофен, Индометацин, Кетопрофен, Мефенаминовая кислота, Метамизол, Напроксен, Оксифенбутазон, Фенилбутазон, Феназон, Пироксикам, Пропилфеназон, Салициламид, тиапрофеновя кислота, Теноксикам, Толфенаминовая кислота; глюкокортикоидов, например таких, как Клобетазол-пропионат, Триамцинолон-ацетонид, Бетаметазон-валерат, Дексаметазон, Преднизолон, Преднизон, Гидрокортизон, Гидрокортизон-ацетат, Флутиказон, Будезонид; прочих антифлогистиков, например таких, как Монтелукаст или растительные экстракты антифлогистиков из ромашки, календулы, арники.
В качестве способствующих заживлению ран растительных веществ или смеси веществ или растительных экстрактов в связи с изобретением следует использовать, в частности, гамамелидовые экстракты, например Hamamelis virgina, экстракты календулы, экстракты алоэ, например Aloe vera, Aloe barbadensis, Aloe feroxoder или Aloe vulgaris, экстракты зеленого чая, экстракты морских водорослей, например экстракты красных или зеленых водорослей, экстракты авокадо, экстракты ароматической смолы, например Commophora molmol, экстракты бамбука, а также комбинации из них. При этом согласно изобретению следует понимать, в частности, экстракты листьев, цветков, стеблей или корней растений или комбинации из них.
В качестве заявляемых факторов роста, в частности, следует назвать: aFGF (кислый фактор роста фибропластов), EGF (эпидермальный фактор роста), PDGF (тромбоцитарный фактор роста), rhPDGF-BB (рекомбинантный человеческий фактор роста (Бекамплермин), PDECGF (тромбоцитарный эндотелиальный фактор роста), bFGF (основной фактор роста фибробластов), TGF-α (трансформирующий фактор рост-альфа), TGF-β (трансформирующий фактор роста-бета), KGF (кератиноцитарный фактор роста), IGF1/IGF2 (инсулиноподобный фактор роста), VEGF (фактор роста сосудистого эндотелия) и TNF (фактор некроза опухоли).
В качестве заявляемых витаминов подходят витамины или провитамины, в частности жирорастворимые или водорастворимые витамины, Витамин A, группа ретиноидов, Провитамин A, группа каротиноидов, в частности β-каротин, Витамин E, группа токоферола, в частности α-токоферол, β-токоферол, γ-токоферол, δ-токоферол и α-токотриенол, β-токотриенол, γ-токотриенол и δ-токотриенол, Витамин K, филлохинон, в частности фитоменадион или растительный Витамин K, Витамин C, L-аскорбиновая кислота, Витамин В1, Тиамин, Витамин В2, Рибофлавин, Витамин G, Витамин ВЗ, Ниацин, никотиновая кислота и никотинамид, Витамин В5, пантотеновая кислота, провитамин В5, Пантенол или Декспантенол, Витамин В6, Витамин В7, Витамин H, Витамин В9, фолиевая кислота, а также комбинации из них.
Согласно изобретению предпочтительными средствами ухода за кожей являются, в частности, антиоксиданты, светозащитные средства, репелленты против насекомых, эфирные масла, увлажнители, отдушки и/или коэнзим Q10.
Заявляемые терапевтические активные вещества, которые могут быть использованы отдельно или в виде смеси различных терапевтически активных веществ, содержатся в составах, в частности, от 0,01 до 40 вес.%, предпочтительно от 0,01 до 20 вес.% и в высшей степени предпочтительно от 0,1 до 10 вес.%, в расчете на вес кизельзоль-материала в составе.
Если заявляемое волокно/нетканое волокно должно использоваться для заживления ран, то золь, полученный на стадии d), предпочтительно имеет вязкость от 35 до 75 Пас (скорость среза 10 с-1 при 4°C) и еще более предпочтительно от 35 до 45 Па·с (скорость среза 10 с-1 при 4°C), предпочтительно при факторе потерь (при 4°С, 10 с-1, 1% деформации) от 2,5 до 3,5.
Слишком высокий фактор потерь означает слишком высокую эластичность материала, которая препятствует, например, образованию стабильной нити при прядении (загеливание, разрыв нити). При слишком низком факторе потерь материал настолько текуч, что стабильное образование нити невозможно (капли).
Условия во время созревания могут варьироваться, поскольку заявляемый кизельзоль должен перерабатываться затем вместо способного к прядению волокна в порошок. Предпочтительно динамическая вязкость в конце стадии (d) составляет в этом случае примерно 60 Па·с (скорость среза 10 с-1 при 4°С).
В случае переработки кизельзоля в монолит динамическая вязкость составляет в конце стадии (d) предпочтительно больше, чем 70 Па·с (скорость среза 10 с-1 при 4°C). Если кизельзоль должен быть использован для нанесения покрытия на изделия или поверхности, то динамическая вязкость лежит, в зависимости от желаемой толщины слоя, при значении меньшем, чем 10 Па·с (скорость среза 10 с-1 при 4°C).
Предпочтительно полученная золь-масса может быть использована по меньшей мере приблизительно количественно на следующих стадиях изготовления и/или процессах изготовления биологически разлагаемых и/или впитываемых кизельгель-материалов. Предпочтительно золь, полученный на стадии d), способен к прядению. На следующей стадии е) согласно изобретению может быть предусмотрен процесс прядения.
Такая стадия процесса прядения может быть проведена при обычных условиях, как, например, описано в немецком патенте DE 196 09 551 C1 и немецкой заявке на патент DE 102004063599 A1.
При этом золь, например, через сосуд с давлением посредством платы с соплами выдувается с помощью отдельных сопел (давление в сосуде 1-100 бар, предпочтительно от 20 до 30 бар).
Шахта для прядения имеет обычно длину 1-5 м, предпочтительно 2 м. Климат в шахте прядения относительно температуры и влажности устанавливается контролируемым. Предпочтительно температуры составляют между 20°C и 30°C и точка росы от -5 до 10°C, соответственно, влага - относительная влажность - от 20 до 40%, предпочтительно относительная влажность 20-25%, и особенно предпочтительно относительная влажность примерно 20%.
Волокна после прохождения нисходящим способом через шахту прядения являются формостабильными и опускаются на раскладочный стол. Ширина петли полученной таким образом копны волокон устанавливается, среди прочего, через скорости раскладки. Она лежит при нескольких см/с. За счет двухосевого движения образуется таким образом копна из волокон (нетканое волокно) с узкими петлями, в котором, в расчете на TEOS в качестве исходного соединения, содержащего Si, в среднем еще находится от 25 до 33% этокси-групп.
Специально при использовании заявляемых материалов для заживления ран вес поверхности волокнистого материала предпочтительно составляет, по меньшей мере, 90 г/м2, и особенно предпочтительно, по меньшей мере, 150 г/м2. Толщина накладки на рану (состоящей из спряденного нетканого волокна) составляет, по меньшей мере, 1,5 мм. Диаметр волокна составляет предпочтительно, по меньшей мере, 45 мкм.
Волокнистые кизельгель-материалы и продукты, полученные в результате заявляемого способа, так, например, нити, волокна, нетканые волокна и/или ткань, проявляют очень высокую способность к биологической разлагаемости и высокую биологическую впитывающую способность.
Другим преимуществом изобретения является то, что волокнистые кизельгель-материалы по отношению к волокнам, которые были получены по способу немецкого патента DE 19609551 C1, проявляют отчетливо улучшенные значения в тесте на цитотоксичность в присутствии L929-фибробластов мышей (см. пример 1 и сравнительный пример). Продукты, которые были получены из заявляемого кизельзоль-материала, отличаются поэтому особенно хорошей биологической совместимостью. Заявляемые нити, волокна или нетканый материал могут быть использованы в известной степени выгодным образом как биоразлагаемые и/или биологически впитываемые материалы и продукты в медицине человека или медтехнике.
Заявляемые волокна и нетканые материалы, по меньшей мере, с одним терапевтически активным веществом могут одни поддерживать улучшенные свойства волокон и нетканых материалов в заживлении ран или еще улучшать. В частности, заявляемые материалы могут быть использованы поэтому выгодным образом в области обработки ран и заживления ран. Нити могут быть использованы, например, в качестве хирургического швейного материала или в качестве усиливающих волокон. Заявляемые нетканые полотна могут быть использованы особенно выгодным образом при обработке поверхностных ран.
Заявляемые биологически разлагаемые и/или биологически впитываемые волокна и нетканое волокно могут быть получены посредством контролируемой реакции гидролиза-конденсации из выше названных Si-соединений и азотнокислой воды посредством следующих стадий:
a) проводят реакцию гидролиза-конденсации одного или нескольких Si-соединений формулы (I)
S i X 4 ( I ) ,
в которой остатки X являются одинаковыми или различными и означают гидрокси, водород, галоген, амино, алкокси, ацилокси, алкилкарбонил и/или алкоксикарбонил и происходят от алкильных остатков, которые представляют собой, при необходимости, замещенные, линейные, разветвленные или циклические остатки с 1-20 атомами углерода, предпочтительно с 1-10 атомами углерода, и могут быть прерваны атомами кислорода или серы или аминогруппами, катализируемая кислотами при начальном значении pH от 0 до ≤7, при необходимости, в присутствии растворимого в воде растворителя, в течение, по меньшей мере, 16 часов, при температуре от 0°C до 80°C, предпочтительно при 20-60°C, особенно предпочтительно при от 20 до 50°C, например при комнатной температуре (приблизительно от 20°C до приблизительно 25°C) или приблизительно при 37°C,
b) за счет последующего упаривания образуется однофазный раствор с вязкостью в области от 0,5 до 2 Па·с при скорости среза 10 с-1 при 4°C,
c) этот раствор затем охлаждают и
d) подвергают кинетически контролируемому созреванию, при этом образуется гомогенный однофазный золь и на одной или нескольких стадиях от a) до d) и предпочтительно на одной или нескольких стадиях от a) до c), добавляют, по меньшей мере, одно терапевтически активное вещество и
e) прядение полученного на стадии d) золя в процессе прядения.
Если в реакции гидролиза-конденсации на стадии а) используют, например, TEOS в качестве Si-соединения, то при достаточном времени гидролиза после упаривания на стадии b) может быть получен гомогенный раствор. В течение времени созревания при пониженной температуре на стадии с) может протекать кинетически контролируемая реакция. Смесь на стадии d) может находиться в таком случае растворенной в виде гомогенной однофазной массы и тем самым может быть получена в виде способной к прядению золь-массы.
Полученные согласно изобретению волокна или нетканое волокно могут быть использованы как биологически впитываемые и/или биоактивные материалы в медицине человека и/или медтехнике, поскольку это выгодно. В частности, материалы, полученные согласно изобретению, могут быть использованы предпочтительно в области обработки ран и заживления ран. Волокна могут быть использованы, например, в качестве хирургического сшивного материала или как усиливающие волокна. Нетканые волокна особенно предпочтительно могут быть использованы при лечении поверхностных ран, в случае которых используются фильтрация жидкостей организма (например, крови) или в области биореакторов в качестве помощи при выращивании животных.
Другой формой исполнения изобретения может быть система доставки лекарств и/или состав лекарственного средства, микропорошок и/или нанопорошок. Понятно, что в окончательном составе (порошке) могут находиться другие вещества, пригодные к соответствующему использованию, и/или вспомогательные средства. Частицы заявляемого микропорошка имеют предпочтительно размер (средний диаметр) от 0,01 до 100 мкм, в частности от 0,1 до 20 мкм. Частицы нанопорошка имеют, как правило, размер (средний диаметр) ≤100 нм.
В другом исполнении заявляемый кизельзоль отливается в форму. После сушки таким образом может быть получен монолит. Такие монолиты могут быть использованы в форме массивных имплантатов в качестве систем доставки действующих веществ (Drug Delivery System), например, подкожно. Они могут быть использованы, например, как место хранения для контрацептивов и через