Искусственный ген, кодирующий химерный белок ангиогенина человека, химерная плазмида pjzz-a, обеспечивающая экспрессию гена химерного белка ангиогенина человека в escherichia coli и штамм escherichia coli bl21(de3)/pjzz-a-продуцент рекомбинантного химерного белка ангиогенина человека
Иллюстрации
Показать всеИзобретение относится к биотехнологии, в частности к генетической инженерии. Представлен искусственный ген, кодирующий химерный белок ангиогенина человека. Описана рекомбинантная плазмида pJZZ-A, представляющая собой вектор pJexpress414 и содержащая данный ген, встроенный по сайтам NdeI/XhoI. Также представлен рекомбинантный штамм E. coli BL21(DE3)/pJZZS-A. Изобретение позволяет повысить эффективность экспрессии гибридного гена и повысить продукцию рекомбинантного химерного белка ангиогенина человека. 3 н.п. ф-лы, 3 ил., 1 табл.
Реферат
Область техники
Изобретение относится к биотехнологии, в частности к генетической инженерии, и представляет собой синтезированный ген, кодирующий химерный белок ангиогенина человека, сконструированную in vitro гибридную плазмиду pJZZS-A, содержащую синтетический ген ангиогенина, слитый с геном IgG-связывающего домена белка А золотистого стафилококка, и штамм Escherichia coli BL21(DE3)/pJZZSA - продуцент рекомбинантного химерного белка ангиогенина человека.
Ангиогенин представляет собой основный полипептид, состоящий из 123 аминокислотных остатков с молекулярной массой 14 кДа и являющийся белковым фактором ангиогенеза. Он стимулирует функции эндотелиальных клеток, важных для развития кровеносных сосудов. Этим объясняется интерес к ангиогенину, как к перспективному средству для лечения ран, ожогов, язв и сердечно-сосудистой патологии.
Предшествующий уровень техники
Известно получение рекомбинантного ангиогенина, слитого с бета-галактозидазным фрагментом (патент EP 0292763, МПК C07K1/20, опубл. 30.11.1988 г.). Слитый белок находится в тельцах включения.
Однако химерный полипептид, описанный в патенте EP 0292763, приобретает вследствие наличия в его составе фрагмента бета-галактозидазы свойства чужеродного белка и не может быть использован в медицинских целях, т.к. на него будут вырабатываться антитела и, более того, может быть стимулирован аутоиммунный ответ против ангиогенина человека.
Известен синтетический ген белка ангиогенина, содержащий модифицированные кодоны, т.е. наиболее часто встречающиеся в геноме E.coli
[патент FR 2610324, МПК С07K 14/515, опубл. 05.08.1988 г.]. При этом получают не слитый с какими-либо полипептидами рекомбинантный ангиогенин человека.
Однако полипептид, описанный в патенте FR 2610324 вследствие отсутствия в его составе дополнительного участка какого-либо белка человека. подвержен значительному действию протеаз, а следовательно, будет обладать и более коротким временем «полужизни» при введении его в организм человека.
Известен структурный ген ангиогенина человека, синтезированный химико-ферментативным методом. Проведено клонирование этого гена в нескольких экспрессирующих векторных системах, в частности в генетической конструкции pRITA16, и сконструирован ряд бактериальных штаммов-продуцентов ангиогенина [Мертвецов Н.П. //Известия Академии наук. Сер. химическая.-1996, т.21, №12, с.2837-2846] гибридов ангиогенина с бета-галактозидазой и с доменами белка А стафилококка, а также сконструирован бактериальный штамм-продуцент Е. coli VL1222p R AngT (депонирован в ГНИИ генетика, № ВКПМ В-6895), продуцирующий свободный ангиогенин [Никонова А.А., Серегин С.В., Чикаев Н.А., Мишин В.П., Бабкина И.Н., Мертвецов Н.П. //Биоорган. химия.- 1996, т.22.- с.891-893].
Однако недостатком указанных генетических конструкций и бактериальных штаммов является низкий уровень экспрессии синтетического гена, составляющий 2 мг белка на литр культуральной среды, что эквивалентно всего лишь 0,02% суммарного клеточного белка [Studier et al. //Meth. Enzimol.-1990, v.185.- p.60-89].
Наиболее близкими аналогами (прототипами) являются следующие объекты.
Структурный ген ангиогенина человека, слитый с геном IgG-связывающего домена белка А стафилококка и синтезированный химико-ферментативным методом [Мертвецов Н.П. //Известия Академии наук. Сер. химическая.-1996, т.21, №12, с.2837-2846].
Указанный синтетический гибридный ген ангиогенина человека, слитый с геном IgG-связывающего домена белка А стафилококка, клонирован в составе новой векторной системы рЕТ-21 а-d(+) по участкам узнавания рестриктаз Hind III и Xba I. В результате получена плазмида pZZSA, в которой гибридный ген находится под контролем раннего промотора фага Т7. Полученная плазмида pZZSA введена в клетки E.coli BL21 (DE3) (из коллекции ВНИИ генетики) [международная заявка WO 03/064660, МПК C12N15/70, опубл. 07.08.2003 г.]. Полученный рекомбинантный штамм E.coli BL21 (DE3) pZZSA депонирован в Коллекции микроорганизмов Межрегионального центра коррекции микроценоза человека под номером №МЦКМ В-127. Синтез белка в полученном штамме осуществляется после индукции 1 мМ изопропил β-D-тиогалактозидом (IPTG). Штамм не имеет протеиназы omp T внешней мембраны клетки, что исключает деградацию белка в процессе очистки целевого продукта.
Гибридная плазмида pZZSA, кодирующая синтез химерного белка ангиогенина, характеризуется следующими признаками:
имеет молекулярную массу 3,814 мегадальтон (Md) (6192 п.о.);
- кодирует синтез химерного белка ангиогенина;
- состоит из:
- XhoI/EcoRI - фрагмента ДНК плазмиды pGM280 (3720 п.о.), включающего тандем промоторов триптофанового оперона E. coli, терминатор транскрипции фага лямбда, ген bla, кодирующий бета-лактомазу и участок ori инициации репликации;
- EcoRI/ EcoNI - фрагмента плазмиды PfM (2500 п.о.), включающего синтетический усилитель трансляции гена бактериофага Т7, и кодирующий аминокислотную последовательность ген Ap (3988-4845п.о.);
- тандема промоторов триптофанового оперона E.coli;
- синтетического химерного гена ангиогенина (Ang), слитого с Spa;
- генетического маркера - гена bla, кодирующего бета-лактамазу, детермини-рующего устойчивость трансформированных плазмидой pZZSA клеток E.coli к ампициллину;
- уникальных сайтов узнавания рестрикционными нуклеазами, расположенными на следующих расстояниях вправо от сайта EcoRI (280 п.о.) со следующими координатами: EcoRI - 192 п.о., XbaI - 276 п.о., Bgl II - 342 п.о., Sph I - 539 п.о., EcoNI - 599 п.о., Mlu I - 1064 п.о.
Гибридный (синтетический) ген ангиогенина находится под контролем раннего промотора фага T7, что обеспечивает специфическую индукцию изопропил β-D-тиогалактозидом синтеза продукта (химерного ангиогенина) и дает высокий выход целевого белка по сравнению со штаммами, сконструированными ранее - E.Coli JM103 pRITA16 и E.Coli VL1222 pRAngT [Мертвецов Н.П. //Известия Академии наук. Сер. химическая.-1996, т.21, №12, с.2837-2846].
Для получения штамма-суперпродуцента рекомбинантного химерного белка ангиогенина человека трансформируют компетентные клетки Escherichia coli BL21 (DE3) рекомбинантной гибридной плазмидой pZZSA.
Однако в конструкции такого синтетического гена не была осуществлена оптимизация кодонового состава в нуклеотидной последовательности, кодирующей IgG-связывающие домены, а при подборе кодонов для синтетического гена ангиогенина не были учтены современные принципы оптимизации структуры гена для обеспечения его эффективной экспрессии. Химерная плазмида pZZSA обеспечивает низкую экспрессию искусственного гена химерного белка ангиогенина в Escherichia coli. Таким образом, вследствие перечисленных выше недостатков в конструкции синтетического гена и плазмидного вектора штамм-продуцент химерного ангиогенина, описанный в международной заявке WO 03/064660, продуцирует меньшее количество рекомбинантного химерного белка ангиогенина человека.
Раскрытие изобретения
Техническим результатом предлагаемых изобретений является создание такого искусственного гибридного гена ангиогенина человека, такой векторной системы (с новым ориджином репликации), обеспечивающей биосинтез белка в виде гибрида и такого рекомбинантного штамма-продуцента E.coli, которые позволили бы повысить эффективность экспрессии гибридного гена и повысить продукцию рекомбинантного химерного белка ангиогенина человека.
Указанный технический результат достигается путем создания нового искусственного гена, кодирующего химерный белок ангиогенина человека и имеющего нуклеотидную последовательность, приведенную на фиг.2.
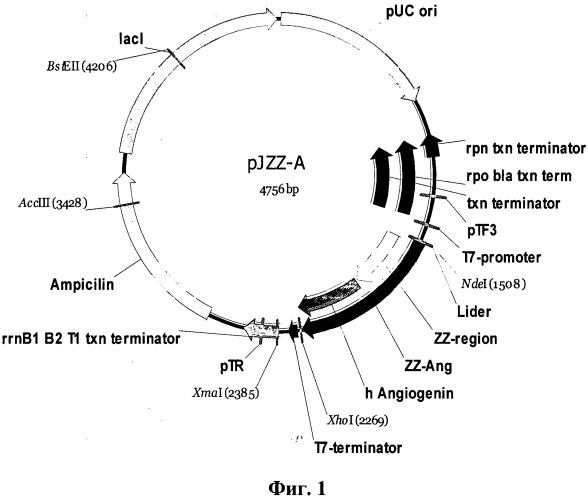
Указанный технический результат достигается также тем, что создана новая химерная плазмида pJZZ-A, обеспечивающая экспрессию искусственного гена химерного белка ZZ-hAng в Escherichia coli, имеющая размер 4756 пар оснований (п.о.), молекулярную массу 3086 кДа и состоящая в соответствии с физической и генетической картой плазмиды, приведенной на фиг.1:
а) синтетического рекомбинантного гена ZZ-Ang (позиции: 1509 - 2267 п.о.), кодирующего химерный полипептид, содержащий с N-конца аминокислотную последовательность двух IgG-связывающих доменов (ZZ) белка A Staphylococcus aureus, а с С-конца аминокислотную последовательность зрелого ангиогенина человека, и включающего следующие генетические элементы:
- Lider и ZZ-region - 5'-концевой фрагмент (позиции: 1509 - 1886 п.о.) синтетического гена ZZ-Ang, кодирующий аминокислотную последовательность искусственного лидера из 8-ми аминокислотных остатков и двух IgG-связывающих доменов (ZZ) белка A Staphylococcus aureus;
- hAngiogenin - 3'-концевой фрагмент (позиции: 1893 - 2264 п.о.) синтетического гена ZZ-Ang, кодирующий аминокислотную последовательность зрелого ангиогенина человека;
б) NdeI/XhoI фрагмента плазмиды pJexpress414, включающего следующие элементы:
- pUC ori - сайт репликации плазмиды pUC (позиции: 2 - 805 п.о.);
- терминаторы транскрипции различных генов: терминатор rpn txn (позиции: 977 - 1090 п.о.), терминатор bla txn (позиции: 1097 - 1397 п.о.), терминатор бактериофага T7 (позиции: 2284-2330 п.о.), терминатор rrnB1 B2 T1 txn (позиции: 2378 - 2552 п.о.);
- T7 promoter - промотор бактериофага Т7 (позиции: 1423 - 1439 п.о.);
- Ampicilin - ген β-лактамазы, определяющий устойчивость бактерии к бета-лактамным антибиотикам (пенициллины, цефалоспорины) (позиции: 2734 - 3582 п.о.);
- lacI - регулятор транскрипции гена lac (позиции: 3677 - 4747 п.о.);
- уникальные сайты рестрикции: NdeI (позиции: 1506-1511 п.о.), XhoI (позиции: 2268-2273 п.о.), XmaI (позиции: 2384-2389 п.о.), AccIII (позиции: 3427-3432 п.о.), BstEII (позиции: 4205-4211 п.о.).
Указанный технический результат достигается также тем, что создан новый штамм Escherichia coli BL21(DE3)/pJZZ-A, являющийся продуцентом рекомбинантного химерного белка ангиогенина человека и депонированный в Коллекции бактерий, бактериофагов и грибов Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии «Вектор» под номером В-1250.
Заявляемая экспрессирующая плазмида pJZZ-A, содержащая синтетический ген химерного белка ZZ-hAng, по сравнению с плазмидой, описанной в прототипе, имеет следующие конструктивные особенности, обеспечивающие существенные преимущества: а) во-первых, плазмида имеет ориджин репликации многокопийной плазмиды pUC, обеспечивающий увеличенное количество в клетке копий плазмиды, а, следовательно, и копий гибридного гена и, соответственно, белкового продукта (белка ZZ-hAng), кодируемого этим геном;
б) во-вторых, кодоновый состав синтетического гена спроектирован специально для обеспечения эффективной экспрессии этого гена в клетках E.coli.
Таким образом, выше указанные особенности предложенной плазмидной конструкции обусловливают более высокий, по сравнению с прототипом, уровень синтеза целевого химерного белка ZZ-hAng.
Краткое описание приведенных графических материалов
На фиг. 1 приведена физическая и генетическая карта заявляемой рекомбинантной плазмиды pJZZ-A, где: pUC ori - сайт репликации плазмиды pUC (позиции: 2 - 805);
rpn txn terminator (позиции: 977 - 1090), bla txn terminator (позиции: 1097 - 1397), T7 terminator (позиции: 2284-2330), rrnB1 B2 T1 txn terminator (позиции: 2378 - 2552) - терминаторы транскрипции различных генов;
T7 promoter - промотор бактериофага Т7 (позиции: 1423 - 1439);
ZZ-Ang - синтетический ген (позиции: 1509 - 2267) химерного полипептида, содержащего с N-конца аминокислотную последовательность двух IgG-связывающих доменов (ZZ) белка A Staphylococcus aureus, а с С-конца аминокислотную последовательность зрелого ангиогенина человека;
Lider и ZZ-region - 5'-концевой фрагмент (позиции: 1509 - 1886) синтетического гена ZZ-Ang, кодирующий аминокислотную последовательность двух IgG-связывающих доменов (ZZ) белка A Staphylococcus aureus;
hAngiogenin - 3'-концевой фрагмент (позиции: 1893 - 2264) синтетического гена ZZ-Ang, кодирующий аминокислотную последовательность зрелого ангиогенина человека;
Ampicilin - ген β-лактамазы, определяющий устойчивость бактерии к бета-лактамным антибиотикам (пенициллины, цефалоспорины) (позиции: 2734 - 3582);
lacI - регулятор транскрипции гена lac (позиции: 3677 - 4747).
На фиг. 2 представлена полная нуклеотидная последовательность искусственного гена химерного белка ZZ-hAng.
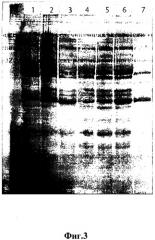
На фиг. 3 приведена электрофореграмма лизатов клеток из клонов E.coli шт. BL-21(DE3), трансформированных плазмидой pJZZ-A. Стрелкой показано положение химерного белка ZZ-Ang (~28кДа).
Дорожки:
(2 - 6) - лизаты клеток клонов № 1 - №5, соответственно, росших при 30оС 18 час в присутствии 1 мМ ИПТГ
(1) - лизат клеток клона №5, росшего при 30оС 18 час в отсутствие 1 мМ ИПТГ (отрицательный контроль)
(6) - Маркер молекулярных масс белков: 25, 29 и 39кДа.
К материалам заявки прилагается перечень нуклеотидных последовательностей заявляемого гена ангиогенина (см. приложение).
Варианты осуществления изобретения
Описание способа получения химерного гена
На первом этапе работы авторами был проведен сравнительный анализ первичных структур синтетического гена ангиогенина человека, описанного в патенте Н.П.Мертвецова и соавт. [1], и кодирующей области природного гена ангиогенина, представленного в международной базе данных GenBank (инвентарные номера: AF449650, AF449651, CS441837). Анализ этих структур позволил сделать заключение, что для эффективной экспрессии гена ангиогенина человека в клетках E.coli необходимо осуществить синтез гена, первичную структуру которого следует задавать с использованием специальной программы выбора оптимальных, т.е. часто встречаемых в генах E.coli кодонов. В связи с этим при расчете нуклеотидной последовательности химерного гена мы в своей работе использовали программу GeneDesigner фирмы DNA2.0 для подбора оптимальных кодонов, а также разработанную нами программу поиска пар кодонов, которые по данным [2] затрудняют или даже останавливают трансляцию мРНК в E.coli.
Как и в работе [1] авторы планировали получить химерный ген, кодирующий с N-конца аминокислотную последовательность двух IgG-связывающих доменов белка А S.aureus (ZZ-область), состыкованную с C-концевым полипептидом, представленным полной аминокислотной последовательностью зрелого ангиогенина человека (hAng). Однако в отличие от работы [1] синтезируемый нами химерный ген должен был быть полностью искусственным, т.е. содержащим состав кодонов, оптимальный для экспрессии в клетках E.coli. Для достижения поставленной цели были выполнены следующие работы:
1) принимая во внимание результаты исследований Bivona et al. [3], продемонстрировавших зависимость эффективности трансляции мРНК в E.coli от природы аминокислотных остатков в позициях со 2-й по 5-ю и структуры кодирующих их кодонов, мы (авторы) в своей работе последовательность гена, кодирующего домен Е белка А S.aureus заменили на последовательность, кодирующую соответствующий ей 5'-концевой участок мРНК, который, согласно заключению, сделанному в статье [3], может быть оптимальным для трансляции в E.coli.
2) исходя из аминокислотных последовательностей IgG-связывающего домена белка А S.aureus (Z-область) и последовательности зрелого ангиогенина человека была рассчитана первичная структура соответствующего химерного гена, содержащего состав кодонов, оптимальный для экспрессии в клетках E.coli;
3) в рассчитанной последовательности химерного гена удалили возникшие сайты рестрикции, за счет синонимической замены одного нуклеотида в каждом сайте.
На втором этапе работы был синтезирован химерный ген, первичная структура которого была рассчитана на первом этапе. Химерный ген кодировал полипептид, содержащий с N-конца ZZ-область белка А S.aureus, состыкованную с C-концевым полипептидом, представленным полной аминокислотной последовательностью ангиогенина человека. Полная нуклеотидная последовательность синтезированного гена химерного белка ZZ-hAng представлена на фиг.2 и в приложении. Полная последовательность заявляемого искусственного гена состоит из 4-х искусственных последовательностей. Первая SEQ ID NO 1 является последовательностью лидера и подобрана для оптимизации инициации трансляции мРНК гена химерного белка. Вторая SEQ ID NO 2 нуклеотидная последовательность гена относится к IgG-связывающей области ZZ белка А из Staphylococcus. Третья нуклеотидная последовательность SEQ ID NO 3 расположена между последовательностью SEQ ID NO 2 гена IgG-связывающей области ZZ белка А из Staphylococcus aureus и нуклеотидной последовательностью SEQ ID NO 4 гена ангиогенина человека, относящейся к его кодирующей области.
В нуклеотидную последовательность, входящую в состав заявляемого гена химерного белка ZZ-hAng и кодирующую ZZ-область белка А S.aureus введены 92 замены нуклеотидов, из которых 83 являются синонимическими, т.е. не приводят к замене аминокислотных остатков в полипептиде. По сравнению с исскуственным геном-прототипом (международная заявка WO 03/064660) в нуклеотидную последовательность, входящую в состав заявляемого синтетического гена химерного белка ZZ-hAng и кодирующую зрелый ангиогенин человека, введено 74 синонимических замены нуклеотидов.
На третьем этапе синтезированный ген химерного белка ZZ-hAng был встроен по сайтам рестрикции NdeI и XhoI в коммерческий плазмидный вектор pJexpress414 [4] в результате чего была получена рекомбинантная плазмида pJZZ-A, в которой встроенный ген находился под контролем промотора раннего гена бактериофага Т7.
Способ конструирования плазмиды pJZZ-A
2 мкг плазмидной ДНК pJexpress414 обрабатывают последовательно рестриктазами NdeI и XhoI в соответствии с руководством фирмы «СибЭнзим» (г. Новосибирск), производяшей эти ферменты, полученный гидролизат подвергают электрофорезу в 0,8% агарозном геле и из области геля, содержащей линеализированный вектор pJexpress414, элюируют вектор с помощью набора для элюции ДНК из агарозного геля фирмы «Ферментас» по прописи фирмы к набору. Синтетический гибридный ген, содержащий на 5'- и на 3'-концах сайты узнавания рестриктазами NdeI и XhoI, соответственно, и включающий на 5'-конце ген IgG-связывающего домена белка А золотистого стафилококка и на 3'-конце ген ангиогенина человека (с нуклеотидной последовательностью, представленной на фиг.2), обрабатывают последовательно рестриктазами NdeI и XhoI, как описано выше для вектора pJexpress414. Гидролизованный рестриктазами синтетический ген и элюированную из геля плазмиду pJexpress414 сшивают при помощи лигазы бактериофага Т4 в 40 мкл реакционной смеси по методике, описанной в руководстве [5]. По 1-2 мкл реакционной смеси используют для трансформации электрокомпетентных клеток E-coli штаммов BL21(DE3) или Rosetta2. Приготовление электрокомпетентных клеток и проведение их трансформации с помощью электропорации осуществляют согласно руководству фирмы PeqLab, Biotechnologie GmbH, производителя электропоратора.
Трансформанты высевают на LB-агар, содержащий 100 мкг/мл ампициллина. Из выросших клонов методом ПЦР колоний с применением праймеров № и № отбирают клоны, содержащие вставку синтетического гена. Рекомбинантные клоны, содержащие по данным ПЦР-анализа вставки синтетического гена анализируют рестрикционным анализом с целью определения размера вставки и выяснения вопроса о восстановлении сайтов рестрикции NdeI и XhoI. Отбирают клоны, содержащие плазмидную ДНК, образующую при обработке рестриктазами NdeI и XhoI два рестриктных фрагмента, соответствующих по размеру линеализированной плазмиде pJexpress414 и синтетическому гибридному гену.
Полученная рекомбинантная плазмида, обозначенная как pJZZ-A, физическая и генетическая карта которой представлена на фиг.1, имеет размер 4756 пар оснований (п.о.), молекулярную массу 3086 кДа и состоит из двух основных частей: а) синтетического рекомбинантного гена ZZ-Ang (позиции: 1509 - 2267 п.о.), кодирующего химерный полипептид, содержащий с N-конца аминокислотную последовательность двух IgG-связывающих доменов (ZZ) белка A Staphylococcus aureus, а с С-конца аминокислотную последовательность зрелого ангиогенина человека, и включающего следующие генетические элементы:
- Lider и ZZ-region - 5'-концевой фрагмент (позиции: 1509 - 1886 п.о.) синтетического гена ZZ-Ang, кодирующий аминокислотную последовательность искусственного лидера из 8-ми аминокислотных остатков и двух IgG-связывающих доменов (ZZ) белка A Staphylococcus aureus;
- hAngiogenin - 3'-концевой фрагмент (позиции: 1893 - 2264 п.о.) синтетического гена ZZ-Ang, кодирующий аминокислотную последовательность зрелого ангиогенина человека;
б) NdeI/XhoI фрагмента плазмиды pJexpress414. NdeI/XhoI фрагмент плазмиды pJexpress414 включает следующие элементы:
- pUC ori - сайт репликации плазмиды pUC (позиции: 2 - 805 п.о.);
- терминаторы транскрипции различных генов: терминатор rpn txn (позиции: 977 - 1090 п.о.), терминатор bla txn (позиции: 1097 - 1397 п.о.), терминатор бактериофага T7 (позиции: 2284-2330 п.о.), терминатор rrnB1 B2 T1 txn (позиции: 2378 - 2552 п.о.);
- T7 promoter - промотор бактериофага Т7 (позиции: 1423 - 1439 п.о.);
- Ampicilin - ген β-лактамазы, определяющий устойчивость бактерии к бета-лактамным антибиотикам (пенициллины, цефалоспорины) (позиции: 2734 - 3582 п.о.);
- lacI - регулятор транскрипции гена lac (позиции: 3677 - 4747 п.о.);
- уникальные сайты рестрикции: NdeI (позиции: 1506-1511 п.о.), XhoI (позиции: 2268-2273 п.о.), XmaI (позиции: 2384-2389 п.о.), AccIII (позиции: 3427-3432 п.о.), BstEII (позиции: 4205-4211 п.о.).
Клетки E.coli BL21(DE3), трансформированные плазмидой pJZZ-A, способны при индукции промотора изопропил-β-D-1-тиогалактопиранозидом (ИПТГ) синтезировать химерный полипептид, содержащий в N-концевой области аминокислотную последовательность искусственного лидера из 8-ми аминокислотных остатков и двух IgG-связывающих доменов (ZZ) белка A Staphylococcus aureus и в С-концевой области последовательность ангиогенина человека (Ang).
Структурно-функциональный анализ рекомбинантной ДНК Химерный полипептид и векторную ДНК соединяют при помощи лигазной реакции в 50 мкл буфера для лигирования. 5 мкг реакционной смеси используют для трансформации компетентных клеток E coli BL21 (DE3).
Трансформанты высевают на LB - агар, содержащий 100 мкг/мл ампициллина. Из выросших клонов выделяют плазмидную ДНК pJZZ-A и анализируют ее путем обработки набором эндонуклеаз рестрикции Hind III, EcoRI, XbaI с последующим электрофоретическим анализом длин рестрикционных фрагментов в 1,8 % агарозном геле.
Из 10 проанализированных клонов 5 показали нужный набор рестрикционных фрагментов. Целевая рекомбинантная плазмида pJZZ-A содержит уникальные сайты узнавания рестрикционными эндонуклеазами, имеющие следующие координаты: NdeI (позиции: 1506-1511 п.о.), XhoI (позиции: 2268-2273 п.о.), XmaI (позиции: 2384-2389 п.о.), AccIII (позиции: 3427-3432 п.о.), BstEII (позиции: 4205-4211 п.о.).
Окончательную структуру рекомбинантной ДНК pJZZ-A подтверждают определением нуклеотидной последовательности в районе встроенного фрагмента, содержащего синтетический ген ангиогенина человека.
Получение рекомбинантного штамма Escherichia coli BL21(DE3)/pJZZ-A - продуцента химерного белка ZZ-hAng
Электрокомпетентные клетки штаммов Escherichia coli BL21(DE3) трансформировали методом электропорации рекомбинантной плазмидой pJZZ-A. Клоны, содержащие рекомбинантную плазмиду pJZZ-A, отбирали селекцией на твердой агаризованной ЛБ-среде, содержащей 200 мкг/мл ампициллина, с последующим ПЦР-анализом клонов in situ на наличие ДНК pJZZ-A. Клоны, содержащие рекомбинантную плазмиду pJZZ-A, анализировали на способность осуществлять индуцируемый ИПТГ синтез химерного белка ZZ-hAng. В итоге был получен рекомбинантный штамм Escherichia coli BL21(DE3)/pJZZ-A, эффективно продуцирующий химерный белок ZZ-hAng, о чем можно судить по результатам электрофоретического анализа белков, синтезируемых индуцируемыми ИПТГ рекомбинантным штаммом (см. фиг. 3).
Судя по результатам анализа экспрессии гена химерного гена белка ZZ-Ang в экспериментальных (неоптимальных) условиях культивирования в исследованном рекомбинантном штамме на долю белка ZZ-Ang приходится ~9,0-11,0% от суммарного белка клетки. Выход целевого белка можно значительно увеличить при условии суспензионного культивирования рекомбинантного штамма в ферментерах до высоких плотностей клеток.
Полученный рекомбинантный штамм Escherichia coli BL21(DE3)/pJZZ-A характеризуется спектром признаков, приведенных в паспорте на штамм, и включающий: морфологические признаки штаммов, культуральные особенности, биохимические признаки и устойчивость к антибиотикам.
Полученный рекомбинантный штамм E.coli BL21 (DE3)/pJZZ-A депонирован в коллекции бактерий, бактериофагов и грибов ФБУН ГНЦ ВБ «Вектор» под номером: B-1250. Справка о депонировании штамма прилагается.
Морфологические признаки. Клетки мелкие размером 1мкм х 3-5 мкм палочковидной формы, грамотрицательные, неспороносные, подвижные.
Культуральные признаки. При росте на плотной среде LA колонии круглые, гладкие, полупрозрачные, блестящие, серые, края ровные; диаметр колоний 1-3 мм; консистенция пастообразная. Рост в жидких средах (LB, минимальная среда с глюкозой) характеризуется ровным помутнением с образованием легкого осадка.
Физико-биохимические признаки. Клетки растут при температуре от +4 до +42° С при оптимумерН от 6,8 до 7,2. В качестве источника азота используют какминеральные соли в аммонийной форме, так и органические соединения в виде пептона, триптона, дрожжевого экстракта, аминокислот. В качестве источника углерода используют аминокислоты, глицерин, углеводы.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к ампициллину (до 300 мкг/мл), обусловленную наличием в плазмиде гена β-лактамазы и устойчивость к тетрациклину (до 50 мкг/мл), связанную с наличием транспозона.
Полученный штамм Escherichia coli BL21(DE3)/pJZZ-A обеспечивает индуцируемый ИПТГ (изопропил-β-D-тиогалактозид) конститутивный синтез химерного белка ангиогенина человека не ниже 5% от суммарного клеточного белка, что в 10 раз выше, чем в прототипе.
Методика культивирования штамма E.coli BL 21 (DE3) pJZZ-A и индукции белка ангиогенина человека
Ночную культуру штамма E.coli BL 21 (DE3) pJZZ-A разводят в 50 раз в среде LB с добавлением ампициллина до концентрации 0,2 мг/мл и культивируют с аэрацией в ферментере в объеме от 2,5 до 5,0 л при 37 °С до завершения логарифмической фазы роста, т.е. до достижения оптической плотности 1 о.е. при длине волны 600 нм. Далее в суспензию добавляют ИПТГ до концентрации 1 мМ и инкубируют для обеспечения индукции экспрессии рекомбинантного гена ангиогенина в течение 3,5 часов. По окончании инкубации клетки бактерий осаждают центрифугированием при 5000 об/мин и далее хранят при -20 °С до момента лизиса.
Методика выделения телец включения и получение химерного белка ангиогенина человека
Клетки суспендируют в буфере "А" (0,1 М трис-HCl; рН 7,2; 0,1 М NaCl; 10 мМ бета-меркаптоэтанол, 10% сахароза), озвучивают в генераторе ультразвука УЗДН2Т и центрифугируют 15 мин при 5000 об/мин. Осадок 5 раз отмывают буфером "А" с добавлением 1% тритона Х-100, 2 М мочевины с обязательной гомогенизацией и последующим центрифугированием в течение 15 мин. После удаления супернатанта осадок растворяют в 50 мл 7М гуанидин хлорида.
Далее для выделения химерного белка ангиогенина к 50 мл солюбилизированного белка добавляют 2,5 мл 1М трис-HCl pH 8,0; 0,5 г тетратионата Na, 1 г сульфита Na и выдерживают 20 часов при 22 °С. После диализа в 1 л фосфатного буфера, рН 8,0 раствор разбавляют в 10 раз тем же буфером с добавлением 1 мМ глутатиона восстановленного и 0,1 мМ глутатиона окисленного и инкубируют 17 часов при +4 °С. Далее проводят хроматографию на целлюлозе DE-52, выполняя ступенчатую элюцию белка раствором NaCl. Концентрация элюента при выходе белка с колонки составляла 0,5 М NaCl. Выход белка составляет 500 мг на 5 г биомассы, т.е. 10,0%.
Анализ специфической активности рекомбинантного белка проводят на хориоаллантоисной оболочке (ХАО) куриного эмбриона [6, 7] по нижеследующей методике с использованием 7-9-суточных куриных эмбрионов с нормальным развитием плода. В опыт берут не менее 7 куриных эмбрионов на точку. Исследуют параллельно не менее двух разведений препарата рекомбинантного ангиогенина и два контроля. В условиях соблюдения стерильности исследуемые образцы по 10 мкл наносят на фильтры Миллипор (диаметр диска 10 мм). Диски подсушивают под лампой в ламинаре. В стерильных условиях фильтры с импрегнированными образцами исследуемых препаратов апплицируют на ХАО. Все яйца, используемые в опыте, подписывают и помещают в термостат с температурой 37°С для дальнейшего инкубирования.
Результаты учитывают через 72-80 часов после имплантации фильтра с нанесенным образцом препарата рекомбинантного ангиогенина на ХАО. Предварительно яйца с куриными эмбрионами анализируют в овоскопе, отбраковывая погибшие. Яйца с живыми куриными эмбрионами вскрывают и производят визуальное исследование сосудистой сети хориоаллантоисной оболочки как к прилежащей к имплантированному диску фильтра, так и пристеночной (прилегающей к скорлупе). Затем извлекают участок хориоаллантоисной оболочки из-под диска фильтра и помещают для фиксации в раствор формалина на 5-7 минут. Фиксированные участки ХАО помещают под лупу (или микроскоп) и производят подсчет сосудов. Берут среднюю величину от результатов измерения плотности сосудов на 7 эмбрионах для каждого образца и сравнивают со степенью васкуляризации хориоаллантоисной оболочки в контрольных образцах. Положительным считают результат, при котором средняя величина плотности сосудов в опыте превышает таковую в контроле в 2 и более раза.
В таблице приведены результаты анализа ангиогенной активности химерного белка на ХАО развивающегося куриного эмбриона.
Таблица
Данные ангиогенной активности химерного белка
на ХАО развивающегося куриного эмбриона
| №п.п | Препарат | Число сосудов на единице поверхности (см2) при прямом подсчете под лупой |
| 1 | 0,9% NaCl (контроль) | 38,7+12,3 |
| 2 | Экстракт белков E.coli, не содержащий плазмиду ангиогенина | 36,7+ 9,7 |
| 3 | Химерный ангиогенин (0,1 мг/мл ) | 111,8+ 85,2 |
| 4 | Химерный ангиогенин (0,2 мг/мл) | 72,6+ 21,4 |
Анализ таблицы показывает, что специфическая активность исследуемых образцов положительна, поскольку средняя величина плотности сосудов в опыте превышают таковую в контроле в 2 и более раза [8].
Промышленная применимость
Предлагаемое изобретение может широко использоваться в медицинской промышленности при изготовлении препаратов на основе рекомбинантного химерного белка ангиогенина человека, продуцируемого заявляемым штаммом Escherichia coli BL21(DE3)/pJZZ-A и обладающего свойством формирования кровеносных сосудов человека.
Источники нформации
1. Мертвецов Н.П., Рамазанов Ю.А., Майстренко В.Ф. Химерная плазмида pZZSA для экспрессии химерного белка ангиогенина и штамм Escherichia coli BL 21(DE3) pZZSA - продуцент рекомбинантного химерного белка ангиогенина человека//Патент РФ № 2221043 (13)/C2, 2004.
2. Hatfield G. W. and Roth D.A. Optimizing scaleup yield for protein production: Computationally Optimized DNA Assembly (CODA) and Translation EngineeringTM //Biotechnology Annual Review. V. 13 ISSN 1387-2656 DOI: 10.1016/S1387-2656(07)13002-7.
3. Bivona L., Zou Z., Stutzman N., Sun P.D. Influence of the second amino acid on recombinant protein expression.// Protein Expression and Purification 74 (2010) 248-256 http://dx.doi.org/10.1016/j.pep.2010.06.005.
4. https://www.dna20.com/pJexpress.php.
5. Sambrook V., Fritsch E.E., Maniatis T. Molecular Cloning. A Laboratory Manual 2nd ed Cold Spring Harbor, NY, 1989.
6. Klasburn M., Knighton D., Folkman J. Tumor angiogenesis activity in cells grown in tissue culture //Cancer Research. - 1976, v.36, - p.110-114.
7. Fett J.W., Strudom D.J., Lobb R.R., Alderman E.M. Isolation and characterization of angiogenin, an angiogenic protein from human carcinoma cells.// Biochemistry. - 1985, v. 24, p.5480-5486.
8. Shapiro R, Strydom DJ, Olson KA, Vallee BL. Isolation of angiogenin from normal human plasma.// Biochemistry. -1987, v.26(16), p. 5141-5146.
1. Искусственный ген, кодирующий химерный белок ангиогенина человека, который имеет полную нуклеотидную последовательность, состоящую из последовательно связанных между собой нуклеотидных последовательностей, представленных на фиг.2 как SEQ ID NO 1, SEQ ID NO 2, SEQ ID NO 3 и SEQ ID NO 4, причем SEQ ID NO 1 является последовательностью лидера и служит для оптимизации инициации трансляции мРНК гена химерного белка, SEQ ID NO 2 - последовательность гена, относящаяся к IgG-связывающей области ZZ белка А из Staphylococcus, SEQ ID NO 3 - последовательность, расположенная между последовательностями SEQ ID NO 2 и SEQ ID NO 4, SEQ ID NO 4 является последовательностью гена ангиогенина человека и относится к его кодирующей области.
2. Рекомбинантная плазмида pJZZ-A, представляющая собой вектор pJexpress414, в который по сайтам NdeI/XhoI включен искусственный ген по п.1.
3. Рекомбинантный штамм Escherichia coli BL21(DE3)/pJZZS-A, являющийся продуцентом рекомбинантного химерного белка ангиогенина человека и депонированный в Коллекции бактерий, бактериофагов и грибов Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии «Вектор» под номером В-1250.