Система лучевой терапии с контролем в реальном времени методом магнитного ядерного резонанса
Иллюстрации
Показать всеИзобретение относится к медицинской технике, а именно к способам и системам лучевой терапии. Способ лучевой терапии заключается в подведении импульсного пучка ионизирующего излучения в область объекта в течение импульсных интервалов, получении набора данных выборок данных магнитно-резонансной визуализации и реконструкции набора данных с формированием МР-изображения. Набор данных выборок получают в течение интервала выборки МР-данных, который продолжительнее, чем импульсные интервалы, при этом интервал выборки перекрывает некоторые из импульсных интервалов. Реконструируют набор данных без измененных выборок данных МР-визуализации, полученных в периоды времени получения данных, которые перекрывают импульсные интервалы. Система содержит подсистему лучевой терапии, подсистему МР-визуализации, синхронизатор и реконструирующий процессор. Использование изобретения позволяет сократить время проведения сеанса лучевой терапии. 2 н. и 14 з.п. ф-лы, 3 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области медицинской техники, области техники для визуализации, области техники магнитного резонанса и смежным областям техники. В частности, настоящее изобретение находит применение в лучевой терапии и описано с конкретной ссылкой на нее.
Уровень техники изобретения
В лучевой терапии пространственно заданные дозы ионизирующего излучения подводят к опухоли или другой области, содержащей раковую или другую злокачественную ткань. Развивающиеся и быстро размножающиеся раковые клетки часто более чувствительны к поражению ионизирующим излучением по сравнению с нормальными клетками, и поэтому подводимое излучение, действие которого усиливают повышением дозы, вводимой при правильном планировании, предпочтительно убивает раковую или злокачественную ткань. Тем не менее, ионизирующее излучение вредоносно как для злокачественных, так и для здоровых клеток, и поэтому точное пространственное нацеливание облучения важно для ограничения сопутствующего поражения здоровых клеток. Кроме того, поражением здоровой ткани обычно управляют посредством выполнения лучевой терапии за серию сеансов, продолжающихся в течение нескольких дней, недель или месяцев, с расчетом на то, что заживление здоровой ткани, подвергнутой лучевому поражению, сможет произойти в течение интервалов времени между сеансами терапии.
При лучевой терапии пучок излучения наводят из нескольких угловых положений вокруг объекта так, что в сочетании создают такое пространственное распределение заданной суммарной дозы облучения, которое сконцентрировано на опухоли или другой области, подлежащей терапии. Угловую зону охвата можно обеспечить применением нескольких неподвижных источников излучения, распределенных вокруг объекта, или поворотом источника излучения, например линейного ускорителя (linac), вокруг объекта (т.е., методом томотерапии). Лучевую терапию предварительно планируют для конкретного объекта на основании данных визуализации упомянутого объекта, собранных с использованием компьютерной томографической (CT), магнитно-резонансной (MR) визуализации или другого подходящего средства визуализации. Чтобы обеспечить достаточно точное нацеливание излучения, планирование выполняют с использованием изображений, полученных для конкретного объекта, подлежащего терапии. Опухоль или другую мишень оконтуривают в изображениях вместе с оконтуриванием критических органов или областей, в которых дозу облучения следует ограничивать. Чтобы оптимизировать пространственные профили и интенсивности пучка излучения для концентрирования излучения в мишени с минимизацией облучения критических, но, возможно, нормальных органов или областей, применяют компьютерное моделирование или другие электронные вычисления.
В большинстве существующих установок лучевой терапии CT, MR или другая система визуализации, применяемая для планирования, является физически отдельной от системы лучевой терапии, которая содержит источник или источники ионизирующего излучения. Тогда пространственную систему координат визуализации необходимо совмещать с пространственной системой координат системы лучевой терапии, например, с использованием указательных меток, наклеиваемых на объект. Погрешности совмещения приводят к менее точно нацеленной лучевой терапии, что может снизить ее эффективность при лечении рака и может усилить сопутствующее поражение здоровой ткани. Другая проблема состоит в том, что время между получением данных для планирования и лучевой терапией может составлять много суток или даже больше. В промежутке анатомия пациента может сместиться или измениться из-за наполнения мочевого пузыря, движения пищеварительного тракта, потери или набора веса и т.д.
Кроме того, хотя объект обычно иммобилизуют во время лечения методом лучевой терапии, все же во время лучевой терапии могут случаться различные виды движения объекта, например дыхательные, движение объекта в целом и т.д.
Ввиду приведенных проблем общепризнан факт, что визуализировать объект целесообразно с использованием средства визуализации, физически связанного с системой лучевой терапии. Предложены различные «гибридные» системы такого рода, которые сочетают CT- или MR-систему с системой лучевой терапии. В некоторых установках с MR-визуализацией магнит MR-сканера разделен на две половины, образующие осевой зазор, который вмещает систему лучевой терапии или который позволяет проходить пучку для лучевой терапии (смотри, например, Demsey, публикация заявки США № 2005/0197564 A1; Green, публикация заявки США № 2001/0001807 A1; Fallone и другие, WO 2007/045076 A1; Lagendijk и другие, WO 2004/024235 A1). Другие компоненты MR-сканера, например градиентные катушки и радиочастотные катушки, могут быть аналогично разделены или расположены для размещения за пределами зазора или могут быть выполнены достаточно тонкими или из подходящих материалов, чтобы пучок для лучевой терапии мог проходить сквозь компоненты без существенного ослабления. В данной системе средства как визуализации, так и лучевой терапии совместно используют одну систему координат, что исключает или упрощает составляющую совмещения процесса планирования лучевой терапии. Кроме того, планирование лучевой терапии можно выполнять непосредственно перед каждым сеансом лучевой терапии, что минимизирует погрешность, вызываемую изменениями анатомии пациента между планированием и терапией.
Чтобы справиться с проблемой возможного перемещения объекта во время сеанса лучевой терапии, рассматривали применение данной гибридной системы для выполнения визуализации во время сеанса лучевой терапии, чтобы обнаруживать движение объекта. Однако при одновременном выполнении визуализации и лучевой терапии возникают затруднения. Компьютерные томографические (CT) сканеры мало пригодны для упомянутой совместной операции из-за сложности или невозможности физического создания компоновки, в которой рентгеновский пучок CT-сканера исследует пространственную область, одновременно подвергаемую лучевой терапии. Метод MR признали более пригодным в качестве возможного метода визуализации для одновременной визуализации. Однако до настоящего времени находили, что помехи, создаваемые системой лучевой терапии, препятствуют получению качественных MR-изображений во время лучевой терапии.
В заявке Fallone et al., WO2007045076 предложено чередовать операции MR-визуализации и лучевой терапии посредством блокирования генерации импульсов линейным ускорителем (linac) в течение промежутка времени получения MR-данных. Это означает, что лучевую терапию не выполняют во время визуализации. Даже для быстрых последовательностей трехмерной визуализации в реальном времени число интервалов выборки данных визуализации является достаточно большим, что существенно увеличивает рабочий цикл источника излучения при упомянутом подходе и тем самым продлевает сеанс терапии.
Ниже предлагаются новые и усовершенствованные устройства и способы, которые решают вышеупомянутые и другие проблемы.
Сущность изобретения
В соответствии с одним аспектом изобретения предлагается способ лучевой терапии, содержащий: этап выполнения лучевой терапии посредством подведения импульсов излучения в область объекта в течение импульсных интервалов; этап получения набора данных выборок данных магнитно-резонансной (MR) визуализации из области объекта в течение, по меньшей мере, одного интервала выборки MR-данных, который продолжительнее, чем импульсные интервалы, при этом, по меньшей мере, один интервал выборки MR-данных перекрывает, по меньшей мере, некоторые из импульсных интервалов; и этап реконструкции набора данных без измеренных выборок данных MR-визуализации, полученных в периоды времени получения данных, которые перекрывают импульсные интервалы, для формирования реконструированного MR-изображения.
В соответствии с другим аспектом изобретения предлагается система лучевой терапии, содержащая: подсистему лучевой терапии, выполненную с возможностью выполнения лучевой терапии посредством подведения импульсов излучения в область объекта с импульсными интервалами; подсистему магнитно-резонансной (MR) визуализации, выполненную с возможностью получения набора данных выборок данных MR-визуализации из области объекта в течение, по меньшей мере, одного интервала выборки MR-данных, который продолжительнее, чем импульсные интервалы, при этом, по меньшей мере, один интервал выборки MR-данных перекрывает, по меньшей мере, некоторые из импульсных интервалов; синхронизатор, выполненный с возможностью идентификации выборок данных MR-визуализации из набора данных, для которых периоды времени получения данных перекрывают импульсные интервалы; и реконструирующий процессор, выполненный с возможностью реконструкции набора данных без измеренных значений выборок данных MR-визуализации, идентифицированных как имеющие периоды времени получения данных, перекрывающие импульсные интервалы, для формирования реконструированного MR-изображения.
Одно из преимуществ заключается в обеспечении более коротких сеансов лучевой терапии.
Другое преимущество заключается в обеспечении контроля в реальном времени лучевой терапии.
Другое преимущество заключается в обеспечении лучевой терапии, адаптивно регулируемой в реальном времени.
Дополнительные преимущества станут очевидными для специалистов со средним уровнем компетентности в данной области техники после прочтения и изучения нижеследующего подробного описания.
Краткое описание чертежей
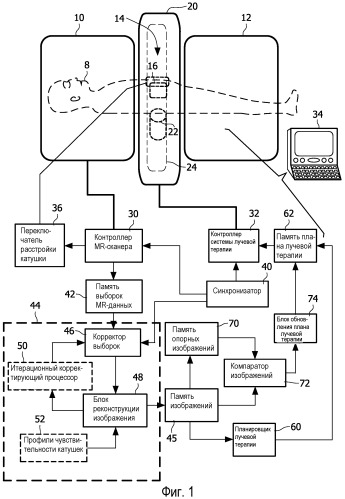
Фигура 1 - схематическое представление гибридной системы, объединяющей систему лучевой терапии с магнитно-резонансным (MR) сканером и дополнительно содержащей компоненты, выполненные с возможностью проведения одновременной лучевой терапии и MR-визуализации.
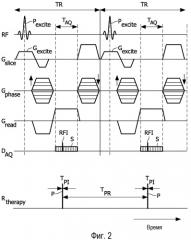
Фигура 2 - схематическое представление импульсной последовательности для магнитно-резонансной визуализации в режиме градиентного эхо, пригодной для получения одной линии k-пространства, вместе с импульсами пучка для лучевой терапии.
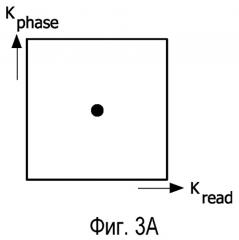
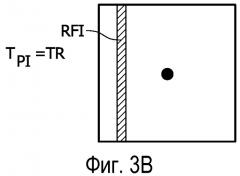
Фигура 3A - схематическое представление выборки данных двумерного слоя k-пространства, а фигуры 3B, 3C, 3D и 3E - схематические представления выборок данных двумерного слоя k-пространства, показанного на фигуре 3A, с пропусками в выборке данных, обусловленной работой в импульсном режиме источника излучения системы лучевой терапии.
Подробное описание вариантов осуществления
Как показано на фигуре 1, гибридная система вмещает объект 8 (изображенный пунктиром) для лучевой терапии. Показанный объект 8 является человеком, но предполагается также возможность построения вариантов осуществления для обеспечения лучевой терапии объектов-животных. Гибридная система содержит магнитно-резонансный (MR) сканер, содержащий магнит, сформированный из двух участков 10, 12 магнита, выполненных с возможностью содержания кольцевого зазора 14 между ними. MR-сканер содержит другие компоненты, например катушки для формирования градиентов магнитного поля (не показанные, обычно расположенные внутри магнитов 10, 12) и, по меньшей мере, одну радиочастотную катушку, например, в типичном случае, по меньшей мере, одну локальную радиочастотную катушку 16 (изображенную пунктиром).
Система лучевой терапии содержит кожух или другую опору, или корпус 20, служащий опорой для источника излучения, например схематически показанного линейного ускорителя (linac) 22 (изображенного пунктиром), расположенного с возможностью перемещения или поворота вокруг объекта 8 по кольцевому гентри или направляющему устройству 24 (изображенному пунктиром), чтобы давать возможность облучения объекта 8 из любого положения на 360° окружности. Вместо показанной томографической схемы расположения источника linac 22, 24 система лучевой терапии может содержать множество неподвижных источников излучения, размещенных в фиксированных положениях вокруг объекта 8, для создания возможности одновременного облучения из нескольких (фиксированных) угловых положений.
Любые компоненты MR-системы, которые расположены на линии визирования между источником 22 излучения (или, в более общем случае, кольцевой траекторией 24 поворота источника излучения) и объектом 8, изготовлены из надлежащего материала или материалов или являются достаточно тонкими, чтобы допускать прохождение излучения, генерируемого источником 22 излучения, через данные компоненты MR-системы и в объект 8, без существенного ослабления в компонентах MR-системы. Например, по меньшей мере, одна радиочастотная катушка 16 может быть изготовлена из тонких медных лент, смонтированных на пропускающей излучение плате и окруженных дополнительным пропускающим излучение кожухом (данные субкомпоненты не показаны). В альтернативном варианте, если компонент MR-системы перекрывает небольшой диапазон углов обзора источника излучения, такой компонент MR-системы можно устанавливать в месте, соответствующем угловому положению или промежутку, в которых источник 22 излучения не генерирует импульсы излучения для терапии. Следует отметить, что хотя показанная MR-система содержит два отдельных участка 10, 12 магнита, обеспечивающих кольцевой зазор 14 для пропускания излучения для терапии, предполагается также, что магнит MR-системы может быть непрерывным по всей области зазора 14, но выполненным достаточно тонким в данной области и/или из достаточно прозрачного для материала, чтобы пропускать излучение для терапии, без существенного ослабления.
Гибридная система дополнительно содержит надлежащие электронные схемы управления, например контроллер 30 MR-сканера, выполненный с возможностью управления подсистемой MR-сканера, чтобы получать данные MR-визуализации, контроллер 32 системы лучевой терапии, выполненный с возможностью управления подсистемой лучевой терапии, чтобы выполнять лучевую терапию посредством подведения импульсов излучения в область объекта 8 в течение импульсных интервалов, которые разделены периодами повторения импульсов, и компьютер 34 или другой пользовательский интерфейс, обменивающийся информацией с контроллерами 30, 32, чтобы давать радиологу или другому пользователю возможность управления подсистемами MR-сканера и лучевой терапии. Несмотря на изображение в виде отдельных компонентов в некоторых вариантах осуществления предполагается, что один или оба контроллера 30, 32 могут быть реализованы компьютером 34, исполняющим подходящее программное обеспечение управления. Электронные схемы, показанные для примера на фигуре 1, дополнительно содержат переключатель 36 расстройки катушки, связанный с, по меньшей мере, одной радиочастотной катушкой 16, для расстройки катушки во время радиочастотного возбуждения. В вариантах осуществления, использующих переключатель 36 расстройки, радиочастотная катушка или катушки 16 служит только в качестве приемной катушки, а для радиочастотного возбуждения служит другая радиочастотная катушка, например катушка для всего тела (не показанная). Хотя переключатель 36 расстройки изображен на фигуре 1 в виде отдельного компонента, предполагается, что переключатель 36 расстройки или его секции может (могут) быть встроен(ы) в контроллер 30 MR-сканера и/или радиочастотную катушку или катушки 16 или оба данных компонента.
Изображенная гибридная система является примерной. Предполагаются также возможными другие гибридные системы с геометрией, позволяющей MR-сканеру визуализировать объект, размещенный для лучевой терапии. В другом примере, если система лучевой терапии использует множество неподвижных источников излучения, то магнит MR-сканера может содержать непрерывный цилиндр с множеством отверстий в фиксированных положениях для пропускания излучения для терапии, генерируемого неподвижными источниками излучения.
Для управления MR-визуализацией, при одновременном подведении импульсов излучения для терапии для осуществления лучевой терапии с контролем методом MR-визуализации в реальном времени, в настоящей заявке рассмотрено влияние импульсов излучения, подводимых источником 22 излучения, на данные MR-визуализации.
Как показано на фигуре 2, источник 22 излучения выдает импульсный пучок ионизирующего излучения, например высокоэнергетических гамма-частиц (т.е. гамма-фотонов), или альфа-частиц, или бета-частиц, или фотонов, или рентгеновских фотонов, или чего-то подобного, направленного в область объекта 8, содержащую опухоль или другое злокачественное образование, проходящее терапию. Ионизирующее излучение взаимодействует с опухолевой тканью и поражает ее. Взаимодействие ионизирующего излучения с тканью создает также поток вторичных электронов, которые дополнительно участвуют в поражении ткани. Упомянутый всплеск вторичных электронов испускает импульс радиочастотного шума, который вызывает радиочастотные помехи, влияющие на чувствительную приемную систему MR-сканера. Радиочастотные помехи снижают качество данных MR-визуализации, полученных в течение импульсного интервала, что снижает качество реконструированного MR-изображения. На фигуре 2 схематически показана временная диаграмма излучения на выходе типичного источника linac в виде самой нижней кривой, обозначенной «Rtherapy». Источник linac излучает гамма-излучение в импульсном режиме, в котором каждый импульс P пучка гамма-излучения имеет продолжительность импульса или импульсный интервал TpI, который обычно имеет значение порядка 10 микросекунд, хотя предполагаются возможными также более короткие или длинные импульсные интервалы, и импульсы повторяются с интервалом TPR повторения импульсов, который обычно имеет значение порядка 0,1- 10 миллисекунд, хотя предполагаются возможными также более длинные или короткие интервалы повторения импульсов. Импульсы P схематически показаны на фигуре 2 в виде прямоугольных импульсов, но в общем импульсы P могут иметь разные формы. В некоторых вариантах осуществления каждый импульс P содержит высокочастотную модуляцию с частотой порядка 1 ГГц, хотя предполагается также возможность более высоко- или низкочастотной модуляции или отсутствие модуляции. Упомянутая частота намного выше диапазона частот MR и по расчетам не должна создавать существенные помехи MR-визуализации.
На фигуре 2 представлена также характерная MR-последовательность градиентного эхо такого типа, который иногда используют для визуализации. Хотя изображение и описание приведены, в качестве примера, для последовательности градиентного эхо, следует понимать, что при MR-визуализации можно использовать, по существу, любой тип последовательности для визуализации, например последовательность эхо-планарной визуализации (EPI), последовательность для визуализации в режиме быстрого спин эхо (TSE) и т.п. На фигуре 2 представлены диаграммы наглядной последовательности градиентного эхо в виде функции времени: подаваемые радиочастотные импульсы (кривая, обозначенная «RF»); слой-селектирующий градиент магнитного поля (кривая, обозначенная «Gslice»); фазо-кодирующий градиент магнитного поля (кривая, обозначенная «Gphase»); считывающий градиент магнитного поля (кривая, обозначенная «Gread»); и интервалы получения данных (кривая, обозначенная «DAQ»). Наглядная последовательность градиентного эхо использует слой-селектирующее радиочастотное возбуждение, содержащее радиочастотный импульс Pexcite и одновременно создаваемый слой-селектирующий градиент Gexcite магнитного поля. За данными Pexcite, Gexcite возбуждения следуют градиенты магнитного поля кодирующие фазу и считывание в слое (изображенные в виде диаграммных кривых «Gphase» и «Gread», но не обозначенные на фигуре 2). Выборки S данных MR-визуализации получают из области объекта 8 в течение интервала TAQ выборки MR-данных. При выборке MR-данных получают сплошную линию k-пространства, содержащую, например, 256 выборок на интервале TAQ выборки MR-данных. То есть, выборки S данных MR-визуализации содержат одну линию k-пространства, например, 256 выборок в некоторых вариантах осуществления. Вся импульсная последовательность, содержащая Pexcite, Gexcite возбуждения, получение выборок S и соответствующие градиенты магнитного поля, занимает интервал TR времени повторения, и приведенная последовательность градиентного эхо повторяется для получения каждой линии k-пространства, пока не будет получен полный набор данных, например, 256×256 выборок. На диаграмме на фигуре 2 показаны два повторения последовательности градиентного эхо (т.е. временной интервал 2×TR).
В неограничивающем количественном примере TR может быть порядка 34 миллисекунд, и TAQ может быть порядка 1 миллисекунды (1000 микросекунд). Если в течение TAQ получают 256 выборок k-пространства, то каждую выборку данных MR-визуализации получают в течение, приблизительно, 4 микросекунд. Данные значения приведены только для наглядности, и можно использовать другие интервалы выборок и времени. Как уже отмечено, один импульс Р излучения для терапии обычно занимает импульсный интервал TpI приблизительно 10 микросекунд, который соответствует приблизительно 3 выборкам данных MR-визуализации в вышеописанном численном примере.
Как показано на фигуре 2, импульс Р излучения для терапии создает радиочастотные помехи RFI в течение импульсного интервала TpI. Упомянутые радиочастотные помехи обычно возникают в виде большого пика или острого импульса в полученных данных MR-визуализации. В результате, упомянутые выборки данных MR-визуализации, для которых периоды времени получения данных перекрывают импульсные интервалы TpI, являются искаженными. Реконструкция набора данных, содержащего упомянутые искаженные выборки данных MR-визуализации, может, по расчетам, синтезировать изображения со значительными артефактами.
Однако в настоящей заявке считается, что искажены только такие выборки данных MR-визуализации, для которых периоды времени получения данных перекрывают импульсные интервалы TpI. Выборки данных MR-визуализации, для которых периоды времени получения данных не перекрывают импульсные интервалы TpI, не искажены и являются применимыми данными. Поскольку интервал TPR повторения импульсов имеет значение порядка 0,1-10 миллисекунд, и интервал TAQ выборки MR-данных в данном наглядном численном примере имеет значение порядка 1 миллисекунды, то в данном наглядном численном примере существует обычно менее чем 10 импульсных интервалов TpI, перекрывающихся с интервалом TAQ выборки MR-данных, и, возможно, всего один или ни одного перекрывающегося импульсного интервала TpI. Из вышеизложенного следует, что приблизительно от 88% до 100% выборок данных MR-визуализации, полученных на интервале TAQ выборки MR-данных, являются применимыми данными, даже когда лучевую терапию выполняют одновременно с получением данных MR-визуализации.
Как было показано на фигуре 1, гибридная система дополнительно содержит синхронизатор 40, выполненный с возможностью идентификации выборок данных MR-визуализации из набора данных визуализации, для которых периоды времени получения данных перекрывают импульсные интервалы. В некоторых вариантах осуществления синхронизатор 40 дополнительно выполнен с возможностью выбора, по меньшей мере, какого-то одного из (i) периода TR времени повторения получения набора данных (например, последовательности градиентного эхо в наглядном примере на фигуре 2) и (ii) интервала TPR времени повторения импульсов, разделяющего импульсные интервалы TpI, чтобы определять, какие выборки данных MR-визуализации из набора данных имеют периоды времени получения, перекрывающие импульсные интервалы. Выборки данных MR-визуализации сохраняются в памяти 42 выборок MR-данных. Реконструирующий 44 процессор выполнен с возможностью реконструкции набора данных без измеренных значений выборок данных MR-визуализации, идентифицированных синхронизатором 40 как имеющие периоды времени получения, перекрывающие импульсные интервалы, чтобы формировать реконструированное MR-изображение. Реконструированное изображение соответственно сохраняется в памяти 45 изображений.
Вставка измеренных значений для выборок данных MR-визуализации, идентифицированных синхронизатором 40 как имеющие периоды времени получения, перекрывающие импульсные интервалы, можно исключить включением в состав корректора 46 выборок, который заменяет искаженные выборки данных расчетными выборками данных для упомянутых выборок данных MR-визуализации, и блок 48 реконструкции изображения, который реконструирует набор данных, содержащий вставленные неизмеренные или расчетные значения. Вставленные неизмеренные или расчетные значения могут быть дополняющими нулевыми значениями или средними значениями, полученными усреднением измеренных значений соседних выборок данных MR-визуализации, или могут быть сформированными или рассчитанными иначе.
В некоторых вариантах осуществления применяют итеративную процедуру реконструкции. Корректор 46 выборок вставляет неизмеренные или расчетные значения выборок данных MR-визуализации, вычисленные как дополняющие нулевые значения или соседние усредненные значения. Блок 48 реконструкции изображения реконструирует упомянутый исходный набор данных для формирования исходного реконструированного изображения. Затем итерационный корректирующий процессор 50 вычисляет и вставляет скорректированные неизмеренные или расчетные значения вместо упомянутых выборок данных MR-визуализации, идентифицированных синхронизатором 40 как имеющие периоды времени получения, перекрывающие импульсные интервалы TpI. Корректирующий процессор 50 может вычислять скорректированные неизмеренные или расчетные значения, например, путем выполнения пространственной фильтрации реконструированного изображения и формирования смоделированного набора данных выборок данных MR-визуализации из реконструированного и отфильтрованного MR-изображения и коррекции неизмеренных или расчетных значений выборок данных MR-визуализации на основании созданного смоделированного набора данных. Моделирование использует «инверсную» процедуру реконструкции изображения, которая соответствует пространственному кодированию, применяемому при получении выборок данных MR-визуализации, например, алгоритм Фурье-преобразования, восстановления изображения по проекциям или пересчета данных на равномерную сеть. Затем блок 48 реконструкции изображений реконструирует набор данных со скорректированными вставленными неизмеренными или расчетными значениями выборок данных MR-визуализации, чтобы создать реконструированное MR-изображение более высокого качества. Упомянутую процедуру можно повторять или более раз, чтобы итерационно повышать качество неизмеренных или расчетных значений выборок данных MR-визуализации и, тем самым, итерационно повышать качество всего реконструированного изображения.
В соответствии с другим решением вставка измеренных значений для выборок данных MR-визуализации, идентифицированных синхронизатором 40 как имеющие периоды времени получения, перекрывающие импульсные интервалы, можно исключить отбрасыванием упомянутых выборок данных MR-визуализации, так что набор данных оказывается с недостаточным числом выборок, и компенсацией недостаточного числа выборок при реконструкции на основании дополнительной информации, обеспечиваемой множеством радиочастотных приемных катушек, имеющих разные чувствительности катушек. Такой подход аналогичен методу SENSE, SMASH или GRAPPA (смотри, например, Pruessmann и другие MRM том 42 стр. 952-62 (1999); Sodickson и другие MRM том 38 стр. 591-603 (1997); Griswold и другие MRM том 47 стр. 1202-10 (2002)). В данном случае, по меньшей мере, одна радиочастотная катушка 16 содержит множество радиочастотных приемных катушек, имеющих разные чувствительности катушек. Например, радиочастотные катушки 16 могут составлять комплект фазированных катушек или катушек типа SENSE. Профили 52 чувствительности катушек создаются для катушек множества радиочастотных приемных катушек с использованием подходящих калибровочных импульсных последовательностей таким же образом, как создаются профили чувствительности катушек для использования при визуализации по методу SENSE (с использованием чувствительности изображения). Затем процессор 48 реконструкции изображения выполняет компенсацию недостаточного числа выборок для реконструкции на основании дополнительной информации, содержащейся в профилях 52 чувствительности катушек.
Как также показано на фигуре 1, MR-подсистема, содержащая реконструирующий процессор 44, выполняет магнитно-резонансным методом в реальном времени контроль процесса лучевой терапии, выполняемого подсистемой лучевой терапии. Под контролем «в реальном времени» понимается, что получение данных MR-визуализации выполняется параллельно с лучевой терапией таким образом, что импульсные интервалы TpI перекрываются с последовательностью MR-визуализации и иногда перекрываются с интервалами TAQ выборки MR-данных, которые более продолжительны, чем импульсные интервалы TpI. Синхронизатор 40 функционально связывает подсистемы MR-визуализации и лучевой терапии посредством идентификации того, и в некоторых вариантах осуществления управления тем, какие выборки данных MR-визуализации имеют периоды времени получения данных, которые перекрывают импульсные интервалы TpI. Реконструирующий процессор 44 вставляет неизмеренные или расчетные значения для таких выборок данных MR-визуализации, которые идентифицированы как имеющие периоды времени получения, перекрывающие импульсные интервалы, или отбрасывает такие выборки данных MR-визуализации, которые имеют периоды времени получения, перекрывающие импульсные интервалы TpI, и, соответственно, способен реконструировать точное MR-изображение несмотря на искажение данных, обусловленное RFI, вызванными импульсами излучения для терапии.
В некоторых вариантах осуществления синхронизатор 40 функционально связан с контроллером 30 MR-сканера, чтобы идентифицировать для контроллера 30 MR-сканера, когда будет иметь место импульс излучения для терапии. В данных вариантах осуществления контроллер 30 MR-сканера, по желанию, выполняет такую операцию, как побуждение переключателя 36 расстройки осуществлять расстройку, по меньшей мере, одной радиочастотной катушки 16 во время соответствующего импульсного интервала TpI.
Например, расстройка может уменьшить величину радиочастотных помех (RFI), вызванных импульсом терапии и принимаемых катушкой или катушками 16. Если интенсивность RFI является достаточно высокой, упомянутая расстройка может быть также полезной для предотвращения перегрузки приемной катушки или катушек 16 под действием RFI и возможного повреждения катушки или катушек 16, обусловленного упомянутой перегрузкой.
С другой стороны, если радиочастотная катушка или катушки 16 вряд ли могут быть повреждены действием RFI, то предполагается пренебречь связью между синхронизатором 40 и контроллером 30 MR-сканера и получать измеренные значения обычным образом для таких выборок данных MR-визуализации, которые идентифицируются как имеющие периоды времени получения, перекрывающие импульсные интервалы. Затем упомянутые измеренные значения заменяются корректором 46 выборок или отбрасываются из набора данных (с недостаточным числом выборок), используемого при реконструкции изображения, и поэтому фактические измеренные значения не важны для реконструкции изображения.
Контроль методом MR-визуализации можно использовать для совершенствования лучевой терапии различным образом. Во время одной предполагаемой последовательности выполняемых действий сеанса лучевой терапии MR-подсистему сначала применяют перед включением импульсов излучения, чтобы получить, по меньшей мере, одно опорное изображение, которое используется планировщиком 60 лучевой терапии для создания плана лучевой терапии, который сохраняется в памяти 62 планов лучевой терапии. Планировщик 60 лучевой терапии может использовать, по существу, любой тип программного обеспечения или алгоритма планирования лучевой терапии для планирования томографической или моделированной по интенсивности лучевой терапии. При типичном подходе опорное MR-изображение или изображения отображаются на пользовательском интерфейсе 34, и радиолог или другой пользователь использует указательное устройство для задания: (i) инструмента лассо или другого оконтуривания опухоли или другой области, содержащей злокачественное образование; и (ii) инструмента лассо или другого оконтуривания любых критических органов или областей, в которых следует ограничивать лучевую нагрузку. Пользователь задает ограничения, например дозу ограничения, подлежащую доставке в область злокачественного образования, пределы максимальных доз излучения для критического органа или органов, предельные значения времени для сеансов лучевой терапии и т.д. На основании априорно известных характеристик поглощения излучения различными тканями объекта, идентифицированными на опорном изображении или изображениях, программное обеспечение моделирует профиль лучевой нагрузки для начальной интенсивности пучка излучения, дополнительный профиль пучка и томографическую схему. Такие параметры, как интенсивность пучка (или интенсивность составляющих пучков в случае модулированного профиля пучка), томографическая схема и т.п., итерационно оптимизируются, пока смоделированный профиль лучевой нагрузки не удовлетворит ограничениям, заданным пользователем. Подходящее программное обеспечение для планирования лучевой терапии выпускается, например, компанией Philips Medical Systems, Eindhoven, Нидерланды.
Опорное изображение или изображения, используемые для планирования излучения, также, при желании, сохраняются в памяти 70 опорных изображений. Подсистема лучевой терапии исполняет план лучевой терапии, сохраненный в памяти 62 плана лучевой терапии. MR-подсистема получает MR-изображения во время исполнения плана лучевой терапии, чтобы обеспечивать контроль объекта 8 в реальном времени 8 во время лучевой терапии. Контрольные MR-изображения в реальном времени характеризуются высоким качеством изображения благодаря операции коррекции, выполняемой реконструирующим процессором 44, по замене или отбрасыванию таких выборок данных MR-визуализации, для которых периоды получения данных перекрывают импульсные интервалы. Контрольные изображения в реальном времени сравниваются с опорным изображением или изображениями, сохраненными в памяти 70 опорных изображений, посредством компаратора 72 изображений, чтобы идентифицировать любые изменения в объекте, которые произошли со времени этапа планирования лучевой терапии. Упомянутые изменения могут содержать, например, перемещение, эффекты дыхания, изменения распределения жидкостей в объекте и т.д.
Информацию, выдаваемую компаратором 72 изображений, можно использовать различными способами. В некоторых вариантах осуществления пользовательский интерфейс 34p обеспечивает звуковой и/или визуально воспринимаемый предупредительный сигнал для радиолога или другого пользователя в случае, когда контрольные изображения указывают, что объект переместился или иначе значительно изменился. Предполагается, что тогда радиолог или другой пользователь должен принять меры по обстоятельствам, например, посредством изменения положения объекта 8, коррекции плана лучевой терапии и т.д.
В некоторых вариантах осуществления предполагается возможность использования информации, выдаваемой компаратором 72 изображений, чтобы реализовать автоматизированную адаптивную лучевую терапию. В данных вариантах осуществления блок 74 обновления плана лучевой терапии получает информацию, выданную компаратором 72 изображений, и вносит любые соответствующие обновления в план лучевой терапии, содержащийся в памяти 62 плана лучевой терапии. Обновленный план лучевой терапии корректирует последующие выдаваемые импульсы излучения для адаптации плана лучевой терапии с учетом идентифицированного движения объекта. Например, в заявке McNutt и другие, WO 2003/099380 предложены некоторые итерационные методы, пригодные для обновления плана луче