Биоискусственная система
Иллюстрации
Показать всеИзобретение может быть использовано в регенеративной медицине для создания живой ткани для восстановления функций органа, потерявшего дееспособность из-за травмы, заболевания или старения, и основано на использовании клеточных механизмов восстановления. Биоискусственная система содержит биосовместимый носитель для размещения культур животных клеток, включающий: внешний матрикс, на котором размещены культуры животных клеток и который состоит из пористого гидрогеля с введенной в него трехмерной сеткой из биорезорбируемого волокнистого полимера; внутренний керн для размещения питательных сред, выполненный из биосовместимого пористого полимерного материала; разделительную мембрану, покрывающую керн с возможностью пропускания молекул питательной среды к матриксу с клеточными культурами; экстракорпоральный дренажный резервуар и экстракорпорально размещенные резервуары с питательными средами. Внутренний объем носителя дренажной трубкой соединен с дренажным экстракорпоральным резервуаром. Резервуары с питательными средами трубками соединены с внутренним объемом носителя, включающего керн. Изобретение обеспечивает оперативную интеграцию имплантата в организм за счет автономного питания имплантата ресурсами и биорегуляторных факторов. 3 ил.
Реферат
Предлагаемое изобретение - имплантируемая биоискусственная система с экстракорпоральным питанием - может быть использовано в регенеративной медицине. Регенеративная медицина - конвергентная отрасль медицинской науки и высоких технологий, направленная на создание живой ткани для восстановления функций органа, потерявшего дееспособность из-за травмы, заболевания или старения. Она базируется, в частности, на использовании клеточных механизмов восстановления. Важнейшей составляющей технологической базы регенеративной медицины являются имплантируемые биоискусственные системы. Благодаря имплантации таких устройств в больной орган, в нем возбуждаются регенеративные процессы выздоровления. Регенеративная медицина является основой медицины, способной заменить трансплантацию донорских органов имплантацией биоискусственных систем.
В данном изобретении понятие «биоискусственная система» определяет клеточную культуру или живую ткань, развивающуюся на объемном трехмерно структурированном биосовместимом носителе - матриксе искусственного или гибридного происхождения. Совместно с клеточными средами в состав биоискусственной системы могут входить необходимые неклеточные лекарственные препараты, питательные материалы и среды. Необходимые клеточные среды могут быть изначально размещены и развиты на матриксе в биореакторе или возникать на матриксе после его имплантации в организм. В зависимости от выполняемой функции биоискусственной системы ее матрикс, при необходимости, может быть биорезорбируемым.
Основные функции матрикса в имплантированной биоискусственной системе: механическое, анкерное, алиментарное, кислородное и лекарственное поддержание развивающейся трехмерной культуры живых здоровых клеток, обеспечение их пролиферации и дифференциации, обеспечение возможности васкуляризации и иннервации образующейся живой ткани, управляемая безопасная деградация за счет процессов метаболизма. Все эти функции должны обеспечить клеточному имплантату возможность выработки и распространения по органу и всему организму комплекса сигнальных факторов, стимулирующих и поддерживающих регенеративные процессы в больном органе. Комплекс сигнальных факторов, в идеале, должен контролироваться извне, видоизменяясь в соответствии с реальным ходом лечебного процесса.
Трудность осуществления метода состоит в том, что сразу после имплантации биоискусственная система, вводимая в ткань больного органа путем хирургического вмешательства, попадает в раневое пространство с локально нарушенной сетью капиллярного кровообращения. Кроме того, раневое пространство и имплантат оказываются в условиях естественной репаративно-воспалительной реакции организма с последующим формированием там изолирующей капсулы из соединительной ткани. В таких сложных начальных условиях выживание, пролиферация и необходимая дифференциация имплантированных клеточных культур подавлены из-за недостаточности важнейших факторов питания, прежде всего - кислорода. Некоторые факторы питания, например растворимые сахара и ряд лекарственных препаратов, могут быть имплантированы вместе с клеточными культурами взапас, поскольку эти вещества находятся в конденсированной фазе, и средства их регулируемого активирования существуют. В то же время важнейшее для жизни газообразное вещество, кислород, не запасается в организме в достаточном количестве.
Решение проблемы критического влияния начальных условий на функционирование имплантированной биоискусственной системы может быть найдено на пути применения временного внешнего, экстракорпорального питания имплантированных клеточных культур. В этом подходе клеточная культура на носителе имплантируется в больной орган, а системы питания, управления и диагностики, связанные с имплантатом по трубкам, размещаются экстракорпорально. В течение всего периода лечения, после имплантации, развивающаяся клеточная культура остается на связи с экстракорпоральными системами питания, управления и диагностики. По завершении лечения имплантат удаляется или биорезорбирует в заданном порядке.
Аналогом нашего предложения выбирем известный патент RU №2401084 со следующей формулой изобретения:
1. Устройство для получения имплантированного биологического материала, включающее:
a) пористую наружную стенку, ограничивающую внутреннее пространство, где указанная наружная стенка имеет пористость, за счет которой обеспечивается васкуляризация, указанное внутреннее пространство обеспечивает хранение имплантированного биологического материала, включающего выбранный тканевой/клеточный продукт и допуская обогащение имплантированного биологического материала сосудистой тканью со стороны наружной пористой стенки;
b) жидкостный коллектор в сборе для инфузии в указанное пространство по крайней мере одного из иммуносупрессивных и/или ростовых факторов, в котором указанный коллектор в сборе включает по крайней мере одну продольно расположенную трубку для распространения среды в указанное пространство и в котором по крайней мере одна указанная трубка является микроперфорированной для распространения среды по ее длине; и
c) насос или резервуар для подобной среды, функционально соединенный с указанным коллектором в сборе.
2. Устройство по п.1, дополнительно включающее корпус сердечника для расположения в указанном пространстве для образования периферического промежутка между сердечником и стенкой.
3. Устройство по п.2, в котором указанный коллектор в сборе сформирован отдельно от указанного корпуса сердечника и указанное пространство включает либо указанный корпус сердечника, либо указанный коллектор в сборе.
4. Устройство по п.3, в котором указанный коллектор в сборе включает закрывающий колпачок.
5. Устройство по п.4, в котором есть множество трубок для распространения среды.
6. Устройство по п.2, в котором корпус сердечника и коллектор в сборе имеют комплементарную конфигурацию для одновременного размещения внутри пространства.
7. Устройство по п.6, в котором коллектор в сборе и корпус сердечника помещены в указанное пространство с противоположных торцевых концов указанного устройства.
8. Устройство по п.6, в котором указанный коллектор в сборе включает закрывающий колпачок.
9. Устройство по п.6, в котором есть множество трубок для распространения среды.
10. Устройство по п.1, в котором пористая наружная стенка имеет первую и вторую параллельные боковые стенки.
11. Устройство по п.10, в котором указанные параллельные боковые стенки изогнуты.
12. Устройство по п.10, в котором пористая наружная стенка имеет третью и четвертую выпукло изогнутые боковые стенки.
13. Устройство по п.7, в котором корпус сердечника имеет встроенные трубки, функционально соединенные с инфузионной системой, где указанные трубки способны доставлять физиологический раствор или выбранный тканевый/клеточный продукт в указанное внутреннее пространство во время удаления сердечника, либо для облегчения смещения сердечника, либо для одновременной загрузки выбранного клеточного продукта.
14. Устройство по п.13, в котором коллектор в сборе включает по меньшей мере одну продольно расположенную трубку для распространения среды, где встроенные трубки корпуса сердечника расположены параллельно и чередуются с трубками коллектора в сборе.
15. Способ имплантации биологического материала пациенту, включающий:
a) предоставление устройства для получения биологического материала, где указанное устройство включает:
i) пористую наружную стенку, ограничивающую внутреннее пространство, где указанная наружная стенка имеет пористость, за счет которой обеспечивается васкуляризация, указанное внутреннее пространство обеспечивает хранение имплантированного биологического материала, включающего выбранный тканевой/клеточный продукт, допуская обогащение имплантированного биологического материала сосудистой тканью со стороны наружной пористой стенки;
ii) жидкостный коллектор в сборе для инфузии по крайней мере одной из сред с иммуносупрессивным фактором и/или фактором роста в указанное внутреннее пространство, в котором указанный коллектор в сборе включает по крайней мере одну продольно расположенную трубку для распространения среды в указанное пространство и в котором по крайней мере одна указанная трубка является микроперфорированной для распространения среды по ее длине; и
iii) насос или резервуар для подобной среды, оперативно соединенный с указанным коллектором в сборе;
b) имплантацию указанного устройства в выбранном расположении у пациента;
c) обеспечение возможности прорастания ткани через указанную пористую наружную стенку в указанное внутреннее пространство;
d) размещение биологического материала, включающего выбранный тканевой/клеточный продукт в пределах указанного внутреннего пространства; и
e) инфузию по крайней мере одной из сред с иммуносупрессивным фактором и/или фактором роста в указанное внутреннее пространство.
16. Способ по п.15, в котором указанная имплантация включает имплантацию указанного устройства в положении, выбранном из группы, состоящей из внутрисальникового, подкожного и интраперитонеального.
17. Способ по п.15, дополнительно включающий расположение корпуса сердечника в указанном внутреннем пространстве таким образом, чтобы образовался периферический промежуток между сердечником и стенкой, после чего указанное врастание ткани происходит в указанный периферический промежуток.
18. Способ по п.17, дополнительно включающий удаление указанного сердечника после указанного возможного врастания ткани и до указанного расположения биологического материала.
19. Способ по п.15, в котором указанное расположение биологического материала предшествует указанной имплантации.
В указанном патенте RU №2401084 запатентована система, включающая экстракорпорально расположенные резервуары с питательными средами, соединенные с внутренним объемом носителя, что обеспечивает лучшую интеграцию имплантата в организм за счет автономного питания.
Один недостаток устройства по патенту RU №2401084 состоит в том, что оно предложено для работы только с жидким клеточно-тканевым биоматериалом, расположенным внутри полости, ограничивающей биоискусственную систему. В устройстве по патенту RU №2401084 полость - это пространство, ограниченное пористой стенкой, которая является внешней перфорированной поверхностью будущего имплантата. Эта полость создается заранее. Сквозь пористую стенку, внутрь полости должны прорастать кровеносные сосуды от организма. На время васкуляризации в полости должен находиться сердечник соответствующих размеров для образования периферического промежутка между сердечником и стенкой, заполняемого сосудами. После васкуляризации выемка сердечника и заполнение полости тканево-клеточным материалом производятся при повторной операции. Это значительно усложняет решение основной задачи создания эффективно действующего имплантата. Для исправления ситуации в патенте RU №2401084 заполнение полости тканево-клеточным материалом после удаления или смещения сердечника производится по трубкам (см. п.13 патента RU №2401084), значит, тканево-клеточный материал этого устройства есть жидкость или суспензия с относительно малой вязкостью. Она не есть цельная ткань, и она не может содержать цельного твердого каркаса, на котором формируется трехмерная клеточная культура - ткань, так как по трубкам его подавать в полость невозможно.
Другой недостаток устройства по патенту RU №2401084 состоит в том, что в п.19 указанного патента, размещение биоматериала в полости производится заранее, до имплантации, а следовательно, до васкуляризации внутриполостного пристеночного пространства (см. п.19 патента RU №2401084). Оно порождает все проблемы выживания клеточного имплантата в период времени от имплантации до васкуляризации, о чем говорится в нашем предложении.
Для решения этих проблем в нашем устройстве применяется твердый матрикс - цельный каркас, на котором клетки пролиферируют при поддержке питанием и кислородом изнутри, от керна, соединенного с внешними резервуарами по соединительным трубкам. В нашем случае на трехмерном матриксе, сохраняющем свою целостность, развивается цельная клеточная культура, модель живой ткани клеточно-органного уровня организации.
В предлагаемой нами биоискусственной системе создается цельный клеточный объект, который принципиально отличается от суспензионных клеточных культур на жидких носителях. В этих культурах отсутствует коллективное взаимодействие клеток, которое свойственно живой ткани, где клетки располагаются на цельном внеклеточном матриксе.
Известен патент РФ №2425647 «Способ и трансплантат для лечения печеночной недостаточности» от 10.08.2011, который мы выбираем в качестве прототипа нашего предложения. Описанное в нем решение направлено на повышение эффективности лечения печеночной недостаточности путем введения в организм долгосрочно функционирующего имплантата типа «вспомогательная печень». Имплантат включает трехмерный биосовместимый биодеградируемый пористый матрикс, созданный из материала на основе полиоксибутирата(3-оксибутирата), синтезируемого различными видами прокариотических клеток. Торговый знак материала - «ЭластоПОБ®». Матрикс имеет общий объем не менее 0,05 см3 и наименьший линейный размер не менее 0,2 мм; размеры пор 2-500 мкм, суммарную пористость 50-97%. Имплантат включает посаженные на него аллогенные прогениторные клетки костного мозга и аллогенные клетки печени, причем концентрация клеток печени и костного мозга 2×106-15×106 клеток на 1 см3 матрикса; соотношение клеток костного мозга к клеткам печени от 1:1 до 1:4. В способе лечения печеночной недостаточности, по данному аналогу имплантат помещают в паренхиму печени и(или) в брыжейку тонкой кишки.
Технический результат, достигаемый при осуществлении этого решения, достигается, в том числе, благодаря созданию в имплантате трехмерного каркаса для размещения в нем ассоциаций образующихся новых клеток, созданию условий для прорастания в этот каркас новых кровеносных сосудов, диффузии питательных веществ, кислорода и факторов тканевой дифференцировки из крови сосудов печени, брыжейки и сосудов, проросших в каркас, к иммобилизированным печеночным клеткам и клеткам костного мозга.
Недостатками данного решения являются:
- необходимость имплантированным клеточным культурам дождаться прорастания в матрикс кровеносных сосудов из раневой зоны органа - «хозяина», избежав при этом последствий ресурсного (прежде всего, кислородного) голодания, и иммунного ответа организма - «хозяина»;
- резкое изменение условий существования клеточных культур, выращенных в условиях биореактора, при имплантации их в раневую зону.
Еще одним недостатком является невозможность автономного (не через кровеносную систему) управления биорегуляторными процессами в зоне имплантата после имплантации.
Вышеперечисленные недостатки могут быть устранены применением предложенной имплантируемой биоискусственной системы с внешним, экстракорпоральным обеспечением имплантированных клеточных культур ресурсами и биорегуляторными факторами. В сравнении с показанными аналогом и прототипом предлагаемое устройство обладает по крайней мере следующими достоинствами и особенностями:
1) Невмешательство в кровеносную систему организма - «хозяина».
Автономное (не через кровеносную систему) питание имплантата ресурсами и биорегуляторными факторами позволит оптимизировать процесс лечения, ориентируясь на послеоперационные диагностические данные и показатели. Это дает возможность контролируемого поддержания требуемых функций имплантированных клеточных культур после имплантации независимо от состояния раневой зоны - зоны имплантации. Действие этих факторов может быть особенно эффективным, так как они диффундируют в имплантат не из сосудов кровеносной системы, а локально, через специальные транспортные трубки и каналы носителя. В этих трубках и каналах не действуют биологические ограничения, свойственные транспортным системам живого организма. Поскольку питание доставляется только имплантату, имеющему количество клеток, ничтожное по сравнению с клеточным массивом органа - «хозяина», необходимые транспортные характеристики системы могут быть обеспечены каналами и трубками весьма малого поперечного размера, порядка миллиметров. Это решаемая хирургическая задача для имплантации.
2) Возможность приготовления и отработки устройства в биореакторе.
Конструкция предлагаемой системы позволяет, в принципе, обеспечить все питание выращиваемой клеточной культуры «изнутри», через носитель по питательным трубкам. Среда в биореакторе, в которую погружен подготавливаемый имплантат, в таком случае не несет питательных функций. Она лишь моделирует, в возможной степени, среду в будущей зоне имплантации. Эта особенность всей системы вида «биореактор - подготавливаемый клеточный имплантат - транспортные каналы - питательные среды» позволяет налаживать функции всех ее составляющих еще в биореакторе, до имплантации. При имплантации эти функции не будут прерваны так жестко, как это было бы для имплантата, не имеющего питания «изнутри».
3) Возможность биорезорбции отработавшего имплантата.
Предлагаемая биоискусственная система, в принципе, есть временная композиция клеточного имплантата с системой внешнего экстракорпорального питания, предназначенная для облегчения внедрения и интеграции имплантата в живую ткань органа - «хозяина». Клеточный имплантат, по возможности раньше, должен интегрироваться с организмом и приступить к своей основной функции - стимулированию процессов регенерации. По завершении интегрирования искусственные составляющие предлагаемого устройства должны быть отключены и удалены из организма. Очевидно, что часть составляющих может резорбировать в организме в ходе процессов метаболизма, в то время как другую часть, например транспортные трубки, расположенные вне носителя, придется удалять хирургическим путем. Эти процессы, конечно, будут разными для различных биомедицинских задач. Можно предположить, например, что транспортные каналы могли бы способствовать резорбции керна носителя, обеспечивая подачу ферментативных факторов в объем керна и дренаж отработавшего материала на завершающем этапе лечения.
Таким образом, новым техническим результатом, на достижение которого направлено изобретение, является обеспечение лучшей интеграции имплантата в организм за счет автономного питания выращиваемых клеточных культур.
Для этого предложена биоискусственная система, содержащая биосовместимый носитель для размещения культур животных клеток, при этом указанный носитель включает: внешний матрикс, на котором размещены культуры животных клеток и который состоит из пористого гидрогеля с введенной в него трехмерной сеткой из биорезорбируемого волокнистого полимера; внутренний керн для размещения питательных сред, выполненный из биосовместимого пористого полимерного материала; разделительную мембрану, покрывающую керн с возможностью пропускания молекул питательной среды к матриксу с клеточными культурами; экстракорпоральный дренажный резервуар и экстракорпорально размещенные резервуары с питательными средами, при этом внутренний объем носителя дренажной трубкой соединен с дренажным экстракорпоральным резервуаром, а резервуары с питательными средами трубками соединены с внутренним объемом носителя, включающего керн.
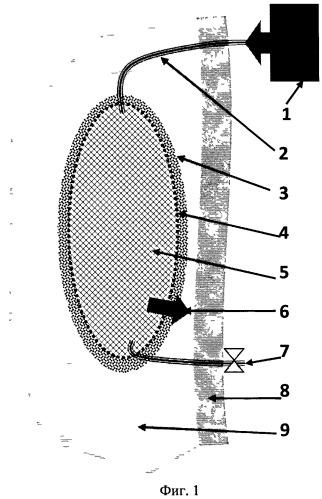
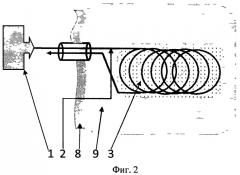
На Фиг.1 показана схема устройства в одноканальном варианте питания; на Фиг.2 - схема устройства в варианте трубчатого многоканального подвода питательных сред. Показана одна трубка в виде плоской растянутой спирали. Таких трубок может быть много.
Перечень обозначений:
1 - резервуар с питательной средой, 2 - питательная трубка, 3 - комплекс клеточных культур на матриксе, 4 - мембрана, диффузионно пропускающая питательную среду, 5 - пористая биосовместимая структура - керн, 6 - диффузия питательной среды из керна через мембрану в матрикс, в комплекс клеточных культур и в живую ткань, 7 - дренажная трубка, 8 - оболочка организма, 9 - живая ткань.
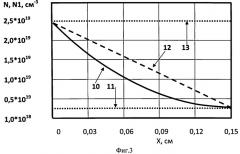
На Фиг.3 дана расчетная зависимость концентрации кислорода N(x) и N1(x) [см-3] от удаления в глубину клеточного слоя x [см], где 10 - зависимость N(x); 11 - значение плотности кислорода 2,5*1018 см-3; 12 - зависимость N1(x); 13 - значение плотности кислорода 2,5*1019 см-3.
Схема устройства, имплантированного в орган, в простейшем, одноканальном, варианте питания с одной питательной трубкой, соединяющей имплантат с резервуаром с кислородом, показана на Фиг.1, где видно, что керн носителя 5, подключенный к питательной трубке 2, имеет внутреннюю пористую полость, заполняемую питательной средой (например, кислородом) от резервуара 1. Резервуар расположен вне тела пациента, экстракорпорально. Питательная трубка проникает через оболочку организма 8 (кожу) и его живую ткань 9. Пленочная диффузионная мембрана 4 отделяет газообразный кислород в пористом керне от слоя клеточной культуры, выращенной на трехмерном матриксе 3, расположенном поверх пленочной мембраны 4. Молекулы кислорода проникают из полости керна сквозь мембрану диффузионно, непосредственный контакт газообразного кислорода с клеточной культурой не предусматривается. При необходимости, система может быть снабжена дренажной трубкой 7, открываемой для удаления отработавших сред из объема носителя в дренажный резервуар (не показан). Подобные трубки, устанавливаемые чрескожно, в разных вариантах применяются в хирургии для послеоперационного поддержания процесса заживления оперированной зоны. Резервуаров с различными питательными средами 1 может быть несколько, соответственно они будут соединены с носителем трубкой 2.
На Фиг.2 показан многоканальный вариант питания предлагаемого устройства, в котором каждый компонент питания (газообразного или жидкого) подается к клеточной культуре на матриксе 3 по отдельной трубке. В зоне матрикса трубка имеет диффузионно-пористую стенку с проницаемостью, достаточной для диффузионного питания участков клеточной культуры, прилегающих к трубке. Существуют технологии приготовления таких трубок диаметром ~1 мм из пороволоконных биосовместимых материалов для использования в различных фильтрах и диализных системах. Одна из таких трубок представлена здесь в виде ссылки [http://www.aquaphor.ru/hollowfibres]. Трубки свиты в плоские спирали, переплетены и скреплены в зоне носителя с тем, чтобы создать керн носителя в виде единой сетки с шагом, меньшим, чем характерная диффузионная длина того или иного продукта в клеточной культуре. Керн покрыт матриксом с клеточной культурой 3, создающим единую квазиоднородную систему диффузионного питания клеточной культуры.
Диффузионный характер питания клеточного имплантата, например кислородом, определяет толщину клеточного слоя и количество клеток в нем, которое можно обеспечить кислородным питанием. Будем считать, что клетки располагаются в матриксе из гидрогеля, что весь кислород поступает к имплантированной клеточной культуре со стороны керна-носителя, а со стороны раневой поверхности кислород не поступает, так как концентрация его мала из-за разрушенной капиллярной кровеносной системы. Будем считать задачу плоской и стационарной, что хорошо соответствует геометрии и условиям работы клеточной культуры на матриксе. Тогда задача сводится к одномерному стационарному уравнению диффузии с поглощением
где N - концентрация молекул кислорода в геле с клетками, см-3 при однородном распределении клеток в геле; D - коэффициент диффузии кислорода через гель, см2/сек; x - координата, см.
Решение уравнения имеет вид
где константа c=(DNd-Vd2-DNo)/d, V=vCe,, v - число молекул кислорода, поглощаемых одной клеткой в секунду, Ce - концентрация клеток в слое, см-3, d - толщина слоя, см. Масштабы значений коэффициента диффузии кислорода через клеточную или жидкую среды, а также потребление кислорода клетками, взяты из экспериментальной практики: D~(1-2)*10-5 см2/сек, v~108 O2/(сек*клетку.). Таким же образом подобрана и толщина матрикса с клеточным слоем d=0,15 см. При малых концентрациях клеток Ce1~0,15*108 (клеток/см3) на распространение кислорода основное влияние оказывают диффузионные характеристики материала матрикса. При больших концентрациях клеток Се~1*108 (клеток/см3) решающую роль играют клетки, поглощающие кислород. Это показывают решения уравнений диффузии с большей концентрацией клеток Ce~1*108 (клеток/см3) и с меньшей концентрацией клеток Ce1~0,15*108 (клеток/см3). Они представлены на Фиг.3 в виде зависимостей, N(x) и N1(x) соответственно. Здесь No=2,5*1019 см-3, Nd=0,25*1019 см-3 - выбранные значения концентрации молекул кислорода у поверхности клеточного слоя, обращенной к керну носителя и к раневой поверхности, соответственно. Из этих оценок следует, что, при выбранных параметрах диффузионной и клеточной сред, кислородом будут обеспечены, соответственно, 2,25*107 и, 2,25*106 (клеток/см2) имплантата. Отсюда следует оценка масштаба диффузионной длины распространения кислорода ~1-2 мм. Данный расчет подтверждает осуществимость изготовления и использования предлагаемой биоискусственной системы, соответствующей размерам и другим характеристикам, указанным в формуле изобретения.
Вариантность выбора формы и структуры носителя (плоский или осесимметричный, однообъемный или многотрубчатый спиральный, с матриксом из гидрополимера или в комбинации вида «гидрополимер - жесткая структурированная трехмерная сетка») обусловлена широким набором медицинских применений, в которых могут использоваться клеточные имплантаты с экстракорпоральным питанием. Именно экстракорпоральность питания имплантата позволяет достигать необходимого результата - облегчить и проконтролировать условия интеграции имплантата в организм на первой, критической стадии лечения, когда выживание и развитие вновь введенного клеточного имплантата осложнены тяжелыми условиями в раневой зоне.
Биоискусственная система, содержащая биосовместимый носитель для размещения культур животных клеток, отличающаяся тем, что указанный носитель включает: внешний матрикс, на котором размещены культуры животных клеток и который состоит из пористого гидрогеля с введенной в него трехмерной сеткой из биорезорбируемого волокнистого полимера, внутренний керн для размещения питательных сред, выполненный из биосовместимого пористого полимерного материала, разделительную мембрану, покрывающую керн с возможностью пропускания молекул питательной среды к матриксу с клеточными культурами, экстракорпоральный дренажный резервуар и экстракорпорально размещенные резервуары с питательными средами, при этом внутренний объем носителя дренажной трубкой соединен с дренажным экстракорпоральным резервуаром, а резервуары с питательными средами трубками соединены с внутренним объемом носителя, включающего керн.