Способ специфического отбора высокоаффинных молекул днк (днк-аптамеров) к рекомбинантному белку-мишени
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к способу специфического отбора высокоаффинных молекул ДНК (ДНК-аптамеров) к рекомбинантному белку-мишени. Указанный способ включает синтез единой полипептидной цепи рекомбинантного белка, содержащего в своем составе фрагмент глютатион-S-трансферазы, целевой белок-мишень, пептидную последовательность, расщепляемую летальным фактором B. anthracis, и пептид, биотинилирующийся in vivo под действием фермента биотин-лигазы E.coli, связывание полученного рекомбинантного полипептида с библиотекой олигонуклеотидов и иммобилизацию белка на парамагнитных частицах, несущих глютатион, промывку парамагнитных частиц с иммобилизованным полипептидом от несвязавшихся олигонуклеотидов в потоке жидкости, отщепление белка-мишени со связанными ДНК-аптамерами с поверхности парамагнитных частиц летальным фактором B. anthracis, выделение и амплификацию аффинной к рекомбинантному белку-мишени последовательности ДНК в полимеразной цепной реакции и получение набора одноцепочечных ДНК-аптамеров, специфичных к белку-мишени. Изобретение позволяет эффективно получать высокоаффинные специфичные ДНК-аптамеры к рекомбинантным белкам-мишеням. 4 ил., 4 пр.
Реферат
Изобретение относится к нанобиотехнологии, конкретно - к областям молекулярной медицины и лабораторных медицинских исследований, получения медицинских терапевтических препаратов, биосенсоров, создания высокочувствительных тест-систем, медицинской микробиологии, касается разработки нового способа селекции высокоспецифичных и высокоаффинных молекул ДНК (ДНК-аптамеров) к диагностически и терапевтически значимым рекомбинантным белкам, которые могут быть получены в различных гетерологичных экспрессионных системах.
Основными сферами применения предлагаемого способа отбора ДНК-аптамеров являются конструирование диагностикумов, биомедицина, создание медицинских лекарственных препаратов, лабораторные биологические и медицинские исследования, получение высокоспецифичных и высокочувствительных систем детекции белков, обладающих медицинским и народно-хозяйственным значением в качестве терапевтических мишеней и диагностических маркеров.
ДНК-аптамеры представляют собой олигонуклеотиды (8-100 п.н.), способные специфически узнавать и эффективно связывать различные молекулярные мишени [Hamula C.L.A., Guthrie J.W., Zhang Н. С соавт. // Trends Anal. Chem. - 2006. - V.25, №7, P.681-691]. Помимо кодирования генетической информации, определяемой их первичной структурой, молекулы ДНК способны функционировать как высокоэффективные аффинные лиганды за счет формирования уникальной трехмерной структуры.
Терапевтическое и диагностическое применение высокоаффинных молекул ДНК имеет ряд существенных преимуществ перед традиционным использованием в этих целях аффинных белковых молекул (например, антител). В частности, молекулы ДНК практически не иммуногенны, ДНК-аптамеры можно в большом количестве сравнительно быстро и недорого получить химическим синтезом, их можно отобрать к огромному спектру мишеней, в том числе к токсическим белкам, к которым трудно получить специфические антитела, их легко химически модифицировать в заданных положениях без потери активности. Кроме того, денатурировавшие аптамеры легко восстанавливаются, могут транспортироваться при комнатной температуре, стабильны при долгосрочном хранении.
Трехмерная структура одноцепочечного олигонуклеотида находится в зависимости от его нуклеотидного состава и, в первую очередь, определяется внутримолекулярной гибридизацией. Подобные трехмерные структуры обладают значительным разнообразием, таким образом, успешность отбора высокоаффинных и специфичных аптамеров зависит от масштаба стартовой комбинаторной олигонуклеотидной библиотеки (как правило, 1012-1015 индивидуальных последовательностей) и от эффективности используемых стратегий их селекции.
Традиционно применяемый процесс селекции аптамеров - технология SELEX ("Systematic Evolution of Ligands by Exponential Enrichment") [US Patent 5567588]. Он основан на повторяющихся раундах связывания библиотеки олигонуклеотидов с мишенью, удалении несвязавшихся олигонуклеотидов и амплификации связавшихся кандидатных аптамеров при помощи полимеразной цепной реакции (ПЦР) с применением праймеров к их констатным фланкирующим областям. При помощи SELEX проводили получение высокоаффинных аптамеров как к малым молекулам, так и к рекомбинантным белкам, вирусам и бактериям [Pestourie C., Tavitian В., Duconge F. // Biochimie. - 2005. - V.87, №9-10. - P.921-930]. Большинство аптамеров, отобранных на данный момент к рекомбинантным белкам, обладает константами аффинности в диапазоне 10-9-10-12 М, что находится на уровне аффинности большинства моноклональных антител к аналогичным мишеням или превышает ее.
При селекции аптамеров к рекомбинантным белкам необходимым этапом является сепарация белка со связанными кандидатными аптамерами от несвязавшихся олигонуклеотидов [Kulbachinskiy A.V. // Biochemistry (Moscow). - 2007. - V.72, №13. - P.1505-1518]. Наиболее широкоупотребимым способом сепарации белка со связавшимися кандидатными аптамерами от непровзаимодействовавших с ним олигонуклеотидов является иммобилизация белка на твердой фазе с последующей промывкой.
Известен классический способ отбора аптамеров с иммобилизацией белков на нитроцеллюлозных мембранах, основанный на низкой степени связывания ДНК с нитроцеллюлозой [Tuerk C., Gold L. // Science. - 1990. - V.249, №4968. - P.505-510].
Известен способ отбора аптамеров с прямой химической иммобилизацией белка-мишени на хроматографическом носителе (сефарозе) [Levesque D., Beaudoin J.-D., Roy S. с соавт. // Biochem. J. - 2007. - V.403. - P.129-138], однако химический способ иммобилизации пригоден не для всех белков, так как в ряде случаев может существенно нарушать их структуру, что негативно влияет на результаты отбора и специфичность аптамеров.
Известны способы отбора аптамеров со связыванием белка на носителе за счет введения в белок универсальных аффинных последовательностей, специфичных к веществу, иммобилизованному на носителе (аффинные пары глютатион/глютатион-S-трансфераза, бивалентный металл/последовательность шести гистидинов, биотин/белки авидинового ряда) [Toscano-Garibay J.D., Benites-Hess M.L., Alvares-Salas L.M. // Arch. Med. Res. - 2011. - V.42. - P.88-96; Tanaka Y., Honda Т., Matsuura К. с соавт.// J. Pharmacol. Exp. Ther. - V.329, №1. - P.57-63; Mayer D., Hover T. // Methods Mol. Biol. - 2009. - V.535. - P.19-32]. Однако нежелательный отбор аптамеров возможен и на введенные в белок последовательности, обеспечивающие его иммобилизацию, например, описаны аптамеры, отобранные на последовательность шести гистидинов [Tsuji S., Tanaka Т., Hirabayashi N. с соавт. // Biochem. Biochys. Res. Commun. - 2009. - V.386,№1. - P.227-231].
Известен способ отбора аптамеров со связыванием белка на магнитных частицах за счет аптамера, полученного к последовательности шести гистидинов [Patent US 8105982]. Описанный способ позволяет осуществлять быстрые манипуляции с парамагнитными частицами и проводить эффективное отделение частиц с иммобилизованным белком и связанными аптамерами за счет магнитного взаимодействия, но постановка подобного отбора в пробирках требует множественных раундов промывки частиц для полного освобождения частиц от неаффинных к белку членов комбинаторной библиотеки. Кроме того, при проведении селекции по данному способу иммобилизация белка на частицах осуществляется за счет полигистидиновой последовательности, что не исключает накопления аптамеров, специфичных к данной последовательности.
Известен способ отбора аптамеров с разделением продуктов селекции гель-электрофорезом в неденатурирующих условиях [Triqueneaux G., Velten М., Franzon Р. с соавт. // Nucleic Acids Res. - 1999. - V.26. - P.1926-1934], однако высокие стартовые концентрации олигонуклеотидов при отборе не позволяют полностью избавиться от присутствия примесей неаффинных нуклеотидов в зоне геля, содержащей белок со связанными кандидатными аптамерами.
Известен способ отбора аптамеров, связанных с рекомбинантным белком, методом капиллярного электрофореза [Mendonsa S.D., Bowser М.Т. // J. Am. Chem. Soc. - 2004. - V.126. - Р.20-21]. Данный метод достаточно эффективен и обладает такими преимуществами, как скорость, емкость, возможность минимального разведения образца, но проведение капиллярного электрофореза требует наличия дорогостоящего оборудования, тогда как эффективность сепарации по данному методу сравнима с таковой, достигаемой при иммобилизации белка на твердой фазе.
Известен наиболее близкий к заявленному способ отбора аптамеров на парамагнитных частицах с использованием микрожидкостных методов [Lou X., Qian J., Xiao Y. с соавт. // Proc. Natl. Acad. Sci. USA. - 2009. - V.106. - Р.2989-2994]. Применение данного метода позволяет провести селекцию аптамеров в крайне малом объеме, утилизация принципа проведения отмывки белков, иммобилизованных за счет взаимодействия с парамагнитными частицами в микрожидкостном потоке, существенно сокращает время отбора и дает возможность автоматизировать его проведение. Однако данный способ основан на использовании высокотехнологичного дорогостоящего оборудования и расходных материалов, таким образом, рутинное проведение подобного скрининга может быть недоступно для небольших экспериментальных лабораторий.
Общей существенной проблемой данного способа отбора аптамеров к рекомбинантным белкам является преодоление неспецифического связывания олигонуклеотидов с поверхностью твердой фазы (нитроцеллюлозной мембранной, поверхностью пробирки, сорбента, магнитных частиц и др.), которое лишь частично может быть снижено за счет применения различных блокирующих агентов, и приводит к параллельному отбору аптамеров, специфичных к носителю (например, были описаны аптамеры, отобранные на хроматографическую целлюлозу [Boese В.J., Breaker R.R. // Nucleic Acids Res. - 2007. - V.35, №19. - Р.6378-6388]). Высокий уровень неспецифического связывания олигонуклеотидов с поверхностями в процессе отбора приводит к наращиванию количества раундов селекции, необходимости проведения раундов негативного отбора на конкретный носитель или смены принципов иммобилизации белка в процессе отбора, к временным и трудовым затратам, обязательному комплексу экспериментов по верификации специфичности для больших панелей первичных аптамерных кандидатов.
Техническим результатом изобретения является создание эффективного способа отбора ДНК-аптамеров к рекомбинантным белкам, применимого для получения высокоаффинных специфичных ДНК-аптамеров к рекомбинантным белкам-мишеням, имеющим диагностический и терапевтический потенциал, употребимого для нужд здравоохранения, клинической диагностики, терапии, мониторинга окружающей среды и качества продуктов питания.
Технический результат изобретения достигается за счет осуществления отбора ДНК-аптамеров из обширных вариабельных наборов коротких одноцепочечных последовательностей ДНК (олигонуклеотидных библиотек), проводимого по отношению к рекомбинантному белку-мишени, синтезируемому в виде единой химерной полипептидной цепи, содержащей целевой белок-мишень, последовательность глютатион-S-трансферазы для связывания рекомбинантного белка на парамагнитных частицах с иммобилизованным глютатионом, пептидный субстрат, содержащий уникальный сайт расщепления протеазой (летальным фактором B.anthracis) и пептид, биотинилирующийся in vivo под действием фермента биотин-лигазы E.coli.
Также технический результат изобретения достигается за счет изоляции рекомбинантного полипептида на покрытых глютатионом парамагнитных частицах, что позволяет иммобилизовать химерный рекомбинантный полипептид на твердой фазе, осуществить специфическое связывание ДНК-аптамеров из олигонуклеотидных библиотек, избавиться от неаффинных ДНК-олигонуклеотидов и провести отщепление фрагмента полипептида, содержащего целевой белок-мишень при помощи протеазы (летального фактора В. anthracis).
Также технический результат изобретения достигается за счет применения радиально намагниченной неодимовой трубки с центральным продольным отверстием, соответствущим внешнему диаметру пропущенного через нее хроматографического шланга, магнитное поле которой удерживает парамагнитные частицы с иммобилизованным рекомбинантным белком в хроматографическом шланге в потоке промывочного раствора.
Также технический результат изобретения достигается за счет расщепления рекомбинантного полипептида протеазой (летальным фактором B.anthracis), при котором отщепляется фрагмент полипептида, содержащий целевой белок-мишень со связанными ДНК-аптамерами, что позволяет изолировать ДНК-аптамеры, специфичные к белку-мишени, от последовательностей ДНК, связавшихся с носителем или другими областями рекомбинантного полипептида.
Отличиями предлагаемого способа являются использование принципа твердофазной иммобилизации белка-мишени на парамагнитных частицах за счет продукции его в составе единого полипептида с последовательностью глютатион-S-трансферазы, применение мощного радиально направленного поля неодимового магнита для удержания магнитных частиц в полости хроматографического шланга и быстрого и эффективного удаления несвязавшихся олигонуклеотидов путем промывки шланга буферным раствором, подаваемым с перистальтического насоса, а также обеспечение специфичности отбора ДНК-аптамеров к белку-мишени за счет отщепления полипептида, содержащего целевой белок со связанными ДНК-аптамерами, с поверхности парамагнитных частиц при помощи протеазы (летального фактора B.anthracis).
В предлагаемом техническом решении специфичность отбора аптамеров обеспечивается за счет введенных в состав рекомбинантного полипептида, содержащего целевой белок-мишень и используемого для отбора ДНК-аптамеров, фрагмента глютатион-S-трансферазы и пептида, представляющего собой уникальный сайт расщепления летальным фактором B.anthracis. Взаимодействие глютатион-S-трансферазы, входящей в состав полипептида, с глютатионом, иммобилизованным на поверхности парамагнитных частиц, позволяет изолировать ДНК-аптамеры, связанные с белком-мишенью, из смеси последовательностей ДНК, входящих в состав олигонуклеотидной библиотеки. Последующее расщепление рекомбинантного полипептида летальным фактором B.anthracis переводит белок-мишень со связанными с ним ДНК-аптамерами в раствор. Отбор ДНК-аптамеров с использованием данного рекомбинантного полипептида не требует проведения негативных раундов селекции на глютатион-S-трансферазу, поскольку олигонуклеотиды, взаимодействующие с глютатион-S-трансферазой, остаются связанными на парамагнитных частицах. Дополнительная возможность повышения специфичности отбора обеспечивается наличием в составе полипептида последовательности, биотинилирующейся in vivo под действием фермента биотин-лигазы E.coli, которая отщепляется связанной с белком мишенью при обработке полипептида летальным фактором B.anthracis. Таким образом, оказывается возможным связать белок-мишень на парамагнитных частицах, несущих белок авидинового ряда (нейтравидин, стрептавидин и др.), и провести промывку частиц с иммобилизованным белком-мишенью и аптамерами от летального фактора B.anthracis, находящегося в растворе. Пептид, биотинилирующийся in vivo под действием фермента биотин-лигазы E.coli, представляет собой короткую аминокислотную последовательность, и риск контаминации пула отобранных на целевой белок-мишень ДНК-аптамеров олигонуклеотидами, связавшимися с данным пептидом, невысок.
Предлагаемое техническое решение предусматривает проведение промывки парамагнитных частиц с иммобилизованным рекомбинантным полипептидом от несвязавшихся олигонуклеотидов в потоке буферного раствора, создаваемом перистальтическим насосом. Частицы удерживаются в хроматографическом шланге мощным радиальным магнитным полем неодимовой трубки, через которую пропущен хроматографический шланг. Подобный способ промывки является значительно более эффективным, чем традиционно используемая промывка частиц сменами раствора в пробирке и сокращает время, необходимое для промывки частиц с использованием магнитного штатива в десятки раз. Экспериментально с применением ПЦР-амплификации нами было установлено, что для промывки частиц в микроцентрифужной пробирке с целью полного освобождения от ДНК-матрицы, содержащейся в растворе после проведения одного раунда связывания, необходимо провести 20 и более смен раствора объемом в 1 мл, что занимает более часа. С применением системы из неодимовой магнитной трубки и перистальтического насоса такую промывку можно провести за 10 минут. Кроме того, использование данной системы снижает риск контаминации препаратов отобранных ДНК-аптамеров продуктами промывки.
Существенным достоинством предлагаемого способа отбора ДНК-аптамеров является использование в качестве носителя комплекса парамагнитных частиц, которые допускают проведение автоматизации этого метода детекции с использованием роботизированных дозаторов и промывочных устройств.
Изобретение осуществляют следующим образом.
К 10 мкг рекомбинантного полипептида, содержащего в своем составе фрагмент глютатион-Б-трансферазы, целевой белок-мишень, пептидную последовательность, специфически расщепляемую летальным фактором B.anthracis, и пептид, биотинилирующийся in vivo под действием фермента биотин-лигазы E.coli, добавляют десятикратный молярный избыток препарата библиотеки олигонуклеотидных последовательностей, содержащих вариабельный центральный фрагмент длиной не менее 20 нуклеотидов, фланкированный константными последовательностями длиной не менее 18 нуклеотидов, и инкубируют смесь в течение 30 минут в буфере, содержащем 20 мМ трис-HCl pH 7,5,100 мМ хлорида натрия.
К смеси добавляют 20 мкл парамагнитных частиц с иммобилизованным глютатионом и инкубируют в течение 30 минут при умеренном встряхивании на шейкере при комнатной температуре. По окончании инкубации смесь помещают в хроматографический шланг с внутренним диаметром 0,5 мм, пропущенный через неодимовую трубку длиной 10 см с радиально направленным магнитным полем, и подключают шланг к перистальтическому насосу, промытому буфером, содержащим 20 мМ трис-HCl рН 7,5, 100 мМ хлорида натрия. Промывают частицы, удерживаемые в магнитном поле в течение 10 минут при скорости потока 2 мл/мин.
После остановки насоса магнит снимают со шланга и собирают раствор с частицами в центрифужную пробирку. Частицы изолируют на стенке пробирки с использованием магнитного штатива, отбирают раствор и добавляют к частицам 100 мкл буфера, содержащего 30 мМ трис-HCl рН 7,5, 70 мМ хлорида натрия и 1 мкг летального фактора B.anthracis. Реакцию протеолиза полипептида проводят в течение 30 минут при 30°C. По окончании реакции частицы изолируют на стенке пробирки при помощи магнитного штатива и переносят раствор, содержащий отщепленный целевой белок со связанными кандидатными ДНК-аптамерами, в другую пробирку.
К отобранному раствору добавляют равный объем смеси фенол:хлороформ:изоамиловый спирт и перемешивают на вортексе в течение 1 минуты, после чего центрифугируют смесь в течение 10 минут при скорости 12000 об/мин. Отбирают водную фазу и осаждают ДНК добавлением 1/10 объема 3 М ацетата натрия pH 5,2 и 10 объемов этанола. Осадок собирают центрифугированием при 12000 об/мин в течение 1 минуты, супернатант отбрасывают, ДНК растворяют в 10 мкл деионизованной воды.
Для проведения ПЦР-амплификации используют 0,1 мкл раствора ДНК аптамерных кандидатов и праймеры, синтезированные к константным частям олигонуклеотидов. Продукты амплификации обрабатывают смесью фенол/хлороформ/изоамиловый спирт и осаждают этанолом. Полученные двухцепочечные фрагменты ДНК обрабатывают экзонуклеазой фага лямбда для получения одноцепочечных фрагментов, которые используются для следующего раунда селекции ДНК-аптамеров или анализа на связывание с рекомбинантным белком-мишенью.
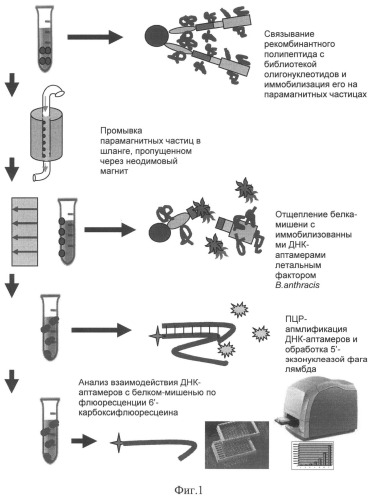
Принципиальная схема осуществления изобретения приведена на фиг.1. Изобретение иллюстрируют следующие графические материалы:
Фиг.1. Схема проведения раунда селекции ДНК-аптамеров к рекомбинантным белкам с использованием разработанного способа.
Фиг.2. Структура рекомбинантного полипептида, используемого для отбора ДНК-аптамеров к рекомбинантным белкам. Последовательность RRKKVYPYPME содержит сайт расщепления летальным фактором B.anthracis.
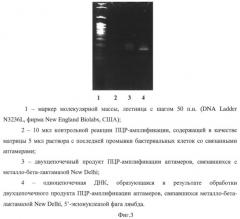
Фиг.3. Типичные результаты контроля селективного связывания ДНК-аптамеров к металло-бета-лактамазе New Delhi электрофорезом в 10% полиакриламидном геле, осуществленные на третьем раунде селекции.
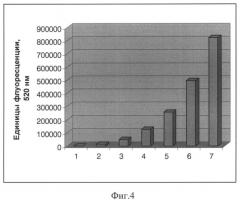
Фиг.4. Детекция нарастания аффинности пула кандидатных ДНК-аптамеров к металло-бета-лактамазе New Delhi при отборе с использованием разработанного способа. На фиг.4 представлена диаграмма нарастания флюоресцентного сигнала, свидетельствующего о повышении аффинности пула кандидатных ДНК-аптамеров к металло-бета-лактамазе New Delhi при последовательных раундах отбора с использованием разработанного способа. В эксперименте регистрировалась флюоресценция 6-карбоксифлуоресцеина, которым модифицированы отобранные олигонуклеотиды, при длине волны возбуждающего излучения 495 нм и длине волны флуоресцентного излучения 520 нм. Рекомбинантный белок New Delhi, иммобилизованный на иммунологическом планшете, инкубировали с 0,1 мкг стартовой олигонуклеотидной библиотеки (1) и ДНК-аптамерами, полученными на раундах селекции (2-7).
Для лучшего понимания сущности изобретения ниже следуют примеры его конкретного выполнения.
Пример 1. Проведение связывания олигонуклеотидов с полипептидом, содержащим в своем составе рекомбинантную металло-бета-лактамазу New Delhi.
Для отбора используют полученный экспрессией в E.coli и хроматографически очищенный рекомбинантный полипептид, содержащий в своем составе фрагмент глютатион-Б-трансферазы, продукт гена NDM-1 (металло-бета-лактамаза New Delhi) и пептидную последовательность, специфически расщепляемую летальным фактором B.anthracis и библиотеку олигонуклеотидов, содержащих вариабельный центральный фрагмент длиной 45 нуклеотидов, фланкированный константными последовательностями длиной 18 нуклеотидов следующей структуры, синтезированную ЗАО "Синтол" (Россия):
5′ CATACGTTCGACTGCTAC NNNNNNNNNN NNNNNNNNNN NNNNNNNNNN NNNNNNNNNNNNNNN GTGAGATGTACAGACTAG
К 10 мкг рекомбинантного полипептида добавляют 45 мкг препарата библиотеки, при помощи одноканального дозатора добавляют 6 мкл 1 М трис-HCl рН 7,5 и 6 мкл хлорида натрия, доводят объем смеси до 300 мкл и инкубируют смесь в течение 30 минут при комнатной температуре со слабым встряхиванием.
К смеси добавляют 20 мкл парамагнитных частиц с иммобилизованным глютатионом (Thermo Scientific, США) и инкубируют в течение 30 минут при умеренном встряхивании на шейкере при комнатной температуре.
Пример 2. Проведение связывания олигонуклеотидов с полипептидом, содержащим в своем составе В-субъединицу рекомбинантного шига-токсина Stx2.
Для отбора используют полученный экспрессией в E.coli и хроматографически очищенный рекомбинантный полипептид, содержащий в своем составе фрагмент глютатион-S-трансферазы, продукт гена Stx2B (В-субъединицу шига-токсина), пептидную последовательность, специфически расщепляемую летальным фактором B.anthracis и библиотеку олигонуклеотидов, содержащих вариабельный центральный фрагмент длиной 45 нуклеотидов, фланкированный константными последовательностями длиной 18 нуклеотидов следующей структуры, синтезированную ЗАО "Синтол" (Россия):
5′ CATACGTTCGACTGCTAC NNNNNNNNNN NNNNNNNNNN NNNNNNNNNN NNNNNNNNNNNNNNN GTGAGATGTACAGACTAG
К 10 мкг рекомбинантного полипептида добавляют 45 мкг препарата библиотеки, при помощи одноканального дозатора добавляют 6 мкл 1 М трис-HCl рН 7,5 и 6 мкл хлорида натрия, доводят объем смеси до 300 мкл и инкубируют смесь в течение 30 минут при комнатной температуре со слабым встряхиванием.
К смеси добавляют 20 мкл парамагнитных частиц с иммобилизованным глютатионом (Thermo Scientific, США) и инкубируют в течение 30 минут при умеренном встряхивании на шейкере при комнатной температуре.
Пример 3. Проведение промывки парамагнитных частиц с иммобилизованным полипептидом, содержащим в своем составе рекомбинантную В-субъединицу шига-токсина Stx2 при помощи неодимового магнита.
Суспензию парамагнитных частиц при помощи одноканального дозатора переносят в хроматографический шланг с внутренним диаметром 0,5 мм, который пропускают через неодимовую трубку длиной 10 см с радиально направленным магнитным полем и перегоняют каплю с суспензией частиц в зону шланга, проходящую через магнит. Шланг подключают к перистальтическому насосу и промывают стерильным буфером, содержащим 20 мМ трис-HCl рН 7,5, 100 мМ хлорида натрия, в течение 10 минут при скорости потока 2 мл/мин. Останавливают насос, смещают неодимовую магнитную трубку к концу шланга, после чего трубку снимают, а суспензию парамагнитных частиц собирают в стерильную пробирку.
Пример 4. Выделение и амплификация аффинных к рекомбинантной металло-бета-лактамазе New Delhi последовательностей ДНК при помощи ПЦР и обработка продуктов реакции 5′-экзонуклеазой фага лямбда для получения одноцепочечных ДНК-аптамеров, специфичных к металло-бета-лактамазе New Delhi.
Парамагнитные частицы, собранные после промывки, изолируют на стенке пробирки при помощи магнитного штатива и отбирают из пробирки промывочный буфер. В пробирку добавляют 100 мкл буфера, содержащего 30 мМ трис-HCl рН 7,5, 70 мМ хлорида натрия и 1 мкг летального фактора B.anthracis (EMD Millipore Chemicals, США). Реакцию протеолиза проводят при 30°C в течение 30 минут. По окончании инкубации изолируют магнитные частицы на стенке пробирки при помощи магнитного штатива и отбирают буферный раствор, содержащий фрагмент рекомбинантного полипептида со связанными ДНК-аптамерами.
К раствору добавляют 100 мкл водонасыщенной смеси фенол:хлороформ: изоамиловый спирт (1:1:0,04) и интенсивно встряхивают на вортексе до образования эмульсии. Эмульсию центрифугируют при 12000 об/мин на микроцентрифуге в течение 10 минут. Отбирают верхнюю (водную) фазу, содержащую олигонуклеотиды, в новую микроцентрифужную пробирку, добавляют 0,5 мкл соосадителя Pellet Paint (Novagen, США) 10 мкл раствора 3 М ацетата натрия рН 5,2 и 1 мл этанола. Инкубируют пробирку при -20°C в течение 30 минут для осаждения ДНК, после чего центрифугируют пробирку при скорости 12000 об/мин и температуре 0°С на микроцентрифуге в течение 10 минут. После центрифугирования супернатант отбрасывают, а осадок олигонуклеотидов растворяют в 50 мкл стерильной деионизованной воды.
Для проведения ПЦР используют праймеры, синтезированные ЗАО "Синтол" (Россия):
форвардный праймер
(5′-FAM-SPACER 9-biotin-spacer 9) CATACGTTCGACTGCTAC,
реверсный праймер
5′(Р) СТAGTCTGTACАТСТСAC.
Модификация форвардного праймера 6-карбоксифлюоресцеином (6-FAM) позволяет электрофоретически контролировать синтез олигонуклеотидной цепи с данного праймера и оценивать связывание данной цепи с молекулой-мишенью в процессе отбора аптамеров путем прямого замера уровня флюоресценции в пробе. Блокирование конца цепи 6-карбоксифлюоресцеином предотвращает ее деградацию под действием лямбда-экзонуклеазы, применяемой для разрушения второй цепи ПЦР-продукта на раундах отбора аптамеров.
Амплификацию проводят с использованием 0,1 мкл раствора аптамерных кандидатов и 1 единицы термостабильной полимеразы Pwo (Roche Applied Science, США) в буфере, рекомендованном производителем, при температуре отжига праймеров 56°C. Время элонгации продуктов реакции составляет 15 секунд, концентрация праймеров в реакции составляет 10 пМ, концентрация каждого варианта дезоксирибонуклеотидтрифосфатов в реакции (А, Т, G, С) составляет 0,2 мМ.
По окончании реакции к продуктам амплификации добавляют равный объем смеси фенол:хлороформ:изоамиловый спирт (1:1:0,04) и встряхивают на вортексе до образования эмульсии. Эмульсию центрифугируют при 12000 об/мин на микроцентрифуте в течение 10 минут. Отбирают верхнюю (водную) фазу, содержащую олигонуклеотиды, в новую микроцентрифужную пробирку добавляют 10 мкл раствора 3 М ацетата натрия pH 5,2 и 1 мл этанола. Осадок собирают при скорости 12000 об/мин на микроцентрифуге в течение 10 минут. После центрифугирования супернатант отбрасывают, а осадок ДНК растворяют в 44 мкл стерильной деионизованной воды.
В пробирку добавляют 5 мкл 10Х буфера для 5′-экзонуклеазы фага лямбда и 1 мкл экзонуклеазы фага лямбда (5000 ед/мл, New England Biolabs, США). Смесь инкубируют при температуре 37°C в течение 30 минут. Удаление одной из цепей ПЦР-продукта контролируют электрофорезом в 10% полиакриламидном геле в трис-боратном буфере.
Для анализа связывания ДНК-аптамеров с белком-мишенью рекомбинантный белок металло-бета-лактамазы New Delhi, иммобилизуют на иммунологическом планшете для флюоресцентных измерений в фосфатно-солевом буфере. Свободные валентности планшета блокируют 1% раствором казеина в фосфатно-солевом буфере. К иммобилизованному белку New Delhi добавляют 0,1 мкг препарата ДНК-аптамеров и инкубируют в течение 30 минут при комнатной температуре при встряхивании. Планшет троекратно промывают фосфатно-солевым буфером и проводят измерения на флуоресцентном спектрофотометре Varioskan Flash (Thermo, США) при длине волны возбуждающего излучения 495 нм и длине волны флуоресцентного излучения 520 нм (максимум поглощения и испускания 6-карбоксифлюоресцеина). Нарастание флуоресценции в лунках, содержащих аптамерные кандидаты, против контрольных лунок, не содержащих ДНК, свидетельствует об успешности отбора аптамеров к рекомбинантному белку.
Таким образом, к преимуществам заявленного способа отбора ДНК-аптамеров к рекомбинантным белкам относятся: 1) высокая специфичность метода отбора, позволяющая эффективно селектировать последовательности ДНК, аффинно связывающиеся с целевым белком, избегая аккумуляции олигонуклеотидов, связывающихся с поверхностью твердой фазы и другими белковыми последовательностями, входящими в состав полипептида, используемого для отбора; 2) повышение эффективности отбора высокоаффинных ДНК-аптамеров за счет применения условий, минимизирующих возможность контаминации последовательностей ДНК, полученных в каждом раунде отбора, параллельно селектируемыми или низкоаффинными последовательностями ДНК; 3) сокращение времени, требуемого на проведение раундов отбора, за счет промывки белка-мишени со связанными ДНК-аптамерами в потоке буферного раствора, подаваемого с перистальтического насоса на удерживаемых в поле неодимового магнита парамагнитных частицах; 4) универсальность технологии отбора ДНК-аптамеров к белкам различного происхождения; 5) дешевизна большинства используемых в анализе материалов; 6) возможность автоматизации процесса отбора.
Способ специфического отбора высокоаффинных молекул ДНК (ДНК-аптамеров) к рекомбинантному белку-мишени, включающий синтез единой полипептидной цепи рекомбинантного белка, содержащего в своем составе фрагмент глютатион-S-трансферазы, целевой белок-мишень, пептидную последовательность, расщепляемую летальным фактором B. anthracis, и пептид, биотинилирующийся in vivo под действием фермента биотин-лигазы E.coli, затем проводят связывание полученного рекомбинантного полипептида с библиотекой олигонуклеотидов и иммобилизацию белка на парамагнитных частицах, несущих глютатион, за счет взаимодействия глютатиона с глютатион-S-трансферазой, входящей в состав полипептида, промывают парамагнитные частицы с иммобилизованным полипептидом от несвязавшихся олигонуклеотидов в потоке жидкости за счет удержания полипептида на парамагнитных частицах в поле действия неодимового магнита, отщепляют белок-мишень со связанными ДНК-аптамерами с поверхности парамагнитных частиц летальным фактором B. anthracis, выделяют и амплифицируют аффинные к рекомбинантному белку-мишени последовательности ДНК в полимеразной цепной реакции, продукты которой обрабатывают 5'-экзонуклеазой фага лямбда и получают набор одноцепочечных ДНК-аптамеров, специфичных к белку-мишени.