Производные алкиламмонийного геминального поверхностно-активного вещества, обеспечивающие эффективную доставку днк в клетки
Иллюстрации
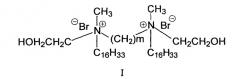
Показать всеИзобретение относится к cредству доставки ДНК в клетки, представляющему собой производные алкиламмонийного геминального поверхностно-активного вещества (ГПАВ) формулы:
где m=4, 6, 12. Указанные соединения являются новыми низкотоксичными соединениями, обеспечивающими эффективную доставку ДНК в эукариотические клетки, и могут быть использованы для терапевтического лечения путем внутриклеточной доставки генов многих человеческих болезней. 6 ил., 1 табл., 13 пр.
Реферат
Изобретение относится к ряду химических соединений, а именно к алкиламмонийным геминальным поверхностно-активным веществам (ГПАВ) формулы (I),
где m=4, 6, 12, обеспечивающих эффективную доставку ДНК в клетки.
Данные соединения являются электролитами и диссоциируют в воде с образованием мицеллообразующего иона, имеющего заряд +2, создаваемого двумя положительно заряженными атомами азота, и двух противоионов: бромид-анионов.
Генная терапия имеет значительный потенциал для терапевтического лечения путем внутриклеточной доставки генов многих человеческих болезней, которые в настоящее время считаются неизлечимыми. Вирусные векторы на основе аденовирусов или ретровирусов очень эффективны в доставке генов. Тем не менее развитие способов доставки ДНК в эукариотические клетки без применения вирусных векторов остается очень актуальным из-за возможности использовать только целевые последовательности ДНК и существенно более низкого риска отдаленных осложнений.
В качестве альтернативы вирусным векторам для доставки ДНК в клетки используются разнообразные катионные полимеры и структуры, такие как полиэтиленимин [Bagnacani V. et al. Macrocyclic nonviral vectors: high cell transfection efficiency and low toxicity in a lower rim guanidinium calix[4]arene. Org Lett. 2008; 10 (18), 3953-6], поли (L-лизин) [Baldini L. et al. Calixarene-based multivalent ligands, Chem Soc Rev. 2007, 36 (2), 254-66], полиамидоамин дендример [Sun X. et al. Cationic polymer optimization for efficient gene delivery. Mini Rev Med Chem. 2010, 10 (2), 108-25] и катионные липосомы [V. Geromel et al. Mitochondria Transfection by Oligonucleotides Containing a Signal Peptide and Vectorized by Cationic Liposomes, Antisense and Nucleic Acid Drug Development. 2001, 11 (3), 175-180]. Эти катионные агенты связываются с ДНК посредством электростатических взаимодействий и формируют комплексы наночастиц [Won Y.W. et al. Intracellular organdie-targeted non-viral gene delivery systems, J Control Release. 2011, 152 (1), 99-109]. В результате ДНК становится защищенной от деградации нуклеазой, в то же время катионные агенты являются посредником при проникновении в клетку и последующем освобождении из эндосом, что повышает эффективность трансфекции.
В литературе есть данные о трансфекции ДНК в присутствии монокатионных ПАВ - цетилтриметиламмоний бромида (ЦТАБ) и цетилгидроксиэтилдиметиламмоний бромида (ЦГАБ) [Mel'nikov S.M. et al. J. Am. Chem. Soc. 1995, 117, 2401], [Mel'nikov, S.M. Et al. J. Am. Chem. Soc. 1995, 117, 9951], [Clamme, J. P. et al. Biochim. Biophys. Acta 2000, 1467, 347], [Pinnaduwage, P. et al. Biochim. Biophys. Acta 1989, 985, 33], [Antara Dasgupta et al. J. Phys. Chem. B, Vol.111, No.29, 2007], которые являются монокатионными структурными аналогами заявляемых соединений и выбраны нами в качестве соединений сравнения.
К недостаткам использования вышеуказанных ПАВ в качестве средств доставки ДНК в клетки можно отнести (1) значительно более высокие величины критических концентраций мицеллообразования и более низкий поверхностный потенциал, что требует более высоких концентраций ПАВ для достижения сравнимых эффектов компактизации ДНК и перезарядки комплексов ПАВ/ДНК; (2) пониженную трансфекцию ДНК.
В литературе также имеются данные о применении в качестве трансфектантов геминальных ПАВ [Jagbir Singh et al. Current drug delivery, 2011, 8 (3), 299-306], [Peng Yang et al., European Journal of Pharmaceutics and Biopharmaceutics 75 (2010) 311-320], [Marianna Foldvari et al., J. Experimental Nanoscience, 1, No.2, 2006, 165-176], [Cecilia Bombelli et al., J. Med. Chem. 2007, 50, 6274-6278]. Однако в описанных примерах трансфекция ДНК в клетки животных достигается только при использовании смеси ПАВ с липидами, а в некоторых случаях еще и при добавлении производных полиэтиленгликоля. Существенным моментом является также то, что независимо от соотношения геминальное ПАВ-липид именно липиды являются структурообразующим компонентом: во всех приведенных источниках рассматриваются липосомы и везикулы, которые формируются по специальной методике в системах в присутствии липидов.
Задачей изобретения является создание новых эффективных средств доставки ДНК в эукариотические клетки, используемых в чистом виде (без вспомогательных агентов) и расширяющих арсенал известных средств указанного назначения.
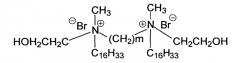
Поставленная задача решается применением геминальных поверхностно-активных веществ (ГПАВ) формулы (I) с гидроксиэтилированной алкиламмонийной головной группой в качестве средств доставки ДНК в клетки.
Для сравнительного описания свойств ГПАВ, являющихся предметом изобретения, получены репрезентативные данные как для заявляемых соединений (3-5), различающихся между собой длиной спейсерного фрагмента (значением m), так и для незамещенных аналогов (1) и (2), где отсутствует гидроксиэтилированный фрагмент в головной группе.
m=4 (соединение 3)
m=6 (соединение 4)
m=12 (соединение 5)
Синтез геминальных алкиламмонийных ПАВ
Алканедил-α, ω-бис(метилдиалкиламмоний бромиды) получают кипячением в ацетоне смеси 2.2 моля метилдиалкиламина, в том числе содержащего гидроксиэтильную группу у атома азота, и 1.0 моля соответствующего α,ω-дибромалкана в течение 40-60-часов. Выпавший после окончания реакции солевой осадок отфильтровывают, промывают ацетоном, перекристаллизуют из смеси растворителей ацетон/метанол и высушивают в вакууме. Строение полученных соединений было подтверждено данными элементного анализа, ИК- и ЯМР-спектроскопии.
Пример 1. Гексанедил-1.6-бис(диметилгексадециламмоний бромид) (1)
получен кипячением 1.0 моли N,N,N',N'-тетраметилгексаметилендиамина в среде ацетонитрила с 2.2 молями гексадецилбромида в течение 40 часов. Выпавший после окончания реакции солевой осадок был отфильтрован, перекристаллизован из смеси растворителей - ацетон/этанол и высушен в вакууме.
1Н ЯМР (CDCl3, δ, м.д.; J, Гц): 0.89 [т, 6Н, 2х N+ CH2(CH2)13CH2 CH 3, J=7.0] 1.26-1.36 [уш.м, 52Н, 2х N+ CH2(CH 2)13CH2CH3] 1.60 [с, 4Н, 2х N+ CH2(CH2)13 CH 2CH3] 1.72-2.03 (м, 8Н, N+CH2(CH 2)4CH2N+) 3.39 [с, 12Н, 2х N+(CH 3)2] 3.45-3.56 [м, 4Н, 2х N+ CH 2(CH2)13CH2CH3N+ CH 2 sp.] 3.73-3.77 (м, 4Н, 2х N+ CH 2sp.)
ИК-спектр (KBr), ν/см-1: 2950, 2919, 2851, 1467, 1402, 1363, 1351, 1122, 1060, 974, 949, 900, 722.
Выход (84%). Формула: C42H90N2Br2. Вычислено (%): С 64.43, Н 11.58, N 3.58. Найдено (%): С 33, H 11.88, N 3.53.
Пример 2. Гексанедил-1.6-бис(диметилдециламмонимй бромид) (2)
получен кипячением 1.0 моли N,N,N',N'-тетраметилгексаметилендиамина в среде ацетонитрила с 2.2 молями децилбромида в течение 40 часов. Выпавший после окончания реакции солевой осадок был отфильтрован, перекристаллизован из смеси растворителей - ацетон/этанол и высушен в вакууме.
1Н ЯМР (CDCl3, δ, м.д.; J, Гц): 0.89 [т, 6Н, 2х N+CH2(CH2)7CH2 CH 3, J=7.0] 1.26-1.36 [уш.м, 28Н, 2х N+СН2(СН 2)7СН2СН3] 1.59 [с., 4Н, 2х N+СН2(CH2)7 CH 2CH3] 1.72-2.01 (м, 8Н, N+CH2(CH 2)4CH2N+) 3.38 [с, 12Н, 2х N+(CH 3)2] 3.46-3.56 [м, 4Н, 2х N+ СН 2(СН2)7СН2СН3] 3.72-3.76 (м., 4Н, 2х N+ CH 2sp.)
ИК-спектр (KBr), ν/см-1: 2953, 2922, 2853, 1485, 1467, 1401, 1377, 1128, 1062, 948, 898, 806, 724.
Выход (95%). Формула: C30H66N2Br2. Вычислено (%): С 58.62, Н 10.82, N 4.56. Найдено (%): С 58.31, Н 10.58, N 4.36.
Пример 3. Бутанедил-1.4-бис(гидроксиэтилметилгексадециламмоний бромид) (3)
получен кипячением 2.2 молей гидроксиэтилметилгексадециламина в среде ацетонитрила с 1.0 молем соответствующего α,β-дибромбутана в течение 50-60-часов. Выпавший после окончания реакции солевой осадок был отфильтрован, промыт ацетоном, перекристаллизован из смеси растворителей - ацетон/метанол и высушен в вакууме.
1Н ЯМР (CDCl3, δ, м.д.; J, Гц): 0.89 [т. 6Н, 2х N+ СН2(CH2)13CH2 CH 3, J=6.75] 1.27-1.36 [уш.м., 52Н, 2х N+ СН2(СН 2)13СН2СН3] 1.75 (с., 4Н, 2х N+ CH2(CH2)13 CH 2CH3] 2.12 (с., 4Н, N+CH2(CH 2)2CH2N+) 3.27 (с, 6Н, 2х N+ CH 3) 3.43-3.88 (м., 12Н, 2х N+ CH 2)3 4.12 (с., 4Н, 2х CH2 CH 2OH) 5.0 (с., 2Н, 2х CH2CH2OH).
ИК-спектр (KBr), ν/см-1: 3264, 2959, 2920, 2851, 1469, 1404, 1378, 1101, 1085, 1055, 721.
Выход (83%). Формула: C42H90O2N2Br2. Вычислено (%): С 61.89, Н 11.13, N 3.43. Найдено (%): С 61.72, Н 11.62, N 3.27.
Пример 4. Гексанедил-1.6-бис(гидроксиэтилметилгексадециламмоний бромид) (4)
получен кипячением 2.2 молей гидроксиэтилметилгексадециламина в среде ацетонитрила с 1.0 молем соответствующего α,β-дибромгексана в течение 50-60-часов. Выпавший после окончания реакции солевой осадок был отфильтрован, промыт ацетоном, перекристаллизован из смеси растворителей - ацетон/метанол и высушен в вакууме.
1Н ЯМР (CDCl3, δ, м.д.; J, Гц): 0.89 [т, 6Н, 2х N+ CH2(CH2)13CH2 CH 3, J=6.97] 1.27-1.367 [уш.м., 52Н, 2х N+ СН2(СН 2)13СН2СН3] 1.57 (с, 4Н, 2х N+ СН2(СН2)13 СН 2СН3] 1.73-1.98 (м, 8Н, N+CH2(CH 2)4CH2N+) 3.31 (с, 6Н, 2х N+ CH 3,) 3.50-3.73 (м, 12Н, 2х N+ CH 2)3 4.11 (с, 4Н, 2х CH2 CH 2OH) 5.06 (с, 2Н, 2х CH2CH2OH).
ИК-спектр (KBr), ν/см-1: 3227, 2918, 2850, 1468, 1377, 1095, 1058, 721.
Выход (87%). Формула: C44H94O2N2Br2. Вычислено (%): С 62.70, Н 11.16, N 3.33. Найдено (%): С 62.85, Н 11.73, N 3.35.
Пример 5. Додеканедил-1.12-бис(гидроксиэтилметилгексадециламмоний бромид) (5)
получен кипячением 2.2 молей гидроксиэтилметилгексадециламина в среде ацетонитрила с 1.0 молем соответствующего α,β-дибромдодекана в течение 50-60-часов. Выпавший после окончания реакции солевой осадок был отфильтрован, промыт ацетоном, перекристаллизован из смеси растворителей - ацетон/метанол и высушен в вакууме.
1Н ЯМР (CDCl3, δ, м.д.; J, Гц): 0.85 [т, 6Н, 2х N+CH2(CH2)13CH2 CH 3, J=7.13] 1.23-1.34 {уш.м., 68Н, [52Н, 2х N+CH2(CH 2)13CH2CH3+16H, (CH 2)8sp.]} 1.71 {с, 8Н [4Н, 2х N+CH2(CH2)13 CH 2CH3+4Н, 2х N+CH2 CH 2sp.]} 3.27 (с, 6Н, 2x N+ CH 3) 3.45-3.51 [м, 8H, 2x N+(CH 2)2] 3.65 (с, 4Н, 2х N+CH2 CH 2OH) 4.07 (с, 4Н, 2х N+ CH 2CH2OH) 5.06 (с, 2Н, 2х N+CH2CH2OH).
ИК-спектр (KBr), ν/см-1: 3261, 2919, 2850, 1469, 1379, 1085, 1053, 720.
Выход (92%). Формула: C50H106O2N2Br2. Вычислено (%): С 64.75, Н 11.52, N 3.02. Найдено (%): С 64.42, Н 11.17, N 3.05.
Биологическая активность (цитотоксичность, доставка ДНК в клетки)
Пример 6. Определение цитотоксичности соединений к клеткам линии 293Т
Цитотоксичность определяли с помощью 3-4,5-диметилтиазол-2-ил-2,5-дифенилтераразола (МТТ реагента). Культуру клеток человека линии НЕК293Т рассаживают по 40 тыс клеток на лунку 96-луночного планшета за день до определения цитотоксичности из расчета получить на следующий день 50-70% монослоя. За час до добавления МТТ-реагента клеткам дают свежую среду DMEM без сыворотки и антибиотика. Делают серию последовательных разведений потенциальных трансфектантов в фосфатно-солевом буфере (ФСБ×1) рН 7.0 с конечной концентрацией 10-3, 10-2, 0,1 и 1 мг/мл, добавляют к раствору плазмидной ДНК и аккуратно пипетируют один раз. По истечении 15 минут инкубирования липокомплексы с 0.6 мкг плазмидной ДНК в суммарном объеме 20 мкл добавляют к клеткам без значительного перемешивания. Параллельно к клеткам добавляют индивидуальные вещества без ДНК в соответствующем количестве. По истечении 48 часов инкубации с соединениями к пробам добавляют по 20 мкл р-ра МТТ (5 мг/мл). После 3 часов инкубации с МТТ удаляют среду из лунок, стараясь не затрагивать кристаллы, растворяют кристаллы формазана в 200 мкл ДМСО. Далее определяют оптическую плотность на приборе Тесал Sunrise Basic при длине волны 492 нм с вычитанием фона. По полученным данным определяется CD50 (концентрация соединения, при которой гибнет 50% популяции клеток). На диаграмме Фиг.1 представлены результаты определения цитотоксичности потенциальных трансфектантов методом МТТ-теста.
Штриховкой отмечены данные, соответствующие пробам ДНК+ исследуемые соединения, ромбами - пробы только с исследуемыми соединениями.
Как видно из диаграммы, заявляемые соединения (3-5) в комплексах с ДНК проявляют цитотоксичность, сравнимую с незамещенными аналогами (1) и (2). Все исследуемые соединения с ДНК оказывают менее токсичное воздействие на клетки, чем без ДНК. Полученные концентрации, при которых наблюдается 50% гибель клеток, оказываются ниже, чем требуется для эффективной доставки ДНК.
Пример 7. Проведение трансфекции с помощью соединения (5)
Монослойную культуру клеток человека линии НЕК293Т рассаживают по 40 тыс клеток на лунку за день до трансфекции из расчета получить на следующий день конфлуэнтность 50-70%. Для трансфекции НЕК293Т используют концентрацию 50-100 тыс клеток на лунку 96-луночного планшета. За час перед трансфекцией клеткам дают свежую среду DMEM без сыворотки и антибиотика. Трансфекции проводят также в 96-луночном планшете, эксперименты проводят в тройном повторе. Сначала делают серию последовательных разведений потенциальных трансфектантов в ФСБ (×1) рН 7.0 с конечной концентрацией 10-3, 10-2, 0,1 и 1 мг/мл, добавляют к раствору ДНК и аккуратно пипетируют один раз. По истечении 15 минут инкубирования липокомплексы с 0,6 мкг плазмидной ДНК peGFP-N1 (Clontech) в суммарном объеме 20 мкл добавляют к клеткам без значительного перемешивания. На следующие сутки флуоресценцию популяции клеток в планшете наблюдают на флуоресцентном микроскопе с обращенной оптикой. Через 48 часов после трансфекции проводят анализ методом проточной цитометрии, как описано далее. Получив результаты о предварительной функциональности новых соединений как трансфектантов, проводят оптимизацию соотношения количества трансфектанта к количеству плазмидной ДНК вблизи значений, при которых наблюдается максимальная трансфекционная эффективность. Используемый шаг в выбранном диапазоне составляет последовательное двукратное увеличение концентрации. Также оптимизируют продолжительность инкубации клеток с трансфекционной смесью и возможность комбинирования трансфекции. Оптимальное время инкубации с трансфектантом составляет 4 часа, по истечении которых среду в клетках меняют на полную среду DMEM с сывороткой и антибиотиком.
Определение эффективности трансфекции клеток методом проточной цитометрии
В исследовании степени трансфекции клеток используют метод проточной цитометрии. Каждую лунку планшета с клетками после инкубации с экспериментальными препаратами в течение 48 часов отмывают 200 мкл ФСБ (×1), обрабатывают трипсином, определяют цитотоксичность и фиксируют в 0,5% формалине. В полученной таким образом клеточной суспензии определяют методом проточной цитометрии процент клеток, экспрессирующих eGFP. Эта величина является мерой эффективности трансфекции. Клетки, инкубируемые без экспериментальных препаратов при тех же условиях, используют в качестве отрицательного контроля. Для сравнения проводится измерение процента eGFP положительных клеток, трансфицированных с помощью коммерческого препарата Metafectene easy по протоколу, предлагаемому производителем (Biontex, EU). Далее из полученных данных рассчитывают процент флуоресцентных клеток с использованием программы FACS Diva («Becton Dickinson», США), средние значения и стандартные отклонения для популяций. Результаты представляют как среднее значение и ошибку среднего для анализируемого соединения.
Микрофотография культуры трансфицированных клеток в флуоресцентном свете и данные эффективности трансфекции представлены на фигуре 2. Для соединения (5) наибольший процент трансфицированных клеток составляет 52±10% при концентрации 0.01 мг/мл (11 мкмоль/л). Эта рабочая концентрация ниже уровня CD50 (концентрации, при которой гибнет 50% популяции клеток), что говорит о малой токсичности соединения.
Пример 8. Проведение трансфекции с помощью соединения ЦТАБ
По указанному в примере 7 протоколу проводят тестирование трансфекционной эффективности соединения ЦТАБ. Получены результаты количества трансфицированных клеток на уровне контроля.
Пример 9. Проведение трансфекции с помощью соединения (1)
По указанному в примере 7 протоколу проводят тестирование трансфекционной эффективности соединения (1). Полученные результаты представлены на фигуре 3.
Для соединения (1) наибольший процент трансфицированных клеток составляет 6.2±1.2% при концентрации 0.01 мг/мл (130 мкмоль/л).
Пример 10. Проведение трансфекции с помощью соединения (2)
По указанному в примере 7 протоколу проводят тестирование трансфекционной эффективности соединения (2). Полученные результаты представлены на фигуре 4.
Для соединения (2) наибольший процент трансфицированных клеток составляет 1.6±0.6% при концентрации 0.1 мг/мл (160 мкмоль/л).
Сравнение результатов по исследованию трансфекции при помощи соединений (2) и (1) показывает, что увеличение гидрофобности (длины алкильного радикала) существенно улучшает эффективность трансфекции (процент трансфицированных клеток). Аналогичная корреляция прослеживается и для гидроксиэтилированных ГПАВ. Поэтому в качестве заявляемых соединений предлагаются наиболее активные гексадецильные производные (3-5)
Пример 11. Проведение трансфекции с помощью соединения ЦГАБ
По указанному в примере 7 протоколу проводят тестирование трансфекционной эффективности соединения ЦГАБ. Получены результаты количества трансфицированных клеток на уровне негативного контроля.
Пример 12. Проведение трансфекции с помощью соединения (3)
По указанному в примере 7 протоколу проводят тестирование трансфекционной эффективности соединения (3). Полученные результаты представлены на фигуре 5.
Наибольший процент трансфицированных клеток составляет 32±5% при концентрации 0.01 мг/мл (25 мкмоль/л). Таким образом, эта рабочая концентрация ниже уровня CD50 (концентрации, при которой гибнет 50% популяции клеток), что говорит о малой токсичности соединения.
Пример 13. Проведение трансфекции с помощью соединения (4)
По указанному в примере 7 протоколу проводят тестирование трансфекционной эффективности соединения (4). Полученные результаты представлены на фигуре 6.
Наибольший процент трансфицированных клеток составляет 6.2±0.2% при концентрации 0.1 мг/мл (120 мкмоль/л).
Данные эффективности трансфекции по результатам проточной цитометрии клеток НЕК293Т через 48 часов после трансфекции объединены в таблице 1.
| Таблица 1 | |||||||
| Соединение | Конц., мг/мл | % GFP(+) | Среднее значение | Станд. Откл. | Конц., мкмоль/л | ||
| 1 | 0.001 | 1 | 1.2 | 1.4 | 1.2 | 0.2 | 1 |
| 1 | 0.01 | 3.6 | 4.8 | 4.1 | 4.2 | 0.6 | 13 |
| 1 | 0.1 | 7.2 | 6.6 | 4.9 | 6.2 | 1.2 | 128 |
| 1 | 1 | 2.9 | 4.6 | 2.7 | 3.4 | 1.0 | 640 |
| 2 | 0.001 | 0.2 | 1 | 0.6 | 0.6 | 0.4 | 2 |
| 2 | 0.005 | 0.6 | 0.9 | 0.5 | 0.7 | 0.2 | 7 |
| 2 | 0.01 | 0.6 | 1.5 | 2 | 1.4 | 0.7 | 13 |
| 2 | 0.1 | 1.2 | 2.3 | 1.2 | 1.6 | 0.6 | 163 |
| 3 | 0.001 | 28 | 30 | 37 | 31.7 | 4.7 | 3 |
| 3 | 0.01 | 18 | 10 | 12 | 13.3 | 4.2 | 25 |
| 3 | 0.1 | 5 | 6.2 | 3.7 | 5.0 | 1.3 | 250 |
| 3 | 1 | 8.2 | 5.1 | 10.1 | 7.8 | 2.5 | 2500 |
| 4 | 0.2 | 4.8 | 6 | 5.8 | 5.5 | 0.6 | 238 |
| 4 | 0.1 | 6.1 | 6.1 | 6.4 | 6.2 | 0.2 | 119 |
| 4 | 0.05 | 4.4 | 6.2 | 6.3 | 5.6 | 1.1 | 59 |
| 5 | 0.002 | 0.6 | 1 | 0.6 | 0.8 | 0.3 | 2.3 |
| 5 | 0.004 | 44 | 37 | 50 | 43.7 | 6.5 | 5.5 |
| 5 | 0.01 | 52 | 41 | 61 | 51.3 | 10.0 | 11 |
| 5 | 0.02 | 6.9 | 8 | 5 | 6.6 | 1.5 | 22 |
| ЦТАБ | 0.001-0.1 | 0 | |||||
| ЦГАБ | 0.001-0.1 | 0 |
Данные табл.1 показывают, что
1. Гидроксиэтильные геминальные ПАВ проявляют более высокую трансфекционную эффективность при более низких концентрациях, чем соединения сравнения (монокатионные ПАВ ЦТАБ и ЦГАБ и незамещенные геминальные аналоги (1) и (2).
2. Среди заявляемых соединений наиболее высокий процент трансфицированных клеток получен для соединений (3) (m=4) и (5) (m=12).
3. Даже незначительное изменение структуры заявляемых ПАВ (изменение количества метиленовых звеньев в спейсере) приводит к значительному, в 5-9 раз, изменению эффективности трансфекции.
Таким образом, заявляемые гидроксиэтильные производные алкиламмонийного геминального поверхностно-активного вещества обладают способностью эффективно доставлять ДНК в клетки без вспомогательных агентов и низкой токсичностью.
Средство доставки ДНК в клетки, представляющее собой производные алкиламмонийного геминального поверхностно-активного вещества формулы: где m=4, 6, 12.