Комбинированный офтальмологический препарат в виде глазных капель, содержащий полигексаметиленгуанидин и таурин
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к офтальмологическим препаратам в виде глазных капель, и предназначено для лечения патологических состояний глаз, а также как репаративное средство при травмах роговицы. Препарат содержит разветвленный полигексаметиленгуанидин, присутствующий в форме гидрохлорида, таурин, промотирующий компонент, вспомогательные вещества и воду. При этом промотирующий компонент выбирают из янтарной кислоты или ее фармацевтически приемлемой соли, а вспомогательные вещества выбирают из группы, состоящей из физиологически переносимых щелочных или кислотных агентов и солевого тонического агента, выбранного из физиологически переносимых солей натрия или калия и их смесей. Использование изобретения позволяет повысить эффективность лечения патологических состояний глаз, а также возможной сопутствующей бактериальной инфекции. 2 з.п. ф-лы, 3 табл., 4 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к фармакологии и офтальмологии. Более конкретно, оно обеспечивает препарат в виде глазных капель для лечения патологических состояний глаз, таких как офтальмогипертензия и катаракта, а также действующий как репаративное средство при травмах роговицы, особенно осложненных бактериальными инфекциями. Препарат в соответствии с изобретением может найти применение в качестве дополнительного средства при подготовке пациентов к хирургическому вмешательству по поводу катаракты и средства против осложнений бактериального генеза в постоперационном периоде.
Уровень техники
В наиболее широком смысле термином «катаракта» определяют любое изменение оптической однородности или снижение прозрачности хрусталика глаза. В этиологию катаракты вовлечено множество факторов, таких как наследственность, старение организма, диабет, табакокурение, питание, кумулятивный эффект рентгеновского и УФ-излучений и нарушения эндокринного и/или ферментного равновесий в организме.
Перечисленные факторы негативно влияют на процессы электролитного обмена, что, в частности, приводит к нарушению клеточной осморегуляции и неблагоприятно изменяет проницаемость мембран клеток роговицы и сетчатки глаза. В публикации Копылов Г. В., Вислабоков И.И., Манцев В.В. // Биология. - 1989. - Сер.3. Т. 3. №1. С.62-66, было показано, что таурин нормализует электролитный обмен. Также в литературе имеются данные о нормализации белкового, углеводного и гормонального обмена при введении таурина. Перечисленные факторы способствовали введению таурина в офтальмологическую врачебную практику со второй половины 1970-х годов.
Офтальмогипертензия не является заболеванием как таковым, но представляет собой патологическое состояние повышенного внутриглазного давления, которое в норме находится в пределах 10-21 мм рт.ст. Стойкая или часто возникающая офтальмогипертензия может стать не только причиной развития глаукомы, но также привести к другим повреждениям глаза, ведущим к потере зрения, например к окклюзии ретинальной вены и неглаукоматозному разрушению слоя волокон зрительного нерва [Minckler D.S. «Histology of optic nerve damage in ocular hypertension and early glaucoma». Surv. Ophthalmol. Vol.33 (April 1989). P.401-411].
Имеются сведения о том, что инстилляции растворов таурина положительно влияют на гематоофтальмический барьер и достоверно снижают внутриглазное давление (ВГД). В статье Бунина А.Я., Ярцева Е.И., Колесникова Ю.А., Ермаковой В.Н., Яковлева А.А., Берниковой Т.А., Комлева Н.А. «Влияние таурина на внутриглазное давление и гемато-офтальмический барьер (экспериментальное исследование)» [Вопр. офт. №1 (1978). С.22-24] на модели простагландиновой гипертензии у кроликов показано, что инстилляция 4% раствора таурина задерживает во времени повышение ВГД и статистически достоверно снижает на 2-5 мм рт.ст. ВГД опытного глаза в течение всего эксперимента. Сходные результаты были получены и на модели солевой гипертензии глаз у макак резус. Таким образом, таурин оказывает гипотензивное действие на офтальмотонус, что может быть обусловлено угнетением секреции водянистой влаги.
Механические травмы роговицы, особенно полученные в отсутствие надлежащей медицинской помощи (например, в условиях стихийных бедствий, военных действий, экспедиций и др.), как правило, сопровождаются бактериальными инфекциями, что может иметь необратимые последствия для глаза вплоть до его потери.
Подготовка пациента к офтальмологическому оперативному вмешательству, в частности, по поводу катаракты, требует эрадикации бактериальных инфекций, способных вызвать постоперационные осложнения, особенно в случае пожилых паниентов или пациентов, страдающих сахарным диабетом (Suto С., Morinaga M., Yagi Т., Tsuji С., Toshida Н. «Conjunctival sac bacterial flora isolated prior to cataract surgery». Infect. Drug Resist. No.5 (2012). P.37-41). В первую очередь должна быть максимально снижена степень заражения типичными возбудителями конъюнктивита и блефарита. Поэтому существует потребность в офтальмологических препаратах с широким профилем антибактериальной активности, обладающих также гипотензивным и репаративным действием.
Из уровня техники известны различные офтальмологические препараты, содержащие таурин. В заявке ЕР0778021 (опубл. 11.06.1997) раскрыты глазные капли для ускорения регенерации роговицы после повреждения, содержащие 0,5-3,0% таурина, хлорид натрия, хлорид калия и бикарбонат натрия, имеющие рН от 5,5 до 8,0 и осмотическое давление от 250 до 450 мОсм.
Недостатком подобных препаратов таурина является их подверженность обсеменению патогенными микроорганизмами при хранении вскрытых упаковок, что делает их применение неэффективным и небезопасным.
В патенте RU 2127099 (опубл. 10.03.1999) раскрыты глазные капли, содержащие (в масс.%):
| натрия сукцинат шестиводный | 1,91 |
| натрия цитрат 5,5-водный | 0,40 |
| сорбит | 0,80 |
| натрия хлорид | 0,31 |
| L-глутаминовая кислота, | 0,015 |
| рибофлавин мононуклеотидфосфат | 0,02 |
| бензалкония хлорид | 0,014 |
| глюкоза | 0,30 |
| таурин | 0,4 |
| вода дистиллированная для инъекций | остальное |
Применение капель позволяет улучшить энергетический метаболизм в клетках переднего и заднего эпителия роговицы, а также в кератобластах при любых процессах, нарушающих этот обмен.
В патенте RU 2404768 (опубл. 10.03.1999) раскрыты глазные капли для профилактики и лечения катаракты, содержащие:
| таурин | 1,5-1,9 г |
| карнозин | 1,5-1,9 г |
| глутатион | не менее 0,01 г |
| декстран низкомолекулярный | |
| микродиспергированный | 10,5-15,0 г |
| бензалкония хлорид | 0,005-0,02 г |
| вода очищенная | до 100 мл |
В патенте RU 2295331 (опубл. 20.03.2007) раскрыты глазные капли репаративного и антиглаукомного действия, содержащие:
| таурин | 4 г |
| цианокобаламин | 0,025 г |
| декстран | 5,0 г |
| бензалкония хлорид | 0,01 г |
| вода очищенная | до 100 мл |
Применение бензалкония хлорида в качестве консерванта позволяет снизить степень загрязнения препарата микроорганизмами после начала применения из открытой упаковки, однако консерванты подобного типа обладают сильным местным раздражающим действием и являются аллергенами, что является их недостатком. Поэтому существует потребность в новых эффективных и безопасных средствах для лечения катаракты.
Раскрытие изобретения
В результате обширных исследований авторы настоящего изобретения установили, что недостатки известного уровня техники могут быть преодолены созданием комбинированного офтальмологического препарата в виде глазных капель, содержащего полигексаметиленгуанидин и таурин и дополнительно включающего сукцинат натрия.
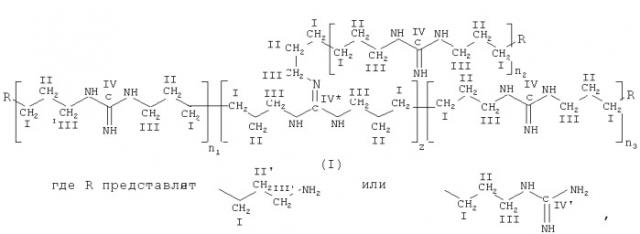
Таким образом, настоящее изобретение, направленное на расширение арсенала лекарственных средств, предоставляет офтальмологический препарат в виде капель, содержащий комбинацию активных компонентов, промотирующий компонент, вспомогательные вещества и воду, в котором комбинация активных компонентов состоит из разветвленного полигексаметиленгуанидина формулы (I)
n1, n2, и n3 равны 1-3, a z равно 0,15-1,10 с молекулярно-массовым распределением MW/Mn от 5,4 до 9,3 при среднемассовой молекулярной массе MW в интервале от приблизительно 3800 до 6300 и среднечисловой молекулярной массе Mn в интервале от приблизительно 600 до 1100, присутствующего в форме гидрохлорида, и таурина;
промотирующий компонент выбран из янтарной кислоты или ее фармацевтически приемлемой соли, со следующим содержанием компонентов (в масс.%):
| гидрохлорид полигексаметиленгуанидина | 0,03-0,5 |
| таурин | 1,0-5,0 |
| промотирующий компонент | 0,5-2,0 |
вспомогательные вещества выбраны из группы, состоящей из физиологически переносимых щелочных или кислотных агентов, присутствующих в количествах, требуемых для поддержания pH препарата в интервале от 6,0 до 7,8, и солевого тонического агента, выбранного из физиологически переносимых солей натрия или калия и их смесей, присутствующего в количестве, обеспечивающем тоничность препарата, сопоставимую с тоничностью естественной слезной жидкости здорового человека.
Предпочтительно в офтальмологическом препарате физиологически переносимый кислотный агент является хлористоводородной кислотой, присутствующей в количестве, требуемом для обеспечения pH препарата 6,0±0,1.
Также предпочтительно в офтальмологическом препарате физиологически переносимый щелочной агент является смесью дигидрофосфата калия и могогидрофосфата натрия, присутствующих в количествах, требуемых для поддержания pH препарата в интервале от 7,2 до 7,7.
Одним из технических результатов настоящего изобретения является ускорение восстановления тканей роговицы при травматическом повреждении, осложненном присоединенной бактериальной инфекцией. Другим техническим результатом является улучшение течения катаракты. Еще одним техническим результатом является возможность снижения лекарственной нагрузки аллергенными антибиотиками при подготовке пациента к офтальмологическому оперативному вмешательству, например, по поводу катаракты.
Сравнительное исследование действия препарата «Тауфон, глазные капли 4%» и препарата в соответствии с изобретением на модели травматической катаракты у кроликов выявило преимущество предлагаемого препарата по сравнению с известным, выражающееся в меньшей площади и интенсивности помутнения поврежденного участка хрусталика. В процессе проведения исследования не было обнаружено каких-либо побочных эффектов, а также признаков непереносимости и аллергизирующего действия предложенного препарата.
Таким образом, авторы подтверждают достижение заявленного технического результата изобретения.
Осуществление изобретения
Далее изобретение будет проиллюстрировано примерами его осуществления.
Пример 1. Приготовление глазных капель, не содержащих буферную смесь
В асептических условиях во взвешенную стерильную емкость загружают апирогенную дистиллированную воду, взятую в объеме 80-85% от объема готового препарата. При перемешивании в воде растворяют 0,05 г гидрохлорида полигексаметиленгуанидина (ПГМГ-ГХ), 1,00 г таурина, 2,00 г сукцината натрия и 0,70 г хлорида натрия, после чего pH раствора доводят до величины 6,0±0,1 добавлением 0,1 М раствора хлористоводородной кислоты. Массу полученной смеси доводят до 100,00 г добавлением апирогенной дистиллированной воды.
Стерилизацию раствора проводят при 120°С в течение 10-12 минут, после чего готовый препарат порциями по 5 мл фасуют в стерильные флаконы из полиэтилена высокого давления с капельницами, снабжают навинчиваемыми крышками и помещают в коробки с указанием информации, необходимой для идентификации и применения.
Пример 2. Приготовление глазных капель с буферной смесью
В асептических условиях во взвешенную стерильную емкость загружают апирогенную дистиллированную воду, взятую в объеме 85-90% от объема готового препарата, которую нагревают до 60°С. При перемешивании в горячей воде растворяют 0,03 г дигидрофосфата калия, 0,27 г моногидрофосфата натрия и 0,50 г сукцината натрия. Полученный раствор охлаждают до 25°С и вносят в него при перемешивании 0,50 г ПГМГ-ГХ, 5,00 г таурина и 0,1 г хлорида натрия. Смесь перемешивают до полного растворения компонентов.
Проводят стерилизующую фильтрацию через фильтр с отсекающей способностью 0,2 мкм, порциями по 2 мл асептически фасуют во флаконы из полиэтилена высокого давления с капельницами, снабжают навинчивающимися крышками и помещают в коробки с указанием информации, необходимой для идентификации и применения.
Пример 3. Исследование лечебного действия на модели травматической катаракты у кроликов
Исследование проводят на 24 кроликах породы «Белый великан» средней массой 4,75 кг возрастом 4-5 месяцев с моделью травматической катаракты, разделенных на группы по 6 особей (n в таблице 2).
После медикаментозного миоза, вызываемого двукратными инстилляциями в конъюнктивальную полость 1%-раствора пилокарпина гидрохлорида с интервалом в 15 минут, производят лазерную коагуляцию пигментной каймы зрачка с локализацией коагулятов 1,5-2,0 мм кнаружи от оптического центра хрусталика в меридиане 8-10 ч, вызывая травматическую катаракту. На радужку каждого глаза наносят 15-40 коагулятов. Параметры лазерного излучения: энергия импульса 1,6-2,2 Вт, длительность импульса 0,6 сек.
В соответствии с задачами исследования все животных разделяют на 4 группы (таблица 1).
| Таблица 1 | |
| Группа | Препарат и режим дозирования |
| 1 | Препарат в соответствии с примером 1; 1 мг/кг массы кролика 1 раз в сутки субконъюнктивально в течение 10 дней |
| 2 | Препарат в соответствии с примером 2; 1 мг/кг массы кролика 1 раз в сутки субконъюнктивально в течение 10-дней |
| 3 | «Таурин, глазные капли 4%», 1 мг/кг массы кролика 1 раз в сутки субконъюнктивально в течение 10 дней |
| 4 | Вода для инъекций по 0,3 мл кролику 1 раз в сутки субконъюнктивально в течение 10 дней |
В первую неделю биомикроскопию хрусталика и исследование его прозрачности проводят ежедневно, а в дальнейшем - еженедельно в проходящем свете с помощью щелевой лампы ЩЛ-2Б и налобного бинокулярного микроскопа (НБО-2) с использованием офтальмоскопических линз различной оптической силы.
Кроме того, у всех кроликов непосредственно после моделирования катаракты, а также через 1 и 2 месяца терапии сравниваемыми препаратами осуществляют фоторегистрацию характера помутнения хрусталика с помощью аппарата «Retcam-2» (производство Massive Research, США). Результаты динамического наблюдения за кроликами заносят в специальную регистрационную карту.
Через 30 минут после лазерного воздействия пигментная кайма зрачка в местах нанесения лазерных коагулятов приобретает молочно-белый цвет. На второй день эксперимента зрачок приобретает прежний размер и обнажает отдел хрусталика, подвергнутый воздействию лазерного излучения. Он представляет собой участок интенсивного помутнения капсулы и передних кортикальных слоев хрусталика подковообразной формы (проекция пигментной каймы суженного зрачка в момент лазерного воздействия). При этом тонкий участок помутнения, повторяющий контур края зрачка, окружен ореолом субкапсулярных вакуолей и участков развивающегося помутнения, не распространяющихся более чем на 1,5 мм от основного «контурного» помутнения.
Начиная с третьего-четвертого дня помутнение рассматриваемых участков хрусталика достигает максимальной интенсивности, глубины и площади и стабилизируется. Тенденция к обратному (крайне незначительному) развитию травматическая катаракта приобретает начиная с 30-го дня эксперимента. Однако даже через 60 суток лечения изучаемыми препаратами ни в одном случае не отмечено полного регресса помутнения хрусталика.
Площадь помутнения хрусталика определяют с помощью микрометрической сетки, накладываемой на полноразмерное изображение хрусталика, выполненное с помощью аппарата «Retcam-2», по формуле
S=N+n/2,
где S - площадь помутнения, мм2; N - число миллиметровых квадратиков, полностью «занятых» помутнением, n - число миллиметровых квадратиков, частично «занятых» помутнением.
Выраженность помутнения хрусталика оценивают по четырехбалльной шкале: «0» - полная прозрачность хрусталика; «1» - нежное облачковидное помутнение; «2» - выраженное помутнение, за которым еще угадывается ослабленный рефлекс с глазного дна; «3» - интенсивное плотное помутнение хрусталика при отсутствии в его проекции рефлекса с глазного дна. В связи с тем что помутнения хрусталика неоднородны, вычисляют усредненный коэффициент помутнения умножением выраженности помутнения в каждом его участке на его площадь с последующим суммированием и делением на общую площадь помутнения.
Результаты динамического наблюдения помутнений хрусталика у кроликов в группах, указанных в таблице 1, представлены в таблице 2.
| Таблица 2 | |||||
| Группа | n | Этап наблюдения | |||
| 30 сутки | 60 сутки | ||||
| Площадь, мм2 | Выраженность | Площадь, мм2 | Выраженность | ||
| 1 | 6 | 4,8±0,6 | 2,3±0,3 | 4,1±0,6 | 2,1±0,3 |
| 2 | 6 | 4,1±0,5 | 2,0±0,4 | 3,7±0,5 | 1,9±0,2 |
| 3 | 6 | 6,1±0,6 | 2,9±0,2 | 5,2±0,6 | 2,3±0,3 |
| 4 | 6 | 6,4±0,7 | 3,1±0,3 | 6,1±0,5 | 2,7±0,3 |
Препарат в соответствии с примерами 1 и 2 изобретения по результатам обследования на 30-е сутки эксперимента оказался статистически значимо эффективнее препарата «Тауфон, глазные капли 4%». В контрольной группе 4 площадь, глубина и интенсивность помутнения оставались более стабильными, чем у животных, получавших терапию.
По результатам дальнейшего наблюдения за кроликами, проведенного в период с 30-го по 60-й день эксперимента, установлена более заметная стабилизация и замедление развития помутнений в хрусталиках (площади, глубины и выраженности помутнения), в особенности в группе 2, получавшей терапию препаратом в соответствии с примерами 1 и 2 изобретения.
Пример 4. Определение спектра бактерицидной эффективности препаратов in vitro и минимальной бактериостатической (подавляющей рост) концентрации (МПК)
Спектр бактерицидной эффективности препаратов в опыте in vitro характеризуют суспензионным методом в соответствии с руководством P 4.2.2643-10 «Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности». Исследуют 0,05% раствор гидрохлорида полигексаметиленгуанидина формулы (I) (Г-ПГМГ) и препараты, приготовленные в соответствии с примерами 1 и 2 изобретения.
Минимальную бактериостатическую (МПК) концентрацию определяют микрометодом серийных двукратных разведений в среде Мюллера-Хинтона (Oxoid) в соответствии с нормативным документом «Методические указания по определению чувствительности микроорганизмов к антибактериальным препаратам» (МУК 4.2 1890-04).
Препараты с концентрацией активного компонента 1000 мкг/мл, приготовленные на апирогенной дистиллированной воде, разводят 128 мкг/мл питательной среды. Исследования выполняют в 96-луночных планшетах для иммунологических исследований. Готовят серии двукратных разведений исследуемого препарата в среде II Мюллера-Хинтона (Oxoid) в объеме 50 мкл. Для микроорганизмов, плохо растущих на обычных питательных средах, в указанную выше среду добавляют 5% дефибринированной бараньей крови.
Инокулят бактериальных культур из изолированных колоний готовят в виде суспензии по стандарту мутности МакФарланда (0,5) в физиологическом растворе. Суспензию разводят в среде II Мюллера-Хинтона до концентрации 108 КОЕ/мл. Приготовленную суспензию вносят в лунки планшетов (50 мкл/лунка) и готовят разведения в диапазоне концентраций от 128 до 0,0003 мкг/мл. Инокулированные планшеты инкубируют в течение 18 часов при 37°С. Наименьшая концентрация исследуемого препарата, при которой отсутствует видимый рост микроорганизмов, является оценкой МПК.
Для определения МПК Candida albicans из изолированной колонии готовят суспензию в питательной среде Сабуро по стандарту мутности МакФарланда (0,5), что соответствует 106 КОЕ/мл для грибных культур. Серию двукратных разведений препаратов готовят в среде Сабуро в объеме 100 мл. После посева дрожжевых культур планшеты инкубируют 48 часов при 30°С.
Результаты действия на МПК серии последовательных двукратных разведений представлены в таблице 3.
| Таблица 3 | |||
| Микроорганизм (Штамм) | Г-ПГМГ | Препарат | |
| Пример 1 | Пример 2 | ||
| Eschenchia coli (АТСС 27952) | 2 | 4 | 8 |
| Proteus mirabilis (5) | 1 | 1 | 4 |
| Staphylococcus aureus (ATCC 29213, чувствителен к метициллину) | 2 | 4 | 8 |
| Staphylococcus aureus (АТСС 43300, устойчив к метициллину) | 2 | 4 | 4 |
| Candida albicans (АТСС 24433) | 4 | 8 | 16 |
| Streptococcus oralis (1105007) | 1 | 2 | 4 |
| Streptococcus pyogenes (151023) | 2 | 8 | 8 |
Полученные данные свидетельствуют о том, что предлагаемый препарат обладает более высокой активностью по сравнению с раствором ПГМГ-ГХ.
1. Офтальмологический препарат в виде капель, содержащий комбинацию активных компонентов, промотирующий компонент, вспомогательные вещества и воду, отличающийся тем, что комбинация активных компонентов состоит из разветвленного полигексаметиленгуанидина формулы (I) n1, n2 и n3 равны 1-3, a z равно 0,15-1,10 с молекулярно-массовым распределением MW/Mn от 5,4 до 9,3 при среднемассовой молекулярной массе MW в интервале от приблизительно 3800 до 6300 и среднечисловой молекулярной массе Mn в интервале от приблизительно 600 до 1100, присутствующего в форме гидрохлорида, и таурина;промотирующий компонент выбран из янтарной кислоты или ее фармацевтически приемлемой соли, со следующим содержанием компонентов (в масс.%):
| гидрохлорид полигексаметиленгуанидина | 0,03-0,5 |
| таурин | 1,0-5,0 |
| промотирующий компонент | 0,5-2,0 |
2. Офтальмологический препарат по п.1, отличающийся тем, что физиологически переносимый кислотный агент является хлористоводородной кислотой, присутствующей в количестве, требуемом для обеспечения pH препарата 6,0±0,1.
3. Офтальмологический препарат по п.1, отличающийся тем, что физиологически переносимый щелочной агент является смесью дигидрофосфата калия и могогидрофосфата натрия, присутствующих в количествах, требуемых для поддержания pH препарата в интервале от 7,2 до 7,7.