Сорбционное извлечение ионов кобальта из кислых хлоридных растворов
Иллюстрации
Показать всеИзобретение относится к сорбционному извлечению ионов кобальта Со2+ из кислых хлоридных растворов и может быть использовано в цветной и черной металлургии, а также для очистки промышленных и бытовых стоков. Сорбцию ионов Со2+ ведут из солянокислых растворов, содержащих хлориды аммония или щелочных или щелочноземельных металлов, на анионитах, выбранных из анионитов марок:
АМП, содержащего обменные группы
или АМ-2б, содержащего обменные группы
при этом техническим результатом является нахождение оптимальных условий для сорбции ионов кобальта на анионитах. 4 ил., 4 пр.
Реферат
Сорбционное извлечение ионов кобальта из кислых хлоридных растворов относится к области извлечения веществ с использованием сорбентов и может быть использовано в цветной и черной металлургии, а также для очистки промышленных и бытовых стоков.
Известно применение катионитов и анионитов в гидрометаллургии для очистки растворов соответственно от катионов и анионов металлов [Г.М.Вольдман, А.Н.Зеликман. Теория гидрометаллургических процессов. М.: Металлургия. 1993. С.263-267].
Однако применение анионитов для извлечения катионов металлов недостаточно исследовано и представляет интерес для нахождения дополнительных возможностей селективного извлечения ионов металлов из растворов сложного состава.
Наиболее близким техническим решением является извлечение ионов кобальта из солянокислых растворов сорбцией на сильно основных анионобменных смолах [Р.Рипан, И.Четяну. Неорганическая химия, т.2. Химия металлов. Из-во «Мир», М., 1972. С.545].
Недостатком способа является то, что не указаны конкретные условия сорбции, а также возможности использования других анионитов для сорбции ионов кобальта.
Задачей, на решение которой направлено заявленное изобретение, является нахождение оптимальных условий для сорбции ионов кобальта на анионитах марок АМ-2б и АМП.
Техническим результатом, который может быть достигнут при осуществлении изобретения, является эффективная сорбция ионов кобальта на анионитах.
Этот технический результат достигается тем, что сорбционное извлечение ионов кобальта из солянокислых растворов включает контактирование раствора с анионитом, сорбцию ионов Со2+ при температуре 70-80°С ведут из солянокислых растворов, насыщенных хлоридами аммония, щелочных и щелочноземельных металлов, на анионитах марок
АМП, содержащих обменные группы
и АМ-2б, содержащих обменные группы
Сущность способа заключается в том, что ионы Со2+ в солянокислых растворах образуют устойчивые анионные комплексы типа [CoCl]2-, которые могут количественно удерживаться на сильноосновных анионных смолах.
Известно, что хлоридная гидрометаллургия находит применение в процессах выщелачивания полиметаллических концентратов. Использование соляной кислоты вследствии повышенной ее способности к комплексообразованию интересно в схемах, включающих сорбционно-экстракционную технологию разделения металлов.
Примеры конкретного выполнения способа.
Рассмотрены возможности использования анионитов марок АМП и АМ-2б для извлечения хлоридных анионных комплексов кобальта из солянокислых растворов.
Пористый анионит АМ-2б смешанной основности со сферическими гранулами получен аминированием ХМС стирола и ДВБ смесью диметил- и триметиламинов. Крупность гранул 0,63-1,60 мм; удельный объем набухшей смолы 2,7-3,2 см3/г; удельная поверхность 50-100 м2/г; общий объем пор 0,80-0,87 см3/г, механическая прочность 98-99%; ПОЕ 3,3-3,7 мг-экв/г. Обменные группы:
Гелевый высокоосновный анионит АМП со сферическими гранулами получен аминированием ХМС стирола и 3,5-4,0% ДВБ пиридином. Крупность гранул 0,63-1,60 мм; удельный объем набухшей смолы 2,7-2,9 см3/г; механическая прочность 98-99%; ПОЕ 3,3-3,7 мг-экв/г.Обменные группы:
Сорбцию ионов кобальта осуществляли при 70-80°С из растворов хлоридов аммония NH4Cl, щелочных (NaCl, KС1) и щелочноземельных (CaCl2) металлов, подкисленных HCl. Объем раствора 100 см3, масса сухого сорбента 1 г. Сорбент предварительно выдерживали в дистиллированной воде. Время сорбции 30-60 мин.
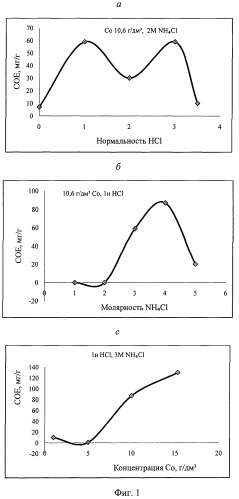
На фиг.1-4 даны результаты сорбции ионов кобальта на анионите марки АМП, где указаны исходная концентрация иона металла, г/дм3, нормальная концентрация соляной кислоты, молярная концентрация хлоридов солей, СОЕ, мг/г - обменная емкость в равновесном состоянии.
На графиках фиг.1-4 даны
а - зависимости СОЕ от нормальной концентрации HCl при фиксированных концентрации CoCl2, г/дм, и молярной концентрации хлоридов солей,
б - зависимость СОЕ от молярной концентрации хлоридов солей при фиксированных концентрации CoCl2, г/дм, и нормальной концентрации HCl,
с - зависимость СОЕ от концентрации CoCl2, г/дм3, при фиксированных молярных концентрациях хлоридов солей и нормальной концентрации HCl.
Пример 1 (фиг.1).
Сорбцию осуществляли из солянокислых растворов, содержащих NH4Cl.
Из данных фиг.1 следует, что получены высокие показатели сорбции ионов кобальта на анионите марки АМП из солянокислых растворов хлоридов кобальта и аммония. Максимальные показатели сорбции СОЕ>140 мг/г получены из растворов 1н. HCl и 3М NH4Cl.
Пример 2 (фиг.2).
Сорбцию осуществляли из солянокислых растворов, содержащих NaCl.
Из данных фиг.2 следует, что получены высокие показатели сорбции ионов кобальта на анионите марки АМП из солянокислых растворов хлоридов кобальта и натрия. Максимальные показатели сорбции СОЕ=140 мг/г получены из растворов 2н. HCl 60 г/дм3 NaCl.
Пример 3 (фиг.3).
Сорбцию осуществляли из солянокислых растворов, содержащих KСl.
Из данных фиг.3 следует, что получены высокие показатели сорбции ионов кобальта на анионите марки АМП из солянокислых растворов хлоридов кобальта и калия. Максимальные показатели сорбции СОЕ=120 мг/г получены из растворов 1н. HCl и 3М KCl.
Пример 4 (фиг.4).
Сорбцию осуществляли из солянокислых растворов, содержащих CaCl2.
Из данных фиг.4 следует, что получены высокие показатели сорбции ионов кобальта на анионите марки АМП из солянокислых растворов хлоридов кобальта и аммония. Максимальные показатели сорбции СОЕ>150 мг/г получены из растворов 3н. НСl и 2М CaCl2.
Пример 5.
Сорбцию осуществляли из солянокислых растворов на анионите марки АМ-2б.
Максимальные показатели сорбции ионов кобальта получены в следующих условиях:
- Раствор: 10 г/дм Со, 2М NH4Cl, 1н. HCl. Время достижения равновесия 30 мин. Равновесная концентрация 9,7 г/дм. СОЕ 28 мг/г.
- Раствор содержит 21 г/дм Со, NaCl 60 г/дм, 2н. НСl. Время достижения равновесия 60 мин. Равновесная концентрация 7,95 г/л. СОЕ=265 мг/г.
- Раствор: 10,7 г/дм Со, 3М KСl, 1н. НСl. Время достижения равновесия 30 мин. Равновесная концентрация 9,7 г/дм. СОЕ 98 мг/г.
- Раствор: 11,8 г/дм Со, 4М CaCl2, 3н. НСl. Время достижения равновесия 30 мин. Равновесная концентрация 9,97 г/дм3. СОЕ 184 мг/г.
- Раствор: 10 г/дм Со, 2М NH4Cl, 1н. HCl. Время достижения равновесия 30 мин. Равновесная концентрация 9,7 г/дм. СОЕ 28 мг/г.
По сравнению с прототипом показаны возможности эффективной сорбции ионов Со2+ из кислых хлоридных растворов на анионитах марок АМП и АМ-2б.
Способ сорбционного извлечения ионов кобальта Со2+ из кислых хлоридных растворов, включающий контактирование раствора с анионитом, отличающийся тем, что сорбцию ионов Со2+ ведут из солянокислых растворов, содержащих хлориды аммония или щелочных или щелочноземельных металлов, на анионитах, выбранных из группы марок:АМП, содержащего обменные группы или АМ-2б, содержащего обменные группы