Пептиды эпитопа wdrpuh и вакцины, содержащие их
Иллюстрации
Показать всеИзобретение относится к пептидам, обладающим способностью индуцировать цитотоксические Т-клетки, содержащим аминокислотную последовательность из SEQ ID NO: 1, 2, 3, 4, 16, 17, 30, 31, 34, 36, 37, 40, 41, 45, 49, 55, 57 и 61, а также к пептидам, содержащим указанные выше аминокислотные последовательности, в которых 1, 2 или несколько аминокислот замещены и/или добавлены. Настоящее изобретение также относится к лекарственным средствам для лечения или предотвращения опухолей, причем лекарственные средства содержат указанные пептиды. Пептиды по настоящему изобретению могут также применяться в качестве вакцин. 9 н. и 5 з.п. ф-лы, 5 ил., 2 табл., 1 пр.
Реферат
Область техники
По настоящей заявке испрашивается приоритет предварительной заявки на патент США № 61/200962, поданной 5 декабря 2008 г., и № 61/209704, поданной 9 марта 2009 г., полное содержание которых включено в настоящее описание путем ссылки.
Настоящее изобретение относится к области биологической науки, конкретнее к области лечения рака. В частности, настоящее изобретение относится к новым пептидам, которые высоко эффективны в качестве противораковых вакцин, и к лекарственным средствам для лечения и профилактики опухолей.
Предшествующий уровень техники
Было продемонстрировано, что CD8-положительные цитотоксические T лимфоциты (CTL) распознают пептиды эпитопов, происходящие из связанных с опухолями антигенов (TAA), обнаруживаемых на молекулах I класса главного комплекса гистосовместимости (MHC), и затем уничтожают опухолевые клетки. Со времени обнаружения семейства антигенов меланомы (MAGE) в качестве первого примера TAA было обнаружено много других TAA, в первую очередь посредством иммунологических подходов (Boon T, Int J Cancer 1993 May 8, 54(2): 177-80; Boon T & van der Bruggen P, J Exp Med 1996 Mar 1, 183(3): 725-9). Некоторые из этих TAA в настоящее время подвергаются клинической разработке в качестве иммунотерапевтических мишеней.
Идентификация новых TAA, способных вызывать мощные и специфические противоопухолевые иммунные ответы, гарантируют дальнейшую разработку и клиническое применение стратегий пептидных вакцинаций по поводу различных типов злокачественных новообразований (Harris CC, J Natl Cancer Inst 1996 Oct 16, 88(20): 1442-55; Butterfield LH et al., Cancer Res 1999 Jul 1, 59(13): 3134-42; Vissers JL et al., Cancer Res 1999 Nov 1, 59(21): 5554-9; van der Burg SH et al., J Immunol 1996 May 1, 156(9): 3308-14; Tanaka F et al., Cancer Res 1997 Oct 15, 57(20): 4465-8; Fujie T et al., Int J Cancer 1999 Jan 18, 80(2): 169-72; Kikuchi M et al., Int J Cancer 1999 May 5, 81(3): 459-66; Oiso M et al., Int J Cancer 1999 May 5, 81(3): 387-94). К настоящему времени было несколько сообщений о клинических испытаниях использования этих пептидов, происходящих из связанного с опухолью антигена. К сожалению, пока в указанных испытаниях противораковых вакцин наблюдалась лишь низкая объективная частота реакции (Belli F et al., J Clin Oncol 2002 Oct 15, 20(20): 4169-80; Coulie PG et al., Immunol Rev 2002 Oct, 188: 33-42; Rosenberg SA et al., Nat Med 2004 Sep, 10(9): 909-15).
В качестве мишени для иммунотерапии подходят TAA, незаменимые для пролиферации и выживания раковых клеток, потому что применение таких TAA может минимизировать достаточно описанный риск иммунного избегания раковых клеток, которое можно отнести на счет делеции, мутации или подавляющей регуляции TAA как последствия терапевтически запускаемого иммунного отбора.
WDRPUH был идентифицирован в качестве нового белка повтора WD, который стимулируется при печеночно-клеточной карциноме, посредством профиля генной экспрессии с использованием микрочипа кДНК шириной генома, содержащего 23040 генов (Silva et al., Neoplasia 2005 Apr;7(4):348-55, WO 2003/104276). Сообщалось, что белки, содержащие повтор WD, играют ключевые роли в широком диапазоне физиологических функций, включая передачу сигналов, процессинг РНК (Bjorn et al., Mol Cell Biol. 1989 Sep;9(9):3698-709.), перестройку цитоскелета (Vaisman et al., Mol Gen Genet. 1995 Apr 20;247(2):123-36), регуляцию везикулярного трафика (Pryer et al., J Cell Biol. 1993 Feb;120(4):865-75), и клеточное деление (Feldman et al., Cell. 1997 Oct 17;91(2):221-30). Анализ с использованием норзерн-блоттинга продемонстрировал, что WDRPUH избыточно экспрессирован на значительно высоком уровне в подавляющем большинстве печеночно-клеточных карцином, не был экспрессирован в нормальных органах, за исключением семенников. Кроме того, было показано, что подавление экспрессии WDRPUH под действием siРНК (малых интерферирующих РНК) значительно ингибировало рост линий клеток печеночно-клеточной карциномы человека (Silva et al., Neoplasia 2005 Apr;7(4):348-55, WO 2003/104276).
Список ссылок
Патентная литература
WO 2003/104276
Не патентная литература
1. Boon T, Int J Cancer 1993 May 8, 54(2): 177-80
2. Boon T & van der Bruggen P, J Exp Med 1996 Mar 1, 183(3): 725-9
3. Harris CC, J Natl Cancer Inst 1996 Oct 16, 88(20) 1442-55
4. Butterfield LH et al., Cancer Res 1999 Jul 1, 59(13), 3134-42
5. Vissers JL et al., Cancer Res 1999 Nov 1, 59(21): 5554-9
6. van der Burg SH et al., J Immunol 1996 May 1, 156(9): 3308-14
7. Tanaka F et al., Cancer Res 1997 Oct 15, 57(20): 4465-8
8. Fujie T et al., Int J Cancer 1999 Jan 18, 80(2): 169-72
9. Kikuchi M et al., Int J Cancer 1999 May 5, 81(3): 459-66
10. Oiso M et al., Int J Cancer 1999 May 5, 81(3): 387-94
11. Belli F et al., J Clin Oncol 2002 Oct 15, 20(20): 4169-80
12. Coulie PG et al., Immunol Rev 2002 Oct, 188: 33-42
13. Rosenberg SA et al., Nat Med 2004 Sep, 10(9): 909-15
14. Silva et al., Neoplasia 2005 Apr;7(4):348-55
15. Bjorn et al., Mol Cell Biol. 1989 Sep;9(9):3698-709
16. Vaisman et al., Mol Gen Genet. 1995 Apr 20;247(2):123-36)
17. Pryer et al., J Cell Biol. 1993 Feb;120(4):865-75
18. Feldman et al., Cell. 1997 Oct 17;91(2):221-30
Краткое описание сущности изобретения
Настоящее изобретение частично основано на обнаружении подходящих мишеней для иммунотерапии. Ввиду того, что иммунная система в целом воспринимает TAA как «себя», то они поэтому часто не обладают врожденной иммуногенностью, и обнаружение соответствующих мишеней имеет очень большое значение. Как отмечено выше, поскольку была идентифицирована стимуляция WDRPUH (SEQ ID NO: 64, кодируемая геном, депонированным в Генном Банке под номером доступа NM_145054 (SEQ ID NO: 63)) в опухолевой ткани печеночно-клеточной карциномы, то WDRPUH является перспективной мишенью для иммунотерапии.
Настоящее изобретение, по меньшей мере частично, основано на идентификации специфических пептидов эпитопов генных продуктов WDRPUH, которые обладают способностью индуцировать CTL (цитотоксические Т-лимфоциты), специфичные для WDRPUH. Как детально обсуждается ниже, мононуклеарные клетки периферической крови (PBMC), полученные у здорового донора, стимулировались с использованием связывающих HLA-A*2402 или HLA-A*0201 перспективных пептидов, полученных из WDRPUH. Затем получали устоявшиеся линии CTL со специфической цитотоксичностью против HLA-A24- или HLA-A2-положительных клеток-мишеней, подвергнутых пульсирующему воздействию каждого из перспективных пептидов. Результаты продемонстрировали, что указанные пептиды представляют собой ограниченные HLA-A24 или HLA-A2 пептиды эпитопов, которые могут вызывать мощные и специфические иммунные реакции против клеток, экспрессирующих WDRPUH, на поверхности. Кроме того, это указало на то, что WDRPUH является сильно иммуногенным, и его эпитопы представляют собой эффективные мишени для иммунотерапии опухолей.
Соответственно, целью настоящего изобретения является получение изолированных пептидов, которые связываются с HLA-антигеном, причем пептиды состоят из WDRPUH (SEQ ID NO: 64) или фрагмент WDRPUH. Ожидается, что такие пептиды обладают способностью индуцировать CTL и могут применяться для индукции CTL in ex vivo или для введения индивиду для индукции иммунных реакций против злокачественных новообразований, таких как печеночно-клеточная карцинома. Пептиды могут представлять собой нонапептиды или декапептиды, предпочтительно, состоящие из аминокислотной последовательности, выбранной среди SEQ ID NO: 1, 2, 3, 4, 16, 17, 30, 31, 34, 36, 37, 40, 41, 45, 49, 55, 57 и 61, которые проявляют способность индуцировать CTL.
Кроме того, настоящее изобретение предусматривает модифицированные пептиды, имеющие аминокислотную последовательность SEQ ID NO: 1, 2, 3, 4, 16, 17, 30, 31, 34, 36, 37, 40, 41, 45, 49, 55, 57 и 61, где одна, две или более аминокислот замещены, вставлены, делетированы или добавлены, пока модифицированные пептиды сохраняют первоначальную способность индуцировать CTL.
Еще одной целью изобретения является получение изолированных полинуклеотидов, кодирующих любой из пептидов по настоящему изобретению. Эти полинуклеотиды могут применяться для индукции экспрессирующих антиген клеток (APC), имеющие способность индуцировать CTL, или для введения индивиду с целью вызова иммунных реакций против пептидов по настоящему изобретению и, таким образом, в конечном счете, против злокачественных новообразований.
При введении индивиду, пептиды по настоящему изобретению представляются на поверхности APC (антигенпрезентирующих клеток) и затем индуцируют CTL, нацеливающие соответствующие пептиды. Поэтому целью настоящего изобретения является получение агентов, содержащих любые из пептидов или полинуклеотидов по настоящему изобретению, для индукции CTL. Эти агенты, содержащие любые из пептидов или полинуклеотидов по настоящему изобретению, могут применяться для лечения и/или профилактики злокачественных новообразований, таких как печеночно-клеточная карцинома, и/или предотвращения их послеоперационного рецидива. Таким образом, еще одной целью настоящего изобретения является получение фармацевтических средств для лечения и/или профилактики злокачественных новообразований и/или предотвращения их послеоперационного рецидива, которые содержат любые из пептидов или полинуклеотидов по настоящему изобретению. Агенты или фармацевтические средства по настоящему изобретению могут также содержать в качестве активных ингредиентов APC или экзосомы, которые представляют любые из присутствующих пептидов вместо или в дополнение к пептидам или полинуклеотидам по настоящему изобретению.
Пептиды или полинуклеотиды по настоящему изобретению способны индуцировать APC, присутствующим на их поверхности комплексом HLA-антигена и пептида по настоящему изобретению. Например, индукция может быть достигнута контактом APC, полученным у индивида, с пептидом по настоящему изобретению или введением полинуклеотида, кодирующего пептид по настоящему изобретению в APC. Такие APC имеют высокую способность индуцировать CTL против пептидов-мишеней и могут применяться для иммунотерапии злокачественных новообразований. Поэтому еще одной целью настоящего изобретения является разработка способов индукции APC, обладающих способностью индуцировать CTL, и получение APC указанными способами.
Еще одной целью настоящего изобретения является разработка способов индукции CTL, причем способы включают стадию совместного культивирования CD8-положительных клеток с APC или экзосомами, представляющими пептид по настоящему изобретению на их поверхности, или стадию введения полинуклеотида в T-клетку, причем полинуклеотид кодирует полипептид субъединицы T-клеточного рецептора (TCR), связывающийся с пептидом по настоящему изобретению. CTL, полученные указанными способами, могут применяться для лечения и/или профилактики злокачественных новообразований, таких как печеночно-клеточная карцинома. Поэтому еще одной целью настоящего изобретения является получение CTL любым из способов по настоящему изобретению.
Другой целью настоящего изобретения является разработка способов индукции иммунной реакции против злокачественных новообразований, причем способы включают стадию введения средства, содержащего любой из полипептидов WDRPUH, полинуклеотидов, кодирующих полипептиды WDRPUH, экзосом или APC, представляющих полипептиды WDRPUH по настоящему изобретению.
Настоящее изобретение может найти применение при любых заболеваниях, связанных с избыточной экспрессией WDRPUH, включая без ограничения злокачественное новообразование, в частности печеночно-клеточную карциному.
Следует понимать, что и предшествующее краткое описание сущности изобретения, и следующее детальное описание относятся к иллюстрируемым вариантам осуществления, а не являются ограничивающими изобретение или другие альтернативные варианты осуществления изобретения.
Краткое описание чертежей
Различные аспекты и способы применения настоящего изобретения станут очевидными для специалиста в данной области после рассмотрения краткого описания чертежей и детального описания настоящего изобретения и следующего описания его предпочтительных вариантов осуществления.
Фиг. 1 включает серию фотографий, изображающих результаты ELISPOT (иммуноферментного спот-анализа) анализа IFN-гамма (интерферона-гамма) на CTL, которые были индуцированы пептидами, происходящими из WDRPUH. CTL в лунках №№ 3 и 6, стимулированные WDRPUH-A24-9-40 (SEQ ID NO: 1) (a), № 8 - WDRPUH-A24-9-314 (SEQ ID NO: 2) (b), №№ 2 и 6 - WDRPUH-A24-9-509 (SEQ ID NO: 3) (c), № 1, № 2 и № 5 - WDRPUH-A24-9-339 (SEQ ID NO: 4) (d), № 2, № 3, № 4, № 6, № 7 и № 8 -WDRPUH-A24-10-409 (SEQ ID NO: 16) (e) и № 5, № 6 и № 8 - WDRPUH-A24-10-40 (SEQ ID NO: 17) (f) проявили активную продукцию IFN-гамма, по сравнению с контролем, соответственно. Клетки в лунках, обозначенные прямоугольной рамкой, размножали для получения установившихся линий CTL. На рисунке «+» указывает, что клетки в лунках подвергались пульсирующему воздействию соответствующих пептидов, а «-» указывает на то, что клетки не подвергались пульсирующему воздействию никакими пептидами.
Фиг. 2 включает серию линейных графиков, изображающих продукцию IFN-гамма линиями CTL, стимулированными WDRPUH-A24-9-40 (SEQ ID NO: 1) (a), WDRPUH-A24-9-314 (SEQ ID NO: 2) (b), WDRPUH-A24-9-509 (SEQ ID NO: 3) (c), WDRPUH-A24-9-339 (SEQ ID NO: 4) (d), WDRPUH-A24-10-409 (SEQ ID NO: 16) (e) и WDRPUH-A24-10-40 (SEQ ID NO: 17) (f) с ELISA (иммуноферментным) анализом IFN-гамма. Линии CTL, установившиеся стимуляцией каждым из пептидов, проявили активную продукцию IFN-гамма, по сравнению с контролем. На рисунке «+» указывает, что клетки в лунках подвергались пульсирующему воздействию соответствующих пептидов, а «-» указывает на то, что клетки не подвергались пульсирующему воздействию никакими пептидами.
Фиг. 3 составлена из линейного графика, изображающего специфическую активность CTL против клеток-мишеней, которые экзогенно экспрессируют WDRPUH и HLA-A*2402. Клетки COS7, трансфецированные только HLA-A*2402, или только геном WDRPUH полной длины, были получены в качестве контроля. Линия CTL, установившаяся WDRPUH-A24-9-314 (SEQ ID NO: 2), проявила специфическую активность CTL против клеток COS7, трансфецированных и WDRPUH, и HLA-A*2402 (черный ромб). Напротив, не была выявлена специфическая активность CTL против клеток-мишеней, экспрессирующих или HLA-A*2402 (треугольник), или WDRPUH (кружок).
Фиг. 4a-h включает серию фотографий, изображающих результаты ELISPOT-анализа IFN-гамма на CTL, которые были индуцированы пептидами, происходящими из WDRPUH. CTL в лунках №№ 2 и 7, стимулированные WDRPUH-A2-9-39 (SEQ ID NO: 30) (a), № 2 - WDRPUH-A2-9-407 (SEQ ID NO: 31) (b), № 3 - WDRPUH-A2-9-288 (SEQ ID NO: 34) (c), № 6 - WDRPUH-A2-9-237 (SEQ ID NO: 36) (d), № 4 - WDRPUH-A2-9-543 (SEQ ID NO: 37) (e), № 4 - WDRPUH-A2-10-570 (SEQ ID NO: 40) (f), № 2 и № 8 - WDRPUH-A2-10-263 (SEQ ID NO: 41) (g), № 5 - WDRPUH-A2-10-78 (SEQ ID NO: 45) (h) проявили активную продукцию IFN-гамма соответственно, по сравнению с контролем. Клетки в лунках, обозначенные прямоугольной рамкой, размножали для получения установившихся линий CTL. На рисунке «+» указывает, что клетки в лунках подвергались пульсирующему воздействию соответствующих пептидов, а «-» указывает на то, что клетки не подвергались пульсирующему воздействию никакими пептидами.
Фиг. 4i-l включает серию фотографий, изображающих результаты ELISPOT-анализа IFN-гамма на CTL, которые были индуцированы пептидами, происходящими из WDRPUH. CTL в лунке № 2, стимулированные WDRPUH-A2-10-10 (SEQ ID NO: 49) (i), № 6 - WDRPUH-A2-10-411 (SEQ ID NO: 55) (j), № 7 - WDRPUH-A2-10-287 (SEQ ID NO: 57) (k) и № 6 - WDRPUH-A2-10-265 (SEQ ID NO: 61) (l) проявили активную продукцию IFN-гамма соответственно, по сравнению с контролем. На рисунке «+» указывает, что клетки в лунках подвергались пульсирующему воздействию соответствующих пептидов, а «-» указывает на то, что клетки не подвергались пульсирующему воздействию никакими пептидами.
Фиг. 5a и b состоят из графиков, изображающих продукцию IFN-гамма линий CTL, стимулированных SEQ ID NO: 30 (a) и SEQ ID NO: 34 (b), выявленную ELISA анализом IFN-гамма. Линии CTL, установившиеся стимуляцией каждым пептидом, проявили активную продукцию IFN-гамма, по сравнению с контролем. На рисунке «+» указывает, что клетки в лунках подвергались пульсирующему воздействию соответствующих пептидов, а «-» указывает на то, что клетки не подвергались пульсирующему воздействию никакими пептидами. Фиг. 5c и 5d изображают продукцию IFN-гамма клонами CTL, установившимися ограничивающим разведением из линий CTL, стимулированных SEQ ID NO: 30 (c) и SEQ ID NO: 34 (d). Результаты, изображенные на данном рисунке, демонстрируют, что клоны CTL, установившиеся стимуляцией SEQ ID NO: 30 (c) и SEQ ID NO: 34 (d), проявили активную продукцию IFN-гамма, по сравнению с контролем. На рисунке «+» указывает, что клетки в лунках подвергались пульсирующему воздействию SEQ ID NO: 30 (c) и SEQ ID NO: 34 (d) и «-» указывает, что клетки не контактировали ни с каким пептидом. Фиг. 5e состоит из линейного графика, изображающего специфическую активность CTL против клеток-мишеней, которые экзогенно экспрессируют WDRPUH и HLA-A*0201. Клетки COS7, трансфецированные только HLA-A*0201 или только геном WDRPUH полной длины, получали в качестве контроля. Клон CTL, установившийся с использованием WDRPUH-A2-9-288 (SEQ ID NO: 34), проявил специфическую активность CTL против клеток COS7, трансфецированных и WDRPUH, и HLA-A*0201 (черный ромб). Напротив, не была выявлена значимая специфическая активность CTL против клеток-мишеней, экспрессирующих или HLA-A*0201 (треугольник), или WDRPUH (кружок).
Описание вариантов осуществления
Хотя любые способы и материалы, аналогичные тем, которые описаны в настоящей заявке, могут использоваться при реализации или тестировании настоящего изобретения, ниже описаны предпочтительные способы, устройства и материалы. Однако перед описанием материалов и способов по настоящему изобретению, следует также понимать, что настоящее изобретение не ограничивается определенными величинами, формами, размерами, материалами, методологиями, последовательностями операций и т.д., описанными в настоящей заявке, поскольку они могут варьироваться в соответствии с обычным экспериментированием и оптимизацией. Следует также понимать, что терминология, используемая в описаниях, применяется с целью описания конкретных вариантов или вариантов осуществления, а не предназначена для ограничения объема настоящего изобретения, который будет ограничиваться только прилагаемой формулой изобретения.
Описание каждой публикации, патента или патентной заявки, указанных в описании, специально полностью включено в настоящее описание путем ссылки. Однако ничто в настоящем описании не должно рассматриваться как допущение, что изобретение не имеет право на предвосхищение такого описания в силу предшествующего изобретения.
В случае противоречия, регулирующую роль выполняет настоящее описание, включая определения. Кроме того, материалы, способы и примеры являются только иллюстративными, а не предназначены для ограничения.
I. Определения
Пока нет иных определенных указаний, используемые в настоящем описании существительные с неопределенными и определенными артиклями означают «по меньшей мере, один (одна)».
Термины «полипептид», «пептид» и «белок» используются в настоящем описании взаимозаменяемо для обозначения полимера или аминокислотных остатков. Эти термины относятся к полимерам аминокислот, в которых один или более аминокислотных остатков представляет собой модифицированный остаток или не встречающийся в естественных условиях остаток, такой как искусственный химический миметик соответствующей естественно встречающейся аминокислоты, а также к полимерам естественно встречающихся аминокислот.
Используемый в настоящем описании термин «аминокислота» относится к естественно встречающимся и синтетическим аминокислотам, а также к аналогам аминокислот и аминокислотным миметикам, которые функционируют аналогично естественно встречающимся аминокислотам. Естественно встречающиеся аминокислоты представляют собой те, которые кодируются генетическим кодом, и также аминокислоты, модифицированные после трансляции в клетках (например, гидроксипролин, гамма-карбоксиглутамат и O-фосфосерин). Фраза «аминокислотный аналог» относится к соединениям, которые имеют такую же основную химическую структуру (альфа-углерод, связанный с водородом, карбоксигруппой, аминогруппой и группой R) с естественно встречающейся аминокислотой, но имеют модифицированную группу R или модифицированные остовы (например, гомосерин, норлейцин, метионин, сульфоксид, метил-метионин-сульфоний). Фраза «аминокислотный миметик» относится к химическим соединениям, которые имеют различные структуры, но функции, аналогичные общим аминокислотам.
В настоящем описании аминокислоты могут именоваться их общеизвестными трехбуквенными символами или однобуквенными символами, рекомендуемыми Комиссией по биохимической номенклатуре IUPAC-IUB (Международного союза по теоретической и прикладной химии-Международного биохимического союза).
Пока нет специальных указаний, в настоящем описании термины «полинуклеотиды», «гены», «нуклеотиды» и «нуклеиновые кислоты» используются взаимозаменяемо.
Пока нет других определений, термин «злокачественное новообразование» относится к злокачественным новообразованиям, которые избыточно экспрессируют ген WDRPUH, примеры которых включают без ограничения печеночно-клеточную карциному.
Пока нет других определений, термины «цитотоксический T лимфоцит», «цитотоксическая T-клетка» и «CTL» используются в настоящем описании взаимозаменяемо и, пока нет иных конкретных указаний, относятся к подгруппе T лимфоцитов, которые способны распознавать не аутоклетки (например, опухолевые клетки, клетки, инфицированные вирусом) и индуцировать гибель таких клеток.
Пока нет иных определений, термин «HLA-A2» содержит такие подтипы как HLA-A0201 или HLA-A0206.
Пока нет иных определений, все технические и научные термины, используемые в настоящем описании, имеют такое же значение, которое обычно понятно среднему специалисту в данной области, для которого предназначено настоящее изобретение.
II. Пептиды
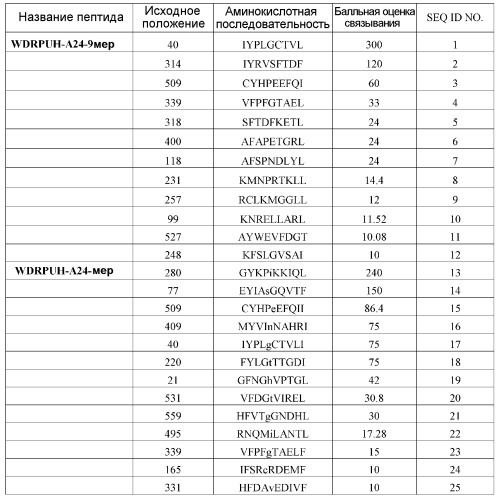
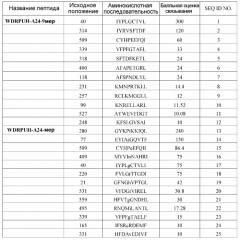
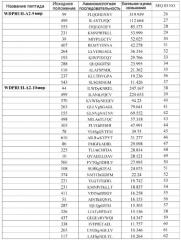
Для демонстрации того, что пептиды, происходящие из WDRPUH, функционируют в качестве антигена, распознаваемого CTL, пептиды, происходящие из WDRPUH (SEQ ID NO: 64), анализировали для определения того, являются ли они эпитопами антигена, ограниченными HLA-A24, которые представляют собой обычно встречающиеся HLA аллели (Date Y et al., Tissue Antigens 47: 93-101, 1996; Kondo A et al., J Immunol 155: 4307-12, 1995; Kubo RT et al., J Immunol 152: 3913-24, 1994). Перспективные связывающие HLA-A24 пептиды, происходящие из WDRPUH, были идентифицированы на основании величин их сродства связывания с HLA-A24. Следующие пептиды представляют собой перспективные пептиды:
WDRPUH-A24-9-40 (SEQ ID NO: 1),
WDRPUH-A24-9-314 (SEQ ID NO: 2),
WDRPUH-A24-9-509 (SEQ ID NO: 3),
WDRPUH-A24-9-339 (SEQ ID NO: 4),
WDRPUH-A24-10-409 (SEQ ID NO: 16), и
WDRPUH-A24-10-40 (SEQ ID NO: 17).
Перспективные связывающие HLA-A02 пептиды, происходящие из WDRPUH, были идентифицированы на основании величин сродства их связывания с HLA-A02. Следующие пептиды представляют собой перспективные пептиды:
WDRPUH-A2-9-39 (SEQ ID NO: 30),
WDRPUH-A2-9-407 (SEQ ID NO: 31),
WDRPUH-A2-9-288 (SEQ ID NO: 34),
WDRPUH-A2-9-237 (SEQ ID NO: 36),
WDRPUH-A2-9-543 (SEQ ID NO: 37),
WDRPUH-A2-10-570 (SEQ ID NO: 40),
WDRPUH-A2-10-263 (SEQ ID NO: 41),
WDRPUH-A2-10-78 (SEQ ID NO: 45),
WDRPUH-A2-10-10 (SEQ ID NO: 49),
WDRPUH-A2-10-411 (SEQ ID NO: 55),
WDRPUH-A2-10-287 (SEQ ID NO: 57) и
WDRPUH-A2-10-265 (SEQ ID NO: 61).
Указанные установившиеся CTL проявляют мощную специфическую активность CTL против клеток-мишеней, подвергнутых пульсирующему воздействию соответствующими пептидами. Представленные в настоящем описании результаты демонстрируют, что WDRPUH представляет собой антиген, распознаваемый CTL, и что пептиды могут представлять собой пептиды эпитопов WDRPUH, ограниченных HLA-A24 или HLA-A2.
Поскольку ген WDRPUH избыточно экспрессирован в раковых клетках, таких как печеночно-клеточная карцинома, то он представляет собой хорошую мишень для иммунотерапии. Таким образом, настоящее изобретение относится к нонапептидам (пептидам, состоящим из 9 аминокислотных остатков) и декапептидам (пептидам, состоящим из 10 аминокислотных остатков), соответствующим распознаваемым CTL эпитопам WDRPUH. Особенно предпочтительны примеры пептидов по настоящему изобретению включают те пептиды, которые состоят из аминокислотной последовательности, выбранной среди SEQ ID NO: 1, 2, 3, 4, 16, 17, 30, 31, 34, 36, 37, 40, 41, 45, 49, 55, 57 и 61.
В целом, программные обеспечения, доступные в интернете, такие как программные обеспечения, описанные в публикации Parker KC et al., J Immunol 1994 Jan 1, 152(1): 163-75, могут использоваться для расчета величин сродства связывания между различными пептидами и HLA-антигенами в компьютерном моделировании. Сродство связывания с HLA-антигенами можно измерить, как описано, например, в ссылке на публикацию Parker KC et al., J Immunol 1994 Jan 1, 152(1): 163-75; и Kuzushima K et al., Blood 2001, 98(6): 1872-81. Способ определения сродства связывания описаны, например, в публикациях: Journal of Immunological Methods, 1995, 185: 181-190; Protein Science, 2000, 9: 1838-1846. Поэтому можно выбрать фрагменты WDRPUH, которые имеют высокое сродство связывания с HLA-антигенами, с использованием программных обеспечений. Таким образом, настоящее изобретение включает пептиды, состоящие из любых фрагментов, происходящих из WDRPUH, которые связываются с HLA-антигенами, идентифицированными с использованием таких известных программ. Кроме того, пептид по настоящему изобретению может также состоять из полной длины WDRPUH.
Пептид по настоящему изобретению может фланкироваться с дополнительными аминокислотными остатками, пока полученный в результате пептид сохраняет свою способность индуцировать CTL. Конкретные аминокислотные остатки, фланкирующие пептиды по настоящему изобретению, могут быть составлены из любого вида аминокислот, пока они не нарушают способность индуцировать CTL первоначального пептида. Таким образом, настоящее изобретение также относится к пептидам, обладающим способностью связывания с HLA-антигенами и содержащим аминокислотные последовательности, происходящие из WDRPUH. Такие пептиды обычно имеют длину менее чем примерно 40 аминокислот, часто менее чем примерно 20 аминокислот, обычно меньше чем примерно 15 аминокислот.
В целом, модификация одной, двух или более аминокислот в пептиде не влияет на функцию пептида, а в некоторых случаях даже усиливает желательную функцию исходного белка. Действительно, было известно, что модифицированные пептиды (т.е. пептиды, составленные из аминокислотной последовательности, в которой один, два или несколько аминокислотных остатков были модифицированы (т.е. замещены, делетированы, добавлены или вставлены, по сравнению с первоначальной эталонной последовательностью), сохраняют биологическую активность исходного пептида (Mark et al., Proc Natl Acad Sci USA 1984, 81: 5662-6; Zoller and Smith, Nucleic Acids Res 1982, 10: 6487-500; Dalbadie-McFarland et al., Proc Natl Acad Sci USA 1982, 79: 6409-13). Таким образом в одном варианте осуществления, пептиды по настоящему изобретению могут обладать и способностью индуцировать CTL, и аминокислотную последовательность, выбранную среди SEQ ID NO: 1, 2, 3, 4, 16, 17, 30, 31, 34, 36, 37, 40, 41, 45, 49, 55, 57 и 61, где одна, две или даже более аминокислот добавлены, вставлены, делетированы и/или замещены.
Специалистам в данной области понятно, что отдельные замещения в аминокислотной последовательности, которые изменяют одну аминокислоту или небольшую процентную долю аминокислот, имеют тенденцию приводить к сохранению свойств боковой цепи исходной аминокислоты. В сущности, они часто именуются «консервативными замещениями» или «консервативными модификациями», где изменение белка приводит к получению модифицированного белка, выполняющего функцию, аналогичную исходному белку. Таблицы консервативного замещения, обеспечивающего получение функционально аналогичных аминокислот, хорошо известны в данной области. Примеры характеристик боковых цепей аминокислот, сохранение которых желательно, включают, например, гидрофобные аминокислоты (A, I, L, M, F, P, W, Y, V), гидрофильные аминокислоты (R, D, N, C, E, Q, G, H, K, S, T) и боковые цепи, имеющие следующие общие функциональные группы или характеристики: алифатическая боковая цепь (G, A, V, L, I, P); боковая цепь, содержащая гидроксильную группу (S, T, Y); боковая цепь, содержащая атом серы (C, M); боковая цепь, содержащая карбоновую кислоту и амид (D, N, E, Q); боковая цепь, содержащая основание (R, K, H); и боковая цепь, содержащая ароматическую группу (H, F, Y, W). Кроме того, каждая из следующих восьми групп содержит аминокислоты, которые приняты в данной области в качестве консервативных замещений друг на друга:
1) Аланин (A), Глицин (G);
2) Аспарагиновая кислота (D), Глутаминовая кислота (E);
3) Аспарагин (N), Глутамин (Q);
4) Аргинин (R), Лизин (K);
5) Изолейцин (I), Лейцин (L), Метионин (M), Валин (V);
6) Фенилаланин (F), Тирозин (Y), Триптофан (W);
7) Серин (S), Треонин (T); и
8) Цистеин (C), Маетионин (M) (см., например, Creighton, Proteins 1984).
Такие консервативно модифицированные пептиды также считаются пептидами по настоящему изобретению. Однако пептиды по настоящему изобретению не ограничиваются ими и могут включать не консервативные замещения, пока модифицированный пептид сохраняет способность индуцировать CTL исходного пептида. Кроме того, модифицированные пептиды не должны исключать индуцируемые CTL пептиды полиморфных вариантов, межвидовые гомологи и аллели WDRPUH.
Для сохранения требуемой способности индуцировать CTL можно модифицировать (вставить, делетировать, добавить и/или заместить) небольшое число (например, 1, 2 или несколько) или небольшую процентную долю аминокислот. В настоящем описании термин «несколько» означает 5 или меньше аминокислот, например, 4, 3 или менее. Процентная доля подлежащих модификации аминокислот составляет предпочтительно 20% или менее, предпочтительнее, 15% или менее, еще предпочтительнее, 10% или менее, или от 1 до 5%.
Кроме того, аминокислотные остатки могут быть замещены, вставлены, делетированы и/или добавлены в пептиды для получения модифицированного пептида, имеющего улучшенное сродство связывания. При использовании в контексте иммунотерапии, пептиды по настоящему изобретению должны быть представлены на поверхности клетки или экзосоме, предпочтительно, в виде комплекса с HLA-антигеном. В дополнение к пептидам, которые естественно представлены, поскольку закономерность последовательностей пептидов, проявляемая связыванием с HLA-антигенами уже известна (J Immunol 1994, 152: 3913; Immunogenetics 1995, 41: 178; J Immunol 1994, 155: 4307), модификации, основанные на такой закономерности, могут быть введены в иммуногенные пептиды по изобретению. Например, может быть желательно замещение второй аминокислоты от N-конца, замещенной фенилаланином, тирозином, метионином или триптофаном, и/или аминокислоты на C-конце фенилаланином, лейцином, изолейцином, триптофаном или метионином для увеличения связывания HLA-A24. Таким образом пептиды, имеющие аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 16 и 17, где вторая аминокислота от N-конца аминокислотной последовательности указанных SEQ ID NO замещена фенилаланином, тирозином, метионином или триптофаном, и/или пептиды, где C-конец аминокислотной последовательности указанных SEQ ID NO замещен фенилаланином, лейцином, изолейцином, триптофаном или метионином, включены в настоящее изобретение. С другой стороны, пептиды, обладающие высоким сродством связывания HLA-A2, имеют замещение своей второй аминокислоты от N-конца лейцином или метионином, а аминокислота на C-конце замещена валином или лейцином. Таким образом, пептиды, имеющие аминокислотные последовательности SEQ ID NO: 30, 31, 34, 36, 37, 40, 41, 45, 49, 55, 57 и 61, где вторая аминокислота от N-конца замещена лейцином или метионином, и/или где C-конец замещен валином или лейцином, охватываются настоящим изобретением. Замещения могут быть введены не только в концевые аминокислоты, но также в положение потенциального распознавания пептидов в T-клеточном рецепторе (TCR). Несколько исследований продемонстрировали, что пептид с аминокислотными замещениями может быть таким же или лучше, чем исходный, например, CAP1, p53(264-272), Her-2/neu(369-377) или gp100 (209-217) (Zaremba et al. Cancer Res. 57, 4570-4577, 1997, T. K. Hoffmann et al. J Immunol. (2002) Feb 1; 168(3):1338-47., S. O. Dionne et al. Cancer Immunol immunother. (2003) 52: 199-206 and S. O. Dionne et al. Cancer Immunology, Immunotherapy (2004) 53, 307-314).
Настоящее изобретение также предусматривает добавление одной, двух или нескольких аминокислот к N- и/или C-концу описанных пептидов. Такие модифицированные пептиды, имеющие высокое сродство связывания HLA-антигена, и сохраняющие способность индукции CTL, также включены в настоящее изобретение.
Однако когда пептидная последовательность идентична части аминокислотной последовательности эндогенного или экзогенного белка, имеющего другую функцию, могут быть вызваны побочные эффекты, такие как аутоиммунные расстройства и/или аллергические симптомы против определенных веществ. Поэтому, предпочтительно сначала выполнение поисков гомологии с использованием доступных бах данных во избежание ситуаций, в которых последовательность пептида совпадает с аминокислотной последовательностью другого белка. Когда в результате поисков гомологии становится ясным, что существует даже не пептид с 1 или 2 аминокислотными различиями, по сравнению с целевым пептидом, то целевой пептид может быть модифицирован для увеличения сродства связывания с HLA-антигенами, и/или увеличения способности индуцировать CTL без любой опасности таких побочных эффектов.
Хотя ожидается, что пептиды, имеющие высокое сродство связывания с HLA-антигенами, как описано выше, являются высокоэффективными, то перспективные пептиды, которые выбраны в соответствии с наличием высокого сродства связывания в качестве индикатора, далее исследуются для выявления наличия способности индуцировать CTL. В настоящем описании фраза «способность индуцировать CTL» указывает на способность пептида индуцировать CTL при представлении на антигенпрезентирующих клетках (APCs). Кроме того, «индуцируемость CTL» включает способность пептида индуцировать активацию CTL, пролиферацию CTL, стимулировать лизис клеток-мишеней под действием CTL и увеличивать с помощью CTL продукции IFN-гамма.
Подтверждение способности индуцировать CTL осуществляется индукцией APC, несущих антигены MHC (главного комплекса гистосовместимости) человека (например, B-лимфоцитов, макрофагов и дендритных клеток (DC)), или конкретнее, DC, происходящие из мононуклеарных лейкоцитов периферической крови, и после стимуляции пептидами, смешиванием с CD8-положительными клетками, и затем измерением количества IFN-гамма, продуцируемого и высвобождаемого CTL, против клеток-мишеней. В качестве реакционной системы могут использоваться трансгенные животные, которые были получены для экспрессии человеческого HLA-антигена (например, трансгенные животные, описанные в публикациях BenMohamed L, Krishnan R, Longmate J, Auge C, Low L, Primus J, Diamond DJ, Hum Immunol 2000 Aug, 61(8): 764-79, Related Articles, Books, Linkout Induction of CTL response by a minimal epitope vaccine in HLA A*0201/DR1 transgenic mice: dependence on HLA class II restricted T(H) response). Например, клетки-мишени могут быть мечены радиоактивным изотопом 51Cr и тому подобными, и цитотоксическая активность может быть рассчитана по радиоактивности, высвобождаемой из клеток-мишеней. Альтернативно, способность индуцировать CTL можно оценить измерением количества IFN-гамма, продуцируемого и высвобождаемого CTL, в присутствии APC, которые несут иммобилизованные пептиды, и визуализацией зоны ингибирования на среде с использованием моноклональных антител против IFN-гамма.
В результате исследования способности индуцировать CTL описанными выше пептидами, было обнаружено, что нонапептиды или декапептиды, имеющие аминокислотную последовательность, выбранную среди SEQ ID NO: 1, 2, 3, 4, 16, 17, 30, 31, 34, 36, 37, 40, 41, 45, 49, 55, 57 и 61, проявляют особенно высокую способность индуцировать CTL, а также высокое сродство связывания с HLA-антигеном. Таким образом, указанные пептиды иллюстрируются в качестве предпочтительных вариантов осуществления настоящего изобретения.
Кроме того, анализ гомологии показал, что указанные пептиды не имеют значимой гомологии с пептидами, происходящими из любых других известных человеческих генных продуктов. Это значит, что возможность неизвестных или нежелательных иммунных реакций, возникающих вследствие использования пептидов по настоящему изобретению при иммунотерапии, является низкой. Поэтому, также вследствие данного аспекта, эти пептиды предпочтительны для вызова иммунитета у пациентов со злокачественными новообразованиями против WDRPUH. Таким образом, особенно предпочтительные пептиды по настоящему изобретению включают те, которые имеют аминокислотную последовательность, выбранную среди SEQ ID NO: 1, 2, 3, 4, 16, 17, 30, 31, 34, 36, 37, 40, 41, 45, 49, 55, 57 и 61.
В дополнение к описанным выше модификациям, пептиды по настоящему изобретению могут быть также связаны с другими пептидами, пока полученный пептид сохраняет требуемую способность индуцировать CTL искодного пептида. Примеры подходящих пептидов включают без ограничения: пептиды по настоящему изобретению или индуцируемые CTL пептиды, происходящие из других TAA (опухолеассоциированных антигенов). Линкеры, подлежащие помещению между пептидами, хорошо известны в данной области и включают без ограничения, например, AAY (P. M. Daftarian et al., J Trans Med 2007, 5:26), AAA, NKRK (R. P. M. Sutmuller et al., J Immunol. 2000, 165: 7308-7315) и K (S. Ota et al., Can Res. 62, 1471-1476, K. S. Kawamura et al., J Immunol. 2002, 168: 5709-5715).
Кроме того, пептиды по настоящему изобретению могут быть также связаны с другими веществами, пока полученный в результате пептид сохраняет требуемую способность индуцировать CTL исходного пептида. Примеры подходящих веществ включают без ограничения: пептиды, липиды, сахар и сахарные цепи, ацетильные гру