Аналоги инсулина с ацильной и алкиленгликолевой группировкой
Иллюстрации
Показать всеИзобретение относится к ацилированному аналогу инсулина, содержащему остаток лизина, который соединен с С-концом аминокислотного остатка А21, где ацильная группировка, включающая алкиленгликолевую группировку, соединена с остатком лизина в положении А22. Такие соединения можно вводить легочным путем. 3 н. и 4 з.п. ф-лы, 51 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым ацилированным аналогам инсулина и их родственным аспектам.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ ДАННОГО ИЗОБРЕТЕНИЯ
Инсулин представляет собой полипептидный гормон, секретируемый β-клетками поджелудочной железы. Инсулин состоит из двух полипептидных цепей, обозначенных как цепи А и В, которые связаны вместе двумя межцепьевыми дисульфидными связями. В человеческом, свином и бычьем инсулине цепи А и В содержат 21 и 30 аминокислотных остатков соответственно. Однако от вида к виду существуют вариации среди аминокислотных остатков, присутствующих в различных положениях в двух цепях. Широко распространенное применение генной инженерии дало возможность получения аналогов природных инсулинов путем замены одного или более чем одного аминокислотного остатка.
Инсулин применяют для лечения диабета и связанных с ним заболеваний или являющихся его результатом. Инсулин является незаменимым при поддержании нормальной метаболической регуляции. Обычно инсулин вводят путем инъекций. К сожалению, многие диабетики неохотно принимают интенсивную терапию вследствие дискомфорта, связанного с многочисленными инъекциями, необходимыми для поддержания строгого контроля уровней глюкозы. При пероральном введении инсулин быстро разлагается в желудочно-кишечном тракте и не всасывается в кровоток. Поэтому исследованы альтернативные пути введения инсулина, такие как пероральный, ректальный, чрескожный и назальный пути. До сих пор, однако, эти пути введения не привели в результате к достаточно эффективному всасыванию инсулина.
За десятилетия стали доступны как препараты инсулина длительного действия, так и препараты инсулина быстрого действия, и многие пациенты принимают 2-4 инъекции в сутки. В последние десятилетия оказалось, что для пациента-диабетика крайне важно поддерживать строгий контроль уровня глюкозы в крови.
В Международной патентной заявке под номером публикации WO 2007/096431, которая была опубликована 30 августа 2007 (Novo Nordisk A/S), описаны инсулины, имеющие сложную боковую цепь без алкиленгликолевых группировок. В Международной патентной заявке под номером публикации WO 2006/082205 (Novo Nordisk A/S) описаны инсулины, имеющие сложную боковую цепь, соединенную с аминокислотой в B цепи. Согласно п.1, US 6444641 В1 относится к аналогу инсулина, ацилированному жирной кислотой, включающему аналог инсулина, к которому жирная ацильная цепь присоединена амидной связью, где изоэлектрическая точка этого жирного аналога инсулина выше, чем изоэлектрическая точка инсулина. Согласно п.1, WO 2006/082205 (Novo Nordisk A/S) относится к производным инсулина, имеющим боковую цепь, присоединенную либо к α-аминогруппе N-концевого аминокислотного остатка В цепи, либо к ε-аминогруппе остатка Lys, присутствующего в B цепи исходной молекулы инсулина. Pharm. Res. 21. (2004), 1498-1504, относится к продлению действия инсулина детермир.
ОПРЕДЕЛЕНИЯ
В данной заявке термин инсулин охватывает как природные инсулины, например человеческий инсулин, так и аналоги инсулина.
В данной заявке термин аминокислотный остаток охватывает аминокислоту, в которой удален атом водорода из аминогруппы, и/или гидроксигруппа удалена из карбоксигруппы, и/или атом водорода удален из меркаптогруппы. Неточно аминокислотный остаток может быть обозначен как аминокислота.
В данной заявке термин пептидный остаток охватывает пептид, в котором удален атом водорода из аминогруппы, и/или гидроксигруппа удалена из карбоксигруппы, и/или атом водорода удален из меркаптогруппы. Неточно пептидный остаток может быть обозначен как пептид.
В данной заявке термин аналог инсулина охватывает полипептид, который имеет молекулярную структуру, которая формально может быть выведена из структуры природного инсулина, например человеческого инсулина, путем делетирования и/или замены (замещения) одного или более чем одного аминокислотного остатка, встречающегося в природном инсулине, и путем добавления одного или более чем одного аминокислотного остатка к аминокислотному остатку А21. Предпочтительно добавленные и/или замененные аминокислотные остатки представляют собой кодируемые аминокислотные остатки. Например, цепь А может быть удлинена с ее С-конца, например, на 1, 2, 3 или 4 аминокислотных остатка (по сравнению с человеческим инсулином), положения которых обозначены А22, А23, А24 и А25 соответственно. Даже, несмотря на то что аналог инсулина имеет удлинение в положении А21/А22, в этом аналоге инсулина могут находиться делеции в других положениях. Так же, как и в человеческом инсулине, в аналоге инсулина по данному изобретению аминокислотный остаток А21 соединен с остатком Cys в положении 20, где этот остаток Cys участвует в образовании межцепьевой дисульфидной связи. В данной заявке также термин исходный инсулин или исходный аналог инсулина используют для аналога инсулина. В основном термин "исходный" используют при дифференциации от аналога инсулина, несущего боковую цепь, которая, например, может быть введена химическим путем в результате ацилирования.
В данной заявке термины, такие как А1, А2, A3 и т.д., указывают на положение 1, 2 и 3, соответственно, в А цепи инсулина (отсчитываемое от N-конца). Подобным образом, термины, такие как В1, В2, В3 и т.д., указывают на положение 1, 2 и 3, соответственно, в B цепи инсулина (отсчитываемое от N-конца). Используя однобуквенные коды аминокислот, термины, такие как А21А, A21G и A21Q, означают, что аминокислота в положении А21 представляет собой А, G и Q, соответственно. Используя трехбуквенные коды для аминокислот, соответствующие выражения представляют собой AlaA21, GlyA21 и GlnA21, соответственно.
В данной заявке термины, такие как desB29 и desB30, указывают на аналог инсулина, в котором отсутствует аминокислотный остаток В29 или В30, соответственно.
Нумерация положений в аналогах инсулина в А и В цепях проведена таким образом, что исходное соединение представляет собой человеческий инсулин с нумерацией, используемой для него.
В данной заявке выражение "кодируемый" в связи с терминами, такими как аминокислота, аминокислотный остаток, пептид или пептидный остаток, используют для указания аминокислоты, аминокислотного остатка, пептида или пептидного остатка, который может кодироваться триплетом ("кодоном") нуклеотидов, как принято генной инженерией.
В данной заявке термин мутация охватывает любое изменение в аминокислотной последовательности (замены и инсерции кодируемыми аминокислотами, а также делеции).
Под инсулином быстрого действия или болюсным инсулином подразумевают инсулин, обладающий быстрым началом действия, подобным или более быстрым, чем у нормального человеческого инсулина, и/или продолжительностью действия, которая подобна или является только немного более длительной, чем у нормального человеческого инсулина.
Под инсулином пролонгированного действия или базальным инсулином подразумевают инсулин, обладающий более длительной продолжительностью действия, чем обычный или нормальный человеческий инсулин.
Под высокой физической стабильностью подразумевают тенденцию к фибрилляции, составляющей менее 50% от таковой человеческого инсулина. Фибрилляция может быть описана лаг-периодом перед тем, как инициировано образование фибрилл при данных условиях.
Полипептид со сродством к рецептору инсулина и к рецептору IGF-1 представляет собой полипептид, который способен к взаимодействию с рецептором инсулина и с рецептором человеческого IGF-1 в соответствующем анализе связывания. Такие анализы рецепторов хорошо известны в данной области техники и дополнительно описаны в примерах. Ацилированные аналоги инсулина по данному изобретению не должны связываться с рецептором IGF-1 или должны обладать достаточно низким сродством к указанному рецептору. Точнее, ацилированные аналоги инсулина по данному изобретению должны обладать сродством по отношению к рецептору IGF-1 по существу такой же или меньшей величины, чем человеческий инсулин.
Для удобства далее следуют названия аминокислот обычными трехбуквенными кодами или однобуквенными кодами в скобках: Глицин (Gly или G), пролин (Pro или Р), аланин (Ala или А), валин (Val или V), лейцин (Leu или L), изолейцин (Ile или I), метионин (Met или М), цистеин (Cys или С), фенилаланин (Phe или F), тирозин (Tyr или Y), триптофан (Trp или W), гистидин (His или Н), лизин (Lys или K), аргинин (Arg или R), глутамин (Gln или Q), аспарагин (Asn или N), глутаминовая кислота (Glu или Е), аспарагиновая кислота (Asp или D), серин (Ser или S) и треонин (Thr или Т). Если вследствие опечаток существуют отклонения от общепринято используемых кодов, применяют общепринято используемые коды. Аминокислоты, присутствующие в инсулинах по данному изобретению, предпочтительно представляют собой аминокислоты, которые могут кодироваться нуклеиновой кислотой. Аминокислоты, такие как Glu и Asp, могут находиться в α, γ, L или D форме.
Приведенные ниже сокращения использованы в описании и в примерах: Да представляет собой дальтон (молекулярная масса), кДа представляет собой килодальтон (=1000 Да), Mw представляет собой молекулярную массу, OSu представляет собой 1-сукцинимидилокси = 2,5-диоксопирролидин-1-илокси, КТ представляет собой комнатную температуру, SA представляет собой синапиновую кислоту, и Su представляет собой 1-сукцинимидил = 2,5-диоксопирролидин-1-ил, ДХМ представляет собой дихлорметан, ДИЭА (и ДИПЭА) представляет собой N,N-диизопропилэтиламин, TSTU представляет собой N,N,N',N'-тетраметил-O-(N-сукцинимидил)урония тетрафторборат, Трис представляет собой трис-(гидроксиметил)аминометан, ОК представляет собой объем колонки, NMP представляет собой N-метилпирролидин-2-он, OTBU представляет собой трет-бутокси, OEG представляет собой аминокислоту 8-амино-3,6-диоксаоктановую кислоту, ЧСА представляет собой человеческий сывороточный альбумин, TNBS представляет собой 2,4,6-тринитробензолсульфоновую кислоту, НОВТ (или HOBt) представляет собой 1-гидроксибензотриазол, HOAt представляет собой 1-гидрокси-7-азабензотриазол, NaOH представляет собой гидроксид натрия, ДМФ представляет собой N,N-диметилформамид, ТГФ представляет собой тетрагидрофуран, ТФУ представляет собой трифторуксусную кислоту, ммоль представляет собой миллимоль, Fmoc представляет собой флуорен-9-илметоксикарбонил, OEG представляет собой 8-амино-3,6-диоксаоктановую кислоту (или ее остаток), gGlu (здесь также обозначен γGlu) представляет собой гамма-глутаминовую кислоту, и в примере 48 для удобства приведенные ниже примечания использованы для обозначения последовательности ацильных группировок инсулинов по изобретению и по предшествующему уровню техники:
С18 представляет собой октадекандиоил, С20 представляет собой эйкозандиоил, gGlu представляет собой гамма-глутаминовую кислоту, PEG3 представляет собой 3-(2-{2-[2-(2-аминоэтокси)этокси]этокси}этокси)пропионовую кислоту, PEG5 представляет собой 3-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]этокси}этокси)этокси]-этокси}пропионовую кислоту и PEG7 представляет собой 3-[2-(2-{2-[2-(2-{2-[2-(2-аминоэтокси)этокси]этокси}этокси)этокси]этокси}этокси)этокси]пропионовую кислоту (полные структуры/последовательности можно найти в примерах).
ЗАДАЧИ ДАННОГО ИЗОБРЕТЕНИЯ
Задача данного изобретения состоит в преодолении или уменьшении по меньшей мере одного из недостатков предшествующего уровня техники или в разработке полезной альтернативы.
Одна из задач данного изобретения состоит в предоставлении производных инсулина, которые обладают хорошей биодоступностью.
Другая задача данного изобретения состоит в предоставлении производных инсулина, которые полезны в качестве инсулинов быстрого действия.
Другая задача данного изобретения состоит в предоставлении производных инсулина, которые можно вводить легочным путем.
Другая задача данного изобретения состоит в предоставлении производных инсулина, которые обладают пролонгированным профилем действия.
Другая задача данного изобретения состоит в предоставлении производных инсулина, которые полезны в качестве базальных инсулинов.
Другая задача данного изобретения состоит в предоставлении производных инсулина, которые обладают высоким связывающим сродством с рецепторами инсулина.
Другая задача данного изобретения состоит в улучшении времени полужизни in vivo инсулинов.
Другая задача данного изобретения состоит в предоставлении производных инсулина, обладающих более низкой склонностью вызывать гипогликемические состояния, чем человеческий инсулин.
Другая задача данного изобретения состоит в нахождении инсулинов, обладающих удовлетворительной физической стабильностью, в частности, после хранения в течение 2 лет.
Другой аспект данного изобретения состоит в нахождении инсулинов, обладающих удовлетворительной химической стабильностью, в частности, после хранения в течение 2 лет.
Другой аспект данного изобретения состоит в нахождении инсулинов, обладающих удовлетворительной протеолитической стабильностью, в частности, после хранения в течение 2 лет.
Другой аспект данного изобретения состоит в нахождении инсулинов, обладающих удовлетворительной растворимостью.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ДАННОГО ИЗОБРЕТЕНИЯ
Кратко, данное изобретение относится к ацилированному аналогу инсулина, где этот аналог инсулина содержит остаток лизина, соединенный с С-концом аминокислотного остатка А21, или пептидный остаток из аминокислотных остатков в количестве вплоть до 4, содержащий остаток лизина, где этот пептидный остаток соединен с С-концом аминокислотного остатка А21, характеризующемуся тем, что ацильная группировка, включающая алкиленгликолевую группировку, присоединена к остатку лизина в положении А22 или присоединена к остатку лизина, присутствующему в пептидном остатке, присоединенном к С-концу аминокислотного остатка А21. Следовательно, аналог инсулина содержит аминокислоту в положении А22.
Неожиданно обнаружили, что инсулины по изобретению (ацилированные аналоги инсулина, содержащие одну или более чем одну алкиленгликолевую группировку) обладают более высоким связывающим сродством к рецепторам инсулина, чем подобные ацилированные аналоги инсулина без алкиленгликолевых группировок, при измерении в анализах связывания рецептора инсулина, проводимых в присутствии высоких концентраций ЧСА (человеческого сывороточного альбумина), например 4,5% ЧСА.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ФОРМ ОСУЩЕСТВЛЕНИЯ
Удивительно, что ацилированные аналоги инсулина по данному изобретению проявляют хорошую биодоступность и высокое связывающее сродство с рецептором инсулина в присутствии высоких концентраций ЧСА.
Аналог инсулина, присутствующий в ацилированном аналоге инсулина согласно данному изобретению, может быть формально проиллюстрирован как человеческий инсулин, который имеет один аминокислотный остаток, соединенный с С-концом аминокислотного остатка в положении А21, или как человеческий инсулин, который имеет пептидный остаток из аминокислотных остатков в количестве вплоть до 4, соединенный с С-концом аминокислотного остатка в положении А21 и, может быть, где один или более чем один из аминокислотных остатков в положениях А1-А21 и В1-В30 делегирован или заменен другим аминокислотным остатком. Что касается номенклатуры, аминокислотный остаток, соединенный с аминокислотным остатком в положении А21, находится в положении А22. Подобным образом, аминокислотные остатки, присутствующие в пептидном остатке, соединенном с аминокислотным остатком в положении А21, находятся в положениях А22, А23, А24 или А25.
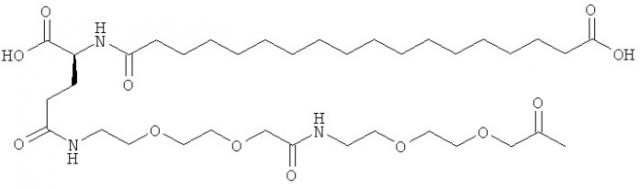
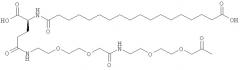
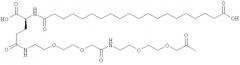
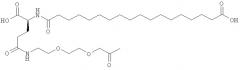
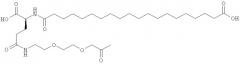
Ацилированные аналоги инсулина по данному изобретению можно формально сконструировать из аналога инсулина и ацильной группировки, содержащей алкиленгликоль, имеющей общую формулу (I): Acy-AA1n-AA2m-AA3p-, где Acy, АА1, АА2, АА3, n, m и p являются такими, как определено здесь, например, путем формального удаления атома водорода из аминогруппы в аналоге инсулина и присоединения к нему боковой цепи формулы (I).
В ацилированных аналогах инсулина по данному изобретению ацильная группировка, содержащая алкиленгликоль, формулы (I) соединена с остатком лизина в положении, которое находится на С-концевой стороне или на С-конце аминокислотного остатка А21. Например, ацильная группировка, содержащая алкиленгликоль, формулы (I) может быть соединена с остатком лизина в положении А22. Если ацильная группировка, содержащая алкиленгликоль, формулы (I) соединена с пептидным остатком, который соединен с аминокислотным остатком в положении А21, ацильная группировка, содержащая алкиленгликоль, формулы (I) соединена с остатком лизина в любом из положений А22, А23, А24 или А25.
Как упомянуто здесь, ацильная группировка, присутствующая в формуле Acy-AA1n-AA2m-AA3p-, образована от жирной кислоты или жирной дикислоты.
В данной заявке термин "жирная кислота" охватывает нормальные или разветвленные алифатические карбоновые кислоты, имеющие по меньшей мере два атома углерода и являющиеся насыщенными или ненасыщенными. Не ограничивающими примерами жирных кислот являются миристиновая кислота, пальмитиновая кислота и стеариновая кислота.
В данной заявке термин "жирная дикислота" охватывает нормальные или разветвленные алифатические дикарбоновые кислоты, имеющие по меньшей мере два атома углерода и являющиеся насыщенными или ненасыщенными. Не ограничивающими примерами жирных дикислот являются янтарная кислота, гександикислота, октандикислота, декандикислота, додекандикислота, тетрадекандикислота, гексадекандикислота, гептадекандикислота, октадекандикислота и эйкозандикислота.
Нейтральный циклический аминокислотный остаток, обозначенный АА1, представляет собой аминокислоту, содержащую насыщенное 6-членное карбоциклическое кольцо, необязательно содержащее гетероатом азота, и предпочтительно это кольцо представляет собой циклогексановое кольцо или пиперидиновое кольцо. Предпочтительно молекулярная масса этой нейтральной циклической аминокислоты находится в интервале от примерно 100 до примерно 200 Да.
Кислый аминокислотный остаток, обозначенный АА2, представляет собой аминокислоту с молекулярной массой вплоть до примерно 200 Да, содержащую две группировки карбоновой кислоты и одну первичную или вторичную аминогруппу.
Нейтральный алкиленгликольсодержащий аминокислотный остаток, обозначенный АА3, представляет собой алкиленгликолевую группировку, может быть, олиго- или полиалкиленгликолевую группировку, содержащую функциональную группу карбоновой кислоты на одном конце и функциональную аминогруппу на другом конце.
В данной заявке термин алкиленгликолевая группировка охватывает олиго- и полиалкиленгликолевые группировки, а также моноалкиленгликолевые группировки. Полиалкиленгликоли включают цепи на основе полиэтиленгликоля на основе полипропиленгликоля и на основе полибутиленгликоля, то есть цепи, которые основаны на повторяющемся звене -CH2CH2O-, -CH2CH2CH2O- или CH2CH2CH2CH2O-. Алкиленгликолевая группировка может быть как монодисперсной (с хорошо определенной длиной/молекулярной массой), так и полидисперсной (с менее хорошо определенной длиной/средней молекулярной массой). Моноалкиленгликолевые группировки включают -OCH2CH2O-, -OCH2CH2CH2O- или -OCH2CH2CH2CH2O-содержащие различные группы на каждом конце.
Как упомянуто здесь, порядок, в котором АА1, АА2 и АА3 встречаются в ацильной группировке формулы (I) (Acy-AA1n-AA2m-AA3p-), может быть независимо взаимозаменяемым. Следовательно, формула Acy-AA1n-AA2m-AA3p- также охватывает группировки, такие как, например, формулы Acy-AA2m-AA1n-AA3p- и формулы Acy-AA3p-AA2m-AA1n-, где Acy, АА1, АА2, АА3, n, m и p являются такими, как определено здесь.
Как упомянуто здесь, связи между группировками Acy, АА1, АА2 и/или АА3 представляют собой амидные связи (-CONH-, где -СО- имеет происхождение от одной из группировок Acy, АА1, АА2 и АА3, a -NH- имеет происхождение от одной из группировок АА1, АА2 и АА3).
ПРЕДПОЧТИТЕЛЬНЫЕ ФОРМЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В форме осуществления исходный инсулин по изобретению может, кроме лизина в положении А22 и кроме любого пептидного остатка из аминокислот в количестве вплоть до 4, соединенного с С-концом аминокислотного остатка А21, и кроме мутаций B29R и/или desB30, включать одну или более чем одну из приведенных ниже мутаций. Здесь сначала указано положение в А или В цепи, а затем возможный аминокислотный остаток(остатки) приведен в виде однобуквенного кода. В одной форме осуществления присутствует 5 мутаций, в другой форме осуществления присутствует 4 мутации, в другой форме осуществления присутствует 3 мутации, в другой форме осуществления присутствует 2 мутации, в другой форме осуществления присутствует 1 мутация и в другой форме осуществления мутации отсутствуют, кроме лизина в положении А22 и кроме любого пептидного остатка из аминокислот в количестве вплоть до 4, соединенного с С-концом аминокислотного остатка А21, и кроме мутаций B29R и/или desB30:
А4: А или Q.
А5: L.
А8: R, N, Q, Е, Н, L или W.
А9: R или L.
А14: Е или О.
А15: А или Т.
А16: М.
А17: D или F.
А18: R, L, I, D или V.
А21: G или А.
В3: A, R, H, I, L, M, F, W, Y, S или Т.
В10: D или Е.
В25: Y, Н или desB25.
В26: Q, Е, S или desB26.
В27: Н, L, M, W или Y.
В28: D или Е.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию А4А или A4Q.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию A5L.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутации A8L, A8N, A8Q, А8Е, А8Н, A8L или A8W. В Другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию А8Н.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию A9R или A9L. В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию A9L.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию А14Е или A14D.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию А15А или А15Т.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию А16М.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию A17D или A17F.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутации A18R, A18L, А181, A18D или A18V. В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию A18L или A18V. В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию А181.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию A21G или А21А.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутации В3А, B3R, В3Н, B3I, B3L, В3М, B3F, B3W, B3Y, B3S или В3Т.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию B10D или В10Е.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутации B25Y, В25Н или desB25.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутации B26Q, В26Е, B26S или desB26.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутации В27Н, B27L, В27М, B27W или B27Y. В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию B27W или B27Y.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутацию B28D или В28Е.
В другой предпочтительной форме осуществления исходный инсулин по изобретению включает мутации A21Q, B1Q, desB1, B3Q, B3S, В3Т, B13Q или desB27.
Не ограничивающие конкретные примеры исходных аналогов инсулина, которые могут присутствовать в ацилированных аналогах инсулина по данному изобретению, включают приведенные ниже, где указаны отклонения от человеческого инсулина:
| A22K, B29R, desB30 | |
| А14Е, A22K, В25Н, B29R, desB30 | |
| А8Н, A22K, B29R, desB30 | |
| A18L, A22K, B29R, desB30 | |
| А181, A22K, B29R, desB30 | |
| A18D, A22K, B29R, desB30 | |
| A5L, A22K, B29R, desB30 | |
| А8Н, A18L, A22K, B29R, desB30 | |
| А8Н, A18L, A22K, В10Е, B29R, desB30 | |
| A5L, А8Н, A17D, A18L, A22K, В10Е, B29R, desB30 | |
| А8Н, A22K, В10Е, B29R, desB30 | |
| A5L, А8Н, A17D, A22K, В10Е, B29R, desB30 | |
| A22K, B27Y, B29R, desB30 | |
| A9L, A22K, B29R, desB30 | |
| A4A, A22K, B29R, desB30 | |
| A4Q, A22K, B29R, desB30 | |
| A16L, A22K,B29R, desB30 | |
| A17F, A22K, B29R, desB30 | |
| A17D, A22K, B29R, desB30 | |
| A18V, A22K, B29R, desB30 | |
| A22K, B10D, B29R, desB30 | |
| A22K, B10E, B29R, desB30 | |
| A22K, B27W, B29R, desB30 | |
| A22K, B27Y, B29R, desB30 | |
| A22K, B28E, B29R, desB30 | |
| A22K, B27Y, B28E, B29R, desB30 | |
| A8H, A22K, B28E, B29R, desB30 | |
| A22K, desB26, B28E, B29R, desB30 | |
| A22K, desB25, B29R, desB30 | |
| A22K, desB26, B29R, desB30 | |
| A22K, B28E, B29R, desB30 | |
| A22K, B28D, B29R, desB30 | |
| A9L, A22K, B28E, B29R, desB30 | |
| A4A, A22K, B28E, B29R, desB30 | |
| A4Q, A22K, B28E, B29R, desB30 | |
| A5L, A22K, B28E, B29R, desB30 | |
| A16L, A22K, B28E, B29R, desB30 | |
| A17F, A22K, B28E, B29R, desB30 | |
| A17D, A22K, B28E, B29R, desB30 | |
| A18V, A22K, B28E, B29R, desB30 | |
| A22K, B10D, B28E, B29R, desB30 | |
| A22K, B10E, B28E, B29R, desB30 | |
| A22K, B27W, B28E, B29R, desB30 | |
| A22G, A23K, B29R, desB30 | |
| A22G, A23G, A24K, B29R, desB30 | |
| A22G, A23G, A24G, A25K, B29R, desB30 | |
| A21Q, A22G, A23G, A24K, B29R, desB30 | |
| A21G, A22G, A23G, A24K, B29R, desB30 | |
| A21Q, A22G, A23G, A24G, A25K, B29R, desB30 | |
| A21G, A22G, A23G, A24G, A25K, B29R, desB30 | |
| A21G, A22K, B29R, desB30 человеческий инсулин | |
| A21G, A22G, A23K, B29R, desB30 | |
| A21G, A22G, A23G, A24K, B29R, desB30 | |
| A21G, A22G, A23G, A24G, A25K, B29R, desB30 | |
| A21Q, A22K, B29R, desB30 | |
| A21Q, A22G, A23K, B29R, desB30 | |
| A21Q, A22G, A23G, A24K, B29R, desB30 | |
| A21Q, A22G, A23G, A24G, A25K, B29R, desB30 | |
| A14E, A21Q, A22K, B25H, B29R, desB30 | |
| A14E, A21G, A22K, B25H, B29R, desB30 | |
| A14E, A21Q, A22G, A23K, B25H, B29R, desB30 | |
| A14E, A21G, A22G, A23K, B25H, B29R, desB30 | |
| A14E, A21Q, A22G, A23G, A24K, B25H, B29R, desB30 | |
| A14E, A21G, A22G, A23G, A24K, B25H, B29R, desB30 | |
| A14E, A21Q, A22G, A23G, A24G, A25K, B25H, B29R, desB30 | |
| A14E, A21G, A22G, A23G, A24G, A25K, B25H, B29R, desB30 | |
| A22K, B3Q, B29R, desB30 | |
| A22K, B3S, B29R, desB30 | |
| A22K, В3Т, B29R, desB30 | |
| A22K, B1Q, B29R, desB30 | |
| A18Q, A22K, B29R, desB30 | |
| A22K, desB1, B3Q, B29R, desB30 | |
| A22K, B28D, B29R, desB30 | |
| A22K, desB27, B28E, B29R, desB30 | |
| A22K, B28R, desB29, desB30 | |
| A22K, B3Q, B28E, B29R, desB30 | |
| A22K, B13Q, B29R, desB30 | |
| A22K, desB1, B29R, desB30 | |
| A21Q, A22G, A23K, B29R, desB30 | |
| A21Q, A22G, A23G, A24K, B29R, desB30 | |
| A21Q, A22G, A23G, A24G, A25K, B29R, desB30 | |
| А21А, A22K, B29R, desB30 | |
| A21A, A22G, A23K, B29R, desB30 | |
| A21G, A22G, A23K, B29R, desB30 | |
| A21A, A22G, A23G, A24K, B29R, desB30 | |
| A21G, A22G, A23G, A24K, B29R, desB30 | |
| A21G, A22G, A23G, A24G, A25K, B29R, desB30 | |
| A21A, A22G, A23G, A24G, A25K, B29R, desB30 | |
| A21Q, A22K, B3Q, B29R, desB30 | |
| A21A, A22K, B3Q, B29R, desB30 | |
| A21G, A22K, B3Q, B29R, desB30 |
He ограничивающие конкретные примеры ацильных группировок формулы Acy-AA1n-AA2m-AA3p-, которые могут присутствовать в ацилированных аналогах инсулина по данному изобретению, приведены ниже:
В одной форме осуществления группировка, обозначенная АА3, выбрана среди приведенных ниже соединений, в которых атом азота удален из аминогруппы и гидроксигруппа удалена из карбоксигруппы:
| где r представляет собой целое число в интервале 1-100, предпочтительно 1-10, более предпочтительно 3. | где r представляет собой целое число в интервале 1-100, предпочтительно 1-10, более предпочтительно 1. |
| где t представляет собой целое число в интервале 1-150, предпочтительно 20-70, более предпочтительно 43. | где r представляет собой целое число в интервале 1-100, предпочтительно 1-10, более предпочтительно 5-7. |
| где s представляет собой целое число в интервале 1-30, предпочтительно 1-10, более предпочтительно 1. |
Любой из вышеуказанных не ограничивающих конкретных примеров ацильных группировок формулы Acy-AA1n-AA2m-AA3p- может быть присоединен к эпсилон-аминогруппе остатка лизина, присутствующего в любом из вышеуказанных не ограничивающих конкретных примеров аналогов инсулина с получением посредством этого дополнительных конкретных примеров ацилированных аналогов инсулина по данному изобретению.
Исходные инсулины могут быть получены способом, который сам по себе известен. Например, их можно продуцировать путем экспрессии последовательности ДНК, кодирующей интересующий одноцепочечный инсулин, в подходящей клетке-хозяине с помощью хорошо известной методики, которая раскрыта, например, в ЕР 1246845. Инсулин экспрессируется в трансформированной клетке-хозяине в виде молекулы-предшественника, которую преобразуют в желаемую молекулу инсулина ферментативными и химическими способами in vitro, как раскрыто, например, в ЕР 163529 и ЕР 214826. Молекула-предшественник может экспрессироваться с N-концевым удлинением, которое позже отщепляется, как раскрыто, например, в ЕР 1246,845. Примеры N-концевых удлинений типа, пригодного в настоящем изобретении, например, раскрыты в патенте США №5395922 и в патенте ЕР №765395. Более конкретно можно сделать ссылку на WO 2006/082205, от с.37, строка 31, до с.39, строка 29.
Исходный аналог инсулина может быть преобразован в ацилированный аналог инсулина по данному изобретению путем введения желаемой группы формулы Acy-AA1n-AA2m-AA3p- в остаток лизина в аналоге инсулина. Желаемая группа формулы Acy-AA1n-AA2m-AA3p- может быть введена любым удобным способом, и многие способы таких реакций раскрыты на предшествующем уровне техники. Большие подробности видны из приведенных ниже примеров.
Ацилированные аналоги инсулина по данному изобретению могут быть представлены в форме соединений, по существу свободных от цинка, или в форме комплексов с цинком. Когда предложены цинковые комплексы ацилированных аналогов инсулина по данному изобретению, с каждым гексамером инсулина могут быть связаны два иона Zn2+, три иона Zn2+ или четыре иона Zn2+. Растворы цинковых комплексов ацилированных аналогов инсулина по данному изобретению содержат смеси таких типов.
В следующем аспекте данное изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество ацилированного аналога инсулина по данному изобретению вместе с фармацевтически приемлемым носителем, которую можно применять для лечения диабета типа 1, диабета типа 2 и других состояний, которые вызывают гипергликемию, у пациентов, нуждающихся в таком лечении. Ацилированный аналог инсулина по данному изобретению можно применять для получения фармацевтической композиции для применения при лечении диабета типа 1, диабета типа 2 и других состояний, которые вызывают гипергликемию. Такие композиции получают способом, который сам по себе известен.
В следующем аспекте данного изобретения предложена фармацевтическая композиция для лечения диабета типа 1, диабета типа 2 и других состояний, которые вызывают гипергликемию, у пациента, нуждающегося в таком лечении, содержащая терапевтически эффективное количество ацилированных аналогов инсулина по данному изобретению в смеси с инсулином или аналогом инсулина, который обладает быстрым началом действия, вместе с фармацевтически приемлемыми носителями и добавками.
В следующем аспекте данное изобретение относится к легочному применению для лечения диабета типа 1, диабета типа 2 и других состояний, которые вызывают гипергликемию, у пациента, нуждающегося в таком лечении, включающему терапевтически эффективное количество ацилированных аналогов инсулина по данному изобретению, может быть, в смеси с инсулином или аналогом инсулина, который обладает быстрым началом действия, вместе с фармацевтически приемлемыми носителями и добавками.
В одном аспекте в данном изобретении предложена фармацевтическая композиция, представляющая собой смесь ацилированного аналога инсулина по данному изобретению и аналога инсулина быстрого действия, выбранного из группы, состоящей из AspB28 человеческого инсулина; LysB28 ProB29 человеческого инсулина и LysB3 GluB29 человеческого инсулина.
Ацилированные аналоги инсулина по данному изобретению и аналог инсулина быстрого действия могут быть смешаны в соотношении примерно 90/10%; примерно 70/30% или примерно 50/50%.
В следующем аспекте изобретения предложен способ лечения диабета типа 1, диабета типа 2 и других состояний, которые вызывают гипергликемию, у пациент