Способ получения препарата антитела против il-18 или его антигенсвязывающей части (варианты)
Иллюстрации
Показать всеГруппа изобретений относится к способам получения препарата антитела против IL-18 или его антигенсвязывающей части со сниженным содержанием белка клетки-хозяина (БКХ) из образца смеси, содержащей антитело против IL-18 или его антигенсвязывающую часть, и по меньшей мере один БКХ. Способ включает понижение рН от 3,0 до примерно 4,0 образца смеси, доведение рН от 4,5 до примерно 5,5 и проводимости до 9±0,5 мС/см, нанесение образца на катионообменную смолу, осуществление хроматографии гидрофобного взаимодействия и сбор образца. Вариант способа включает осуществление анионообменной хроматографии перед стадией катионообменной хроматографии. Также вариант способа включает фильтрование образца перед анионообменной хроматографией. Группа изобретений позволяет получить препарат антитела с повышенным выходом и чистотой. Выход составляет 96±4%, чистота 99,51±0,26%. 3 н. и 25 з.п. ф-лы, 2 ил., 9 табл., 2 пр.
Реферат
Перекрестная ссылка на родственные заявки
По данной заявке испрашивается приоритет предварительной заявки на патент США № 61/196751, поданной 20 октября 2008 г., включенной в данное описание посредством ссылки во всей своей полноте.
Предпосылки создания изобретения
Интерлейкин-18 человека представляет собой идентифицированный цитокин, который синтезируется в виде биологически неактивного белка-предшественника, включающего 193 аминокислоты. Отщепление белка-предшественника, например, с помощью каспазы-1 или каспазы-4 высвобождает зрелый белок из 156 аминокислот, который проявляется биологическую активность, которая включает костимулирование пролиферации Т-клеток, усиление цитотоксичности NK клеток, запуск продуцирования IFN-γ Т-клетками и NK-клетками и потенцирование дифференциации Т-хелпера типа 1 (Th1). Кроме того, представляет собой эффективный индуктор провоспалительных медиаторов моноцитов человека, включая IL-8, фактор-α некроза опухоли (TNF-α) и простагландин Е2 (PGE2).
IL-18 играет потенциальную роль в иммунорегулировании или воспалении посредством усиления функциональной активности лиганда Fas на клетках Th1. IL-18 также экспрессируется в коре надпочечников и, таким образом, может представлять собой секретируемый нейроиммуномодулятор, играющий важную роль в настройке иммунной системы после стресса.
Клетки Th1, которые продуцируют провоспалительные цитокины, такие как IFN-γ, IL-2 и TNF-β, вовлечены в опосредование многих аутоиммунных заболеваний, включая рассеянный склероз (РС), ревматоидный артрит (РА), диабет типа 1 или инсулинозависимый (IDDM), воспалительное заболевание кишечника (ВЗК) и псориаз. Таким образом, можно ожидать, что антагонизм ТН1 промотирующего цитокина, такого как IL-18, будет ингибировать развитие заболевания. В качестве антагониста можно использовать IL-18-специфические mAb.
In vivo IL-18 образуется за счет расщепления pro-IL-18, и его эндогенная активность, по-видимому, рассматривается в IFN-γ продуцировании в P. acnes и LPS-опосредованной смертности. Блокирование биологической активности IL-18 при заболеваниях человека является терапевтической стратегией при многих заболеваниях. Это можно осуществить с использованием растворимых рецепторов или блокирующих антител для связанного с клетками рецептора IL-18.
Цитокин-связывающие белки (растворимые рецепторы цитокинов) соответствуют межклеточным лиганд-связывающим доменам поверхностных цитокиновых рецепторов на поверхности соответствующих клеток. Они образуются или путем альтернативного сплайсинга пре-мРНК, обычной для поверхностного клеточного рецептора, или путем протеолитического расщепления поверхностного клеточного рецептора. Такие растворимые рецепторы были описаны в прошлом, включая, наряду с прочим, растворимые рецепторы IL-6 и IFN-γ. Один цитокин-связывающий белок, называемый остеопротегерином (OPG, также известный как ингибирующий фактор остеокластов OCIF), член семейства TNFR/Fas, оказался первым примером растворимого рецептора, который существует только в качестве секретированного белка.
Было предположено, что IL-18 вовлечен в развитие патогенности при хронических воспалительных заболеваниях, включающих эндотоксиновый шок, гепатит и аутоиммунный диабет. Возможная роль IL-18 в развитии повреждения печени постулировалась на основании экспериментов, показавших повышенный уровень IL-18 в индуцированном липосахаридом остром повреждении печени на мышиной модели. Однако механизм мультифункционального фактора IL-18 в развитии повреждения печени до настоящее времени не выяснен.
Исследования последних лет показывают, что IL-18 играет провоспалительную роль в обобщенном метаболизме. Исследователи показали, что IL-18 продуцируется суставными хондроцитами и индуцирует провоспалительную и катаболическую ответные реакции. мРНК IL-18 стимулируется посредством IL-1β в хондроцитах. Хондроциты продуцируют предшественник IL-18 и, в ответ на стимуляцию за счет IL-1, продуцируют зрелую форму IL-18. Исследования эффекта IL-18 на хондроциты дополнительно показали, что он ингибирует индуцированную TGF-β пролиферацию и усиливает продуцирование окиси азота. IL-18 стимулировал экспрессию нескольких генов в нормальных суставных хондроцитах человека, включая индуцируемую окисью азота синтазу, индуцируемую циклооксигеназу, IL-6 и стромелизин. Экспрессию гена связывали с синтезом соответствующих белков. Обработка с использованием IL-18 нормального суставного хряща увеличивала высвобождение гликозаминогликанов. Эти данные выявили IL-18 в качестве цитокина, который регулирует ответные реакции хондроцитов и вносит свой вклад в разрушение хряща.
Было предположено, что IL-18 играет провоспалительную роль в ревматоидном артрите. Было показано, что уровни IL-18 значительно повышаются в синовиальной жидкости у пациентов с ревматоидным артритом. Исследователи выявили мРНК IL-18 и белок в синовиальных тканях при ревматоидном артрите на значительно более высоких уровнях, чем при остеоартрите в качестве контроля. Также было показано, что комбинация IL-12 или IL-15 с IL-18 вызывает продуцирование IFN-γ в синовиальных тканях in vitro. Кроме того, введение IL-18 мышам, иммунизированным коллагеном в неполном адъюванте Фрейнда, облегчало развитие эрозионного воспалительного артрита, давая возможность предположить, что IL-18 может представлять собой провоспалительный фактор in vivo.
Была продемонстрирована роль IL-18 в развитии других аутоиммунных заболеваний. Соответственно, было показано, что экспрессия IL-18 существенно увеличивается в поджелудочной железе и селезенке у не страдающих ожирением диабетических мышей непосредственно перед началом заболевания. Кроме того, было показано, что введение IL-18 увеличивает клиническую тяжесть экспериментального аллергического энцефаломиелита (ЕАЕ) у мышей, Th1-опосредованного аутоиммунного заболевания, которое представляет собой модель рассеянного склероза. Дополнительно было показано, что антисыворотка, нейтрализующая антикрысиный IL-18, предотвращает развитие ЕАЕ у самок крыс Lewis. Соответственно, IL-18 представляет собой желаемую мишень при разработке новых терапевтических средств для аутоиммунных заболеваний.
IL-18 представляет собой плейотропный интерлейкин, обладающий как усиливающими воспаление, так и ослабляющими его свойствами. С одной стороны, он усиливает продуцирование провоспалительных цитокинов, таких как TNF-α, промотируя тем самым воспаление. С другой стороны, он вызывает продуцирование NO, ингибитора каспазы-1, промотируя, тем самым, созревание IL-1β и IL-18 и, возможно, облегчая воспаление. Такая двойственная роль IL-18 поднимает вопросы, связанные с эффективностью ингибиторов IL-18 при лечении воспалительных заболеваний. Кроме того, из-за взаимодействия большого множества различных цитокинов и хемокинов, в регулировании воспаления нельзя ожидать, что благоприятное действие будет получено путем блокирования только одного из игроков в таком сложном сценарии.
Невзирая на все вышесказанное, нейтрализация антител IL-18 рассматривается как полезный фактор для облегчения аутоиммунных заболеваний и родственных симптомов. Соответственно, существует необходимость в данной области в антителе IL-18 с высокой аффинностью, таком как нейтрализующее моноклональное антитело интерлейкина IL-18 человека. Более того, важно, чтобы терапевтический режим, включающий антитела против IL-18, имел высокую чистоту. Настоящее изобретение адресовано данной необходимостью без использования колонки с белком А или эквивалентной стадии очистки на основе белка А.
Краткое изложение сущности изобретения
В некоторых вариантах осуществления настоящее изобретение относится к очищенным выделенным антителам и фрагментам антител, которые связываются с IL-18, а также к фармацевтическим композициям, содержащим такие антитела и фрагменты. В некоторых вариантах осуществления изобретение относится к выделенным антителам или их антигенсвязывающим частям, которые связываются с IL-18 человека. Выделенные антитела против IL-18 по настоящему изобретению можно использовать в клинических условиях, а также в научных исследованиях и разработках. В некоторых вариантах осуществления настоящее изобретение относится к антителу против IL-18, включающему последовательности тяжелой и легкой цепи, идентифицированные в SEQ ID NO 1 и 2.
Некоторые варианты осуществления изобретения относятся к способам очистки антител против IL-18 или их антигенсвязывающих частей, из матричных образцов, чтобы сделать их по существу не содержащими белков клетки-хозяина («БКХ»). В некоторых аспектах матричные образцы (или просто «образцы») включают клеточную линию, используемую для продуцирования антител против IL-18 по настоящему изобретению. В конкретных аспектах, образцы включают клеточную линию, используемую для продуцирования антител против IL-18 человека.
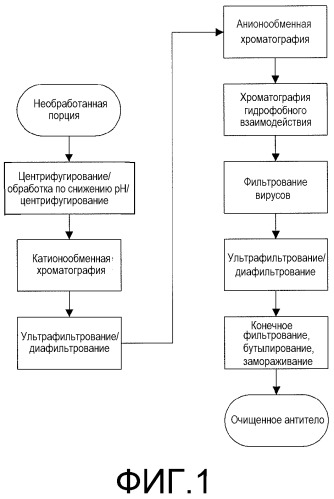
В некоторых вариантах осуществления настоящего изобретения матричный образец, включающий предполагаемое антитело против IL-18 или его антигенсвязывающую часть, подвергают регулированию рН. В некоторых аспектах рН доводят примерно до 3,5. Низкое значение рН, помимо прочего, промотирует сокращение и/или дезактивацию рН-чувствительных вирусов, которые могут присутствовать в образце. После подходящего промежутка времени рН доводят примерно до 5,0 и образец подвергают ионообменной хроматографии для получения элюата. В некоторых аспектах полученный при ионном обмене элюат собирают и дополнительно подвергают хроматографии гидрофобного взаимодействия для получения элюата. Элюат, полученный при хроматографии гидрофобного взаимодействия, затем может быть собран для дополнительной переработки или применения.
В некоторых вариантах осуществления настоящее изобретение относится к способу очистки антител против IL-18, который включает первичную стадию выделения для, помимо прочего, удаления клеток и клеточного дебриса. В некоторых вариантах осуществления указанного выше способа первичная стадия выделения включает одну или несколько стадий центрифугирования или глубокого фильтрования. Например, но не в качестве ограничения, такие стадии центрифугирования можно осуществлять приблизительно от 7000×g до приблизительно 11000×g. Дополнительно некоторые варианты осуществления вышеуказанного способа будут включать стадию глубокого фильтрования, такую как делипидная стадия глубокого фильтрования.
В некоторых вариантах осуществления вышеуказанного способа стадия ионного обмена может представлять собой либо катионную, либо анионообменную хроматографию или их комбинацию. Данная стадия может включать множество стадий ионного обмена, как, например, стадия катионного обмена с последующей стадией анионного обмена или наоборот. В некоторых аспектах стадия ионного обмена включает двухстадийный процесс ионного обмена. Такие двухстадийные процессы могут быть осуществлены, например, не в качестве ограничения, путем проведения первоначально стадии катионного обмена с последующей второй стадией анионного обмена. Примером катионообменной колонки является колонка, стационарная фаза которой содержит анионные группы, такая как колонка CM Hyper DFTM. Такая хроматографическая стадия ионообменного захвата облегчает выделение антител против IL-18 из первичной смеси для выделения. Подходящая анионообменная колонка представляет собой колонку, стационарная фаза которой включает катионные группы. Примером такой колонки является колонка Q SepharoseTM. На одной или нескольких стадиях ионного обмена происходит дополнительное отделение антител против IL-18 за счет уменьшения примесей, таких как белки и ДНК клетки-хозяина, и, где это осуществимо, аффинного матричного белка. Такой метод анионного обмена представляет собой поток через хроматографический модуль, где антитела против IL-18 не взаимодействуют или не связываются с анионообменной смолой (или твердой фазой). Однако множество примесей действительно взаимодействует и связывается с анионообменной смолой.
В некоторых вариантах осуществления первую и вторую стадии ионного обмена проводят после первичного выделения. В некоторых таких вариантах осуществления образец для ионного обмена подвергают промежуточной стадии фильтрования, либо перед первой стадией ионного обмена, между двумя стадиями ионного обмена или после обоих стадий. В некоторых аспектах, стадия фильтрования включает захват методами ультрафильтрования/диафильтрования ("UF/DF"). Помимо прочих задач, такое фильтрование облегчает концентрирование и буферный обмен антител против IL-18 и их антигенсвязывающих частей.
Некоторые варианты осуществления данного изобретения относятся к способу, включающему проведение одной или нескольких стадий хроматографии гидрофобного взаимодействия (ХГВ). Подходящая колонка для ХГВ представляет собой колонку, стационарная фаза которой включает гидрофобные группы. Неограничивающим примером такой колонки является колонка Phenyl HP SepharoseTM. В некоторых обстоятельствах антитела против IL-18 будут образовывать агрегаты во время процесса выделения/очистки. Включение одной или нескольких стадий ХГВ облегчает уменьшение образования или исключает образование таких агрегатов. ХГВ также способствует удалению примесей. В некоторых вариантах осуществления на стадии ХГВ используется высокосолевой буфер для того, чтобы способствовать взаимодействию антител против IL-18 (или их агрегатов) с гидрофобной колонкой. Антитела против IL-18 затем могут быть элюированы с использованием более низкой концентрации соли.
В некоторых вариантах осуществления элюат, полученный при ХГВ, фильтруют с использованием фильтра для удаления вирусов, такого как, но без ограничений, фильтр Ultipor DV50TM (Pall Corporation, East Hills, N.Y.). В таких вариантах осуществления также можно использовать альтернативные фильтры, такие как фильтры ViresolveTM (Millipore, Billerica, Mass.); фильтры Zeta Plus VRTM (CUNO; Meriden, Conn.); фильтры PlanovaTM (Asahi Kasei Pharma, Planova Division, Buffalo Grove, I11).
В некоторых вариантах осуществления изобретение относится к одной или нескольким фармацевтическим композициям, содержащим выделенное антитело против IL-18 или его антигенсвязывающую часть и приемлемый носитель. В одном аспекте композиция дополнительно содержит одно или несколько антител или их антигенсвязывающих частей в дополнение к антителу против IL-18. В другом аспекте композиция дополнительно содержит один или несколько фармацевтических агентов.
Краткое описание фигур
Фиг.1. На фиг.1 представлен неограничивающий пример схемы очистки по настоящему изобретению.
Фиг.2. На фиг.2 показаны последовательности тяжелой и легкой цепи неограничивающего примера антитела против IL-18 (АВТ-325).
Подробное описание изобретения
Настоящее изобретение относится к антителам, которые связываются с IL-18 человека. В одном аспекте изобретение относится к выделенным антителам или их антигенсвязывающим частям, которые связываются с IL-18 человека. Выделенные антитела против IL-18 по настоящему изобретению можно использовать в клинических условиях, а также в научных исследованиях и разработках. Настоящее изобретение также относится к способам очистки антител против IL-18 или их антигенсвязывающих частей. Подходящие антитела против IL-18, которые могут быть очищены в соответствии с контекстом настоящего изобретения, описаны в заявках на патент США 09/780035 и 10/988360, включая антитело, которое впоследствии было идентифицировано как АВТ-325. Последовательности тяжелой и легкой цепей АВТ-325 представлены на фиг.2. Настоящее изобретение также относится к фармацевтическим композициям, содержащим описанные в настоящем изобретении антитела против IL-18 или их антигенсвязывающие части.
Для простоты, но не для ограничения, данное подробное описание разделено на следующие подразделы:
Определения;
Генерирование антител;
Продуцирование антител;
Очистка антител;
Способы анализа чистоты образца;
Дополнительные модификации;
Фармацевтические композиции; и
Применение антител.
Определения
Для более легкого понимания настоящего изобретения сначала будут определены некоторые термины.
Термин «антитело» включает молекулу иммуноглобулина, состоящую из четырех полипептидных цепей, двух тяжелых (Н) цепей и двух легких (L) цепей, связанных между собой дисульфидными связями. Каждая тяжелая цепь включает вариабельную область тяжелой цепи (сокращенно называемую в данном описании как HCVR или VH) и константную область тяжелой цепи (СН). Константная область тяжелой цепи включает три домена, СН1, СН2 и СН3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно называемой в данном описании LCVR или VL) и константной области легкой цепи. Константная область легкой цепи включает один домен, CL. Области VH и VL могут быть дополнительно подразделены на области гипервариабельности, обозначаемые определяющими комплементарность областями (CDR), перемежающиеся с областями, которые являются более сохраняющимися, называемыми областями рамки считывания (FR). Каждая VH и VL состоит из трех областей CDR и четырех областей FR, расположенных, начиная от аминного конца к карбоксильному концу в следующем порядке: FRl, CDRl, FR2, CDR2, FR3, CDR3, FR4.
Термин «антигенсвязывающая часть» антитела (или часть антитела) включает фрагменты антитела, которые сохраняют способность специфически связываться с антигеном (например, hIL-18). Было показано, что антигенсвязывающая функция антитела может осуществляться посредством фрагментов полного антитела. Примеры связывающих фрагментов, охватываемых термином «антигенсвязывающая часть» антитела, включают: (i) фрагмент Fab, одновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) фрагмент F(ab')2, двухвалентный фрагмент, состоящий из двух фрагментов Fab, связанных дисульфидным мостиком в шарнирной области; фрагмент Fd, состоящий из доменов VH и CH1; (iv) фрагмент Fv, состоящий из доменов VL и VH одной «плеча» антитела; (v) фрагмент dAb (Ward et al., (1989) Nature 341:544-546, полное содержание которой включено в данное описание посредством ссылки), который состоит из домена VH, и (vi) выделенную, определяющую комплементарность область (CDR). Кроме того, хотя два домена фрагмента Fv, VL и VH, кодируются отдельными генами, они могут быть объединены, с использованием рекомбинантных методов, синтетическим линкером, который дает возможность получить их в виде одной белковой цепи, в которой области VL и VH располагаются парами с образованием одновалентных молекул (известных как одноцепочечный Fv (scFv); см., например, Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883, полное содержание которых включено в данное описание посредством ссылки). Подразумевается, что такие одноцепочечные антитела также охватываются термином «антигенсвязывающая часть» антитела. Также охватываются другие формы одноцепочечных антител, такие как диатела. Диатела являются двухвалентными, биспецифическими антителами, в которых домены VH и VL экспрессируются на одной полипептидной цепи, но с использованием линкера, который является слишком коротким, чтобы образовывались пары между двумя доменами одной и той же цепи, тем самым вынуждая домены располагаться парами с комплементарными доменами другой цепи и создавая два антигенсвязывающих сайта (см., например, Holliger, P., et al. (1993) Proc. Natl. Acad. Sci. USA 90:6444-6448; Poljak, R.J., et al. (1994) Structure 2:1121-1123, полное содержание которых включено в данное описание посредством ссылки). Еще помимо этого антитело или его антигенсвязывающая часть могут представлять собой часть большей иммуноадгезионной молекулы, образованной за счет ковалентной или нековалентной ассоциации антитела или части антитела с одним или несколькими другими белками или пептидами. Примеры таких иммуноадгезионных молекул включают применение стрептавидинового ядра для получения тетрамерной молекулы scFv (Kipriyanov, S.M., et al. (1995) Human Antibodies and Hybridomas 6:93-101, полное содержание которой включено в данное описание посредством ссылки) и применение цистеинового остатка, маркерного пептида и С-концевого полигистидинового остатка для получения двухвалентных и биотинилированных молекул scFv (Kipriyanov, S.M., et al. (1994) MoI. Immunol. 31:1047-1058, полное содержание которой включено в данное описание посредством ссылки). Части антител, такие как фрагменты Fab и F(ab')2, могут быть получены из цельных антител с использованием общепринятых способов, таких как расщепление цельных антител с использованием папаина или пепсина, соответственно. Более того, антитела, части антител и иммуноадгезионные молекулы могут быть получены с помощью стандартных рекомбинантных технологий ДНК, как описано в данном описании. В одном аспекте антигенсвязывающие части представляют собой полные домены или пары полных доменов.
Выражение «интерлейкин 18 человека» (сокращенно приведенный в данном описании как hIL-18 или IL-18), как оно использовано в данном описании, относится к цитокину человека, который первоначально синтезируется в качестве биологически неактивного белка-предшественника, включающего 193 аминокислоты, а также к зрелому белку, продуцируемому, например, не в качестве ограничения, путем расщепления белка-предшественника, например, под действием каспазы-1 или каспазы-4, который проявляет биологическую активность, которая включает костимулирование пролиферации Т-клеток, усиление цитотоксичности NK клеток, запуск продуцирования IFN-γ Т-клетками и NK-клетками и потенцирование дифференциации Т-хелпера типа 1 (Th1). Нуклеиновая кислота, кодирующая IL-18, доступна из GenBank с кодом доступа NM_001562, и последовательность полипептида доступна из GenBank с кодом доступа NP_001553. Подразумевается, что термин «IL-18 человека» включает рекомбинантный IL-18 человека (rh IL-18), который может быть получен стандартными методами рекомбинантной экспрессии.
Термины «нумерация Кабата», «определения Кабата» и «мечение по Кабату» используются в данном описании взаимозаменяемо. Эти термины, которые известны в данной области, относятся к системе нумерации аминокислотных остатков, которые являются более вариабельными (т.е. гипервариабельными) по сравнению с другими аминокислотными остатками в вариабельных областях тяжелой и легкой цепи антитела или его антигенсвязывающей части (Kabat et al. (1971) Ann. NY Acad, Sci. 190:382-391 и Kabat, E.A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NTH Publication No. 91-3242, полное содержание которых включено в данное описание посредством ссылки). Для вариабельной области тяжелой цепи область гипервариабельности располагается в диапазоне положений аминокислот от 31 до 35 для CDR1, положений аминокислот от 50 до 65 для CDR2 и положений аминокислот от 95 до 102 для CDR3. Для вариабельной области легкой цепи область гипервариабельности располагается в диапазоне положений аминокислот от 24 до 34 для CDR1, положений аминокислот от 50 до 56 для CDR2 и положений аминокислот от 89 до 97 для CDR3.
Термин «антитело человека» включает антитела, имеющие вариабельные и константные области, соответствующие зародышевой последовательности иммуноглобулина человека, как описано Kabat и др. (см., Kabat, et al. (1991) Sequences of proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Антитела человека настоящего изобретения могут включать остатки аминокислот, которые не кодируются зародышевой последовательностью иммуноглобулина человека (например, мутации, введенные путем случайного или сайт-специфического мутагенеза in vitro или путем соматической мутации in vivo), например, в областях CDR и, в частности, CDR3. Мутации могут быть введены с помощью «подхода селективного мутагенеза»). Антитело человека может содержать по меньшей мере одно положение, замененное остатком аминокислоты, например, увеличивающим активность остатком аминокислоты, который не кодируется зародышевой последовательностью иммуноглобулина человека. Антитело человека может содержать до двадцати положений, замененных аминокислотными остатками, которые не являются частью зародышевой последовательности иммуноглобулина человека. В других вариантах осуществления заменено до десяти, до пяти, до трех или до двух положений. В одном варианте осуществления данные замены находятся в областях CDR. Однако не предполагается, что термин «антитело человека», как он используется в данном описании, включает антитела, в которых области CDR, полученные от зародышевых линий других видов млекопитающих, таких как мышь, были привиты на последовательности рамки считывания человека.
Выражение «подход селективного мутагенеза» включает способ улучшения активности антитела путем выбора и индивидуального мутирования аминокислот области CDR по меньшей мере в одном подходящем положении для селективной мутации, гипермутации и/или контактном положении. «Селективно мутированное» антитело человека представляет собой антитело, которое включает мутацию в положении, выбранном с использованием селективного мутагенезного подхода. В другом аспекте подразумевается, что «подход селективного мутагенеза» относится к способу предпочтительного мутирования выбранных индивидуальных аминокислотных остатков в CDR1, CDR2 или CDR3 вариабельной области тяжелой цепи (здесь и далее Н1, Н2 и Н3, соответственно) или в CDR1, CDR2 или CDR3 вариабельной области легкой цепи (здесь и далее L1, L2 и L3, соответственно) антитела. Остатки аминокислот могут быть выбраны из положений селективного мутагенеза, контактных положений или положений гипермутации. Индивидуальные аминокислоты выбирают на основании их положения в вариабельной области легкой или тяжелой цепи. Следует понимать, что положение гипермутации также может представлять собой контактное положение. В одном аспекте подход селективного мутагенеза представляет собой «направленный подход». Подразумевается, что выражение «направленный подход» включает способ мутирования выбранных аминокислотных остатков в CDR1, CDR2 или CDR3 вариабельной области тяжелой цепи или CDR1, CDR2 или CDR3 вариабельной области легкой цепи антитела направленным образом, например, «групповым направленным подходом» или «CDR направленным подходом». В «групповом направленном подходе» индивидуальные остатки аминокислот в определенных группах нацеливают для селективных мутаций, включающих группы I (включая L3 и H3), II (включая H2 и L1) и III (включая L2 и H1), где группы перечислены в порядке предпочтительности для нацеливания. В «CDR направленном подходе» индивидуальные остатки аминокислот в определенных CDR нацеливают для селективных мутаций в следующем порядке предпочтительности нацеливания: H3, L3, H2, L1, H1 и L2. Проводят мутацию выбранных аминокислотных остатков, например, по меньшей мере на два остатка других аминокислот и определяют воздействие мутации на активность антитела. Активность измеряют как изменение специфичности/аффинности связывания антитела и/или нейтрализации эффективности антитела. Следует понимать, что подход селективного мутагенеза можно использовать для оптимизации любого антитела, полученного из любого источника, включая фаговый дисплей, трансгенных животных с генами IgG зародышевой линии человека, антитела человека, выделенные из В-клеток человека. Подход селективного мутагенеза можно использовать для антител, которые не могут быть в дальнейшем оптимизированы с использованием технологии фагового дисплея. Следует понимать, что антитела из любого источника, включая фаговый дисплей, трансгенных животных с генами IgG зародышевой линии человека, антитела человека, выделенные из В-клеток человека, могут быть подвергнуты обратной мутации перед или после подхода селективного мутагенеза.
Выражение «рекомбинантное антитело человека» включает антитела человека, которые получают, экспрессируют, создают или выделяют рекомбинантными способами, как, например, антитела, экспрессированные с использованием рекомбинантного вектора экспрессии, трансфицированного в клетку-хозяина, антитела, выделенные из рекомбинантной комбинаторной библиотеки антител, антитела, выделенные из животного (например, мыши), которое является трансгенным для генов иммуноглобулина человека (см., например, Taylor, L.D., et al. (1992) Nucl. Acids Res. 20:6287-6295, полное содержание которой включено в данное описание посредством ссылки) или антитела, которые получают, экспрессируют, создают или выделяют с помощью других способов, включающих слайсинг последовательностей иммуноглобулина человека с другими последовательностями ДНК. Такие рекомбинантные антитела человека имеют вариабельные и константные области, полученные из зародышевой последовательности иммуноглобулина человека (см., Kabat, E.A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Однако в некоторых вариантах осуществления такие рекомбинантные антитела человека подвергают мутагенезу in vitro (или когда используют животных, трансгенных для последовательностей IgG человека, соматическому мутагенезу in vivo), и, таким образом, последовательности аминокислот областей VH и VL рекомбинантных антител представляют собой такие, которые, хотя и получены из или являются родственными зародышевым последовательностям VH и VL человека, могут не существовать в природе в рамках иммунной системы зародышевого антитела человека in vivo. Однако в некоторых вариантах осуществления такие рекомбинантные антитела представляют собой результат подхода селективного мутагенеза или обратной мутации или обоих.
Выражение «выделенное антитело» относится к антителу, которое по существу не содержит других антител, имеющих другую антигенную специфичность (например, выделенное антитело, которое специфически связывает hIL-18, по существу не содержит антител, которые специфически связывают антигены, отличные от hIL-18). Выделенное антитело, которое специфически связывает hIL-18, может связывать молекулы IL-18 других видов. Более того, выделенное антитело может по существу не содержать других клеточных веществ и/или химических соединений.
Выражение «нейтрализующее антитело» (или «антитело, которое нейтрализует активность hIL-18») включает антитело, чье связывание с hIL-18 приводит к ингибированию биологической активности hIL-18. Такое ингибирование биологической активности hIL-18 может быть оценено путем измерения одного или нескольких индикаторов биологической активности hIL-18, таких как вызывание продуцирования IFNγ Т-клетками или NK-клетками, или ингибирование связывания рецептора IL-18 в анализе связывания рецептора IL-18 человека. Данные индикаторы биологической активности hIL-18 могут быть оценены с использованием одного или нескольких стандартов в анализах in vitro или in vivo, известных в данной области.
Термин «активность» включает активности, такие как специфичность/аффинность связывания антитела в отношении антигена, например, антитела против hIL-18, которое связывается с антигеном IL-18, и/или нейтрализующая эффективность антитела, например, антитела против hIL-18, чье связывание с hIL-18 ингибирует биологическую активность hIL-18, например, ингибирование пролиферации бластов РНА или ингибирование связывания рецептора в анализе связывания рецептора IL-18 человека.
Выражение «поверхностный плазмонный резонанс» включает оптическое явление, которое дает возможность анализа в режиме реального времени биоспецифических взаимодействий путем обнаружения изменений в концентрациях белка в биосенсорной матрице, например, с использованием системы BIAcore (Pharmacia Biosensor AB, Uppsala, Швеция и Piscataway, NJ.). Дополнительные определения см. в публикациях Jonsson, U., et al. (1993) Ann. Biol. Clin. 51:19- 26; Jonsson, U., et al. (1991) Biotechniques 11:620-627; Johnsson, B., el al. (1995) J. MoI. Recognit. 8:125-131; и Johnnson, B., et al. (1991) Anal. Biochem. 198:268-277, полное описание которых включено в настоящее описание посредством ссылки.
Термин «Koff», как он использован в данном описании, предназначен для обозначения константы скорости диссоциации антитела из комплекса антитело/антиген.
Термин «Kd», как он использован в данном описании, предназначен для обозначения константы диссоциации взаимодействия определенного антитела-антигена.
Выражение «молекула нуклеиновой кислоты» включает молекулы ДНК и молекулы РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но в одном аспекте относится к двухцепочечной ДНК.
Выражение «выделенная молекула нуклеиновой кислоты», как оно использовано в данном описании при определении нуклеиновых кислот, кодирующих антитела или части антител (например, VH, VL, CDR3), которые связывают hIL-18 (включая «выделенные антитела»), включает молекулу нуклеиновой кислоты, в которой последовательность нуклеотидов, кодирующая антитело или часть антитела, не содержит других последовательностей нуклеотидов, кодирующих антитела или части антител, которые связывают антигены, отличные от hIL-18, указанные другие последовательности могут по природе примыкать к нуклеиновой кислоте в геномной ДНК человека. Таким образом, например, выделенная молекула нуклеиновой кислоты настоящего изобретения, кодирующая область VH антитела против IL-18, не содержит других последовательностей, кодирующих другие области VH, которые связывают антигены, отличные от IL-18. Также подразумевается, что выражение «выделенная молекула нуклеиновой кислоты» включает последовательности, кодирующие бивалентные, биспецифические антитела, такие как диатела, в которых области VH и VL не содержат других последовательностей, отличающихся от последовательностей диатела.
Выражение «рекомбинантная клетка-хозяин» (или просто «клетка-хозяин») относится к клетке, в которую был введен рекомбинантный вектор экспрессии. Следует понимать, что подобные термины подразумеваются, как относящиеся не только к конкретной рассматриваемой клетке, но и к потомству таких клеток. Поскольку определенные модификации могут существовать в последующих поколениях вследствие либо мутации, либо влияний окружающей среды, такое потомство может, в действительности, не быть идентичным исходной клетке, но оно все еще входит в объем термина «клетка-хозяин», как он использован в данном описании.
Термин «модифицированный», как он использован в данном описании, предназначен для обозначения изменений одной или нескольких аминокислот в антителах или их антигенсвязывающих частях. Изменение может быть вызвано путем добавления, замещения или удаления аминокислоты в одном или нескольких положениях. Изменение может быть осуществлено с использованием известных способов, таких как ПЦР мутагенез.
Термин «примерно», как он использован в данном описании, предназначен для обозначения диапазонов приблизительно на 10-20% больших или меньших, чем указанное значение. В некоторых обстоятельствах специалисту в данной области будет понятно, что вследствие природы приведенного значения термин «примерно» может означать больше или меньше, чем 10-20% отклонение от значения.
Выражение «уменьшение/дезактивация вирусов», как оно использовано в данном описании, предназначено для обозначения снижения числа вирусных частиц в конкретном образце («уменьшение»), а также снижения активности, например, но без ограничения, инфекционности или способности к репликации вирусных частиц в конкретном образце («дезактивация»). Такое снижение числа и/или активности вирусных частиц может составлять примерно от 1% до примерно 99%, предпочтительно примерно от 20% до примерно 99%, более предпочтительно примерно от 30% до примерно 99%, более предпочтительно примерно от 40% до примерно 99%, еще более предпочтительно примерно от 50% до примерно 99%, еще более предпочтительно примерно от 60% до примерно 99%, и еще более предпочтительно примерно от 70% до примерно 99%, еще более предпочтительно примерно от 80% до примерно 99% и еще более предпочтительно примерно от 90% до примерно 99%. В некоторых неограничивающих вариантах осуществления количество вирусов, если они присутствуют, в очищенном продукте антитела составляет менее чем ID50 (количество вируса, которое будет инфицировать 50% популяции-мишени) для данного вируса, предпочтительно по меньшей мере в 10 раз меньше, чем ID50 для данного вируса, более предпочтительно по меньшей мере в 100 раз меньше, чем ID50 для данного вируса, и еще более предпочтительно по меньшей мере в 1000 раз меньше, чем ID50 для данного вируса.
Выражение «контактное положение» включает положение аминокислот в CDR1, CDR2 или CDR3 вариабельной области тяжелой цепи или вариабельной области легкой цепи антитела, которое занимает аминокислота, которая контактирует с антигеном в одном из двадцати шести известных структу