Пиперидиновые соединения, содержащая их фармацевтическая композиция и ее применение
Иллюстрации
Показать всеИзобретение относится к пиперидиновым соединениям формулы (I) и их фармацевтически приемлемым солям, фармацевтической композиции на их основе, способу лечения с их использованием и их применению для лечения желудочно-кишечных заболеваний. В формуле (I)
m представляет собой целое число 1 или 2; n представляет собой целое число от 0 до 2; A выбран из фенильной группы и бензимидазольной группы, где фенильная группа замещена одной или более группами, независимо выбранными из C1-C6 линейной или разветвленной алкильной группы, C1-C6 линейной или разветвленной алкоксигруппы, аминогруппы и галогена, а бензимидазольная группа замещена одной или более группами, независимо выбранными из C1-C6 линейной или разветвленной алкильной группы, C1-C6 линейной или разветвленной алкоксигруппы, C3-C7 циклической алкильной группы, аминогруппы, галогена и оксогруппы; X представляет собой гидрокси или OCONR1R2, где R1 и R2 независимо выбраны из водорода и C1-C6 линейной или разветвленной алкильной группы, или R1 и R2 образуют 5-7-членное гетероциклическое кольцо или 3,5-диметилпиперидиновое кольцо, вместе с атомом азота, к которому они присоединены, и В выбран из фенильной группы, феноксигруппы, тиенильной группы и нафтильной группы, где фенильная группа, феноксигруппа, тиенильная группа или нафтильная группа замещена одной или более группами, независимо выбранными из водорода, галогена, нитро, циано, трифторметила, трифторметокси, дифторметокси, фенила, C1-C6 линейной или разветвленной алкильной группы и C1-C6 линейной или разветвленной алкоксигруппы. 4 н. и 21 з.п. ф-лы, 3 табл., 163 пр.
Реферат
ТЕХНИЧЕСКАЯ ОБЛАСТЬ
Настоящее изобретение в общем относится к пиперидиновому соединению и его фармацевтически приемлемым солям, фармацевтической композиции, содержащей эффективное количество рацемических или энантиомерно обогащенных пиперидиновых соединений, для лечения желудочно-кишечных заболеваний и к способу лечения желудочно-кишечных заболеваний у млекопитающего. Более конкретно, настоящее изобретение относится к рацемическим или энантиомерно обогащенным О-карбамоильным и гидроксильным пиперидиновым соединениям и их фармацевтически приемлемым солям, которые пригодны для лечения синдрома раздраженного кишечника (IBS), нарушения двигательной функции желудка и висцеральной боли.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Во многих сообщениях указано, что пиперидиновые соединения эффективно используются для лечения различных желудочно-кишечных заболеваний, особенно синдрома раздраженного кишечника (IBS) и нарушений двигательной функции желудка.
Например, цис-4-амино-5-хлор-N-[1-[3-(4-фторфенокси)-пропил]-3-метокси-4-пиперидинил]-2-метоксибензамид (общее наименование: цизаприд (Cisapride)) широко применялся в клинике в качестве усилителя перистальтики желудочно-кишечного тракта или в качестве желудочно-кишечного прокинетического агента, а другие пиперидиновые соединения были описаны в многочисленных патентных документах (WO 2005/092882, WO 1999/055674, WO 2005/021539, WO 04/026868, WO 04/094418, WO 99/02494) в качестве терапевтических лекарственных средств для лечения желудочно-кишечных заболеваний.
Продолжались активные исследования и попытки создания, направенные на использование пиперидиновых соединений для лечения желудочно-кишечных заболеваний.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В некоторых воплощениях предложены пиперидиновое соединение и/или его фармацевтически приемлемая соль, фармацевтическая композиция, содержащая эффективное количество пиперидинового соединения и/или его фармацевтически приемлемой соли, для лечения желудочно-кишечного заболевания, а также способ лечения заболеваний у млекопитающего, таких как синдром раздраженного кишечника (IBS), нарушение двигательной функции желудка и/или висцеральной боли.
В некоторых воплощениях предложены способ лечения расстройств у млекопитающего путем введения эффективного количества рацемического или энантиомерно обогащенного пиперидинового соединения, представленного приведенной ниже структурной формулой (I), в частности соединений, представленных приведенными ниже структурными формулами (IV) и (V), и фармацевтически приемлемого носителя млекопитающему, нуждающемуся в терапии синдрома раздраженного кишечника (IBS) или нарушения двигательной функции желудка.
В некоторых воплощениях предложено применение пиперидинового соединения и/или его фармацевтически приемлемой соли для предупреждения и/или лечения желудочно-кишечного заболевания, такого как синдром раздраженного кишечника (IBS), нарушение двигательной функции желудка, запор и/или висцеральная боль, у млекопитающего.
В некоторых воплощениях предложено применение пиперидинового соединения и/или его фармацевтически приемлемой соли в изготовлении фармацевтической композиции для предупреждения и/или лечения желудочно-кишечного заболевания, такого как синдром раздраженного кишечника (IBS), нарушение двигательной функции желудка, запор и/или висцеральная боль, у млекопитающего.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Более полное понимание изобретения и многие присущие ему преимущества будут очевидны в результате лучшего его понимания со ссылкой на следующее далее его подробное описание.
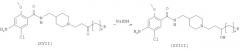
В одном воплощении предложены пиперидиновое соединение, представленное следующей структурной формулой (I), и его фармацевтически приемлемые соли
Где m представляет собой целое число 1 или 2;
n представляет собой целое число от 0 до 2, предпочтительно 0;
A выбран из группы, состоящей из фенильной группы и бензимидазольной группы, где фенильная группа может быть замещена одной или более одинаковыми или разными группами, независимо выбранными из группы, состоящей из водорода, С1-С6 линейной или разветвленной алкильной группы, C1-С6 линейной или разветвленной алкоксигруппы, аминогруппы и галогена, а бензимидазольная группа может быть замещена одной или более одинаковыми или разными группами, независимо выбранными из группы, состоящей из водорода, С1-С6 линейной или разветвленной алкильной группы, С1-С6 линейной или разветвленной алкоксигруппы, C3-С7 циклической алкильной группы, аминогруппы, галогена и оксогруппы;
X представляет собой гидрокси или OCONR1R2, где R1 и R2 могут быть одинаковыми или разными и независимо выбраны из группы, состоящий из водорода, С1-С6 линейной или разветвленной алкильной группы, бензильной группы и 5-7-членного циклического или гетероциклического соединения, которое может быть замещено одной или более одинаковыми или разными группами, независимо выбранными из группы, состоящей из С1-С6 алкила, либо Ri и R2 могут образовывать 5-7-членное гетероциклическое кольцо вместе с атомом азота, к которому они присоединены; и
В выбран из группы, состоящей из фенильной группы, феноксигруппы, тиенильной группы и нафтильной группы, где фенильная группа, феноксигруппа, тиенильная группа или нафтильная группа могут быть замещены одной или более одинаковыми или разными группами, независимо выбранными из группы, состоящей из водорода, галогена, нитро, циано, метансульфонила, трифторметила, трифторметокси, дифторметокси, фенила, С1-С6 линейной или разветвленной алкильной группы и С1-С6 линейной или разветвленной алкоксигруппы.
В определении заместителей алкильная группа может быть выбрана из группы, состоящей из метила, этила, линейного или разветвленного пропила, линейного или разветвленного бутила, циклопропила, циклобутила, циклопентила, циклогексила и бензила. Галоген выбран из атомов фтора, хлора, брома и йода.
В одном воплощении заместитель A в структурной формуле (I) может представлять собой фенильную группу, которая может быть замещена одной или более одинаковыми или разными группами, независимо выбранными из группы, состоящей из водорода, галогена, аминогруппы, С1-С6 линейной или разветвленной алкильной группы или С1-С6 линейной и разветвленной алкоксигруппы.
Заместитель A может быть представлен структурной формулой (II):
где R3 представляет собой замещенный или незамещенный С1-С6 линейный или разветвленный алкил.
Когда заместитель A в структурной формуле (I) имеет структурную формулу (II), пиперидиновое соединение представлено следующей структурной формулой (IV):
где m, n, X, B и R3 являются такими, как определено выше.
Примеры соединения, имеющего химическую формулу (IV), могут включать 4-амино-5-хлор-N-[[1-(2-гидрокси-2-фенилэтил)пиперидин-4-ил]метил]-2-метоксибензамид;
4-амино-5-хлор-N-[[1-[2-(4-фторфенил)-2-гидроксиэтил]пиперидин-4-ил]-метил]-2-метоксибензамид: гидрохлорид;
4-амино-5-хлор-N-[[1-[2-гидрокси-2-(4-метилфенил)этил]пиперидин-4-ил]метил]-2-метоксибензамид: гидрохлорид;
4-амино-5-хлор-N-[[1-[2-гидрокси-2-(4-метоксифенил)этил]пиперидин-4-ил]метил]-2-метоксибензамид: гидрохлорид;
4-амино-5-хлор-N-[[1-[2-(4-хлорфенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-метоксибензамид: гидрохлорид;
4-амино-5-хлор-N-[[1-[2-(3,4-дихлорфенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-метоксибензамид: гидрохлорид;
4-амино-5-хлор-N-[[1-[2-гидрокси-2-[4-(трифторметил)фенил]этил]-пиперидин-4-ил]метил]-2-метоксибензамид : гидрохлорид;
4-амино-5-хлор-N-[[1-[2-(3,4-дифторфенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-метоксибензамид: гидрохлорид;
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-фенилэтил]карбамат:гидрохлорид;
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(4-фторфенил)этил]карбамат:гидрохлорид;
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(3,4-дихлорфенил)этил]карбамат:гидрохлорид;
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(3,4-дифторфенил)зтил]карбамат:гидрохлорид;
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-[4-(трифторметил)фенил]этил]карбамат:гидрохлорид;
4-амино-5-хлор-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-метоксибензамид:гидрохлорид;
4-амино-5-хлор-N-[[1-[3-(4-фторфенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид: гидрохлорид;
4-амино-5-хлор-N-[[1-[3-(3,4-дихлорфенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид : гидрохлорид;
4-амино-5-хлор-N-[[1-(3-гидрокси-3-тиофен-2-илпропил)пиперидин-4-ил]метил]-2-метоксибензамид: гидрохлорид;
4-амино-5-хлор-N-[[1-[4-(4-фторфенил)-3-гидроксибутил]пиперидин-4-ил]метил]-2-метоксибензамид: гидрохлорид;
4-амино-5-хлор-N-[[1-[5-(4-фторфенил)-3-гидроксипентил]пиперидин-4-ил]метил]-2-метоксибензамид:гидрохлорид;
[3-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(4-хлорфенил)пропил]карбамат:гидрохлорид;
[4-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(4-фторфенил)бутан-2-ил]карбамат:гидрохлорид;
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-5-(4-фторфенил)пентан-3-ил]карбамат:гидрохлорид;
4-амино-5-хлор-N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]-метил]-2-метоксибензамид:гидрохлорид;
4-амино-5-хлор-N-[[1-[3-(4-хлорфенокси)-2-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид : гидрохлорид;
4-амино-5-хлор-N-[[1-[2-гидрокси-3-[4-(трифторметил)фенокси]пропил]-пиперидин-4-ил]метил]-2-метоксибензамид:гидрохлорид;
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-феноксипропан-2-ил]карбамат:гидрохлорид;
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-(4-фторфенокси)пропан-2-ил]-3,5-диметилпиперидин-1-карбоксилат гидрохлорид;
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-(4-метоксифенокси)пропан-2-ил]карбамат:гидрохлорид;
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-(2,3-дихлорфенокси)пропан-2-ил]азепан-1-карбоксилат: гидрохлорид;
4-амино-5-хлор-N-[[1-[(2S)-2-гидрокси-2-фенилэтил]пиперидин-4-ил]-метил]-2-метоксибензамид;
4-амино-5-хлор-М-[[1-[(2К)-2-гидрокси-2-фенилэтил]пиперидин-4-ил]-метил]-2-метоксибензамид;
4-амино-5-хлор-N-[[1-[3-(4-хлорфенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид;
[3-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(4-фторфенил)пропил]карбамат;
(R)-[3-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(4-фторфенил)пропил]карбамат;
(S)-[3-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(4-фторфенил)пропил]карбамат;
4-амино-5-хлор-N-[[1-[2-гидрокси-3-(4-метоксифенокси)пропил]пиперидин-4-ил]метил]-2-метоксибензамид;
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-феноксипропан-2-ил]пиперидин-1-карбоксилат; и
4-амино-5-хлор-N-[[1-[3-(2,5-дихлорфенокси)-2-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид.
В другом воплощении заместитель A может представлять собой бензимидазольную группу, которая может быть замещена одной или более одинаковыми или разными группами, независимо выбранными из группы, состоящей из водорода, С1-С6 линейной или разветвленной алкильной группы, С1-С6 линейной или разветвленной алкоксигруппы, СЗ-С7 циклической алкильной группы, аминогруппы, галогена и оксогруппы.
Заместитель A в структурной формуле (I) представлен структурной формулой (III):
где R4 представляет собой C1-С6 линейную или разветвленную алкильную группу или C3-С7 циклический алкил, который может быть замещенным или незамещенным.
Когда заместитель A в структурной формуле (I) имеет структурную формулу (III), пиперидиновое соединение представлено следующей структурной формулой (V):
Примеры соединения, имеющего химическую формулу (V), могут включать [1-(2-метилфенокси)-3-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1-карбонил)амино]метил]пиперидин-1-ил]пропан-2-ил]карбамат;
N-[[1-[2-гидрокси-3-(4-нитрофенокси)пропил]пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид: гидрохлорид;
N-[[1-[2-гидрокси-3-(4-метоксифенокси)пропил]пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид:гидрохлорид;
N-[[1-[3-(4-фторфенокси)-2-гидроксипропил]пиперидин-4-ил]метил]-3-метил-2-оксобензимидазол-1-карбоксамид: гидрохлорид;
3-этил-N-[[1-[2-гидрокси-3-(4-метоксифенокси)пропил]пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамид:гидрохлорид;
[1-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1 -карбонил)амино]-метил]пиперидин-1-ил]-3-феноксипропан-2-ил]карбамат: гидрохлорид;
[1-(4-фторфенокси)-3-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1-карбонил)амино]метил]пиперидин-1-ил]пропан-2-ил]карбамат: гидрохлорид;
[1-(4-метоксифенокси)-3-[4-[[(3-метил-2-оксобензимидазол-1-карбонил)-амино]метил]пиперидин-1-ий-1-ил]пропан-2-ил]карбамат: гидрохлорид;
[1-[4-[[(3-этил-2-оксобензимидазол-1-карбонил)амино]метил]пиперидин-1-ил]-3-феноксипропан-2-ил]карбамат: гидрохлорид;
[1-(4-хлорфенокси)-3-[4-[[(3-этил-2-оксобензимидазол-1-карбонил)-амино]метил]пиперидин-1-ил]пропан-2-ил]карбамат: гидрохлорид;
3-циклопропил-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамид:гидрохлорид;
3-циклопропил-N-[[1-[3-(4-фторфенил)-3-гидроксипропил]пиперидин-1-ий-4-ил]метил]-2-оксобензимидазол-1-карбоксамид:гидрохлорид;
[3-[4-[[(3-циклопропил-2-оксобензимидазол-1-карбонил)амино]метил]-пиперидин-1-ий-1-ил]-1-фенилпропил]карбамат: гидрохлорид;
[1-(4-фторфенил)-3-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1-карбонил)амино]метил]пиперидин-1-ий-1-ил]пропил]карбамат: гидрохлорид;
[1-(4-метоксифенил)-3-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1-карбонил)амино]метил]пиперидин-1-ий-1-ил]пропил]карбамат: гидрохлорид;
М-[[1-[2-(4-фторфенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид:гидрохлорид;
[1-(4-фторфенил)-2-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1 -карбонил)амино]метил]пиперидин-1-ий-1-ил]этил]карбамат: гидрохлорид;
[[2-[4-[[(3-циклопропил-2-оксобензимидазол-1-карбонил)амино]метил]-пиперидин-1-ий-1-ил]-1-(3-метоксифенил)этил]карбамат:гидрохлорид;
[1-[4-[[(3-метил-2-оксобензимидазол-1-карбонил)амино]метил]пиперидин-1-ил]-3-феноксипропан-2-ил]карбамат;
N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид; и
[3-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1-карбонил)амино]метил]-пиперидин-1-ил]-1-фенилпропил]карбамат.
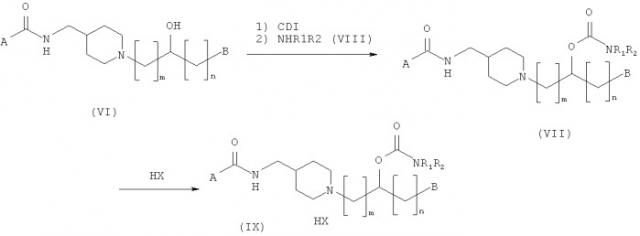
В соответствии с одним воплощением настоящего изобретения соединение, представленное структурной формулой (I), и его фармацевтически приемлемые соли могут быть получены согласно следующим стадиям, начиная с аминоспиртовых соединений, представленных следующей общей структурной формулой (VI):
где A, B, m и n такие, как описано выше.
Способ получения О-карбамоильных соединений, представленных следующей общей структурной формулой (VII):
где A, B, R1, R2, m и n такие, как описано выше, подробно описан ниже.
О-карбамоильные соединения, представленные общей структурной формулой (VII), получают взаимодействием аминоспирта, представленного общей структурной формулой (VI), с 1,1'-карбонилдиимидазолом (CDI) и затем с аминным основанием, представленным следующей общей структурной формулой (VIII):
где R1 и R2 такие, как описано выше.
Эта процедура суммирована, как представлено на Реакционной схеме I ниже.
Реакционная схема I
Реакционные условия, описанные на Реакционной схеме I, раскрыты подробно ниже. Для превращения соединения (VI) в соединение (VII) концентрация исходного вещества (VI) составляет приблизительно от 0,005 до 0,1 моль, с количеством 1,1'-карбонилдиимидазола (CDI), варьирующим приблизительно от 2,0 до 3,0 эквивалентов. Эту реакцию предпочтительно осуществляют при температуре от 10 до 30°С. Без очистки полученное промежуточное соединение обрабатывают от 1 до 1000 эквивалентов аминного основания, представленного общей структурной формулой (VIII), при температуре от 10 до 30°С с получением соединения общей структурной формулы (VII). Для такого карбамоилирования могут быть использованы растворители, представляющие собой простые эфиры, такие как диэтиловый эфир и тетрагидрофуран, растворитель, представляющий собой галогенированный углеводород, такой как дихлорметан и хлороформ, или их смесь.
На Реакционной схеме I НХ представляет собой кислоту, которая способна образовывать фармацевтически приемлемую соль с основным атомом азота. Конкретные примеры кислот, используемых для получения соединения (IX) из соединения (VII), включают соляную кислоту, серную кислоту, фосфорную кислоту, уксусную кислоту, бензойную кислоту, лимонную кислоту, малоновую кислоту, салициловую кислоту, яблочную кислоту, фумаровую кислоту, щавелевую кислоту, янтарную кислоту, винную кислоту, молочную кислоту, глюконовую кислоту, аскорбиновую кислоту, малеиновую кислоту, аспарагиновую кислоту, бензолсульфоновую кислоту, метансульфоновую кислоту, этансульфоновую кислоту, гидроксиметансульфоновую кислоту, гидроксиэтансульфоновую кислоту и тому подобное. Дополнительные кислоты могут быть найдены в "Pharmaceutical Salts", J. Pharm. Sci., 1977; 66 (1): 1-19. Это получение осуществляют в реакционной среде, примером которой может служить растворитель, представляющий собой простой эфир, такой как тетрагидрофуран, спиртовой растворитель, такой как метанол, сложно-эфирный растворитель, такой как этилацетат, растворитель, представляющий собой галогенированный углеводород, и их смеси. Растворитель, представляющий собой простой эфир, рекомендуется в качестве добавляемого раствора, включая этиловый эфир, пропиловый эфир, изопропиловый эфир, бутиловый эфир и изобутиловый эфир. Концентрация соединения (VII) составляет порядка приблизительно от 0,01 до 5 моль.
Пиперидиновые соединения структурной формулы (I), имеющие все возможные изомерные формы, такие как рацемические, энантиомерные и диастереоизомерные формы, и фармацевтически приемлемые соли присоединения с неорганическими и/или органическими кислотами или с неорганическими и/или органическими основаниями указанного соединения структурной формулы (I), могут быть использованы для получения лекарственных средств, предназначенных для предупреждения и/или лечения желудочно-кишечных заболеваний, таких как синдром раздраженного кишечника (IBS), нарушение двигательной функции желудка и/или висцеральная боль.
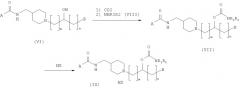
Способ получения амино-спиртовых бензамидных соединений, представленных следующей структурной формулой (X)
где B, m и n являются такими, как описано выше, подробно описан ниже.
Амино-спиртовые бензамидные соединения, представленные общей структурной формулой (X), получают посредством взаимодействия перидинбензамида, представленного общей структурной формулой (XI), с алкилгалогенидом, представленным следующей общей структурной формулой (XII), эпоксидом, представленным следующей общей структурной формулой (XIII), или амидом Вейнрауба, представленным следующей общей структурной формулой (XIV):
где m представляет собой целое число 1 или 2, Z представляет собой галоген, и B является таким, как определено выше;
,
где n представляет собой целое число от 0 до 2, предпочтительно 0, и B является таким, как определено выше; и
,
где n представляет собой целое число от 0 до 2, предпочтительно 0, и B является таким, как определено выше.
Эта процедура суммирована так, как представлено на Реакционной схеме II ниже.
Реакционная схема II
Стадия II-1
Стадия II-2
Стадия II-3
Стадия II-1
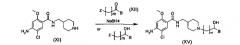
На этой стадии целевое пиперидиновое соединение структурной формулы (XV) получают посредством алкилирования соединения структурной формулы (XI) с помощью алкилгалогенида (XII) и восстановления полученного кетона. Подробности реакционных условий, описанных на Стадии II-1, являются следующими. Для превращения соединения (XI) в соединения (XV) концентрация исходного вещества (XI) составляет приблизительно от 0,005 до 0,1 моль, с количеством соединения (XII-1), варьирующим от приблизительно 1,1 до 3,0 эквивалентов, и основания, такого как карбонат калия, карбонат цезия и триэтиламин, варьирующим от приблизительно 1,5 до 5,0 эквивалентов. Эту реакцию предпочтительно проводят при температуре от 20 до 80°C. Без очистки полученный промежуточный кетон обрабатывают от 1,0 до 10,0 эквивалентов NaBH4 при температуре от 0 до 30°C с получением соединения общей структурной формулы (XV).
Для альтернативного превращения соединения (XI) в соединение (XV), где алкилгалогенид представлен структурной формулой (XII-2), концентрация исходного вещества (XI) составляет приблизительно от 0,005 до 0,1 моль, с количеством соединения (XII-2), варьирующим от приблизительно 1,1 до 3,0 эквивалентов, и основания, такого как карбонат калия, карбонат цезия и триэтиламин, варьирующим от приблизительно 1,5 до 5,0 эквивалентов. Эту реакцию предпочтительно проводят при температуре от 20 до 80°C. Для этой реакции могут быть использованы растворитель, представляющий собой простой эфир, такой как диэтиловый эфир и тетрагидрофуран, растворитель, представляющий собой галогенированный углеводород, такой как дихлорметан и хлороформ, спиртовой растворитель, такой как метанол, этанол и изопропанол, или ацетонитрил.
Стадия II-2
На этой стадии пиперидиновое соединение (XVI) получают посредством реакции раскрытия эпоксидного кольца.
Подробности реакционных условий, описанных на Стадии 11-2, являются следующими. Для првращения соединения (XI) в соединение (XVI) концентрация исходного вещества (XI) составляет приблизительно от 0,005 до 0,1 моль, с количеством соединения (XIII), варьирующим приблизительно от 1,1 до 3,0 эквивалентов. Эту реакцию предпочтительно проводят при температуре от 20 до 80°C. Для этой реакции могут быть использованы растворитель, представляющий собой простой эфир, такой как диэтиловый эфир и тетрагидрофуран, растворитель, представляющий собой галогенированный углеводород, такой как дихлорметан и хлороформ, спиртовой растворитель, такой как метанол, этанол и изопропанол, или ацетонитрил.
Стадия II-3
На этой стадии пиперидиновое соединение (XVIII) получают посредством реакции сочетания соединения структурной формулы (XI) с соединением, представляющим собой амид Вейнрауба, структурной формулы (XIV) и восстановления полученного кетонного соединения структурной формулы (XVII). Подробности реакционных условий, описанных на Стадии II-3, являются следующими. Для превращения соединений (XI) в соединения (XVIII) концентрация амида Вейнрауба (XIV) составляет приблизительно от 0,005 до 0,1 моль, с количеством бромида винилмагния, варьирующим приблизительно от 1,1 до 2.0 эквивалентов. Затем полученное промежуточное соединение обрабатывают пиперидиновым соединением, представленным общей формулой (XI), и избытком воды при температуре от 0 до 30°C с получением соединения общей структурной формулы (XVII). Без очистки полученное промежуточное кетонное соединение обрабатывают от 1,0 до 10,0 эквивалентов NaBH4 при температуре от 0 до 30°C с получением соединения общей структурной формулы (XVIII). Для этой реакции могут быть использованы растворитель, представляющий собой простой эфир, такой как диэтиловый эфир и тетрагидрофуран, растворитель, представляющий собой галогенированный углеводород, такой как дихлорметан и хлороформ, спиртовой растворитель, такой как метанол, этанол и изопропанол, или ацетонитрил.
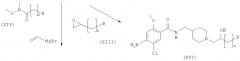
Способ получения амино-спиртовых бензимидазольных соединений, представленных следующей общей структурной формулой (XIX), будет подробно описан ниже.
здесь B, R4, m и n являются такими, как определено выше.
Амино-спиртовые бензимидазольные соединения, представленные общей структурной формулой (XIX), получают посредством взаимодействия пиперидинового бензимидазола, представленного общей структурной формулой (XX), с алкилгалогенидом, представленным следующей общей структурной формулой (XII), или эпоксидом, представленным следующей общей структурной формулой (XIII):
где m представляет собой целое число 1 или 2, Z представляет собой галоген, и B является таким, как определено выше; и
где n представляет собой целое число от 0 до 2, и В является таким, как определено выше.
Эта процедура суммирована так, как представлено на Реакционной схеме III ниже.
Реакционная схема III
Стадия II1-1
Стадия III-2
Стадия III-1
На этой стадии пиперидиновое соединение структурной формулы (XXI) получают посредством алкилирования соединения структурной формулы (XX) с помощью алкилгалогенида и восстановления. Реакция может быть осуществлена при тех же самых условиях, что и описанные на Стадии 11-1.
Стадия III-2
На этой стадии пиперидиновое соединение структурной формулы (XXII) получают посредством реакции раскрытия эпоксидного кольца. Реакция может быть проведена в тех же условиях, что и описанные на Стадии II-2.
Следует отметить, что стереохимия продукта (I, IV или V) зависит исключительно от стереохимии исходного вещества (XII или XIII); исходное вещество (XII или XIII) в виде (S)-энантиомера дает только продукт в виде (S)-энантиомера, а исходное вещество (XII или XIII) в виде (R)-энантиомера дает только продукт в виде (R)-энантиомера.
На основе терапевтических активностей новых пиперидиновых соединений, как показано в следующих примерах, в другом воплощении предложена фармацевтическая композиция, содержащая в качестве активного ингредиента пиперидиновые соединения, представленные структурной формулой (I), в частности соединения, представленные структурными формулами (IV) и (V).
В другом воплощении предложена фармацевтическая композиция, содержащая эффективное количество пиперидиновых соединений, представленных структурной формулой (I), в частности соединений, представленных структурными формулами (IV) и (V), для лечения расстройств желудочно-кишечного тракта, таких как синдром раздраженного кишечника (IBS), нарушение перистальтики желудочно-кишечного тракта (например, нарушение двигательной функции желудка), запор, висцеральная боль и тому подобное.
В другом воплощении предложен способ лечения расстройств желудочно-кишечного тракта, таких как синдром раздраженного кишечника (IBS), нарушение перистальтики желудочно-кишечного тракта (например, нарушение двигательной функции желудка), запор и висцеральная боль, у млекопитающего, включающий введение композиции соединения структурной формулы (I) млекопитающему, нуждающемуся в терапии расстройства желудочно-кишечного тракта.
Соединения структурной формулы (I) полезны в лечении IBS, особенно IBS с преобладанием запоров, запора и других желудочно-кишечных расстройств, ассоциированных с нарушением перистальтики желудочно-кишечного тракта, поскольку они могут усиливать перистальтику желудочно-кишечного тракта.
Кроме того, соединения структурной формулы (I) полезны в ослаблении висцеральной боли, вызываемой IBS и/или другими желудочно-кишечными расстройствами, поскольку они могут уменьшать висцеральную боль и дискомфорт, ассоциированные с IBS и тому подобным.
Соединения структурной формулы (I) могут вводиться перорально или парентерально, сами по себе или в комбинации с традиционными фармацевтическими носителями. Приемлемые твердые носители могут включать одно или более веществ, которые также могут действовать в качестве корригентов, смазывающих агентов, солюбилизаторов, суспендирующих агентов, наполнителей, скользящих веществ, веществ, облегчающих прессование, связующих агентов, агентов, обеспечивающих распадаемость таблеток, или инкапсулирующих материалов. В порошках носитель может представлять собой тонкоизмельченное твердое вещество, которое находится в смеси с тонкоизмельченным активным ингредиентом. В таблетках активный ингредиент в соответствующих пропорциях смешан с носителем, обладающим необходимыми компрессионными свойствами, и представлен в желаемой форме необходимого размера. Порошки и таблетки могут содержать вплоть до 99% активного ингредиента.
Подходящие твердые носители включают, например, фосфат кальция, стеарат магния, тальк, сахара, лактозу, декстрин, крахмал, желатин, целлюлозу, метилцеллюлозу, натриевую карбоксиметилцеллюлозу, поливинилпирролидон, низкоплавкие воски и ионообменные смолы. Жидкие носители могут быть использованы в приготовлении растворов, суспензий, эмульсий, сиропов и эликсиров.
Активный ингредиент может быть растворен или суспендирован в фармацевтически приемлемом жидком носителе, таком как вода, органический растворитель, их смесь или фармацевтически приемлемые масла или жиры. Жидкий носитель может содержать другие подходящие фармацевтические добавки, такие как солюбилизаторы, эмульгаторы, буферные агенты, консерванты, подсластители, корригенты, суспендирующие агенты, загустители, красители, регуляторы вязкости, стабилизаторы или регуляторы осмоса. Подходящие примеры жидких носителей для перорального и парентерального введения включают воду (в частности, содержащую вышеописанные добавки, например производные целлюлозы, предпочтительно раствор натриевой карбоксиметилцеллюлозы), спирты (включая одноатомные спирты и многоатомные спирты, например гликоли) и их производные и масла (например, фракционированное кокосовое масло и арахисовое масло).
Носитель для парентерального введения также может представлять собой эфир жирной кислоты, такой как этилолеат и изопропилмиристат. В стерильных композициях в жидкой форме для парентерального введения используются стерильные жидкие носители. Жидкие фармацевтические композиции, которые представляют собой стерильные растворы или суспензии, могут быть введены посредством, например, внутримышечной, внутрибрюшинной или подкожной инъекции. Стерильные растворы также могут вводиться внутривенно.
Пероральное введение может быть осуществлено в виде композиции в жидкой или твердой форме. Предпочтительно фармацевтические композиции, содержащие настоящие соединения, представлены в стандартной лекарственной форме, например в виде таблеток или капсул. В такой форме композиция подразделена на единичные дозировки, содержащие соответствующие количества активных ингредиентов. Стандартные лекарственные формы могут представлять собой упакованные композиции, например упакованные порошки, флаконы, ампулы, предварительно заполненные шприцы или саше, содержащие жидкости. Альтернативно стандартная лекарственная форма может представлять собой, например, саму капсулу или таблетку, или она может представлять собой соответствующее количество любых таких композиций в упакованной форме. Применяемая терапевтически эффективная дозировка может варьироваться или корректироваться осуществляющим введение врачом, и в общем варьирует от 0,5 мг до 750 мг, в соответствии с конкретным(и) состоянием(ями), подлежащим(и) лечению, и габаритами, возрастом и типом ответной реакции пациента.
Соединения структурной формулы (I) могут быть введены пациентам в дозировке от 0,7 до 7000 мг в сутки. Для нормального взрослого человека с массой тела приблизительно 70 кг вводимое количество составляет суточную дозу от 0,01 до 100 мг на 1 кг массы тела. Конкретная применяемая доза, однако, может варьировать в зависимости от требований пациента, тяжести состояния пациента и активности соединения. Определение оптимальных дозировок для конкретной ситуации должно осуществляться в клинических условиях и находится в компетенции специалиста в данной области.
В другом воплощении предложено применение пиперидинового соединения и/или его фармацевтически приемлемой соли в предупреждении и/или лечении желудочно-кишечного заболевания, такого как синдром раздраженного кишечника (IBS), нарушение двигательной функции желудка, запор и/или висцеральная боль, у млекопитающего. В еще одном воплощении предложено применение пиперидинового соединения и/или его фармацевтически приемлемой соли в изготовлении фармацевтической композиции для предупреждения и/или лечения желудочно-кишечного заболевания, такого как синдром раздраженного кишечника (IBS), нарушение двигательной функции желудка, запор и/или висцеральная боль, у млекопитающего.
Лучшее понимание сущности настоящего изобретения может быть достигнуто в свете следующих далее примеров, которые представлены в качестве иллюстрации и не предназначены для ограничения настоящего изобретения.
ПРИМЕР 1
4-амино-5-хлор-N-[[1-(2-гидрокси-2-фенилэтил)пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Смесь 4-амино-5-хлор-2-метокси-N-((пиперидин-4-ил)метил)бензамида (5,0 ммоль), 2-бромацетофенона (6,0 ммоль) и карбоната калия (7,6 ммоль) перемешивали в 15 мл ацетонитрила в течение 2 ч. Этот раствор затем концентрировали в роторном испарителе и разбавляли этилацетатом. Эту смесь затем промывали рассолом и полученный органический слой сушили и очищали колоночной хроматографией. Ее растворяли в этаноле (10 мл) и добавляли борогидрид натрия (10,0 ммоль) при 0°C и перемешивали при 25°C в течение 2 ч. Этот раствор концентрировали на роторном испарителе и разбавляли этилацетатом. Эту смесь промывали рассолом, сушили и концентрировали в вакууме. Остаток очищали колоночной хроматографией. Полученный 4-амино-5-хлор-N-((1-(2-гидрокси-2-фенилэтил)пиперидин-4-ил)метил)-2-метоксибензамид растворяли в метиленхлориде (MC) и раствор обрабатывали раствором HCl в диэтиловом эфире. Полученный осадок отфильтровывали с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.8 (m, 1Н), 7.4-7.2 (m, 5Н), 6.35 (s, 1Н), 4.95 (m, 1Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.4-3.3 (m, 3H), 3.0 (m, 1Н), 2.6 (т, 2Н), 2.4 (m, 1Н), 2.2 (m, 1Н), 1.9-1.6 (m, 3H), 1.6-1.4 (m, 2Н).
ПРИМЕР 2
4-амино-5-хлор-N-[[1-[2-(4-фторфенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 1, используя в качестве реагента 2-бром-4'-фторфцетофенон вместо 2-бромацетофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.4-7.15 (m, 2Н), 7.1-6.95 (m, 2Н), 6.35 (s, 1Н), 4.9 (m, 1Н), 4.4 (s, 2Н), 3.9 (m, 3H), 3.4-3.2 (m, 3H), 3.1-2.9 (m, 1Н), 2.6-2.3 (m, 3H), 2.3-2.1 (m, 1Н), 1.9-1.7 (m, 3H), 1.6-1.4 (m, 2Н).
ПРИМЕР 3
4-амино-5-хлор-N-[[1-[2-гидрокси-2-(4-метилфенил)этил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 1, используя в качестве реагента 2-бром-4'-метилацетофенон вместо 2-бромацетофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.3-7.1 (m, 4Н), 6.35 (s, 1Н), 4.9 (m, 1Н), 4.4 (s, 2Н), 3.9 (m, 3H), 3.5-3.3 (m, 3H), 3.3-3.1 (m, 1H), 2.7 (m, 2H), 2.6-2.5 (m, 1H), 2.4 (m, 4H), 1.9-1.7 (m, 3H), 1.6-1.5 (m, 2H).
ПРИМЕР 4
4-амино-5-хлор-N-[[1-[2-гидрокси-2-(4-метоксифенил)этил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 1, используя в качестве реагента 2-бром-4'-метоксиацетофенон вместо 2-бромацетофенона, с получением указанного в заголовке соединения.
1Н ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.4-7.2 (m, 2Н), 6.95-6.85 (m, 2Н), 6.35 (s, 1Н), 4.9 (m, 1Н), 4.4 (s, 2Н), 3.9 (m, 3H), 3.8 (s, 3H), 3.4-3.2 (m, 3H), 3.1-3.0 (m, 1Н), 2.6 (m, 2Н), 2.5 (m, 1Н), 2.3-2.1 (m, 1Н), 1.9-1.7 (m, 3H), 1.6-1.4 (m, 2Н).
ПРИМЕР 5
4-амино-5-хлор-N-[[1-[2-(4-цианофенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 1, используя в качестве реагента 2-бром-4'-цианоацетофенон вместо 2-бромацетофенона, с получением указанного в заголовке соеди