Предотвращение образования и/или стабилизации тромбов
Иллюстрации
Показать всеЗаявленная группа изобретений относится к медицине, в частности к гематологии, и может быть использована для предотвращения формирования и/или стабилизации патологических тромбов. Предложено применение по меньшей мере одного антитела, ингибирующего фактор XII. Предложено также фармацевтическое средство, содержащее по меньшей мере одно антитело, ингибирующее фактор XII. Изобретения обеспечивают возможность предотвращения роста трехмерного внутрипросветного тромба без проявлений влияния на гемостаз. 2 н. и 5 з.п. ф-лы, 7 ил.
Реферат
Настоящее изобретение, рассматриваемое в самом широком смысле, относится к предотвращению формирования и/или стабилизации трехмерных артериальных или венозных тромбов.
В частности, настоящее изобретение относится к применению по меньшей мере одного антитела и/или одного ингибитора для ингибирования активности фактора XII и предотвращению формирования и/или стабилизации тромбов и роста тромбов. Изобретение также относится к фармацевтическому составу и применению фактора XII в качестве антитромботического средства.
Повреждение стенок сосудов немедленно приводит к адгезии и агрегации тромбоцитов, после чего следует активация системы свертывания плазмы и формирование содержащего фибрин тромба, который перекрывает поврежденный участок. Эти события являются критическими для ограничения посттравматической потери крови, но также могут приводить к закупорке пораженных сосудов, что приводит к ишемии и инфаркту жизненно важных органов. В каскадной модели (модели водопада) свертывание крови протекает в виде последовательности реакций, включающих активацию зимогенов ограниченным протеолизом, что в конечном счете приводит к очень быстрому образованию тромбина, который преобразует фибриноген плазмы в фибрин и эффективно активирует тромбоциты. В свою очередь сцепленные с коллагеном или фибрином тромбоциты увеличивают образование фибрина на несколько порядков путем экспонирования прокоагулянта фосфатидилсерина (PS) на своей внешней поверхности, что ускоряет сборку и активацию протеазных комплексов свертывания, и путем прямого взаимодействия между рецепторами тромбоцитов и факторами свертывания.
Для свертывания существуют два сходящихся пути, которые запускаются либо внешними (стенка сосуда) либо внутренними (образованными в крови) компонентами сосудистой системы. "Внешний" путь инициируется комплексом фактора VII (FVII) плазмы и интегрального мембранного белка тканевого фактора (TF), ключевого кофактора свертывания, который отсутствует на поверхности внутренней стороны сосуда, но интенсивно экспрессируется в субэндотелиальном слое сосуда. TF, экспрессируемый в микрополостях кровеносной системы, также может давать вклад в распространение тромба путем поддержки образования тромбина на поверхности активированных тромбоцитов.
"Внутренний" или контактный путь активации инициируется, когда фактор XII (FXII, фактор Хагемана) контактирует с отрицательно заряженными поверхностями в реакции, в которой участвуют высокомолекулярный кининоген и калликреин плазмы крови. FXII может быть активирован макромолекулярными составляющими субэндотелиального матрикса, такими как гликозаминогликаны и коллагены, сульфатиды, нуклеотиды и другие растворимые полианионы, или нефизиологическими материалами, такими как стекло или полимеры. Одним из наиболее эффективных контактных активаторов является каолин, и эта реакция лежит в основе главного клинического теста на свертываемость, (активированное) парциальное тромбопластиновое время (PTT, aPTT). В реакциях, стимулируемых тромбоцитами, активированный FXII затем активирует FXI, a FXIa в свою очередь активирует фактор IX. Независимо от его высокой эффективности при индуцировании свертывания крови in vitro (пато)физиологическая значимость запускаемого фактором FXII внутреннего пути свертывания ставится под сомнения тем фактом, что унаследованный недостаток FXII, а также высокомолекулярного кининогена и калликреина плазмы крови не связан с геморрагическими осложнениями. В сочетании с наблюдениями, выявившими тот факт, что люди и мыши, у которых отсутствуют составляющие внешнего пути, такие как TF, FVII или фактор IX, страдают от острых кровотечений, это приводит к принятой в настоящее время гипотезе, что образование фибрина in vivo инициируется исключительно внешним каскадом (Mackman. N. (2004). Role of tissue factor in hemostasis, thrombosis, and vascular development. Arterioscler. Thromb. Vase. Biol. 24, 1015-1022).
Подобно любому физиологическому механизму, каскад свертывания может быть активирован неверно, что приводит в результате к образованию кровоостанавливающих препятствий в кровеносных сосудах. В результате этого сосуды могут оказаться блокированными, и кровоснабжение дистальных органов может уменьшиться. Этот процесс известен как тромбоэмболия и связан с высокой смертностью. Помимо этого, использование протезирующих устройств, которые находятся в контакте с кровью, является чрезвычайно ограниченным из-за активации каскада коагуляции и образования отложений на поверхности протеза, что часто нарушает его функциональность. Примерами таких протезов являются устройства гемодиализа, кардиопульмональные шунты, сосудистые стенты и постоянные катетеры. При использовании таких устройств для предотвращения осаждения фибрина на поверхность применяются антикоагулянты, такие как гепарин. Однако некоторые пациенты не переносят гепарин, который может вызвать тромбоцитопению (HIT), приводящую к агрегации тромбоцитов и опасному для жизни тромбозу. Помимо этого, все антикоагулянты, используемые в клинике, естественным образом связаны с повышенным риском сильного кровотечения. Таким образом, существует потребность в новых типах антикоагулянтов, которые не связаны с указанными осложнениями и которые могут быть использованы для больных пациентов или для улучшенной терапии, предотвращающей тромбоз без увеличения вероятности возникновения кровотечения.
В этой связи также является очевидной потребность в улучшенных лекарственных средствах для лечения или профилактики тромбозов или сходных расстройств. Таким образом, удовлетворение вышеперечисленных потребностей является задачей, решаемой настоящим изобретением. Уже более пятидесяти лет известно, что недостаток фактора FXII свертывания не связан с увеличением спонтанных или связанных с травмой геморрагических осложнений (Ratnoff, O.D. & Colopy, J.E. (1955) A familial hemorrhagic trait associated with a deficiency of a clot-promoting fraction of plasma. J Clin Invest 34, 602-13). Действительно, хотя они и демонстрируют патологический aPTT (клинический тест на свертываемость, который относится к внутреннему пути коагуляции), люди с дефицитом FXII не страдают от патологических кровотечений даже во время обширного хирургического вмешательства (Colman, R.W. Hemostasis and Thrombosis. Basic principles & clinical practice (eds. Colman R.W., Hirsch. J., Mader V.J., Clowes A.W., & George J.) 103-122 (Lippincott Williams & Wilkins, Philadelphia, 2001). Напротив, дефицит FXII связывают с повышенным риском венозного тромбоза (Kuhli, С, Scharrer, I., Koch, F., Ohrloff, C. & Hattenbach, L.O. (2004) Factor XII deficiency: a thrombophilic risk factor for retinal vein occlusion. Am. J. Ophthalmol. 137, 459-464., Halbmayer, W.M., Mannhalter, C, Feichtinger, C, Rubi, K. & Fischer, M. (1993) Factor XII (Hageman factor) deficiency: a risk factor for development of thromboembolism. Incidence of factor XII deficiency in patients after recurrent venous or arterial thromboembolism and myocardial infarction. Wien. Med. Wochenschr. 143, 43-50). Исследования и истории болезней, подтверждающие это предположение, ссылаются на индексный случай дефицита фактора FXII, случай Джона Хагемана, умершего от легочной эмболии. Гипотеза, что дефицит фактора FXII связан с повышенным риском тромбообразования, ставится под сомнение недавним пересмотром нескольких случаев, в которых сообщается о связи дефицита фактора FXII с тромбозом (Girolami, A., Randi, M.L, Gavasso, S., Lombardi, A.M. & Spiezia, F. (2004) The Occasional Venous Thromboses Seen in Patients with Severe (Homozygous) FXII Deficiency are Probably Due to Associated Risk Factors: A Study of Prevalence in 21 Patients and Review of the Literature. J. Thromb. Thrombolysis 17, 139-143). В большинстве случаев авторы в сочетании с дефицитом фактора FXII идентифицировали сопутствующие врожденные или приобретенные факторы риска тромбообразования, которые могли бы быть ответственными за случаи тромбообразования независимо от FXII. Наиболее обширные эпидемиологические исследования с привлечением хорошо охарактеризованных пациентов (Koster, Т., Rosendaal, F.R., Briet, E. & Vandenbroucke, J.P. (1994) John Hageman′s factor and deep-vein thrombosis: Leiden thrombophilia Study. Br. J. Haematol. 87, 422-424) и семей с дефицитом фактора FXII (Zeerleder, S. et al. (1999) Reevaluation of the incidence of thromboembolic complications in congenital factor XII deficiency-a study on 73 subjects from 14 Swiss families. Thromb. Haemost. 82, 1240-1246) выявили отсутствие корреляции между дефицитом фактора FXII и риском тромбообразования или риском отсутствия образования тромбов.
Неожиданно и вопреки всем сложившимся представлениям специалистов заявители обнаружили, что внутренний путь свертывания крови, связанный с фактором XII, является существенным для формирования тромба in vivo, но не является необходимым для нормального тканеспецифического гемостаза. Эти результаты изменяют давно устоявшуюся концепцию, заключающуюся в том, что свертываемость крови in vivo опосредована исключительно внешним путем, и указывают на фактор XII как играющий ключевую роль в процессе патологического образования тромбов.
Соответственно, первой задачей, решаемой настоящим изобретением, является применение по меньшей мере одного антитела и/или по меньшей мере одного ингибитора для ингибирования фактора XII и предотвращения образования и/или стабилизации трехмерных артериальных или венозных тромбов. Анти-FXII антитело или соответствующий ингибитор может функционировать таким образом, чтобы ингибировать активацию FXII и/или интерферировать с другими частями молекулы FXII, которые в существенной степени вовлечены в активацию FXII.
Вместе с тем фактом, что внутренний путь не является необходимым для гемостаза, это указывает на фактор XII как на новую мишень для эффективной антитромботической терапии. Помимо этого, указанные результаты являются важными для разработки анти-FXII агентов, для контроля других (пато)механизмов, связанных с системой контакта, таких как воспаление, активация комплемента, фибринолиз, ангиогенез и образование кинина.
Таким образом, настоящее изобретение дополнительно предоставляет применение такого антитела и/или ингибитора для лечения или профилактики состояния или расстройства, связанного с образованием артериального тромба, т.е. инсульта или инфаркта миокарда, воспаления, активации комплемента, фибринолиза, ангиогенеза и/или заболеваний, связанных с патологическим образованием кинина, таких как гипотонический шок, отек, включая наследственный ангионевротический отек, бактериальные инфекции, артриты, панкреатиты или суставная подагра.
В частности, применение по меньшей мере одного анти-FXII антитела (например, антитела F1 (MoAb F1, Ravon etal., Blood. 1995 Dec 1; 86 (11): 4134-43)) и/или применение по меньшей мере одного ингибитора протеазы для ингибирования образования тромба, опосредованного FXII, также является объектом настоящего изобретения.
Особенно предпочтительным является ингибитор протеазы, выбранный, например, из следующей группы: ингибитор AT III, ингибитор ангиотензин-превращающего фермента, ингибитор С1, апротинин, ингибитор протеазы альфа-1, антиболевое средство ([(S)-1-карбокси-2-фенилэтил]-карбамоил-L-Arg-L-Val-аргинал), Z-Pro-Pro-альдегид-диметилацетат, DX88 (Dyax Inc., 300 Technology Square, Cambridge, MA 02139, USA; cited in: Williams A. and Baird LG., Transfus Apheresis Sci. 2003 Dec: 29 (3): 255-8), леупептин, ингибиторы пролиловой лигопептидазы, такие как Fmoc-Ala-Pyr-CN, ингибитор трипсина из кукурузы, мутанты бычьего панкреатического ингибитора трипсина, экотин, YAP (антикоагулянтный белок желтоперой камбалы (Yellowfin sole)) и ингибитор-V трипсина Curcurbita maxima, включая изоингибиторы Curcurbita maxima.
Соответственно, настоящее изобретение предоставляет применение такого антитела и/или ингибитора, описанного в настоящем документе, в медицине, а также применение такого антитела и/или ингибитора для изготовления лекарственного средства.
Таким образом, в соответствии другим с аспектом настоящего изобретения предоставляется фармацевтический состав, содержащий по меньшей мере одно антитело и/или один ингибитор, который подходит для ингибирования фактора XII и который предотвращает формирование и/или стабилизацию трехмерных венозных или артериальных тромбов.
В частности, антитело, используемое для фармацевтического состава, представляет собой анти-FXII антитело (например, такое как F1 антитело (MoAb F1, Ravon et al., Blood. 1995 Dec 1;86(11):4134-43)), и ингибитор представляет собой ингибитор протеазы, выбранный, например, без ограничения, из следующей группы: ингибитор AT III, ингибитор ангиотензин-превращающего фермента, ингибитор C1, апротинин, ингибитор протеазы альфа-1, антиболевое средство ([(S)-1-карбокси-2-фенилэтил]-карбамоил-L-Arg-L-Val-аргинал), Z-Pro-Pro-альдегид-диметилацетат, DX88 (Dyax Inc., 300 Technology Square, Cambridge, MA 02139, USA; cited in: Williams A. and Baird LG., Transfus Apheresis Sci. 2003 Dec: 29 (3): 255-8), леупептин, ингибиторы пролилолигопептидазы, такие как Fmoc-Ala-Pyr-CN, ингибитор трипсина из кукурузы, мутанты бычьего панкреатического ингибитора трипсина, экотин, YAP (антикоагулянтный белок желтоперой камбалы (Yellowfin sole)) и ингибитор-V трипсина Curcurbita maxima, включая изоингибиторы Curcurbita maxima.
Антитело также может представлять собой его фрагмент или миметик, сохранивший ингибирующую активность, например аналоги домена ингибитора протеаз типа Куница белка-предшественника амилоида, описанные в патенте US 6,613,890 (см., в частности, колонки 4-8). Другим подходящим ингибитором может быть Hamadarin, раскрытый Harahiko Isawa et al. в The Journal of Biological Chemistry, Vol.277, No.31 (August 2, pp.27651-27658, 2002). Подходящий ингибитор трипсина из кукурузы и способы его получения раскрыты у Zhi-Yuan Chen et al., Applied and Environmental Microbiology, March 1999, p.1320-1324 (см. также ссылку 19, указанную в этом документе). Содержание всех перечисленных выше документов включено в настоящую заявку в полном объеме. В заключение следует особо отметить, что малые молекулы, выделенные, например, с использованием соответствующего ингибирования FXIIa в качестве анализа, на котором основан выбор, также являются частью изобретения, а также соответствующее их применение, описанное выше или ниже. Указанные низкомолекулярные ингибиторы FXIIa могут быть разработаны, исходя из кристаллической структуры FXII. Таким образом, несколько доменов FXII или легкая цепь могут быть рекомбинантно экспрессированы в такой экспрессионной системе, как E.coli, дрожжи, или клетки млекопитающих. Затем белок очищают и кристаллизуют с использованием стандартных процедур, как описано для FXI субстрата FXII (Jin L, et al. (2005) Crystal structures of the FXIa catalytic domain in complex with ecotin mutants reveal substrate-like interactions. J Biol Chem. 280(6):4704-12). В качестве альтернативы могут быть включены низкомолекулярные ингибиторы сериновой протеазы для стабилизации структуры FXII. Такие препараты, содержащие низкомолекулярные ингибиторы белковых мишеней, которые могут быть разработаны, например, с учетом кристаллической структуры этих целевых белков, хорошо известны в данной области техники и включают фармацевтические препараты, которые могут быть, например, введены пациенту системно, например парентерально, перорально или местно.
Термин "парентерально", как он используется в настоящем документе, включает подкожные, внутривенные, внутримышечные, внутриартериальные и интратрахеальные инъекции, инстилляцию, введение в виде спрея и инфузию. Парентеральные составы предпочтительно вводятся внутривенно, либо в форме болюсов, либо в форме постоянной инфузии, либо подкожно, в соответствии и известными процедурами. Предпочтительные жидкие носители, которые хорошо известны для использования при парентеральном введении, включают стерильную воду, физиологический раствор, водную декстрозу, растворы сахаров, этанол, гликоли и масла.
Таблетки и капсулы для перорального введения могут содержать общеизвестные вспомогательные вещества, такие как связующие агенты, наполнители, лубриканты, смачивающие агенты и т.п. Пероральные жидкие составы могут быть в форме водных или масляных суспензий, растворов, эмульсий, сиропов, эликсиров, и т.п. или могут быть представлены в виде сухого продукта, восстанавливаемого водой или другим подходящим носителем для использования. Такие жидкие составы могут содержать общеизвестные добавки, такие как суспендирующие агенты, эмульгаторы, неводные носители и консерванты.
Составы, подходящие для местного применения, могут быть в форме водных или масляных суспензий, растворов, эмульсий, гелей или, предпочтительно, эмульсионных мазей. Составы, подходящие для нанесения в виде спрея, могут быть в форме распыляемой жидкости или сухого порошка.
В соответствии с третьим аспектом настоящего изобретения предоставляется применение фактора XII в качестве антитромботической мишени путем ингибирования фактора XII по меньшей мере одним антителом и/или одним ингибитором и предотвращения, таким образом, образования и/или стабилизации трехмерных тромбов в сосудах.
Сущность настоящего изобретения, обеспечиваемые им преимущества и его дополнительные признаки изложены в нижеследующем подробном описании выполненных экспериментов и их результатов, которое следует изучать совместно с прилагаемыми чертежами, описанными ниже.
При анализе функций внутреннего каскада коагуляции в гемостазе и тромбозе использовали мышей с дефицитом фактора XII. Интравитальная флуоресцентная микроскопия и ультразвуковое измерение параметров потока выявили сильные нарушения в образовании и стабилизации трехмерных тромбов в различных артериальных отделах сосудистой системы. Введение мутантным мышам человеческого фактора XII восстанавливало внутренний путь коагуляции in vitro и формирование артериальных тромбов in vivo. С точки зрения механики процесса, прокоагулянтная активность внутреннего пути в существенной степени опосредована активированными тромбоцитами. Эти результаты указывают на внутренний каскад свертывания крови, инициируемый FXII, как на ключевой элемент в процессе формирования артериальных тромбов, связывающий плазменную коагуляцию с агрегацией тромбоцитов.
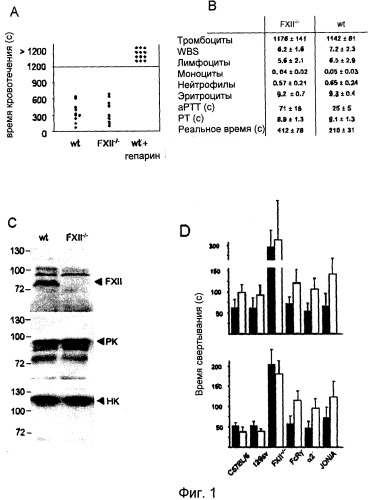
На Фиг.1 представлен анализ свертывания крови у мышей, дефицитных по FXII: (A) Время кровотечения из хвостовой вены у мышей дикого типа (n=12) и FXII-/- мышей (n=11). Каждый символ представляет одну особь. (B) Измерение периферийной крови в тыс./мкл и параметры глобального свертывания для мышей дикого типа и FXII-/- мышей. Расшифровка аббревиатур: количество лейкоцитов (WBC), активированное парциальное тромбопластиновое время (aPTT) и протромбиновое время (PT). Значения представляют собой средние ±SD для 10 мышей каждого генотипа. (C) Белки FXII контактной системы, калликреин плазмы (PK) и высокомолекулярный кининоген (HK) в 0,3 мкл плазмы мышей дикого типа и FXII-/- мышей, определенные методом вестерн-блоттинга с использованием специфических антител. Стандарт молекулярного веса приведен слева. (D) Время свертывания при рекальцификации определяли для плазмы без тромбоцитов (верхняя часть) и обогащенной тромбоцитами плазмы (нижняя часть), полученной от мышей C57BL/6 и 129sv wt, FXII-/-, FcRγ-/- и дефицитных по интегрину α2, после активации каолином (темные столбцы) или коллагеном (светлые столбцы). Эффект JON/A анализировали на плазме C57BL/6 с добавлением 50 мкг/мл антитела. Приводятся средние±STD по 6 экспериментам.
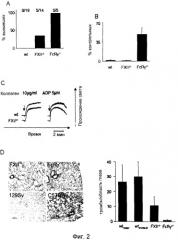
Фиг.2. (A) Наблюдали смертность вследствие тромбоэмболических осложнений, возникших после внутривенной инъекции коллагена (0,8 мг/кг) и эпинефрина (60 мкг/кг). Мыши дикого типа погибали в течение 5 мин. Животные, оставшиеся в живых спустя 30 мин после введения, расценивались как выжившие. (B) Количество тромбоцитов у контрольных (n=19), FXII-/- (n=14) и FcRγ-/- (n=5) мышей спустя 2 мин после инфузии коллагена/эпинефрина. (C) Гепаринизированную обогащенную тромбоцитами плазму, полученную от мышей дикого типа и FXII-/- мышей, стимулировали коллагеном (10 мкг/мл) или ADP (5 мкМ) и регистрировали величину светопроницаемости в стандартном агрегометре. Представленные результаты получены для групп из шести мышей. (D) Окрашенные гематоксилином/эозином срезы легких указанных мышей через 2 мин после инъекции коллагена/эпинефрина. Количество тромбов в поле зрения подсчитывали при увеличении 20×. Столбцы представляют средние ±SDT по 100 полям зрения.
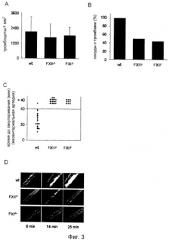
На Фиг.3 показано образование in vivo дефектного тромба у мыши без фактора XII. Образование тромба наблюдали in vivo в мезентериальных артериолах при поражении, вызванном 20% FeCl3. (А) Адгезию единичных тромбоцитов обнаружили у всех линий мышей спустя 5 мин после нанесения повреждения, при этом спустя 7-8 мин после нанесения повреждения наблюдали первые тромбы у мышей дикого типа, в то время как у FXII-/-мышей первые тромбы появлялись спустя 14-35 мин после нанесения повреждения, а у FXI-/- мышей спустя 5-35 мин после нанесения повреждения. (В) Образование тромбов в мезентериальных артериях наблюдали в 100% случаях у мышей дикого типа, но только в 50% случаях у FXII-/- мышей и в 44,4% случаях у FXI-/- мышей. (C) Тромбы, образовавшиеся у мышей дикого типа, закупоривали сосуд в среднем спустя 25 мин после нанесения повреждения, тогда как тромбы, образовавшиеся у мышей, дефицитных по FXII-/- и FXI-/-, не приводили к закупориванию. Каждый символ представляет одну наблюдавшуюся артериолу. (D) Репрезентативные фотографии одного эксперимента.
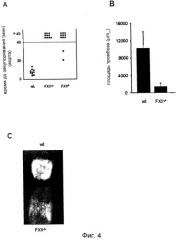
Фиг.4. (A) Мышей дикого типа (n=10), FXII-/- (n=10) и FXI-/- (n=11) анализировали на модели закупоривания артерии. Тромбоз индуцировали в аорте посредством одного плотного сжатия щипцами. Ток крови отслеживали с помощью периваскулярного ультразвукового датчика потока до полного закупоривания. Эксперимент прекращали через 40 мин. Каждый символ представляет одну особь. (B) Механическое повреждение сонной артерии инициировали наложением лигатуры. После удаления нити измеряли в мкм2 площадь тромба у мышей дикого типа (n=10) и FXII-/- (n=10). (C) На фотомикрографиях представлены репрезентативные изображения спустя 2 мин после нанесения повреждения.
На Фиг.5 показан дефект образования тромба у животных, дефицитных по FXII, которым был введен человеческий FXII. (A) Образование тромба после повреждения, индуцированного FeCl3, наблюдали в мезентериальных артериях в 100% случаях как у мышей дикого типа, так и у FXII-/- мышей, которым был инъецирован человеческий FXII. (B) Формирующиеся тромбы закупоривали сосуд в среднем спустя 25 мин после нанесения повреждения у мышей дикого типа и спустя 22,7 мин после нанесения повреждения у FXII-/- мышей, которым был инъецирован человеческий FXII. Каждый символ представляет одну особь. (C) Представлены репрезентативные фотографии. (D) FXII-/- мыши получали 2 мг/кг hFXII-/-, и в аорте индуцировали тромбоз посредством одного плотного сжатия щипцами. Ток крови отслеживали с помощью периваскулярного ультразвукового датчика потока до полного закупоривания. Эксперимент прекращали через 40 мин. Каждый символ представляет одну особь.
На Фиг.6 показано in vivo ингибированное анти-FXII антителами образование тромба у мыши. Мыши дикого типа получали 2 мг/кг анти-FXII антител или нечеловеческого IgG i.v. Спустя 15 мин проводили мониторинг in vivo образования тромба в мезентериальных артериолах при поражении, вызванном 20% FeCl3. (A) Адгезия единичных тромбоцитов была обнаружена у обоих групп спустя 5 мин после нанесения повреждения. Спустя 7-8 минут наблюдали первые тромбы у мышей контрольной группы, обработанной IgG, тогда как у мышей, обработанных анти-FXII антителами, первые тромбы появились спустя 12-32 минуты после нанесения повреждения. (B) Образование тромбов наблюдали в мезентериальных артериях в 100% случаях у контрольных мышей, но только в 60% случаях у мышей, обработанных анти-FXII антителами. (C) Показано время до полного закупоривания. Каждый символ представляет одну особь.
На Фиг.7 показана пересмотренная модель формирования артериального тромба. Сначала на участках очагов повреждений сосудов происходит образование тромбина вследствие экспозиции тканевого фактора (TF) в субэндотелиальном матриксе. TF в комплексе с FVII инициирует внешний путь свертывания крови. На участке повреждения вклад FXII, опосредующего внутренний путь через FXI с образованием тромбина (FII), является незначительным, и им можно пренебречь в случае нормального гемостаза. Соответственно, индивиды с дефицитом FXII не страдают от кровотечений. Образование тромбина инициирует формирование сгустка путем образования фибрина и активации тромбоцитов. Рост тромба: на поверхностях, открытых к растущему тромбу, индуцированный FXII внутренний путь вносит существенный вклад в образование тромбина. Активированный FXII с участием FXI образует дополнительный фибрин. Соответственно, дефицит как по FXII, так и по FXI вызывает серьезное нарушение процесса формирования тромбов.
В настоящем изобретении потенциальный вклад внутреннего пути свертывания при патологическом образовании тромбов in vivo оценивали с помощью моделей артериального тромбоза, основанных на интравитальной микроскопии и измерении параметров потока, с использованием мышей без фактора XII. Несмотря на то что начальная адгезия тромбоцитов на участках повреждений у мутантных животных не меняется, последующее формирование и стабилизация трехмерных тромбов сопровождается серьезными нарушениями. Это нарушение наблюдалось в различных ветвях сосудистой сети и полностью устранялось с помощью экзогенного фактора XII человека. Эти факты указывают на опосредованный фактором XII внутренний путь свертывания крови как на основное звено, связывающее первичный и вторичный гемостаз в пересмотренной модели образования тромбов.
Для анализа функций FXII при свертывании крови in vivo выводили мышей с дефицитом FXII. FXII-/- мыши являлись здоровыми особями, бесплодными и фенотипически неотличимыми от однопометных животных дикого типа. Подробный гистологический и гемостазиологический анализ не выявил корреляций с увеличенным тромбообразованием и кровотечением у FXII-/- мышей, несмотря на увеличенное aPTT, равное 68±17 сек, и время рекальцификации, равное 412±78 сек, плазмы, отобранной из ретроорбитального синуса (дикий тип: 23±4 и 210±31 сек) (Pauer.H.U., et al. (2004). Targeted deletion of murine coagulation factor XII gene-a model for contact phase activation in vivo. Thromb. Haemost. 92, 503-508). Так же как и люди с дефицитом FXII, FXII-/- мыши не подвержены кровотечениям, что подтверждается временем кровотечения при надрезе хвоста, сходным с таковым у животных дикого типа (369.5±201,7 и 355,9±176,1 сек соответственно n=12 на группу, Фиг.1A). Количество клеток периферийной крови у мутантных мышей не отличалось от контроля дикого типа. Следует отметить, что протромбиновое время (PT) у FXII-/- мышей и у мышей дикого типа было схожим (8,9±1,3 и 9,1±1,3 сек), что указывает на то, что недостаток FXII не оказывает негативного влияния на образование фибрина внешней системой свертывания крови (Фиг.1B). Для оценки потенциальных отличий прокоагулянтной активности FXII между человеком и мышью плазму человека с дефицитом FXII (FXII<1%) восстанавливали плазмой мышей дикого типа, или наоборот, и определяли PTT смесей. В каждом случае отмечалась нормализация процесса формирования сгустка, что подтверждает предположение о том, что функция FXII при образовании сгустка является сопоставимой у человека и мыши.
У человека, аналогично случаю дефицита FXII, дефицит белков контактной системы: калликреина плазмы (PK) и высокомолекулярного кининогена (HK), не приводит к повышенному риску кровотечения, несмотря на увеличенное aPTT. Для подтверждения того, что увеличение aPTT у FXII-/- мышей не является следствием дополнительных дефектов белков контактной фазы, был проведен анализ PK и HK плазмы мышей дикого типа и FXII-/-. По данным вестерн-блот анализа уровни HK и PK были эквивалентны у мутантных мышей и мышей дикого типа (Фиг.1C). Функционально, в FXII-/- плазме, подвергнутой воздействию коллагена или каолина, обработка и образование тромбина были серьезно нарушены по сравнению с диким типом.
Свертывание крови и активация тромбоцитов представляют собой комплементарные и взаимозависимые процессы. Тромбоциты взаимодействуют с несколькими факторами свертывания крови и вносят вклад в их активацию, и основной продукт свертывания, тромбин, является мощным активатором тромбоцитов. В этой связи было проведено более подробное изучение вклада тромбоцитов и FXII в формирование сгустка. С этой целью инициировали свертывание, используя либо каолин, который классически активирует FXII, но не оказывает непосредственного воздействия на тромбоциты, либо коллаген, который активирует как FXII, так и тромбоциты, где он взаимодействует со множеством рецепторов, наиболее важными из которых являются интегрин α2β1 и GPVI. В случае присутствия, но не в случае отсутствия тромбоцитов, коллаген очень хорошо подходит для формирования сгустка в плазме дикого типа (Фиг.1D). Напротив, в плазме, содержащей дефектные по активации FcRγ-/- тромбоциты, относительная эффективность коалина и коллагена была похожа на PFP (плазма без тромбоцитов), и схожий эффект наблюдался с PRP (плазма обогащенная тромбоцитами) из интегрина α2-/- мышей. Прокоагулянтная активность тромбоцитов также эффективно запускалась в свертывающейся плазме, и было показано, что фибриновый (фибриногеновый) рецептор αllbβ3 играет ключевую роль в этом процессе, хотя лежащие в его основе механизмы не вполне понятны. В полном соответствии с этими результатами антитело JON/A, блокирующее функции αllbβ3, в существенной степени ингибировало зависящее от тромбоцитов сокращение времени свертывания (Фиг.1D). Вместе эти результаты демонстрируют, что тромбоциты в прокоагулянтном состоянии могут опосредовать индуцированное FXII формирование сгустка.
Для определения, имеет ли индуцированная коллагеном активация FXII функциональные последствия in vivo, на мышах дикого типа и FXII-/- мышах реализовывали модель летальной легочной тромбоэмболии, индуцированной инфузией смеси коллагена (0,8 мг/кг массы тела) и эпинефрина (60 мкг/кг массы тела). Все контрольные мыши (19/19) погибали в течение 5 минут от обширного тромбоза легких и остановки сердца, что сопровождалось более чем 95% уменьшением количества тромбоцитов в кровотоке спустя 2 мин после оказания воздействия (Фиг.2A, 2B). В этих экспериментальных условиях выживало 35,7% (5/14) FXII-/- мышей, хотя количество их периферийных тромбоцитов также уменьшалось, как и у контрольных мышей дикого типа, что указывает на то, что наблюдаемая защита не основана на дефекте активации тромбоцитов. Это предположение было подтверждено исследованиями in vitro, показавшими, что FXII-/- тромбоциты экспрессируют нормальные уровни основных поверхностных гликопротеинов, включая рецепторы коллагена, и что указанные клетки являются нормально активируемыми классическими агонистами, такими как тромбин, аденозиндифосфат (АДФ) или GPVI-специфический агонист, родственный коллагену пептид (измерено активацией экспрессии αllbβ интергина и P-селектина). В полном соответствии с этими результатами, FXII-/- тромбоциты демонстрируют неизмененный агрегационный ответ на коллаген, АДФ (Фиг.2C), PMA или тромбин.
В параллельной серии экспериментов FcRγ-/- мыши подвергались воздействию коллагена/эпинефрина. Эти мыши были полностью защищены от смертельного исхода и количество тромбоцитов не очень сильно уменьшалось спустя 2 минуты после воздействия, что подтверждает обязательность активации тромбоцитов для обеспечения смертельного исхода в этой модели. Эти данные были дополнительно подтверждены результатами гистологических анализов срезов легких, полученных от мышей различных групп. Хотя у мышей дикого типа подавляющее количество сосудов было закупорено, этот эффект был в существенной степени снижен у FXII-/- мышей (выживших и погибших). В полном соответствии с предыдущими публикациями, в легких FcRγ-/- практически не было обнаружено тромбов (Фиг.2D). Эти результаты указывают на то, что in vivo коллаген запускает как активацию тромбоцитов, так и опосредованный FXII внутренний путь свертывания крови, которые в данной модели действуют синергически, формируя легочные тромбы.
Патологическое образование тромбов часто инициируется разрывом или внезапным разрушением атеросклеротической бляшки в артериальной ветви сосудистой сети, что приводит к нефизиологически сильной активации тромбоцитов и прокоагулянтной активности на поверхности субэндотелиальных слоев. Для оценки роли FXII в этих процессах изучали формирование тромбов у мышей дикого типа и FXII-/- мышей, используя различные модели артериальных повреждений. В первой модели индуцировали окислительное повреждение в мезентериальных артериолах (60-100 мкм в диаметре) и исследовали формирование тромбов с помощью in vivo флуоресцентной микроскопии. Мыши дикого типа и FXII-/- мыши получали меченные флуоресцентными метками тромбоциты (1×108) такого же генотипа, и повреждение индуцировали путем топического наложения на 1 минуту фильтровальной бумаги, пропитанной 20% хлоридом железа (FeCl3), что вызывало образование свободных радикалов, ведущее к разрушению эндотелия. Взаимодействие тромбоцитов с поврежденной стенкой сосуда начиналось очень быстро, и спустя пять минут после нанесения повреждения количество надежно прикрепленных тромбоцитов было одинаковым у обеих групп мышей (Фиг. 3A). Однако хотя у мышей дикого типа прикрепившиеся тромбоциты непрерывно мобилизовали дополнительные тромбоциты из кровотока, в результате чего формировались агрегаты, этот процесс был сильно искажен у мутантных мышей. В контрольных сосудах в 100% случаях (17/17) стабильные тромбы диаметром >20 мкм формировались в течение 10 минут после нанесения повреждения и со временем стабильно росли, приводя в конечном счете к полному закупориванию сосудов в 94,1% (16/17) случаях в течение времени наблюдения 40 минут (среднее время закупоривания 25,6±8,9 мин) (Фиг.3). Напротив, у мутантных мышей формирование микроагрегатов или тромбов полностью отсутствовало в 50% (7/14) сосудов. В оставшихся 50% (7/14) сосудов сформировались тромбы, которые, однако, были нестабильными и быстро отделялись от стенки сосуда. Ни в одном из сосудов тромбы с диаметром >20 мкм не оставались прикрепленными к участку поражения дольше 1 минуты. Соответственно, у FXII-/- мышей ни один из сосудов не закупорился за период наблюдения (40 минут). Этот неожиданный результат демонстрирует, что FXII необходим для возникновения и стабилизации обогащенных тромбоцитами тромбов в артериолах, поврежденных FeCl3, и указывает на то, что индуцируемый FXII путь свертывания крови вносит существенный вклад в наблюдаемый тромботический ответ. Это предположение было подтверждено при анализе мышей, дефицитных по FXI, в той же самой модели. Поскольку FXI представляет собой основной субстрат для FXII во "внутреннем" каскаде, у этих мышей также должен наблюдаться похожий дефект образования тромбов. Действительно, практически так же, как и у FXII-/- мышей, по существу нормальная адгезия тромбоцитов на участке повреждения наблюдалась в течение первых трех минут после нанесения повреждения, тогда как образование тромбов было полностью подавлено в сосудах в 55.6% (5/9) случаях. В остальных сосудах сформировавшиеся микроагрегаты и тромбы были нестабильными и непрерывно эмболизировались. В результате ни один из сосудов не закупорился за период наблюдения (40 минут). Эти данные показывают, что мыши, дефицитные по FXI, защищены в модели индуцированного FeCl3 закупоривания сонной артерии.
Известно, что индуцированное FeCl3 формирование артериальных тромбов зависит от тромбоцитов и образования тромбина, но остается неясным, насколько хорошо этот тип повреждения имитирует среду, возникающую в пораженных сосудах, например, при разрыве атеросклеротической бляшки. В этой связи, для исключения возможности того, что массивное индуцированное FeCl3 окислительное поражение создает нефизиологические условия, которые могут искусственно благоприятствовать активации зависящей от FXII контактной фазы, функцию FXII исследовали на хорошо изученной модели артериального тромбоза, в которой повреждение индуцировалось в аорте механически, и кровоток отслеживали с помощью ультразвукового датчика потока. После временного возрастания непосредственно после нанесения повреждения кровоток непрерывно уменьшался в течение нескольких минут у всех тестированных мышей. У всех тестированных мышей дикого типа (10/10) это снижение приводило к полному и необратимому закупориванию сосуда за период времени от 1,6 до 11,1 минут после нанесения повреждения (среднее время закупоривания 5,3±3,0 минут, Фиг.4A). Другую картину наблюдали у FXII-/- мышей, у которых формирование стабильных тромбов было сильно искажено. Хотя у всех животных наблюдали постоянное снижение кровотока в течение первых минут после нанесения повреждения, закупоривание произошло только у 4 из 10 мышей. Более того, закупоривающие тромбы у этих мышей во всех случаях были нестабильными и быстро эмболизировались, так что кровоток восстанавливался за 10-115 сек после закупоривания. Ни один из повторно открывшихся сосудов не закупоривался второй раз. Соответственно, все FXII-/- мыши демонстрировали по существу нормальную скорость кровотока через поврежденный сосуд в конце периода наблюдения (40 минут). Очень похожие результаты были получены на FXI-/- мышах, где у 9 из 11 мышей не сф