Способ иммобилизации биомолекул на поверхности магнитоуправляемых наночастиц железа покрытых углеродной оболочкой
Иллюстрации
Показать всеИзобретение относится к cпособу иммобилизации белковых молекул на поверхности магнитоуправляемых наночастиц железа, покрытых углеродной оболочкой. Способ включает взаимодействие порошка с растворенным в воде 4-карбоксибензолдиазоний тозилатом для формирования ковалентной связи органических функциональных групп с поверхностью порошка наночастиц железа, покрытых углеродной оболочкой. Дополнительно проводят карбодиимидную активацию с использованием систем: дициклогексилкарбодиимида с N-гидроксисукцинимидом в диметилсульфоксиде (DCC/NHS в ДМСО) или 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлориде с N-гидроксисукцинимидом в воде (EDC/NHS в H2O) или фосфатном буферном растворе. Осуществляют ковалентную «сшивку» белковых молекул с активированной COOH-группой в водной или буферной среде. Изобретение позволяет осуществить иммобилизацию биомолекул на поверхности магнитоуправляемых наночастиц железа, покрытых углеродной оболочкой. 3 ил., 8 пр.
Реферат
Изобретение относится к химическим методам ковалентной иммобилизации белковых молекул на поверхность наноразмерных объектов с целью создания конструкции «Биомолекула-наночастица».
Интерес к магнитным наночастицам для медицины прежде всего связан с возможностью управления, отделения, концентрирования, а также детектирования конструкций на их основе при наложении внешнего магнитного поля [Jun, Y.W., \\ Аcc Chem Res. - 2008. - 41. - 2. - p.179-89].
Ключевым этапом для создания нанобиогибридных конструкций является модификация поверхности металлсодержащих наночастиц с последующей иммобилизацией белковых молекул, которая может быть реализована методами физической и/или химической сорбции на поверхности либо за счет ковалентного связывания с активными группами на поверхности. Альтернативным вариантом можно назвать закрепление через молекулу-адаптер (например система стрептавидин/биотин). Наиболее перспективным подходом на данном этапе развития науки считается формирование ковалентной связи, позволяющей обеспечить наиболее прочное и сайт-специфичное закрепление биомолекулы.
Так, например, в работе Can K. [K. Can, M. Ozmen, M. Ersoz. Colloids and Surfaces В: Biointerfaces - 71 - 2009 - 154-159] для иммобилизации молекулы альбумина на поверхность наночастиц порошка Fe3O4 было предложено проделать ряд последовательных реакций.
Метод иммобилизации заключался в синтезе непосредственно наноразмерного порошка Fe3O4 в щелочной среде, авторами было доказано наличие на поверхности полученных частиц активных OH-групп. Вторая реакция заключалась в обработке полученных частиц (3-аминопропил)-этоксисиланом, авторами с использованием ИК-спектроскопиии доказана ковалентная прививка модификатора. Для активации NH2-группы на поверхности модифицированных частиц авторами был использован глутаровый альдегид, далее в течение 5 часов при 37°C происходила собственно иммобилизация альбумина. Ковалентное связывание иммобилизованной макромолекулы с углеродом авторами доказывалась ИК-спектроскопией, термогравиметрией.
Mikhaylova M. и другие [Mikhaylova M, Do Kyung Kim, Berry С С., Zagorodni A, Toprak M.G. Curtis A.S., Muhammed M. Chem. Mater. - 2004 - 16. - 2344-2354] предложили несколько иной способ иммобилизации биомолекулы (в качестве биомолекулы авторы использовали Бычий сывороточный альбумин BSA). После предварительного синтеза наночастиц Fe3O4 и активации OH-групп на поверхности с использованием (3-аминопропил)-этоксисилана авторы иммобилизировали N-гидроксисукцинимидный эфир BSA (полученный в условиях карбодиимидной активации).
Yong Ya. и др. [Yong Ya., Bai Yo., Li Ya., Lin L., Cui Ya., Xia Ch. // Journal of magnetism and Magnetic Materials. - 320. - 2008. - 2350-2355] предлагают в качестве линкера использовать полимерную «шубу», образованную полимеризацией глицидил метакрилата (GMT) и метакрилоксиэтил триметил аммоний хлорида (МАТАС) на поверхности наночастиц Fe3O4. Иммобилизация липаз в таком способе проходит по свободным концам полимерной оболочки через образования амидных связей.
Авторы Chenjie Xu и др., [Ch. Xu, K. Xu, H. Gu, R. Zheng, H. Liu, X. Zhang, Zh. Guo, B. Xu. // J. AM. CHEM. SOC. 2004. - 126. - 9938-9939] предложили принципиально иной способ иммобилизации биомолекул на поверхность наноразмерных частиц. Метод заключается в добавлении наночастиц Fe2O3 к синтезированной структуре модификатора, функционализация поверхности проходит через образования ковалентной связи между модификатором и OH-группой, которая находится на поверхности наночастиц. Далее авторы проводят комплексообразования с металлом, который в свою очередь будем комплементарен с иммобилизируемой биомолекулой.
В 2008 г. [Grass R.N. and other. WO 2008/055371 A2, 2008] был запатентован метод функционализации поверхности (в данном случае - это поверхность из углерода, которая окружает металлическое ядро в виде оболочки в нанопорошках кобальта) фенильными радикалами, содержащими в качестве заместителей хлор-, амино-, карбокси-, карбоксиметил-, сульфо-, триметиламмонийную и хелатную (остаток диэтилентриаминопентауксусной кислоты) группы, посредством реакции с тетрафторборатами или хлоридами арендиазония, содержащими именно те органические фрагменты, которые в ходе реакции образуют химические связи с поверхностью нанопорошка.
При этом реакция для тетрафторборатных солей арендиазония реализуется в водной среде под действием интенсивной ультразвуковой обработки в присутствии поверхностно-активного вещества (ПАВ - додецилсульфат натрия). В случае использования хлоридов диазония реакция протекает in situ.
Наиболее близким к заявленному методу является способ функционализации наноразмерных порошков металлов или оксидов металлов в углеродной оболочке или без нее, или наноуглерода, или наноалмаза, который включает взаимодействие порошка с растворенной в воде солью арендиазония тозилата для формирования ковалентных связей органических функциональных групп с поверхностью порошка [Филимонов В.Д., Федущак Т.А., Ермаков А.Е., Уймин М.А., Итин В.И., Постников П.С., Трусова М.Е., Кувшинов В.А., Мысик А.А., Восмериков А.В. Способ функционализации наноразмерных порошков // Патент РФ. 2405655. - 2010 г.]. Авторами прототипа было предложено использовать водные растворы арендиазоний тозилатов (XArN2+TsO-, где Ar=C6H4, C6H4(CH2)C6H4; X=I, NO2, NH2, COOH, N(CH2COOH)2, OCH3, CH3, фрагменты ЭДТА, ДТПА и других хелатирующих агентов).
Недостатком указанного способа является то, что способ не позволяет проводить иммобилизацию белковых молекул с целью создания магнитоуправляемой конструкции «Наночастица-Биомолекула».
Задачей данного изобретения является разработка способа иммобилизации белковых молекул на поверхности магнитоуправляемых наночастиц железа, покрытых углеродной оболочкой (Fe@C).
Способ иммобилизации белковых молекул на поверхности магнитоуправляемых наночастиц железа, покрытых углеродной оболочкой (Fe@C), включающий взаимодействие порошка с растворенным в воде 4-карбоксибензолдиазоний тозилатом для формирования ковалентной связи органических функциональных групп с поверхностью порошка, отличающийся тем, что дополнительно проводят карбодиимидную активацию с использованием систем: дициклогексилкарбодиимида с N-гидроксисукцинимидом в диметилсульфоксиде или дистиллированной воде (DCC/NHS в ДМСО/H2O) или 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид с N-гидроксисукцинимидом в воде (EDC/NHS в H2O) или в фосфатном буфере, осуществляют ковалентную «сшивку» белковой молекулы с активированной COOH-группой в водной или буферной среде.
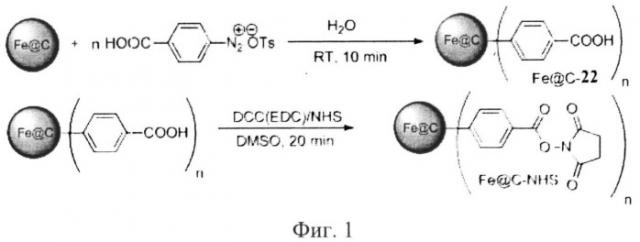
Технический результат достигается применением карбодиимидной активации с использованием DCC/NHS в ДМСО или EDC/NHS в H2O или фосфатном буфере. Эта система позволяет упростить процесс выделения и отмывки наночастиц от сорбированных молекул органических веществ, так как не происходит образования стабильной суспензии вода-наночастицы. На фиг.1 изображена активация COOH-группы с использованием системы DCC/NHS в ДМСО либо EDC/NHS в воде
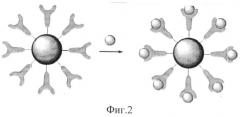
Заключительный этап осуществляется в водной среде или фосфатном буфере, где происходит ковалентная «сшивка» белковых молекул с активированной COOH-группой. После процедуры иммобилизации осуществляется тщательная многократная промывка полученной конструкции «Наночастица-Биомолекула» этиловым спиртом, ацетоном. На фиг.2 схематично изображена иммобилизация белковых молекул на поверхности магнитоуправляемых наночастиц железа, покрытых углеродной оболочкой через «сшивку» с активированными COOH-группами.
Способ иммобилизации белковых молекул на поверхности магнитоуправляемых наночастиц железа, покрытых углеродной оболочкой, заключается в следующем: 4-карбоксибензолдиазоний тозилат растворяют в воде, добавляют магнитоуправляемые наночастицы железа, покрытые углеродной оболочкой (диаметр ядра 2-100 нм, толщина оболочки 0,3-3 нм), перемешивают и оставляют на 20-30 минут. Реакция протекает самопроизвольно без ультразвукового вмешательства и добавок поверхностно-активных веществ. Химическую реакцию можно контролировать визуально по выделению пузырьков азота или использовать различные методы анализа концентрации диазониевых солей в растворе. Продукты отделяют магнитным сепарированием, отмывают от избытка соли диазония водой, органическими растворителями и высушивают на воздухе. Наличие соответствующих органических групп в нанопорошках доказывают по изменениям в спектрах ИК (спектрометр NICOLET-5700) относительно исходного нанопорошка. На Фиг.3 изображены ИК-спектры Fe@C (черные точки), Fe@C функционализированные 4-карбоксибензодиазоний тозилатом (линия a), Fe@C с привитой белковой молекулой (пероксидаза хрена HRP) (линия b) и чистой биомолекулой HRP (линия c).
Полученный функционализированный наноразмерный порошок наночастиц железа, покрытый углеродной оболочкой массой 3 мг, промывают буферным раствором (дистиллированной водой) порционно трижды объемами 1,5 мл, к промытому образцу поверхностно-модифицированных наночастиц после промывки прибавляют 1 мл буферного раствора (водного раствора) и 0.33 ммоль EDC, 0.33 ммоль NHS. После суспензию подвергают озвучиванию на ультразвуковом диспергаторе в течение 1 секунды. Время активации 15 минут. Активированный образец трижды промывают фосфатным буферным раствором или дистиллированной водой. К полученному образцу прибавляют 0.002 ммоль белка содержащего раствора. Время иммобилизации белковых молекул 30 минут. Далее проводят промывку образца трижды водой и еще трижды фосфатным буфером.
Определение концентрации биомолекул BSA и HrP проводилось в ходе анализа остаточной концентрации после отмывки нанокомпозита спектрофотометрическим методом (длина волны, E403=95000 моль-1см-1). Содержание белковых молекул BSA и HrP в полученной конструкции «Биомолекла-наночастица», составило 0,24*10-6 моль/г.
Пример 1: 0,02 г (0,063 ммоль) 4-карбоксибензолдиазоний тозилата растворяют в 15 мл дистиллированной воды, добавляют 0,03 г (0,5 ммоль) наноразмерных частиц железа, покрытых углеродной оболочкой, затем реакционную смесь интенсивно перемешивают и оставляют при комнатной температуре. Последующая спонтанная функционализация наноразмерных частиц происходит в течение 30 минут. Из реакционной смеси продукт выделяют при помощи магнита, избыток 4-карбоксибензолдиазоний тозилата сначала отмывают дистиллированной водой, а затем метиловым спиртом, ацетоном и сушат на воздухе. Полученный функционализированный порошок наночастиц железа (3 мг) промывался фосфатным буферным раствором порционно трижды объемами 1,5 мл. Далее промытый образец функционализированных наночастиц суспендировали в 1 мл фосфатного буферного раствора. К полученной суспензии добавляли 0.33 ммоль EDC и 0.33 ммоль NHS. После суспензию подвергали озвучиванию на ультразвуковом диспергаторе в течение 1 секунды. Время активации 15 минут. Активированный образец трижды промывался фосфатным буферным раствором. К полученному образцу прибавляли 0.002 ммоль биомолекулы BSA. Время присоединения белковых молекул 30 минут. Далее проводилась промывка образца трижды водой и еще трижды фосфатным буфером.
Пример 2: 0,02 г (0,063 ммоль) 4-карбоксибензолдиазоний тозилата растворяют в 15 мл дистиллированной воды, добавляют 0,03 г (0,5 ммоль) наноразмерных частиц железа, покрытых углеродной оболочкой, затем реакционную смесь интенсивно перемешивают и оставляют при комнатной температуре. Последующая спонтанная функционализация наноразмерных частиц происходит в течение 30 минут. Из реакционной смеси продукт выделяют при помощи магнита, избыток 4-карбоксибензолдиазоний тозилата сначала отмывают дистиллированной водой, а затем метиловым спиртом, ацетоном и сушат на воздухе. Полученный функционализированный порошок наночастиц железа, покрытый углеродной оболочкой массой 3 мг, промывался ДМСО порционно трижды объемами 1,5 мл. К промытому образцу функционализированных наночастиц после промывки прибавлялось 1,5 мл ДМСО. К полученной суспензии добавляли 0.33 ммоль DCC и 0.33 ммоль NHS. После суспензию подвергали озвучиванию на ультразвуковом диспергаторе в течение 1 секунды. Время активации 15 минут. Активированный образец дважды промывался ДМСО и еще трижды дистиллированной водой. К полученному образцу прибавляли 0.002 ммоль биомолекулы BSA. Время присоединения белковых молекул 20 мин. Далее проводилась промывка образца трижды водой и еще трижды фосфатным буфером.
Пример 3: 0,02 г (0,063 ммоль) 4-карбоксибензолдиазоний тозилата растворяют в 15 мл дистиллированной воды, добавляют 0,03 г (0,5 ммоль) наноразмерных частиц железа, покрытых углеродной оболочкой, затем реакционную смесь интенсивно перемешивают и оставляют при комнатной температуре. Последующая спонтанная функционализация наноразмерных частиц происходит в течение 30 минут. Из реакционной смеси продукт выделяют при помощи магнита, избыток 4-карбоксибензолдиазоний тозилата сначала отмывают дистиллированной водой, а затем метиловым спиртом, ацетоном и сушат на воздухе. Далее промытый образец функционализированных наночастиц (3 мг) суспендировали в 1 мл дистиллированной воды. К полученной суспензии добавляли 0.33 ммоль EDC и 0.33 ммоль NHS. После суспензию подвергали озвучиванию на ультразвуковом диспергаторе в течение 1 секунды. Время активации 15 минут. Активированный образец трижды промывался дистиллированной водой. К полученному образцу прибавляли 0.002 ммоль биомолекулы BSA. Время присоединения белковых молекул 30 минут. Далее проводилась промывка образца трижды водой.
Пример 4: 0,02 г (0,063 ммоль) 4-карбоксибензолдиазоний тозилата растворяют в 15 мл дистиллированной воды, добавляют 0,03 г (0,5 ммоль) наноразмерных частиц железа, покрытых углеродной оболочкой, затем реакционную смесь интенсивно перемешивают и оставляют при комнатной температуре. Последующая спонтанная функционализация наноразмерных частиц происходит в течение 30 минут. Из реакционной смеси продукт выделяют при помощи магнита, избыток 4-карбоксибензолдиазоний тозилата сначала отмывают дистиллированной водой, а затем метиловым спиртом, ацетоном и сушат на воздухе. К промытому образцу функционализированных наночастиц (3 мг) после промывки прибавлялось 1,5 мл дистиллированной воды. К полученной суспензии добавляли 0.33 ммоль DCC и 0.33 ммоль NHS. После суспензию подвергали озвучиванию на ультразвуковом диспергаторе в течение 1 секунды. Время активации 15 минут. Активированный образец промывали трижды дистиллированной водой. К полученному образцу прибавляли 0.002 ммоль белковой молекулы BSA. Время присоединения белковых молекул 20 мин. Далее проводилась промывка образца трижды дистиллированной водой.
Пример 5: 0,02 г (0,063 ммоль) 4-карбоксибензолдиазоний тозилата растворяют в 15 мл дистиллированной воды, добавляют 0,03 г (0,5 ммоль) наноразмерных частиц железа, покрытых углеродной оболочкой, затем реакционную смесь интенсивно перемешивают и оставляют при комнатной температуре. Последующая спонтанная функционализация наноразмерных частиц происходит в течение 30 минут. Из реакционной смеси продукт выделяют при помощи магнита, избыток 4-карбоксибензолдиазоний тозилата сначала отмывают дистиллированной водой, а затем метиловым спиртом, ацетоном и сушат на воздухе. Полученный функционализированный порошок наночастиц железа (3 мг) промывался фосфатным буферным раствором порционно трижды объемами 1,5 мл. Далее промытый образец функционализированных наночастиц суспензировали в 1 мл фосфатного буферного раствора. К полученной суспензии добавляли 0.33 ммоль EDC и 0.33 ммоль NHS. После суспензию подвергали озвучиванию на ультразвуковом диспергаторе в течение 1 секунды. Время активации 15 минут. Активированный образец трижды промывался фосфатным буферным раствором. К полученному образцу прибавляли 0.002 ммоль биомолекулы HrP. Время присоединения белковых молекул 30 минут. Далее проводилась промывка образца трижды водой и еще трижды фосфатным буфером.
Пример 6: 0,02 г (0,063 ммоль) 4-карбоксибензолдиазоний тозилата растворяют в 15 мл дистиллированной воды, добавляют 0,03 г (0,5 ммоль) наноразмерных частиц железа, покрытых углеродной оболочкой, затем реакционную смесь интенсивно перемешивают и оставляют при комнатной температуре. Последующая спонтанная функционализация наноразмерных частиц происходит в течение 30 минут. Из реакционной смеси продукт выделяют при помощи магнита, избыток 4-карбоксибензолдиазоний тозилата сначала отмывают дистиллированной водой, а затем метиловым спиртом, ацетоном и сушат на воздухе. Полученный функционализированный порошок наночастиц железа, покрытых углеродной оболочкой массой 3 мг промывался ДМСО порционно трижды объемами 1,5 мл. К промытому образцу функционализированных наночастиц после промывки прибавлялось 1,5 мл ДМСО. К полученной суспензии добавляли 0.33 ммоль DCC и 0.33 ммоль NHS. После суспензию подвергали озвучиванию на ультразвуковом диспергаторе в течение 1 секунды. Время активации 15 минут. Активированный образец дважды промывался ДМСО и еще трижды дистиллированной водой. К полученному образцу прибавляли 0.002 ммоль биомолекулы HrP. Время присоединения белковых молекул 20 мин. Далее проводилась промывка образца трижды водой и еще трижды фосфатным буфером.
Пример 7: 0,02 г (0,063 ммоль) 4-карбоксибензолдиазоний тозилата растворяют в 15 мл дистиллированной воды, добавляют 0,03 г (0,5 ммоль) наноразмерных частиц железа, покрытых углеродной оболочкой, затем реакционную смесь интенсивно перемешивают и оставляют при комнатной температуре. Последующая спонтанная функционализация наноразмерных частиц происходит в течение 30 минут. Из реакционной смеси продукт выделяют при помощи магнита, избыток 4-карбоксибензолдиазоний тозилата сначала отмывают дистиллированной водой, а затем метиловым спиртом, ацетоном и сушат на воздухе. Далее промытый образец функционализированных наночастиц (3 мг) суспензировали в 1 мл дистиллированной воды. К полученной суспензии добавляли 0.33 ммоль EDC и 0.33 ммоль NHS. После суспензию подвергали озвучиванию на ультразвуковом диспергаторе в течение 1 секунды. Время активации 15 минут. Активированный образец трижды промывался дистиллированной водой. К полученному образцу прибавляли 0.002 ммоль белковых молекул HrP. Время присоединения белковых молекул 30 минут. Далее проводилась промывка образца трижды дистиллированной водой.
Пример 8: 0,02 г (0,063 ммоль) 4-карбоксибензолдиазоний тозилата растворяют в 15 мл дистиллированной воды, добавляют 0,03 г (0,5 ммоль) наноразмерных частиц железа, покрытых углеродной оболочкой, затем реакционною смесь интенсивно перемешивают и оставляют при комнатной температуре. Последующая спонтанная функционализация наноразмерных частиц происходит в течение 30 минут. Из реакционной смеси продукт выделяют при помощи магнита, избыток 4-карбоксибензолдиазоний тозилата сначала отмывают дистиллированной водой, а затем метиловым спиртом, ацетоном и сушат на воздухе. К промытому образцу функционализированных наночастиц (3 мг) после промывки прибавлялось 1,5 мл дистиллированной воды. К полученной суспензии добавляли 0.33 ммоль DCC и 0.33 ммоль NHS. После суспензию подвергали озвучиванию на ультразвуковом диспергаторе в течение 1 секунды. Время активации 15 минут. Активированный образец промывался трижды дистиллированной водой. К полученному образцу прибавляли 0.002 ммоль белковых молекул HrP. Время присоединения белковых молекул 20 мин. Далее проводилась промывка образца трижды дистиллированной водой.
Таким образом, сочетание функционализации поверхности магнитоуправляемых наночастиц железа, покрытых углеродной оболочкой, с использованием 4-карбоксибензолдиазоний тозилата и последующая карбодиимидная активация COOH-группы позволяет иммобилизировать белковые молекулы на поверхности магнитоуправляемых наночастиц железа, покрытых углеродной оболочкой.
Способ иммобилизации белковых молекул на поверхности магнитоуправляемых наночастиц железа, покрытых углеродной оболочкой, включающий взаимодействие порошка с растворенным в воде 4-карбоксибензолдиазоний тозилатом для формирования ковалентной связи органических функциональных групп с поверхностью порошка наночастиц железа, покрытых углеродной оболочкой, дополнительно проводят карбодиимидную активацию с использованием систем: дициклогексилкарбодиимида с N-гидроксисукцинимидом в диметилсульфоксиде (DCC/NHS в ДМСО) или 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид с N-гидроксисукцинимидом в воде (EDC/NHS в H2O) или фосфатном буферном растворе, осуществляют ковалентную «сшивку» белковых молекул с активированной COOH-группой в водной или буферной среде.