Производные аминоалканолов, способ получения аминоалканолов и их применение
Иллюстрации
Показать всеИзобретение относится к новым производным аминоалканолов, которые могут быть использованы для изготовления лекарства, которое применяется при профилактике, предотвращении и/или лечении заболеваний или симптомов неврологического происхождения, в частности эпилепсии. При этом соединения выбраны из R,S-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанола, R,S-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол гидрохлорида, R-(-)-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанола, R-(-)-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол гидрохлорида, S-(+)-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанола, R,S-2N-[(2,6-диметилфенокси)ацетил]амино-1-пропанола, R-(+)-2N-[(2,6-диметилфенокси)ацетил]амино-1-пропанола, S-(-)-2N-[(2,6-диметилфенокси)ацетил]амино-1-пропанола, R,S-1N-[(2-хлор-6-метилфенокси)ацетил]амино-2-бутанола. Изобретение также относится к способу получения указанных соединений. 4 н. и 3 з.п. ф-лы, 6 ил., 6 табл., 4 пр.
Реферат
Предметом данного изобретения является группа новых производных аминоалканолов, а именно [(фенокси)алкил]аминоалканолы и [(фенокси)ацил]аминоалканолы, способ их получения и их применение для изготовления лекарства, которое используется при профилактике, предупреждении и/или лечении заболеваний или симптомов, имеющих неврологическое происхождение, и для изготовления лекарства с противосудорожной активностью, которое используется при припадках разного происхождения, также возникающих в лимбической системе, при миоклонических или вызванных звуком припадках, при психомоторной эпилепсии, а также облегчении невропатической или воспалительной боли.
Обзор литературы, касающейся биологической активности в группе аминоалканолов, указывает на возможность выбора соединений, обнаруживающих противосудорожные свойства, например из числа лекарственных средств, стабилизирующих электрический потенциал клеток, проявляющих свою собственную электрическую активность. Примером является пропранолол, так как он проявляет полезные свойства при лечении гипертонии и аритмии, а также он обладает свойствами предотвращения некоторых видов припадков [1]. Похожий профиль можно наблюдать у мексилетина, проявляющего защитное действие при припадках, вызванных МЭШ (максимальным электрошоком), ScMet (подкожным введением пентилентетразола) и звуком [2]. Важно, что механизм, ответственный за подавление припадков и у пропранолола, и у мексилетина, главным образом заключается в ингибировании потенциалзависимых натриевых каналов, тогда как при лечении аритмии оба лекарства действуют по-разному: посредством антагонизма β-адренергических рецепторов или через открытие калиевых каналов, соответственно [3]. Однако возможность использования мексилетина при лечении эпилепсии очень низка вследствие того факта, что он понижает судорожный порог при дозе не намного выше ЭД50 (максимальный электрошок МЭШ, мыши, внутрибрюшинное введение), несмотря на ингибирование фокальных эпилептических припадков. Данная активность обуславливает необходимость осуществления теста на тоническое снижение порога (ТТЕ от threshold tonic extension) при предварительных фармакологических анализах для всех веществ подобной структуры, обнаруживающих противосудорожную активность, чтобы исключить эту опасную проконвульсивную активность [4]. Более того, при лечении эпилепсии применение лекарственных средств, подобных пропранололу или мексилетину, также оказывающих активность на сердце, неправомерно. Следовательно, должны быть созданы новые структуры таким образом, чтобы они были активными в центральной нервной системе (ЦНС), не влияя на сердечно-сосудистую систему (ССС).
Поэтому основная задача данного изобретения состояла в создании новых химических соединений, которые полезны при лечении, особенно при лечении или предотвращении заболеваний или симптомов неврологического происхождения. Изобретение относится к группе замещенных производных аминоалканолов, предпочтительно (фенокси)алкил- и [(фенокси)ацетил]аминоалканолам, их фармацевтически приемлемым солям и пролекарствам, пригодным для применения при лечении или предотвращении заболеваний неврологического происхождения. Новые соединения, описанные в данной патентной заявке, проявляют противосудорожную активность на различных моделях припадков, включая припадки, вызванные максимальным электрошоком (МЭШ, мыши, крысы), припадки при гиппокампальном киндлинге (крысы), и содержат некоторые элементы структур (аминоалканольные группировки, ароксиалкильную группу) некоторых известных лекарственных средств, используемых при лечении аритмии (пропранолол, мексилетин), которые проявляют доказанную противосудорожную активность [1, 2]. Общим типичным признаком активности новых веществ, а также упомянутых антиаритмических лекарственных средств является влияние на клетки, проявляющие свою собственную электрическую активность (нервные клетки). Однако антиаритмические лекарственные средства действуют на центральную и периферическую нервную систему, а соединения, представленные в данном изобретении, из-за их липофильности - главным образом в пределах ЦНС.
В настоящем изобретении было достигнуто воплощение этой изложенной задачи и решены проблемы, связанные с профилактикой, предотвращением и/или лечением заболеваний или симптомов неврологического происхождения. Данная определенная цель неожиданно была достигнута с помощью настоящего изобретения.
Предметом данного изобретения является производное аминоалканолов формулы
где R1 представляет собой СН3, Н или Cl,
R2 представляет собой СН3, Н или Cl,
R3 представляет собой СН3, Н или Cl,
n представляет собой целое число от 1 до 5, предпочтительно от 1 до 3,
Х представляет собой
где Z представляет собой аминоалканол
или
где Z представляет собой аминоалканол или аминокислоту, за исключением соединения, выбранного из группы, включающей:
2-[(4-метилфенокси)этил]амино-1-бутанол,
2-[(4-метилфенокси)этил]амино-1-пропанол,
1-[(4-метилфенокси)этил]амино-2-бутанол,
1-[(4-метилфенокси)этил]амино-2-пропанол,
2-[(4-метилфенокси)этил]амино-2-метил-1-пропанол,
2-[(2,6-диметилфенокси)этил]амино-1-бутанол,
R,S-2-[(2,6-диметилфенокси)этил]амино-1-пропанол,
1-[(2,6-диметилфенокси)этил]амино-2-бутанол,
1-[(2,6-диметилфенокси)этил]амино-2-пропанол,
2-[(2,6-диметилфенокси)этил]амино-2-метил-1-пропанол,
R,S-2-[(2,6-диметилфенокси)этил]амино-1-бутанол гидрохлорид,
R-(-)-2-[(2,6-диметилфенокси)этил]амино-1-бутанол гидрохлорид,
S-(+)-2-[(2,6-диметилфенокси)этил]амино-1-бутанол гидрохлорид,
S-(+)-2N-[(2,6-диметилфенокси)этил]-2N-метиламино-1-бутанол,
R,S-1-[(2,6-диметилфенокси)этил]амино-2-пропанол,
R-(-)-1-[(2,6-диметилфенокси)этил]амино-2-пропанол,
S-(+)-1-[(2,6-диметилфенокси)этил]амино-2-пропанол,
R,S-2-[(4-метилфенокси)этил]амино-1-бутанол гидрохлорид,
R-(-)-2-[(4-метилфенокси)этил]амино-1-бутанол гидрохлорид,
S-(+)-2-[(4-метилфенокси)этил]амино-1-бутанол гидрохлорид,
R,S-2-[(4-метилфенокси)этил]амино-1-пропанол гидрохлорид,
R,S-2-[(4-метилфенокси)этил]амино-2-метил-1-пропанол гидрохлорид,
D,L-транс-2-[(4-метилфенокси)этил]амино-1-циклогексанол гидрохлорид,
R,S-1-[(4-хлор-3-метилфенокси)ацетил]амино-2-пропанол,
R,S-1-[(4-хлор-3-метилфенокси)ацетил]амино-2-бутанол,
R-(+)-2-[(4-хлор-3-метилфенокси)ацетил]амино-1-бутанол,
S-(-)-2-[(4-хлор-3-метилфенокси)ацетил]амино-1-бутанол,
R,S-2-[(4-хлор-3-метилфенокси)ацетил]амино-1-фенилэтанол,
R,S-2-[(2-хлор-S-метилфенокси)ацетил]амино-1-пропанол,
R,S-2-[(2-хлор-S-метилфенокси)ацетил]амино-1-бутанол,
R,S-2-[(2-хлор-S-метилфенокси)ацетил]амино-2-метил-1-пропанол,
R,S-2-[(4-хлор-3-метилфенокси)этил]амино-1-бутанол гидрохлорид,
R-(-)-2-[(4-хлор-3-метилфенокси)этил]амино-1-бутанол гидрохлорид,
S-(+)-2-[(4-хлор-3-метилфенокси)этил]амино-1-бутанол гидрохлорид,
R,S-1-[(4-хлор-3-метилфенокси)этил]амино-2-бутанол гидрохлорид,
R,S-2-[(2-хлор-S-метилфенокси)этил]амино-1-пропанол,
R,S-2-[(2-хлор-S-метилфенокси)этил]амино-1-бутанол,
2-[(2-хлор-S-метилфенокси)этил]амино-2-метил-1-пропанол,
R,S-1-[(4-хлор-2-метилфенокси)ацетил]амино-2-пропанол,
R,S-1-[(4-хлор-2-метилфенокси)ацетил]амино-2-бутанол,
R,S-2-[(4-хлор-2-метилфенокси)ацетил]амино-1-бутанол,
R,S-2-[(4-хлор-2-метилфенокси)ацетил]амино-1-фенилэтанол,
метиловый эфир D,L-2N-[(4-хлор-2-метилфенокси)ацетил]аланина,
R,S-1-[(4-хлор-2-метилфенокси)этил]амино-2-пропанол,
R,S-2-[(4-хлор-2-метилфенокси)этил]амино-1-пропанол,
2-[(4-хлор-2-метилфенокси)этил]амино-2-метил-1-пропанол,
R,S-1-[(4-хлор-2-метилфенокси)этил]амино-2-бутанол,
R,S-2-[(4-хлор-2-метилфенокси)этил]амино-1-бутанол,
R,S-2-[(4-хлор-2-метилфенокси)этил]амино-1-фенилэтанол,
D,L-транс-2-[(4-метилфенокси)этил]амино-1-циклогексанол,
R,S-2-[(4-метилфенокси)этил]амино-1-пропанол гидрохлорид,
S-(+)-2-[(2,6-диметилфенокси)этил]амино-1-пропанол гидрохлорид,
2-[(2,6-диметилфенокси)этил]амино-2-метил-1-пропанол гидрохлорид,
2-[(4-метилфенокси)этил]амино-2-метил-1-пропанол гидрохлорид,
R,S-1-[(4-хлор-3-метилфенокси)этил]амино-2-бутанол гидрохлорид,
R-(-)-2-[(4-метилфенокси)этил]амино-1-бутанол гидрохлорид,
S-(+)-2-[(4-метилфенокси)этил]амино-1-бутанол гидрохлорид,
S-(+)-2N-[(2,6-диметилфенокси)этил]-2N-метиламино-1-бутанол гидрохлорид,
S-(+)-1-[(2,6-диметилфенокси)этил]амино-2-пропанол.
Предпочтительно, когда Х представляет собой
,
Z представляет собой аминоалканол, выбранный из группы, включающей:
2-амино-1-этанол, 3-амино-1-пропанол, 4-амино-1-бутанол, 5-амино-1-пентанол, 1-амино-2-пропанол, 2-амино-1-пропанол, 1-амино-2-бутанол, 2-амино-1-бутанол, 2-амино-1-фенилэтанол, 2-амино-2-метил-1-пропанол, 2-амино-2-метил-1,3-пропандиол, 3-метил-2-амино-1-бутанол, 3-метил-3-амино-1-бутанол, D,L-транс-1,2-циклогексаноламин, транс-1,4-цикпогексаноламин, N-метиламиноэтанол, N-этиламиноэтанол, N-метил-2-амино-1-бутанол, N-метил-2-амино-1-пропанол, N-метил-2-амино-1-фенилэтанол, L-трео-2-амино-1-фенил-1,3-пропандиол.
Предпочтительно, когда Х представляет собой
Z представляет собой аминоалканол или аминокислоту, выбранные из группы, включающей:
2-амино-1-этанол, 3-амино-1-пропанол, 4-амино-1-бутанол, 5-амино-1-пентанол, 1-амино-2-пропанол, 2-амино-1-пропанол, 1-амино-2-бутанол, 2-амино-1-бутанол, 2-амино-1-фенилэтанол, 2-амино-2-метил-1-пропанол, 2-амино-2-метил-1,3-пропандиол, 3-метил-2-амино-1-бутанол, 3-метил-3-амино-1-бутанол, D,L-транс-1,2-циклогексаноламин, транс-1,4-циклогексаноламин, N-метиламиноэтанол, N-этиламиноэтанол, N-метил-2-амино-1-бутанол, N-метил-2-амино-1-пропанол, N-метил-2-амино-1-фенилэтанол, L-трео-2-амино-1-фенил-1,3-пропандиол, глицин или глицинамид, или глициновый эфир, аланин или аланинамид, или аланиновый эфир, 2-амино- и 4-аминомасляную кислоту, или соответствующий амид или эфир.
Предпочтительно соединение выбрано из группы, включающей:
R,S-2N-[(2,3-диметилфенокси)этил]амино-1-пропанол (1)
D,5-2N-[(2,3-диметилфенокси)этил]амино-1-бутанол (2)
2N-[(2,3-диметилфенокси)этил]амино-2-метил-1-пропанол (3)
R,S-2N-[(2,3-диметилфенокси)этил]амино-1-фенилэтанол (4)
R,S-1N-[(2,5-диметилфенокси)этил]амино-2-пропанол (5)
R,S-2N-[(2,5-диметилфенокси)этил]амино-1-пропанол (6)
R,S-1N-[(2,5-диметилфенокси)этил]амино-2-бутанол (7)
R,S-2N-[(2,5-диметилфенокси)этил]амино-1-бутанол (8)
R,S-2N-[(2,5-диметилфенокси)этил]амино-1-фенилэтанол (9)
R-(-)-1N-[(2,6-диметилфенокси)этил]амино-2-пропанол (10)
R,S-2N-[(2,6-диметилфенокси)этил]амино-1-пропанол (11)
R,S-2N-[(2,6-диметилфенокси)этил]амино-1-пропанол гидрохлорид (11а)
R-(-)-2N-[(2,6-диметилфенокси)этил]амино-1-пропанол (12)
R-(-)-2N-[(2,6-диметилфенокси)этил]амино-1-пропанол гидрохлорид (12а)
S-(+)-2N-[(2,6-диметилфенокси)этил]амино-1-пропанол (13)
S-(+)-2N-[(2,6-диметилфенокси)этил]амино-1-пропанол гидрохлорид (13а)
R,S-2N-[(2,6-диметилфенокси)этил]-2N-метиламино-1-пропанол гидрохлорид (14)
3N-[(2,6-диметилфенокси)этил]амино-3-метил-1-бутанол гидрохлорид (15)
L-2N-[(2,6-диметилфенокси)этил]амино-3-метил-1-бутанол гидрохлорид (16)
5N-[(2,6-диметилфенокси)этил]амино-1-пентанол гидрохлорид (17)
D,L-транс-2N-[(2,6-диметилфенокси)этил]амино-1-циклогексанол (18)
D,L-транс-2N-[(2,6-диметилфенокси)этил]амино-1-циклогексанол гидрохлорид (18а)
R,S-2N-[(2,6-диметилфенокси)этил]амино-1-фенилэтанол (19)
R-(-)-2N-[(2,6-диметилфенокси)этил]амино-1-фенилэтанол (20)
S-(+)-2N-[(2,6-диметилфенокси)этил]амино-1-фенилэтанол (21)
R,S-2N-[(2,6-диметилфенокси)этил]-2N-метиламино-1-фенилэтанол гидрохлорид (22)
R,S-1N-[(2-хлор-6-метилфенокси)этил]амино-2-пропанол (23)
R,S-2N-[(2-хлор-6-метилфенокси)этил]амино-1-пропанол (24)
R,S-1N-[(2-хлор-6-метилфенокси)этил]амино-2-бутанол (25)
R,S-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол (26)
R,S-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол гидрохлорид (26а)
R-(-)-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол (27)
S-(+)-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол (28)
2N-[(2-хлор-6-метилфенокси)этил]амино-2-метил-1,3-пропандиол (29)
D,L-транс-2N-[(2-хлор-6-метилфенокси)этил]амино-1-циклогексанол (30)
R,S-2N-[(2-хлор-6-метилфенокси)этил]амино-1-фенилэтанол (31)
R,S-1N-[(4-хлор-2-метилфенокси)этил]амино-2-пропанол (32)
R,S-2N-[(4-хлор-2-метилфенокси)этил]амино-1-пропанол (33)
R,S-1N-[(4-хлор-2-метилфенокси)этил]амино-2-бутанол (34)
R,S-2N-[(4-хлор-2-метилфенокси)этил]амино-1-бутанол (35)
2N-[(4-хлор-2-метилфенокси)этил]амино-2-метил-1-пропанол (36)
R,S-2N-[(4-хлор-2-метилфенокси)этил]амино-1-фенилэтанол (37)
R,S-2N-[(2,3,5-триметилфенокси)этил]амино-1-пропанол (38)
R,S-2N-[(2,3,5-триметилфенокси)этил]амино-1-бутанол (39)
R-(-)-2N-[(2,3,5-триметилфенокси)этил]амино-1-бутанол (40)
S-(+)-2N-[(2,3,5-триметилфенокси)этил]амино-1-бутанол (41)
R,S-2N-[(2,3,5-триметилфенокси)этил]амино-1-фенилэтанол гидрохлорид (42)
R-(-)-2N-[(2,4,6-триметилфенокси)этил]амино-1-пропанол (43)
D,L-транс-2N-[(2,4,6-триметилфенокси)этил]амино-1-циклогексанол (44)
R,S-2N-[(2,4,6-триметилфенокси)этил]амино-1-фенилэтанол (45)
R,S-2N-[(2,3-диметилфенокси)пропил]амино-1-пропанол (46)
2N-[(2,3-диметилфенокси)пропил]амино-2-метил-1-пропанол (47)
R,S-2N-[(2,3-диметилфенокси)пропил]амино-1-бутанол (48)
R,S-2N-[(2,3-диметилфенокси)пропил]амино-1-фенилэтанол (49)
R,S-1N-[(2,6-диметилфенокси)пропил]амино-2-пропанол (50)
R,S-2N-[(2,6-диметилфенокси)пропил]амино-1-пропанол (51)
R-(-)-2N-[(2,6-диметилфенокси)пропил]амино-1-пропанол гидрохлорид (52)
2N-[(2,6-диметилфенокси)пропил]амино-2-метил-1-пропанол (53)
R,S-1N-[(2,6-диметилфенокси)пропил]амино-2-бутанол (54)
R,S-2N-[(2,6-диметилфенокси)пропил]амино-1-бутанол гидрохлорид (55)
R,S-2N-[(2,6-диметилфенокси)пропил]амино-1-фенилэтанол (56)
R,S-2N-[(2-хлор-6-метилфенокси)пропил]амино-1-пропанол (57)
R,S-2N-[(2-хлор-6-метилфенокси)пропил]амино-1-бутанол гидрохлорид (58)
R,S-2N-[(2,6-диметилфенокси)ацетил]-2N-метиламино-1-этанол (59)
R,S-2N-[(2,6-диметилфенокси)ацетил]амино-1-пропанол (60)
R-(+)-2N-[(2,6-диметилфенокси)ацетил]амино-1-пропанол (61)
S-(-)-2N-[(2,6-диметилфенокси)ацетил]амино-1-пропанол (62)
R,S-1N-[(2,6-диметилфенокси)ацетил]амино-2-бутанол (63)
транс-4N-[(2,6-диметилфенокси)ацетил]амино-1-цикпогексанол (64)
D-2N-[(2,6-диметилфенокси)ацетил]аминопропионамид (65)
D,L-2N-[(2,6-диметилфенокси)ацетил]аминобутирамид (66)
N-метиламид D,L-2N-[(2,6-диметилфенокси)ацетил]аминопропионовой кислоты (67)
R,S-1N-[(2-хлор-6-метилфенокси)ацетил]амино-2-пропанол (68)
R,S-2N-[(2-хлор-6-метилфенокси)ацетил]амино-1-пропанол (69)
R-(-)-2N-[(2-хлор-6-метилфенокси)ацетил]амино-1-пропанол (70)
S-(+)-2N-[(2-хлор-6-метилфенокси)ацетил]амино-1-пропанол (71)
R,S-1 N-[(2-хлор-6-метилфенокси)ацетил]амино-2-бутанол (72)
R,S-2N-[(2-хлор-6-метилфенокси)ацетил]амино-1-бутанол (73)
D,L-N-[(2-хлор-6-метилфенокси)ацетил]аланин (74)
D-(+)-N-[(2-хлор-6-метилфенокси)ацетил]аланин (75)
L-(-)-N-[(2-хлор-6-метилфенокси)ацетил]аланин (76)
D,L-2N-[(2-хлор-6-метилфенокси)ацетил]аминомасляная кислота (77)
D,L-2N-[(2-хлор-6-метилфенокси)ацетил]аминобутирамид (78)
4N-[(2-хлор-6-метилфенокси)ацетил]аминомасляная кислота (79)
R,S-1N-[(4-хлор-2-метилфенокси)ацетил]амино-2-пропанол (80)
R,S-1N-[(4-хлор-2-метилфенокси)ацетил]амино-2-бутанол (81)
R,S-2N-[(4-хлор-2-метилфенокси)ацетил]амино-1-фенилэтанол (82)
R,S-2N-[(2,4,6-триметилфенокси)ацетил]амино-1-фенилэтанол (83).
Другим предметом данного изобретения является применение производного аминоалканолов формулы
где R1 представляет собой СН3, Н или Cl,
R2 представляет собой СН3, Н или Cl,
R3 представляет собой СН3, Н или Cl,
n представляет собой целое число от 1 до 5, предпочтительно от 1 до 3,
Х представляет собой
, где Z представляет собой аминоалканол
или
, где Z представляет собой аминоалканол или аминокислоту, за исключением соединения, выбранного из группы, включающей:
2-[(4-метилфенокси)этил]амино-1-бутанол,
2-[(4-метилфенокси)этил]амино-1-пропанол,
1-[(4-метилфенокси)этил]амино-2-бутанол,
1-[(4-метилфенокси)этил]амино-2-пропанол,
2-[(4-метилфенокси)этил]амино-2-метил-1-пропанол,
2-[(2,6-диметилфенокси)этил]амино-1-бутанол,
R,S-2-[(2,6-диметилфенокси)этил]амино-1-пропанол,
1-[(2,6-диметилфенокси)этил]амино-2-бутанол,
1-[(2,6-диметилфенокси)этил]амино-2-пропанол,
2-[(2,6-диметилфенокси)этил]амино-2-метил-1-пропанол,
для изготовления лекарства или пролекарства, которое применяется при профилактике, предотвращении и/или лечении заболеваний или симптомов неврологического происхождения.
Используемое производное предпочтительно является соединением согласно описанным выше соединениям.
Используемое производное предпочтительно является соединением, выбранным из:
R-(-)-2-[(2,6-диметилфенокси)этил]амино-1-пропанола,
S-(+)-2-[(2,6-диметилфенокси)этил]амино-1-пропанола, предпочтительно R-(-)-2-[(2,6-диметилфенокси)этил]амино-1-пропанол,
R,S-2-[(2-хлор-6-метилфенокси)этил]амино-1-бутанола,
R-(-)-2-[(2-хлор-6-метилфенокси)этил]амино-1-бутанола,
S-(+)-2-[(2-хлор-6-метилфенокси)этил]амино-1-бутанола,
предпочтительно R-(-)-2-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол,
R,S-2-[(2,6-диметилфенокси)ацетил]амино-1-пропанола,
R-(+)-2-[(2,6-диметилфенокси)ацетил]амино-1-пропанола,
S-(-)-2-[(2,6-диметилфенокси)ацетил]амино-1-пропанола,
более предпочтительно R-(+)-2-[(2,6-диметилфенокси)ацетил]амино-1-пропанол.
Заболевание или симптом неврологического происхождения предпочтительно представляет собой эпилепсию, особенно большой эпилептический припадок, психомоторную эпилепсию, фокальные эпилептические припадки, эпилептический статус, миоклонические припадки или припадки различного происхождения (вызванные звуком, светом, химическим раздражителем, нейрональным повреждением, генетического происхождения), а также невропатическую или воспалительную боль.
Предпочтительно, когда изготовленное лекарственное средство является болеутоляющим, противовоспалительным, противосудорожным или противоэпилептическим.
Предпочтительно, когда соединение, выбранное из группы, включающей:
2-[(4-метилфенокси)этил]амино-1-бутанол,
2-[(4-метилфенокси)этил]амино-1-пропанол,
1-[(4-метилфенокси)этил]амино-2-бутанол,
1-[(4-метилфенокси)этил]амино-2-пропанол,
2-[(4-метилфенокси)этил]амино-2-метил-1-пропанол,
2-[(2,6-диметилфенокси)этил]амино-1-бутанол,
R,S-2-[(2,6-диметилфенокси)этил]амино-1-пропанол,
1-[(2,6-диметилфенокси)этил]амино-2-бутанол,
1-[(2,6-диметилфенокси)этил]амино-2-пропанол,
2-[(2,6-диметилфенокси)этил]амино-2-метил-1-пропанол,
используется для изготовления лекарства или пролекарства с противосудорожной активностью, которое применяется в противосудорожной терапии для лечения связанных или несвязанных с эпилепсией припадков, парциальных и генерализованных тонико-клонических припадков (большой эпилептический припадок), тонических судорог, клонических судорог, миоклонических судорог, припадков, возникающих в лимбической системе, психомоторной эпилепсии, фармакорезистентной эпилепсии или эпилепсии другого происхождения, а также облегчения невропатической или воспалительной боли.
Предпочтительно, когда заболевание или симптом представляет собой невропатическую боль, включая боль различной этиологии: диабетическую невропатию, раковую боль, невропатию при СПИДе, повреждение спинного мозга, фантомную боль в ампутированных конечностях или фибромиалгию.
Другим предметом данного изобретения является способ получения производных аминоалканолов, предпочтительно [(фенокси)алкил]аминоалканолов согласно пунктам формулы изобретения 1-4, отличающийся тем, что осуществляют N-алкилирование указанных аминоалканолов с соответствующими (фенокси)алкилбромидами, добавляя 0,010-0,015 моль соответствующего (фенокси)этил или 3-(фенокси)пропилбромида в 100 мл колбу, затем 0,010-0,015 моль соответствующего аминоалканола и избыток безв. К2СО3, затем смесь нагревают с обратным холодильником в толуоле в течение приблизительно 3-15 часов и охлаждают, после чего добавляют силикагель и смесь опять нагревают, гель и выпавший в осадок КВг отфильтровывают и оставшуюся смесь перегоняют до маслянистого остатка, затем добавляют 10-20% HCl и активированный уголь и смесь нагревают, после чего суспензию отфильтровывают и фильтрат подщелачивают 5-20% NaOH, чтобы осадить свободное основание, которое экстрагируют бензолом или толуолом, органическую фазу высушивают (безв. MgSO4) и органический растворитель отгоняют до маслянистого остатка, который кристаллизуют.
Следующим предметом данного изобретения является способ получения аминоалканолов, предпочтительно [(фенокси)ацил]аминоалканолов согласно пунктам формулы изобретения 1-4, отличающийся тем, что осуществляют N-ацетилирование указанных аминоалканолов или гидрохлорида сложных эфиров аминокислот с применением хлорангидрида соответствующей (фенокси)карбоновой кислоты в двухфазной среде (толуол/вода) в присутствии К2СО3, где 0,015-0,025 моль соответствующего аминоалканола в 30 мл толуола помещают в колбу, добавляют избыток К2СО3, растворяют в 50 мл воды, смесь охлаждают и перемешивают, затем к смеси добавляют небольшие количества раствора соответствующего хлорангидрида (фенокси)уксусной кислоты в толуоле и эмульсию перемешивают около 0,5 часа, и затем нагревают, после охлаждения органическую фазу отделяют и высушивают с безв. MgSO4, затем растворитель отгоняют и остаток кристаллизуют до белого осадка соответствующего производного.
Приложенные Фигуры способствуют лучшему пониманию и представлению сущности настоящего изобретения.
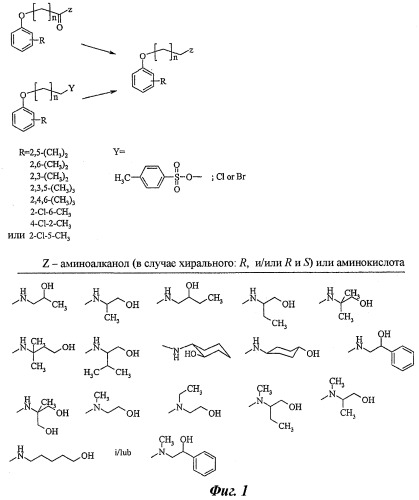
Фигура 1 представляет схему синтеза [(фенокси)алкил]аминоалканолов.
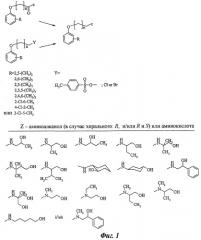
Фигура 2 представляет схему синтеза [(фенокси)ацетил]аминоалканолов.
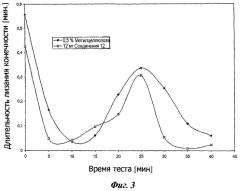
Фигура 3 представляет результаты формалинового теста для R-(-)-2-[(2,6-диметилфенокси)этил]амино-1-пропанола.
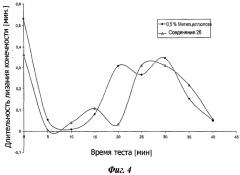
Фигура 4 представляет результаты формалинового теста для R,S-2-[(2-хлор-6-метилфенокси)этил]амино-1-бутанола.
Фигура 5 представляет результаты сравнения чувствительности к боли у мышей после введения соединения 26 и известных лекарственных средств.
Фигура 6 представляет результаты для соединения 27.
Ниже представлены примеры воплощений настоящего изобретения, описанного выше.
Пример 1. Классификация соединений по изобретению и основные схемы их синтеза.
Новые соединения по изобретению определены с помощью формулы 1, а также их фармацевтически приемлемые соли и пролекарства. Обычно в изобретении указаны две подгруппы производных аминоалканолов: замещенные [(фенокси)алкил]аминоалканолы (формула 1) и замещенные [(фенокси)ацетил]аминоалканолы (формула 2).
Формула 1
| R | Z - аминоалканол |
| - 2,5-(СН3)2 | - 6-амино-1-пентанол |
| - 2,6-(СН3)2 | - 1-амино-2-пропанол |
| - 2,3-(СН3)2 | - 2-амино-1-пропанол |
| - 2,3,5-(СН3)3 | - 1-амино-2-бутанол |
| - 2,4,6-(СН3)3 | - 2-амино-1-бутанол |
| - 2-Cl, 6-СН3 | - 2-амино-1-фенилэтанол |
| - 4-Cl, 2-СН3 | - 2-амино-2-метил-1-пропанол |
| - 2-Cl, 5-СН3 | - 2-амино-2-метил-1,3-пропандиол |
| - 3-метил-2-амино-1-бутанол | |
| - 3-метил-3-амино-1-бутанол | |
| - D,L-транс-1,2-циклогексаноламин | |
| - N-метил-2-амино-1-бутанол | |
| - N-метил-2-амино-1-пропанол | |
| - N-метил-2-амино-1-фенилэтанол |
Синтез [(фенокси)алкил]аминоалканолов (Фиг.1).
Реакции синтеза соответствующих [(фенокси)алкил]аминоалканолов осуществляли несколькими способами, т.е.:
1) аминолизом толуолсульфоната соответствующих (фенокси)алканолов [5];
2) N-алкилированием соответствующих аминоалканолов с использованием подходящих (фенокси)алкилбромидов, опубликованных на предфинальной стадии, которая была модифицирована [5];
3) восстановлением соответствующих [(фенокси)ацетамидо]алканолов до соответствующих аминов с использованием LiAlH4 в диэтиловом эфире/N2 [6].
Некоторые соединения получали в форме гидрохлоридов, используя насыщенный раствор HCl в этаноле или используя газ HCl, после чего осуществляли кристаллизацию из смеси этилацетата/EtOH (3:1).
Чтобы получить соединения, являющиеся рацематами или энантиомерами, использовали имеющиеся в продаже аминоалканолы за исключением R,S-1-амино-2-бутанола, R-(-)- и S-(+)-2-амино-1-бутанола, а также D,L-транс-циклогексаноламина [7]. Некоторые необходимые реагенты могут быть получены согласно ранее опубликованным процедурам [5, 7, 8].
Формула 2
| R | Z - аминоалканол или аминокислота: |
| - 2,5-(СН3)2 | - 1-амино-2-пропанол |
| - 2,6-(СН3)2 | - 2-амино-1-пропанол |
| - 2,3-(СН3)2 | - 1-амино-2-бутанол |
| - 2,3,5-(СН3)3 | - 2-амино-1-бутанол |
| - 2,4,6-(СН3)3 | - 2-амино-1-фенилэтанол |
| - 2-Cl, 6-СН3 | - 2-амино-2-метил-1-пропанол |
| - 4-Cl, 2-СН3 | - 2-амино-2-метил-1,3-пропандиол |
| - 2-Cl, 5-СН3 | - 3-метил-2-амино-1-бутанол |
| - 3-метил-3-амино-1-бутанол | |
| - транс-1,4-циклогексаноламин | |
| - N-метиламиноэтанол | |
| - N-метил-2-амино-1-бутанол | |
| - N-метил-2-амино-1-пропанол | |
| - N-метил-2-амино-1-фенилэтанол | |
| - глицин, или глицинамид, или эфир | |
| - аланин, или аланинамид, или эфир | |
| - 2-амино- или 4-аминомасляная кислота, или соответствующий амид или эфир |
Синтез [(фенокси)ацетил]аминоалканолов или [(фенокси)ацетил]аминокислот и некоторых их производных (Фиг.2).
1) N-Ацетилирование соответствующих аминоалканолов или гидрохлорида сложных эфиров аминокислот осуществляют с применением хлорангидрида соответствующей (фенокси)карбоновой кислоты в двухфазной среде (толуол/вода) в присутствии К2СО3 [6]. Продукт реакции получают в ходе отделения органической фазы, промывая 10% NaHCO3, высушивая и выпаривая до остатка, который затем кристаллизуют из смеси н-гептана/толуола (1:2). В случае соответствующих эфиров амидокислот их дополнительно гидролизовали, используя 10% NaHCO3, подкисляли и кристаллизовали (Фиг.2).
Необходимые феноксикарбоновые кислоты получают в ходе O-алкилирования подходящего фенола (например, фенолята натрия) с использованием подходящей галогенкарбоновой кислоты в форме натриевой соли. Использовали имеющиеся в продаже кислоты (в форме сложных эфиров).
2) Альтернативным и подходящим способом является реакция смешанных ангидридов с применением метилхлорформиата с триэтиламином.
3) Другой используемый способ синтеза представляет собой азеотропную дегидратацию аммониевой соли соответствующей (фенокси)карбоновой кислоты с подходящим аминоалканолом.
4) Другой способ, используемый для получения некоторых алканоламидов, представляет собой синтез с применением соответствующих (фенокси)карбоновой кислоты и аминоалканола в присутствии триэтиламина и ВОР ((бензотриазол-1-илокситрис)диметиламинофосфония гексафторфосфата).
5) Чтобы получить некоторые (фенокси)ацетильные производные аминокислот, использовали способ окисления спиртовой группы (из ранее полученных [(фенокси)ацетил]аминоалканолов) (Фиг.2).
Пример 2. Описание синтеза конкретных продуктов
2.1 Синтез 2,3-, 2,5; 2,6-диметил-, 2-хлор-6-метил- и 4-хлор-2-метил-, 2,3,5- и (2,4,6-триметилфенокси)этанола или соответствующего 3-(фенокси)-1-пропанола
Раствор этанолята натрия получали в 750 мл круглодонной колбе (0,5 моль натрия растворяли в этаноле), в которую добавляли 0,5 моль соответствующего фенола. Смесь нагревали с обратным холодильником и в точке кипения добавляли по каплям около 3 часов раствор 2-бром- или 2-хлорэтанола (или 3-хлор-1-пропанола). После чего смесь нагревали в течение еще 2 часов и охлаждали. Выпавшую в осадок белую гущу (NaBr или NaCl) отфильтровывали и фильтрат перегоняли до маслянистого остатка. К остатку добавляли 200 мл воды и 10% раствор NaOH (чтобы освободиться от оставшегося фенола). Затем осуществляли экстракцию бензолом и органическую фазу дополнительно промывали 10% NaOH, водой и высушивали с безводным MgSO4. После перегонки растворителя получали маслянистый остаток. Неочищенный продукт использовали для дальнейшего бромирования.
2.2 Синтез 2,3-, 2,5-, 2,6-диметил-, 2-хлор-6-метил- и 4-хлор-2-метил-, 2,3,5- и (2,4,6-триметилфенокси)алкилбромидов
0,15 моль соответствующего производного (фенокси)этанола или (фенокси)пропанола помещали в 100 мл круглодонную колбу и медленно добавляли 0,05 моль PBr3. Смесь нагревали в течение 1,5 часа с обратным холодильником на водяной бане. Затем смесь помещали в колбу со льдом и нейтрализовали 15% NaHCO3, после чего осуществляли экстракцию бензолом. После сушки органической фазы (безв. MgSO4) растворитель отгоняли и получали маслянистый остаток. Неочищенный продукт использовали для дальнейшего аминолиза.
2.3 Синтез 2,3-, 2,5-, 2,6-диметил-, 2-хлор-6-метил- и 4-хлор-2-метил-, 2,3,5- и [(2,4,6-триметилфенокси)алкил]аминоалканолов
0,012 моль соответствующего (фенокси)этил или 3-(фенокси)пропилбромида помещали в 100 мл круглодонную колбу. Затем 0,012 моль подходящего аминоалканола и избыток безв. K2CO3 добавляли. Смесь нагревали в толуоле с обратным холодильником в течение приблизительно 5 часов и охлаждали. После чего добавляли силикагель и опять смесь нагревали. Гель и выпавший в осадок KBr отфильтровывали и оставшуюся смесь перегоняли в маслянистый остаток. Затем добавляли 10% HCl и активированный уголь и смесь нагревали. После чего суспензию отфильтровывали и фильтрат подщелачивали 10% NaOH, чтобы осадить свободное основание, которое экстрагировали бензолом. Органическую фазу высушивали (безв. MgSO4) и органический растворитель отгоняли до маслянистого остатка, который кристаллизовали.
2.4 Синтез 2,6-диметил; 2,4,6-триметил-, 2-хлор-6-метил- и (4-хлор-2-метилфенокси)уксусной кислоты
Раствор 0,3 моль NaOH в 250 мл воды получали в 750 мл круглодонной колбе. Затем добавляли 0,3 моль соответствующего фенола. Отдельно в колбе получали 0,3 моль хлоруксусной кислоты в 300 мл 10% NaHCO3, смесь добавляли к прежде полученному раствору соответствующего фенолята натрия и нагревали с обратным холодильником в течение 1 часа. Затем добавляли активированный уголь, смесь отфильтровывали от суспензии и после охлаждения фильтрат подкисляли 10% HCl. Выпавшую в осадок кислоту, после фильтрации и сушки, кристаллизовали из смеси гептана/толуола (1:1) и потом получали белый кристаллический осадок.
2.5 Синтез хлорангидридов 2,6-диметил-, 2,4,6-триметил-, 2-хлор-6-метил- и (4-хлор-2-метилфенокси)уксусной кислоты
0,15 моль соответствующей (фенокси)уксусной кислоты помещали в 500 мл круглодонную колбу и добавляли 0,75 моль SOCl2 (d=1,63 г/см3), смесь нагревали с обратным холодильником около 30 минут. После чего избыток тионилхлорида отгоняли при пониженном давлении и к оставшемуся жидкому хлорангидриду добавляли толуол до 100 мл и раствор неочищенного хлорида использовали в реакциях с подходящим аминоалканолом.
2.6 Синтез 2,6-диметил; 2,4,6-триметил-, 2-хлор-6-метил- и [(4-хлор-2-метилфенокси)ацетил]аминоалканолов
0,02 моль соответствующего аминоалканола в 30 мл толуола помещали в колбу Эрленмейера, добавляли избыток K2CO3 и растворяли в 50 мл воды. Смесь охлаждали и включали устройство для электромагнитного перемешивания. К смеси добавляли небольшие количества раствора соответствующего хлорангидрида (фенокси)уксусной кислоты в толуоле, эмульсию перемешивали около 0,5 часа, после чего ее нагревали. После охлаждения органическую фазу отделяли и высушивали с безв. MgSO4. Затем растворитель отгоняли и остаток кристаллизовали до белого осадка соответствующего производного.
Пример 3. Физико-химические данные некоторых производных согласно данному изобретению
Физико-химические параметры (точка плавления Тпл, Rf для обычных элюентов, ИК и 1H ЯМР спектры и/или оптическое вращение [α]) были измерены для некоторых полученных соединений с помощью стандартных методов анализа.
R,S-2N-[(2,3-диметилфенокси)этил]амино-1-пропанол (1)
Тпл=76-78°С (толуол/гептан (1/1)); Rf=0,47 (СН3ОН); ИК (KBr, см-1) v: 3735, 3649, 3295, 3127, 2964, 2931, 2886, 2833, 2601, 2361, 2116, 1909, 1587, 1461, 1266, 771; 1Н-ЯМР: (δ ppm) 7.01 (dd, J=7.9, J=7.5, 1H, H-5); 6.77 (d, J=7.9, 1H, H-4); 6.74 (d, J=7.5, 1H, H-6); 4.54 (t, J=5.2, 1H, OH); 4.03-3.97 (m, 1H, C H _ H-OAr); 3.97-3.91 (m, 1H, CH H _ -OAr); 3.27-3.24 (m, 1H, C H _ H-OH); 3.24-3.17 (m, 1H, CH H _ -OH); 2.97-2.90 (m, 1H, C H _ H-N); 2.90-2.83 (m, 1H, CH H _ -N); 2.71-2.62 (m, 1H, СН); 2.20 (s, 3H, СН3-Ar (2)); 2.07 (s, 3H, СН3-Ar(3)); 1.89 (bs, 1H, NH); 0.92 (d, J=6.4, 3H, СН3).
R,S-2N-1(2,3-диметилфенокси)этил]амино-1-бутанол (2)
Тпл=55-56°С (толуол/гептан (1/1)); Rf=0,51 (СН3ОН); ИК (KBr, см-1) v: 3295, 3158, 2964, 2931, 2875, 2837, 1900, 1585, 1470, 1263, 1109, 1062, 762; [%]: N р а с ч . а н а л и з и р . : 5.90 5.82 ; С р а с ч . а н а л и з и р . : 70.86 70.76 ; H р а с ч . а н а л и з и р . : 9.77 9.76 .
2N-[(2,3-диметилфенокси)этил]амино-2-метил-1-пропанол (3)
Тпл=75-77°С (толуол/гептан (1/1)); Rf=0,44 (СН3ОН); ИК (KBr, см-1) v: 3295, 3154, 2986, 2971, 2926, 2877, 2827, 2756, 2557, 2359, 1584, 1464, 1263, 1068, 768; [%]: N р а с ч . а н а л и з и р . : 5.90 5.72 ; С р а с ч . а н а л и з и р . : 70.85 70.70 ; H р а с ч . а н а л и з и р . : 9.77 9.90 .
R,S-2N-[(2,3-диметилфенокси)этил]амино-1-фенилэтанол (4)
Тпл=118-120°С (толуол/гептан (1/1)); Rf=0,62 (СН3ОН); ИК (KBr, см-1) v. 3310, 3064, 3033, 2975, 2921, 2899, 2871, 2836, 2735, 2519, 2364, 1892, 1588, 1453, 1266, 1108, N р а с ч . а н а л и з и р . : 4.91 4.82 ; С р а с ч . а н а л и з и р . : 75.75 75.83 ; H р а с ч . а н а л и з и р . : 8.12 8.28