Способ получения адаптивно-селективного к редкоземельным металлам ионообменного материала
Иллюстрации
Показать всеИзобретение относится к области ионного обмена. Предложен способ получения адаптивно-селективного ионообменного материала, который включает приготовление темплатсодержащей фазы, мономерной смеси, введение мономерной смеси в приготовленную темплатсодержащую фазу при перемешивании и повышенной температуре. Полученные гранулы обрабатывают десорбирующим раствором с образованием пористого сшитого полимера с молекулярными отпечатками, имеющего полости заданного размера. Формирование молекулярных отпечатков проводят за счет образования химических связей катиона редкоземельного металла с функциональными группами аминометиленфосфиновых кислот, образующихся при взаимодействии уротропина, параформа и водного раствора фосфорноватистой кислоты. Техническим результатом является повышение селективности и сорбционной емкости по отношению к ионам редкоземельных металлов. 2 табл., 1 ил., 1 пр.
Реферат
Изобретение относится к области ионного обмена с комплексообразованием, хелатообразованием с использованием полимеров с ионными отпечатками и может быть использовано в гидрометаллургии редкоземельных металлов, в химической промышленности, а также для получения веществ особой чистоты [B01J 20/22, B01J 45/00].
Большинство известных ионообменных и сорбционных материалов проявляют пониженную селективность в процессах разделения смеси ионов металлов, что определяется различиями в стерической конфигурации, строении электронных оболочек сорбционных центров ионитов и сорбентов, количеством, видом и взаимным расположением комплексообразующих и хелатообразующих функциональных групп в структуре данных материалов. В большинстве же случаев требуется высокая селективность и сорбционная емкость при извлечении, концентрировании требуемого металла из сильно разбавленных водных растворов или в присутствии сильного солевого фона, обеспечиваемого примесями, например, в гидрометаллургии редких и рассеянных металлов.
Известен способ получения сорбента, селективного к ионам тяжелых металлов, например, к меди (II) (емкость по меди 4,2 мг-экв/г, время полуобмена 30 мин), включающий взаимодействие медного комплекса сополимера диэтилового эфира винилфосфоновой кислоты и акриловой кислоты с дивинильным структурирующим агентом при 150°C в течение 3 ч (SU 502907 A1, C08F 220/04, 15.02.76).
Недостатками данного способа являются получение продукта в форме рыхлых хлопьев, что приводит к последующему повышенному разрушению материала при эксплуатации, высокая энергоемкость синтеза, пониженная селективность к индивидуальным ионам металла за счет термодеструкции сорбционных центров при продолжительном нагревании при высоких температурах.
Известны селективные твердые сорбенты катионов эрбия из водных растворов, представляющие полимеры с ионными отпечатками редкоземельного металла эрбия (Er), и способ их получения, включающий сополимеризацию смеси функционального и сшивающего мономеров в присутствии ионов эрбия в форме четвертичного комплекса под действием γ-излучения, фотохимического или термического инициирования с последующим измельчением, просевом и выщелачиванием Er3+ минеральной кислотой (US 2005215762 A1, G02B 6/00, 29.09.2005).
Недостатками данных материалов является пониженная обменная емкость, обусловленная низкой концентрацией комплементарных сорбционных центров на единицу массы полимера, и плохие гидродинамические показатели материала, связанные с отсутствием сферичности гранул, ввиду использования механического измельчения продукта полимеризации.
Известен метод селективного разделения ионов тяжелых металлов с использованием полимера с отпечатками ионов металлов и способ их синтеза, включающий взаимодействие соли металла с мономером с образованием металлсодержащей мономерной группы с последующим смешением со сшивающим агентом, инициатором в растворителе и суспензионной или эмульсионной полимеризацией полученной смеси с дальнейшим выщелачиванием ионов металла из материала (US 20070191551 A1, C08F 292/00, 16.08.2007).
Недостатками данного способа являются невозможность селективного извлечения металлов, находящихся в растворе в анионной форме, а также низкая обменная емкость (например, 0,331 ммоль/г по Cu2+), что обусловлено проблемой создания в материале высокой концентрации центров специфичной сорбции с помощью данного метода, т.к. в условиях суспензионной или эмульсионной полимеризации гомогенизированной смеси наблюдается коалесценция (слияние) сорбционных центров с нарушением электронной и стерической структуры, а также образование исключенных сорбционных центров, заблокированных для доступа ионов из внешней среды.
Для селективного разделения ионов тяжелых металлов известен метод получения микросфер типа «ядро-оболочка», покрытых полимером с ионными отпечатками, включающий на первой стадии взаимодействие соли металла с мономером с последующим смешением со сшивающим агентом и инициатором с получением металлсодержащей мономерной смеси, которая далее на второй стадии адсорбируется на поверхности предварительно синтезированных полистирольных гранул с оболочкой из дибутилфталата с получением при нагревании целевых микросфер типа «ядро-оболочка», покрытых полимером с ионными отпечатками, которые на третьей стадии подвергаются выщелачиванию минеральной кислотой для удаления темплатных ионов металла (US 20080221248 A1, С08К 5/092, 11.09.2008).
Недостатками данного способа, несмотря на хорошую кинетику сорбции, являются длительность процесса синтеза (24 ч) и низкая селективность по целевым ионам металла: 69,7% по Cu2+, 62,9% по Ni2+, 55,7% по Pb2+, для полимеров с ионными отпечатками меди, никеля и свинца, соответственно. Еще одним недостатком является наличие в микросферах продукта балластной массы в виде инертного полистирольного ядра, не участвующего в извлечении целевых ионов металлов, что сокращает общую полезную сорбционную емкость и приводит к необходимости частой регенерации материала.
Наиболее близким является способ получения гранул ионообменных материалов с молекулярными отпечатками, имеющих полости молекулярного размера для селективного извлечения из водных сред неорганических ионов, относящихся к d-, p- и f-элементам, а также оксианионов, которым они специфичны. При этом упрощается технология, улучшаются кинетические показатели процесса извлечения целевого иона. Ионообменные материалы с молекулярными отпечатками синтезированы суспензионной полимеризацией смеси, включающей стадии подготовки реакционной смеси смешением непредельных мономеров, сшивающего агента и неорганического комплекса, содержащего целевой ион, сополимеризации с получением гранул и последующего удаления ионов-темплатов из материала. Для улучшения процесса диспергирования мономерной смеси в ходе суспензионной полимеризации, а также для формирования однородных гранул продукта рекомендовано вводить в водную фазу тиксотропные агенты. Подходящими инициаторами реакции полимеризации являются перекись бензоила, диацетилпероксид и азобисизобутиронитрил. Для выщелачивания ионов из полученных гранул используется обработка растворами минеральных кислот. В результате синтеза получается ионообменный материал макропористой структуры, состоящий из сшитого полимера с молекулярными отпечатками, являющимися сорбционными центрами, комплементарными специфическим ионам и адаптированными для селективного поглощения и связывания данных ионов из жидких сред (WO 2007055767 A1, B01J 20/22, 18.05.2007).
Недостатками данного способа получения селективных ионообменных материалов является дефицитность исходных органических мономеров, существенные различия в динамике протекания процесса извлечения ионов и нестабильность показателей селективности сорбции ионов в зависимости от глубины расположения сорбционных центров в материале, сложность полного извлечения из ионообменного материала селективно сорбированных ионов, в особенности из центральных частей гранул, ввиду протекания нежелательных процессов изоляции каналов и схлопывания микропор при синтезе.
Задачей предлагаемого технического решения является разработка технологичного способа получения адаптивно-селективного к редкоземельным металлам ионообменного материала, позволяющего получить новый комплексообразующий и хелатообразующий полимерный продукт с комплементарными к целевым ионам сорбционными центрами в промышленных масштабах с высокими показателями селективности и сорбционной емкости, который можно использовать для селективного извлечения и концентрирования ионов редкоземельных металлов в гидрометаллургии, химической промышленности, а также для получения веществ особой чистоты.
Техническим результатом является повышение селективности и сорбционной емкости по отношению к ионам редкоземельных металлов, что приводит к упрощению технологии извлечения, концентрирования и очистки редкоземельных металлов от примесей, что улучшает комплекс потребительских свойств данных материалов.
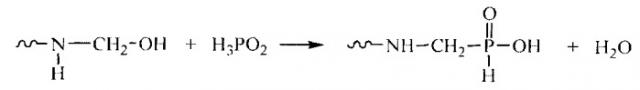
Технический результат достигается в способе получения адаптивно-селективного к редкоземельным металлам ионообменного материала, включающем приготовление мономерной смеси, диспергирование и сополимеризацию с получением гранул материала, десорбцию темплатных катионов, причем приготовление мономер-олигомерной смеси осуществляют путем перемешивания смеси фосфорноватистой кислоты, уротропина и параформа с образованием аминометиленфосфиновых кислот общей формулы
диспергирование и сополимеризацию полярной мономер-олигомерной смеси проводят в несмешивающейся с ней предварительно подготовленной неполярной фазе, содержащей темплатные катионы редкоземельного металла, выдерживают реакционную смесь с получением гранул, полученные гранулы продукта промывают дистиллированной водой, десорбируют темплатные катионы редкоземельного металла аммиачным раствором динатриевой соли этилендиаминтетрауксусной кислоты и промывают гранулы дистиллированной водой от остатков десорбирующего раствора.
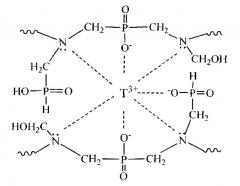
Заявляемое техническое решение по сравнению с прототипом предусматривает формирование молекулярных отпечатков в структуре ионообменного материала за счет образования химических связей катиона редкоземельного металла с функциональными группами аминометиленфосфиновых кислот, общей формулы
образующихся при взаимодействии уротропина, параформа и водного раствора фосфорноватистой кислоты, что представляет значительное преимущество, так как увеличивается селективность и сорбционная емкость по редкоземельным металлам, что положительно сказывается на комплексе потребительских свойств материалов.
Процесс получения селективных ионообменных материалов по предлагаемому способу протекает через 2 стадии и отражен на чертеже.
На первой стадии жидкая полярная мономер-олигомерная смесь диспергируется одним из известных в технике и технологии способов в предварительно подготовленной не смешивающейся с ней неполярной темплатсодержащей фазе. Ионы-темплаты в неполярной темплатсодержащей фазе распределены благодаря использованию поверхностно-активных веществ (ПАВ), относящихся к классу анионных ПАВ. Поскольку мономер-олигомерная смесь представляет собой полярную фазу, термодинамически более выгодную для темплатных ионов РЗЭ, то последние начинают активно диффундировать через поверхность раздела фаз из неполярной темплатсодержащей среды вглубь капли полярной мономер-олигомерной смеси. Оказавшись внутри диспергированной капли, темплатные ионы координируют вокруг себя компоненты мономер-олигомерной смеси по одним из функциональных групп, образуя специфичные по строению комплексы, которые вступают в параллельно идущую реакцию соединения с оставшимися функциональными группами, образуя слой специфичных макрокомплексов темплатный ион - полимер. Процесс диффузии ионов-темплатов сопровождается выходом паров летучих соединений, являющихся низкомолекулярными побочными продуктами синтеза. Таким образом, темплатные ионы образуют ионные отпечатки на поверхности и в глубине микро- и макропор, т.е. в тех зонах, которые будут доступны впоследствии раствору, из которого требуется извлечь целевые ионы. Это представляет существенное преимущество по сравнению с прототипом, в котором используется мономерная смесь с предварительно введенными в ее состав комплексами темплатных ионов, ввиду сокращения в предлагаемом варианте доли исключенных из процесса сорбции молекулярных отпечатков, «замурованных» в массе материала в силу отсутствия каналов, по которым к ним способен проникать рабочий раствор при эксплуатации. Процесс на первой стадии завершается при повышении температуры фиксацией в пространстве разветвленной структуры макрокомплексов темплатный ион - полимер с образованием сферических гранул пространственно-сшитого полимера с молекулярными отпечатками (комплементарными сорбционными центрами), заполненными темплатными ионами.
На второй стадии происходит десорбция темплатных ионов из полученных гранул пространственно-сшитого полимера с молекулярными отпечатками под действием растворов комплексонов при стандартной температуре. Продуктом десорбции являются гранулы адаптивно-селективного ионообменного материала с вакантными комплементарными сорбционными центрами.
Повышенная селективность и сорбционная емкость при извлечении редкоземельных металлов из раствора связана с высокой комплексообразующей и хелатообразующей способностью функциональной полимерной матрицы, что может быть объяснено образованием полного насыщенного лигандного контура при построении комплементарных сорбционных центров, а также прочных водородных и полиядерных комплексов с темплатными ионами. Принципиальное отличие данных материалов и способа их получения от материалов и способа получения, предложенного в прототипе, состоит в синергетическом действии, с одной стороны, пространственных и энергетических эффектов, определяемых природой и взаимным расположением хелатогенных групп молекулярных отпечатков, образующих прочные координационные химические связи с ионами редкоземельных металлов за счет взаимодействия электронных оболочек и перераспределения электронных плотностей, а с другой - высокой доступностью родственным ионам молекулярных отпечатков, расположенных на поверхности и внутри разветвленной сети микро- и макропор, сформированных в материале в условиях комплексообразующего поглощения темплатных ионов при синтезе.
Анионные поверхностно-активные вещества (АПАВ), служащие для распределения ионов-темплатов в неполярной темплатсодержащей среде и стабилизации дисперсии мономер-олигомерных частиц, могут быть выбраны из группы, содержащей высшие карбоновые кислоты (стеариновую, пальмитиновую, олеиновую кислоты), перфторированные карбоновые кислоты, первичные алкилсульфокислоты (додецилсульфокислота), алкиларилэтилсульфокислоты, алкилциклогексилэтилсульфокислоты, алкил- и алкилбензолсульфонаты (додецилбензолсульфонат натрия), сульфо- и карбоксиэтоксилаты спиртов, сульфоэтоксилаты алкилфенилэтиловых спиртов, диметаллические соли сульфоянтарной кислоты, амидосульфонаты, амиды и сульфоамиды сульфокарбоновых кислот, амидосульфаты и сульфоамидосульфаты, амидокарбоксилаты и сульфоамидокарбоксилаты. Приведенный перечень АПАВ дан в качестве примера, и можно также использовать другие АПАВ, причем единственными ограничениями является способность давать растворимые в расплавах ПАВ соединения с катионами редкоземельных металлов, что необходимо для создания требуемой концентрации темплатных ионов в темплатсодержащей среде, а также способность обменивать целевые катионы на протоны при контакте с мономер-олигомерной смесью.
Введение темплатных ионов редкоземельных металлов в расплав АПАВ осуществляют в виде их соединений с АПАВ - соответствующих солей, например стеаратов, пальмитатов, алкилсульфатов, алкиларилэтилсульфатов, алкилциклогексилэтилсульфатов.
Предпочтительными, но не исключительными мономерами для получения адаптивно-селективного к катионам редкоземельных металлов сорбционного и ионообменного материала высокой емкости и селективности описанным в данном изобретении способом являются уротропин, параформ, фосфорноватистая кислота, аминометиленфосфиновые кислоты.
При использовании для получения необходимой мономер-олигомерной смеси в качестве мономеров уротропина, параформа и фосфорноватистой кислоты, смешиваемых в соотношении, близком к 1:6:6, соответственно, протекает реакция фосфонометилирования с образованием аминометиленфосфиновых кислот. Реакция начинается с расщепления уротропина и параформа в кислой среде с образованием реакционноспособных метилольных производных. Далее фосфорноватистая кислота реагирует с этими производными с выделением воды и образованием продуктов реакции фосфонометилирования, содержащих звенья с хелатогенными фосфинокислыми группировками. Строение получаемых аминометиленфосфиновых кислот можно отразить следующей формулой:
Исследование полученной мономер-олигомерной смеси методом ЯМР 31P спектроскопии показало присутствие фосфинокислых групп, на что указывает сигнал ядер P, которому соответствует пик с δ=8,1 м.д. Наряду с ним присутствует сильный сигнал в виде дуплета с δ=10,7 м.д. (J=553 Hz, 1P, PH) в более сильном поле, обусловленный спин-спиновым взаимодействием ядер Р с Н в концевых фосфонистых функциональных группах, существующих в тетрагональной конфигурации и образующихся вследствие основного процесса фосфонометилирования при присоединении фосфорноватистой кислоты по атому азота через метиленовый мостик:
При введении полученной таким образом мономер-олигомерной смеси в несмешивающуюся с ней неполярную фазу, насыщенную катионами редкоземельных металлов, последние начинают активно обменивать протоны на Tn+, образуя хелатные координационнонасыщенные комплексы с фосфинокислыми и фосфонистыми группами аминометилфосфиновых кислот. Строение одного из возможных комплексов можно представить следующим образом:
Концевые фосфонистые группы аминометилфосфиновых кислот, обладая типичной гидрофосфорильной активностью, могут также далее реагировать со свободными метилольными производными, приводя к сшивкам разных молекул друг с другом, образованию циклов и нерастворимых полиаминометиленфосфиновых кислот.
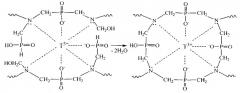
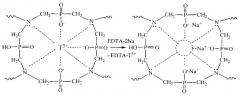
Полученный продукт представляет сшитый полимерный металлокомплекс, имеющий специфичное расположение функциональных групп в пространстве координационных центров, определяемое направлением и характером координационных связей, образованных данным темплатным катионом (Tn+) - комплексообразователем. При получении полимерного металлокомплекса выделяющиеся из реакционной смеси пары воды приводят к образованию в материале сети взаимопроникающих канальцев и микропор. Это обеспечивает хорошую доступность к координационным центрам десорбирующего раствора, который вымывает из материала темплатные катионы редкоземельных металлов Tn+, освобождая специфичные им молекулярные полости - ионные отпечатки. Для десорбции могут быть использованы водные растворы реагентов, образующих более прочные соединения с десорбируемыми катионами. Подходящие десорбирующие растворы можно выбрать из группы, содержащей EDTA-2Na (комплексон III), нитрилотриуксусную кислоту, оксиэтилидендифосфоновую кислоту. Приведенный перечень дан в качестве примера, и можно также использовать другие десорбирующие растворы, причем единственным ограничением является их высокое сродство к десорбирующим катионам редкоземельных металлов, достаточное для того, чтобы извлекать темплатные ионы из ионных отпечатков ионообменного материала. Процесс десорбции с использованием щелочного раствора динатриевой соли этилендиаминтетрауксусной кислоты (EDTA-2Na, комплексон III) отражен на схеме:
Продуктом десорбции является полимер с ионными отпечатками (комплементарными сорбционными центрами), проявляющий высокие селективные сорбционные свойства по отношению к темплатным катионам редкоземельных металлов Tn+, которые наиболее полно соответствуют ионным отпечаткам.
Участие в связывании темплатного катиона редкоземельного металла фосфино-кислых групп и третичных атомов азота подтверждается результатами ИК-Фурье спектрометрии тонко измельченных образцов адаптивно-селективного ионообменного материала, насыщенного темплатными ионами редкоземельных металлов, и материала после десорбции. Так, сравнение частот полос поглощения функциональных групп P-СН2, Р=O, Р-Н, C-N для насыщенного образца (δ(Р-СН2) - 1413-1419, ν(P=O) - 1147-1164, ν(P-H) - 2315-2356, ν(C-N) - 1027-1037) и образца после десорбции (δ(Р-CH2) - 1417-1428, ν(P=O) - 1153-1168, ν(P-H) - 2320-2360, ν(C-N) - 1033-1043) показывает смещение полос поглощения в спектре у десорбированного образца в коротковолновую область среднем на 5-7 см-1, что можно объяснить эффектами комплексо- и хелатообразования темплатных ионов редкоземельных металлов и этих групп.
Примерами катионов (Tn+), входящих в состав темплатсодержащей фазы являются катионы редкоземельных металлов (лантана, церия (III), неодима, самария). Перечень предпочтительных катионов редкоземельных металлов не является всеобъемлющим и приведен только для того, чтобы выделить предпочтительные типы, которые могут быть использованы для получения полимера с ионными отпечатками так, как это описано выше.
Способ осуществляется следующим образом.
Жидкая полярная мономер-олигомерная смесь диспергируется при интенсивном механическом перемешивании в предварительно подготовленной несмешивающейся с ней неполярной фазе, содержащей темплатные ионы редкоземельных металлов в количестве 0,5-4% масс. в течение 40-60 мин при постоянной температуре в интервале 70-90°C. Для завершения процесса температуру темплатсодержащей фазы повышают до 95-100°C и выдерживают при данной температуре 15-20 мин. Образующиеся сферические гранулы пространственносшитого полимера с молекулярными отпечатками, заполненными темплатными ионами, отделяют от темплатсодержащей среды фильтрованием или центрифугированием. Далее полученный продукт промывают последовательно 2-3 раза горячей водой, 2-3 раза десорбирующим раствором и 1-2 раза деминерализованной водой. Избыток влаги удаляют центрифугированием полученного продукта до заданной степени влажности.
Мономер-олигомерную смесь получают смешением исходных мономеров: уротропина, параформа и фосфорноватистой кислоты при температуре 15-20°C в мольном соотношении 1:6:6, фосфорноватистую кислоту берут в виде водного раствора с концентрацией 35-55% масс. Смесь перемешивают в течение 60 минут в атмосфере азота при температуре 15-20°C. По истечении данного промежутка времени полученную вязкую мономер-олигомерную смесь используют при синтезе адаптивно-селективного ионообменного материала с ионными отпечатками.
Темплатсодержащую фазу получают, расплавляя АПАВ. Далее в расплав АПАВ вводят при перемешивании соединение АПАВ с темплатным ионом редкоземельного металла (соль), добиваясь полного растворения и распределения темплатных ионов по объему темплатсодержащей среды. При использовании в качестве АПАВ стеариновой кислоты темплатсодержащую фазу получают, расплавляя стеариновую кислоту при 90-95°C и вводя при перемешивании порошок стеарата соответствующего темплатного катиона редкоземельного металла (например, стеарат неодима), добиваясь конечной концентрации катиона в темплатсодержащей среде в интервале 0,5-4% масс. При перемешивании добиваются полного растворения стеарата в среде стеариновой кислоты.
Пример 1. В двухгорлый стеклянный реактор объемом 2 л, снабженный термометром и перемешивающим устройством якорного типа, загружают 1293 г стеариновой кислоты (4,553 моль) и погружают в глицериновую баню с температурой 90-95°C. После перехода всей стеариновой кислоты в расплавленное состояние при работающей мешалке постепенно загружают 207 г (0,208 моль) стеарата неодима. Выдерживают темплатсодержащую смесь при работающем перемешивающем устройстве в течение 40-60 мин до полного смешения реагентов. Выход темплатсодержащей неодим среды 98%. Концентрация неодима в полученной среде составляет 2,0%.
Приготовление мономер-олигомерной смеси осуществляют следующим образом. В трехгорлый стеклянный реактор на 250 мл, помещенный в охлаждающую баню с температурой 15-20°C, снабженную термометром и лопастной мешалкой, загружают при работающей мешалке 67,9 мл (0,579 моль) фосфорноватистой кислоты с концентрацией 44% (плотность 1,279 г/мл), 13,50 г (0,096 моль) уротропина и 17,36 г (0,579 моль) параформа. В течение 60 минут перемешивают смесь при скорости мешалки 300-400 об/мин, не допуская повышения ее температуры больше 25°C. По истечении времени останавливают мешалку и выгружают полученную вязкую мономер-олигомерную смесь из реактора. Выход мономер-олигомерной смеси 96%. ЯМР 31Р (D2O) спектр δ, м.д.: 8,1, 10,7 (J=553 Hz, 1P, PH).
На основе полученной мономер-олигомерной смеси и неодимсодержащей среды получают селективный ионообменный материал к катионам неодима. В трехгорлый стеклянный реактор на 1 л, помещенный в глицериновую баню с температурой 70°C, снабженный термометром и лопастной мешалкой, загружают 514,8 г предварительно полученной темплатсодержащей среды в жидком виде. Затем вливают при работающей мешалке тонкой струей 115 г мономер-олигомерной смеси на основе аминометиленфосфиновых кислот. Скорость мешалки при вводе смеси и синтезе составляет 400 об/мин. Спустя 20 мин поднимают температуру в бане до 85°C, еще через 20 мин - до 95°C и выдерживают реакционную систему при данной температуре и работающей мешалке в течение 20 мин. Гранулы образовавшегося продукта отделяют от жидкой отработанной темплатсодержащей среды фильтрованием через стальное сито с размером ячеек 0,25 мм. Полученный продукт переносят в химический стакан объемом 300 мл, ставят под якорную мешалку на малых оборотах (60-100 об/мин) и отмывают от остатков темплатсодержащей среды 3-кратной обработкой по 10 минут каждая порциями по 150 мл горячей дистиллированной воды с температурой 85-90°C, каждый раз отделяя осадок продукта от горячей промывочной жидкости декантацией. Остатки жидкости удаляют от отмытого продукта фильтрованием на вакуум-фильтре в течение 3 мин. Выход гранул селективного ионообменного материала, насыщенного темплатными ионами, составляет 95%. Влажность полученного продукта 70%. Содержание фосфора 24% масс. (в пересчете на сухой продукт). Содержание связанных материалом темплатных ионов 1,8 мг-экв/г (в пересчете на сухой продукт). ИК-спектр, см-1: δ(Р-СН2) - 1413-1419, ν(P=O) - 1147-1164, ν(P-H) - 2315-2356, ν(C-N) - 1027-1037, ν((R3NH)+A-) - 2540-2570 (высушенный и растертый в тонкий порошок продукт).
Десорбцию связанных с селективным ионообменным материалом темплатных катионов редкоземельных металлов осуществляют с помощью аммиачного раствора динатриевой соли этилендиаминтетрауксусной кислоты (EDTA-2Na). Отмытый от остатков темплатсодержащей среды ионообменный материал в количестве 150 г переносят в химический стакан на 500 мл, заливают 250 мл десорбирующего раствора, представляющего смесь 2,5% масс. EDTA-2Na и 2,5% масс. аммиака в воде, и ставят под якорную мешалку на малые обороты (60-100 об/мин). Обработку десорбирующим раствором при непрерывно работающей мешалке продолжают в течение 40 мин. По истечении данного времени мешалку отключают и дают гранулам ионообменного материала осесть на дно стакана. Сливают декантацией десорбирующий раствор с извлеченными катионами, а продукт заливают свежей порцией десорбирующего раствора объемом 250 мл и повторяют описанные выше процедуры еще 2 раза. После третьей десорбции гранулы продукта промывают для удаления остатков отработанного десорбирующего раствора 3 раза по 10 мин свежими порциями дистиллированной воды по 250 мл, каждый раз отделяя жидкость над осадком продукта декантацией. После 3-й промывки порцией дистиллированной воды продукт отфильтровывают от избытка влаги на вакуум-фильтре и взвешивают. В ходе описанных процедур получают селективный к ионам редкоземельного металла неодима ионообменный материал в рабочей аммонийной форме. Выход продукта 93%.
Влажность полученного продукта 78-80%. Содержание фосфора 22-23% масс, (в пересчете на сухой продукт). Содержание связанных материалом темплатных катионов 0,05-0,06 мг-экв/г (в пересчете на сухой продукт). ИК-спектр, см-1: δ(Р-СН2) - 1417-1428, ν(P=O) - 1153-1168, ν(P-H) - 2320-2360, ν(C-N) - 1033-1043 (высушенный и растертый в тонкий порошок продукт).
Следующие примеры показывают селективное извлечение требуемых ионов с помощью адаптивно-селективного ионообменного материала с ионными отпечатками. Для иллюстрации даны примеры селективного извлечения ионов из растворов посредством гранул ионообменного материала, имеющего в своей структуре отпечатки целевых катионов редкоземельных металлов, полученные в ходе операций, описанных в примере. Для оценки эффективности извлечения целевого иона адаптивно-селективным ионообменным материалом рассчитывали статическую обменную емкость (СОЕ, мг-экв/г) по каждому из ионов, коэффициент распределения D, характеризующий степень сродства ионообменного материала к каждому из ионов, коэффициент разделения (Kd), показывающий, во сколько раз сродство к целевому иону больше, селективность к целевому иону (ST, % мольн.). Формулы для расчета данных характеристик материала (1-4) приведены ниже.
где c i 0 - начальная концентрация i-иона в растворе, н.;
c j 1 - конечная концентрация i-иона в растворе после сорбции, н.;
V - объем раствора, взятого для сорбции, мл;
m - навеска адаптивно-селективного ионообменного материала, взятого на сорбцию, г;
i - индекс, отражающий принадлежность параметра данному иону;
где DT - коэффициент распределения, соответствующий целевому темплатному иону редкоземельного металла (Т ion), на который адаптирован ионообменный материал.
где Т - индекс, отражающий принадлежность параметра темплатному иону (Т ion), на который адаптирован ионообменный материал;
∑ i N ˜ I ^ Å i - полная статическая обменная емкость ионообменного материала по всем ионам, мг-экв/г.
Пример 2. В этом примере осуществляют селективное извлечение катионов неодима из раствора. Навеску адаптивно-селективного к неодиму ионообменного материала в аммонийной форме массой 2,0 г помещают в коническую колбу на 250 мл и заливают 100 мл раствора смеси хлоридов Nd3+, La3+, Sm3+, Ce3+ с начальными концентрациями 0,025 н. по каждому из катионов. Доводят pH сорбируемого раствора до 6,0 добавлением 0,01 н. раствора соляной кислоты или гидроксида натрия. Колбу с погруженным в раствор материалом перемешивают и оставляют при комнатной температуре на 24 ч для достижения сорбционного равновесия. Периодически проверяют pH раствора и при фиксируемом отклонении более чем на 0,3 ед. в обе стороны производят корректировку добавлением 0,01 н. раствора соляной кислоты или гидроксида натрия. По истечении данного промежутка времени материал отфильтровывают через фильтровальную бумагу на воронке Бюхнера под вакуумом. Раствор собирают и анализируют на остаточное содержание катионов металлов спектрометрией ICP по известным методикам. Материал промывают порцией дистиллированной воды объемом 100 мл от остатков сорбируемого раствора, переносят количественно в коническую колбу на 100 мл и заливают 10 мл регенерирующего раствора (2,5% масс. EDTA-2Na и 2,5% масс. NH3) для десорбции поглощенных катионов. Материал, помещенный в десорбирующий раствор, перемешивают и отставляют при комнатной температуре на 30 мин для завершения процесса. После этого материал отфильтровывают через фильтровальную бумагу на воронке Бюхнера под вакуумом. Раствор десорбированных ионов собирают и анализируют на содержание металлов спектрометрией ICP по известным методикам. Ионообменный материал промывают порцией дистиллированной воды объемом 100 мл от остатков десорбирующего раствора, высушивают в течение 6 ч при температуре 80°C в сушильном шкафу и анализируют на остаточное содержание в нем металлов спектрометрией ICP с предварительным разложением материала известным способом при кипячении в смеси серной, азотной и хлорной кислот.
Результаты эксперимента представлены в таблице 1.
| Таблица 1 | |||||
| Использование адаптивно-селективного к неодиму ионообменного материала для извлечения Nd3+ из водных растворов | |||||
| Катион | СОЕ, мг-экв/г | D | Kd | Селективность к целевому иону, % мольн. | Концентрация иона в десорбате, н. |
| Nd3+ | 4,86 | 194,4 | - | 95,3 | 0,190 |
| La3+ | 0,08 | 3,3 | 59,6 | - | 0,003 |
| Sm3+ | 0,05 | 2,0 | 95,3 | - | 0,002 |
| Се3+ | 0,11 | 4,3 | 45,4 | - | 0,004 |
Как видно из таблицы 1, коэффициент распределения D катионов Nd3+ в 45-95 раз больше, чем других катионов, присутствующих в растворе, что может быть объяснено повышенным сродством темплатных сорбционных центров адаптивно-селективного ионообменного материала к целевому иону - неодиму за счет его соответствия ионным отпечаткам материала. Статическая обменная емкость по Nd3+ 4,86 мг-экв/г, селективность 95,3% мольн., извлечение неодима в десорбат97,5% мольн., степень концентрирования неодима 7,58.
Пример 3. В этом примере осуществляют селективное извлечение катионов лантана из раствора. Навеску адаптивно-селективного к лантану ионообменного материала в аммонийной форме массой 2,0 г помещают в коническую колбу на 250 мл и заливают 150 мл раствора смеси хлоридов La3+, Sm3+, Се3+ с начальными концентрациями 0,03 н. по каждому из катионов. Доводят pH сорбируемого раствора до 5,7 добавлением 0,01 н. раствора соляной кислоты или гидроксида натрия. Колбу с погруженным в раствор материалом перемешивают и выдерживают при комнатной температуре 24 ч для достижения сорбционного равновесия. Периодически проверяют pH раствора и при отклонении более чем на 0,3 ед. в обе стороны производят корректировку добавлением 0,01 н. раствора соляной кислоты или гидроксида натрия. По истечении данного промежутка времени материал отфильтровывают через фильтровальную бумагу на воронке Бюхнера под вакуумом. Раствор собирают и анализируют на остаточное содержание катионов металлов спектрометрией ICP по известным методикам. Материал промывают порцией дистиллированной воды объемом 100 мл от остатков сорбируемого раствора, переносят количественно в коническую колбу на 100 мл и заливают 10 мл регенерирующего раствора (1% масс. EDTA-2Na и 1% масс. NH3) для десорбции поглощенных катионов. Материал, помещенный в десорбирующий раствор, перемешивают и отставляют при комнатной температуре на 30 мин для завершения процесса. После этого материал отфильтровывают через фильтровальную бумагу на воронке Бюхнера под вакуумом. Раствор десорбированных ионов собирают и анализируют на содержание металлов спектрометрией ICP по известным методикам. Ионообменный материал промывают порцией дистиллированной воды объемом 100 мл от остатков десорбирующего раствора, высушивают в течение 6 ч при температуре 80°C в сушильном шкафу и анализируют на остаточное содержание в нем металлов спектрометрией ICP с предварительным разложением материала известным способом при кипячении в смеси серной, азотной и хлорной кислот.
Результаты эксперимента представлены в таблице 2.
| Таблица 2 | |||||
| Использование адаптивно-селективного к лантану ионообменного материала для извлечения La3+ из водных растворов | |||||
| Катион | СОЕ, мг-экв/г | D | Kd | Селективность к целевому иону, % мольн. | Концентрация иона в десорбате, н. |
| La3+ | 4,51 | 150,3 | - | 98,0 | 0,265 |
| Sm3+ | 0,04 | 1,2 | 122,5 | - | 0,002 |
| Се3+ | 0,06 | 1,8 | 81,7 | - | 0,003 |
Как видно из таблицы 2, коэффициент распределения D ионов La3+ в 81-122 раз больше, чем других катионов редкоземельных металлов, присутствующих в ра