Средства, обладающие фунцигидной активностью
Иллюстрации
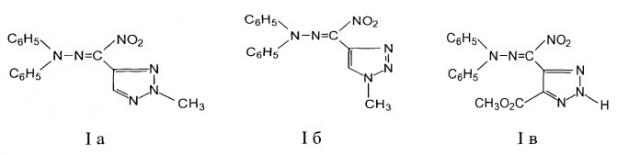
Показать всеОписываются средства, обладающие фунгицидной активностью, содержащие гидразоны нитро-1,2,3-триазол-4-ил карбальдегида формулы Ia-в
в концентрации 30 мг/л в ацетоне, которые могут найти применение в сельском хозяйстве для борьбы с грибковыми заболеваниями растений. 1 табл., 4 пр.
Реферат
Изобретение относится к области органической химии, а именно к гидразонам нитро-1,2,3-триазол-4-ил карбальдегидам формулы Ia-в,
и применению этих соединений в качестве фунгицидов в сельском хозяйстве для борьбы с нежелательными грибковыми заболеваниями растений.
Известен способ получения аналогов по структуре, основанный на реакции гем.-нитрооксадиазолметилирования 3-арил-5-тринитрометил-1,2,4-оксадиазолами 1,1-дифенилгидразина в мягких условиях (0°С, 2 часа) [А.Г. Тырков. Журн. орган, химии. 2002. 38 (12), 1874].
Известны замещенные 1-(2-феноксиэтил)-1,2,4-триазолы и композиции на их основе, проявляющие фунгицидную активность [патент RU №2329646], а также производные бензотриазола и их соли, которые эффективны в борьбе с нежелательными грибами при защите растений и материалов [патент RU №2158740].
1,2,3-Триазольный цикл, связанный с нитрогидразонной функцией является практически неисследованной системой. Тем не менее, соединения, содержащие 1,2,3-триазольный каркас, перспективны с точки зрения их практического применения.
В частности, замещенные 2-арил-1,2,3-триазол-1-оксиды рекомендуются в качестве инсектицидов [Т.И. Годовикова, Е.Л. Игнатьева, Л.И. Хмельницкий. Синтез и свойства 1,2,3-триазол-1-оксидов. Химия гетероциклических соединений. 1989. №2. С.147-156]. 1-Фенил-4(5)-(арилоксиметил)-1,2,3-триазолы обладают высокой фунгицидной активностью [Г.И. Каплан, С.С. Куполенко. Триазолы и их пестицидная активность. М. 1983. 38 с]. Однако способ получения таких представителей 1,2,3-триазолов достаточно трудоемок.
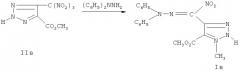
Техническим результатом являются вещества, обладающие фунгицидной активностью и представляющие собой гидразоны нитро-1,2,3-триазол-4-ил карбальдегида Ia-в. Соединения получены реакцией гем-нитротриазолметилирования замещенными производными 4-тринитрометил-1,2,3-триазолами IIa-в 1,1-дифенилгидразина, что позволяет расширить базу веществ, обладающих фунгицидной активностью.
Полученный технический результат позволяет расширить спектр биологически активных веществ обладающих фунгицидной активностью.
Способ получения гидразонов нитро-1,2,3-триазол-4-ил карбальдегида Ia-в проиллюстрирован на следующих примерах.
Пример 1.
1-Нитро-3,3-дифенил-1-(2-метил-1,2,3-триазол-4-ил)-2,3-диазопроп-1-ен (соединение Ia).
К раствору 1 г 2-метил-4-тринитрометил-1,2,3-триазола IIa в 20 мл осушеного этоксиэтана при 0°С и перемешивании добавляют 0.74 г 1,1-дифенилгидразина в 10 мл того же растворителя. Реакционную смесь выдерживают 2 часа при температуре 0°С. Растворитель выпаривают, остаток подвергают колоночной хроматографии на стеклянной колонке (l 500 мм, d 10 мм), используя в качестве сорбента силикагель марки Silicagel 100/400µ, собирают элюат бензола. Получают 0.57 г (42%) соединения Ia, т.пл. 123°С (из этанола).
ИК спектр, ν, см-1, CHCl3: 1555, 1290 (NO2).
Спектр ЯМР1Н, (80 МГц), δ, м.д., d6: 7.25 с (1Н, СН), 7.10-7.15 м (10Н, 2С6Н5), 3.78 с (3Н, СН3).
Электронный спектр, нм (lgε), СН3ОН: 235 (4.10), 370 (3.98).
Найдено, %: С 59.58; Н 4.37; N 26.02. C16H14N6O2. Вычислено, %: С 59.70; Н 4.68; N 26.22.
Пример 2.
1-Нитро-3,3-дифенил-1-(1-метил-1,2,3-триазол-4-ил)-2,3-диазопроп-1-ен (соединение Iб).
Получают аналогично соединению Ia из 1 г 1-метил-4-тринитрометил-1,2,3-триазола IIб и 0.74 г 1,1-дифенилгидразина, элюат-бензол.
Получают 0.6 г (44%) соединения Iб, т.пл. 144°С (из этанола).
ИК спектр, ν, см-1, CHCl3: 1555, 1290 (NO2).
Спектр ЯМР1Н, (80 МГц), δ, м.д., d6: 7.31 с (1Н, СН), 7.12-7.17 м (10Н, 2С6Н5), 3.67 с (3Н, СН3).
Электронный спектр, нм (lgε), СН3ОН: 235 (4.11), 370 (4.0).
Найдено, %: С 59.62; Н 4.34; N 26.08. C16H14N6O2. Вычислено, %: С 59.70; Н 4.68; N 26.22.
Пример 3.
1-Нитро-3,3-дифенил-1-(5-метоксикарбонил-2H-1,2,3-триазол-4-ил)-2,3-диазопроп-1-ен (соединение Iв).
Получают аналогично соединению Ia из 1 г 5-метоксикарбонил-4-тринитрометил-2H-1,2,3-триазола IIв и 0.74 г 1,1-дифенилгидразина, элюат-хлороформ.
Получают 0.63 г (48%) соединения Iв, т.пл. 201-202°С (из CHCl3 : гексана 1:1).
ИК спектр, ν, см-1, CHCl3: 1550, 1285 (NO2); 1730 (СО).
Спектр ЯМР1Н, (80 МГц), δ, м.д., d6: 7.10-7.16 м (10Н, 2С6Н5), 3.73 с (3Н, СН3О).
Электронный спектр, нм (lgε), СН3ОН: 235 (4.07), 372 (4.06).
Найдено, %: С 55.73; Н 3.82; N 22.95. C17H14N6O4. Вычислено, %: С 56.14; Н 3.95; N 23.06.
Применение гидразонов нитро-1,2,3-триазол-4-ил карбальдегида Ia-в в качестве фунгицидов проиллюстрировано на следующем примере.
Пример 4.
Испытание на фунгицидную активность соединений проводили в экспериментах в условиях in vitro [Методические испытания по определению фунгицидной активности новых соединений. Черкассы: НИИТЭХИМ. 1984. 34 с]. Действие препаратов на радиальный рост мицелия определяли растворением соединений в ацетоне и внесением аликвоты в картофелесахарозный агар при 50°С до концентрации 30 мг/л по действующему веществу. Конечная концентрация ацетона в контрольных растворах и растворах с действующими веществами составила 1%. В чашки Петри, содержащие 15 мл агаровой среды, наносили иглой культуры грибов на агаровую поверхность. Образцы выдерживали в термостате при 25°С±1°С и измеряли радиальный рост через 3 суток. Процент ингибирования рассчитывали по Эбботу по отношению к необработанному контролю. В качестве эталона использовали коммерческий фунгицид «Триадимефон» (3,3-диметил-1-(1,2,4-триазол-1-ил)-1-(4-хлорфенокси)-2-бутанон) в той же концентрации. Результаты испытаний представлены в таблице.
| Таблица. | ||||
| Результаты испытаний гидразонов нитро-1,2,3-триазол-4-ил карбальдегидов Ia-в на фунгицидную активность в концентрации 30 мг/л в ацетоне | ||||
| № соед. | Соединение | Подавление радиального роста мицелия грибов, в % к контролю | ||
| Sclerotinia scleorotiorum | Helminthosporum satovum | Venturia inaequalis | ||
| Ia | 100 | 100 | 100 | |
| Iб | 75 | 64 | 80 | |
| Iв | 100 | 100 | 100 | |
| Эталон | 50 | 60 | 44 |
Данные таблицы показывают, что соединения Ia-в проявляют фунгицидную активность более высокую, по сравнению с широко используемым триазольным фунгицидом «Триадимефон».
Таким образом, техническим результатом являются гидразоны нитро-1,2,3-триазол-4-ил карбальдегида Ia-в, обладающие фунгицидной активностью.
Средства, обладающие фунгицидной активностью, содержащие гидразон нитро-1,2,3-триазол-4-ил карбальдегидный фрагмент формулы Ia-в, в концентрации 30 мг/л в ацетоне.