Гибридный белок, обладающий пролонгированным действием, на основе рекомбинантного интерферона альфа-2 человека (варианты), способ его получения и штамм saccharomyces cerevisiae для осуществления этого способа (варианты)
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может быть использовано для получения рекомбинантного интерферона альфа-2 человека. Гибридные белки GFN80 и GFN100 конструируют на основе рекомбинантныго интерферона альфа-2 человека, слитого с N-конца с аминокислотной последовательностью полипептида S(G4S)16 или S(G4S)20 соответственно. Рекомбинантным путем получают штаммы продуценты Saccharomyces cerevisiae ВКПМ Y-3927 и Saccharomyces cerevisiae ВКПМ Y-3928. Штаммы используют в способе получения гибридного белка GFN80 и GFN100, который предусматривает культивирование в подходящих условиях дрожжевых клеток, трансформированных вектором экспрессии, который содержит область инициации репликации эндогенной 2-мкм плазмиды дрожжей Saccharomyces cerevisiae, а также промотор GAL1 дрожжей, контролирующий экспрессию гена, включающего последовательность ДНК SEQ ID NO:1 или SEQ ID NO:2, соответственно, с последующим выделением гибридного белка из культуральной жидкости. Изобретение позволяет получить гибридный рекомбинантный интерферон альфа-2 человека с пролонгированным действием в организме животных. 5 н.п. ф-лы, 7 табл., 15 пр.
Реферат
Группа изобретений относится к области биотехнологии и касается белка, обладающего пролонгированным действием (более длительным временем жизни в организме животных по сравнению с природным белком), на основе рекомбинантного интерферона альфа-2 человека и способа его получения путем культивирования дрожжей Saccharomyces cerevisiae.
Интерфероны альфа-2 человека (ИФН) относятся к классу цитокинов, к группе альфа-интерферонов, секретируемых практически всеми типами вирус-инфицированных клеток. Лекарственные формы ИФН являются препаратами широкого спектра действия, обладающими иммуномодулирующей, противовирусной и противоопухолевой активностью. В настоящее время лекарственные средства на основе ИФН являются наиболее востребованными противовирусными препаратами, входящими в «золотые лекарственные стандарты» для лечения различных вирусных заболеваний, в том числе вирусного гепатита В и вирусного гепатита С (ВГС), требующих пожизненной терапии.
Фармакокинетические характеристики рекомбинантного немодифицированного (стандартного) ИФН не позволяют поддерживать постоянным его уровень в плазме, что частично объясняет недостаточно высокий терапевтический эффект [Reddy, 2004].
Известны способы модификации белков, в том числе ИФН, увеличивающие их время жизни в плазме крови животных. Большинство известных модификаций направлено на увеличение физических размеров (гидродинамического объема) или заряда (отрицательного) молекул лекарственных белков, которое осуществляют с целью замедления процесса их фильтрации из плазмы крови сквозь поры почечных канальцев [Therapeutic Proteins, ed. R.Kontermann, 2012].
Химическая модификация ИФН с помощью полиэтиленгликолей (ПЭГ) позволила получить молекулы ПЭГ-ИФН, для которых характерны увеличенное время жизни в плазме крови и улучшенный фармакокинетический профиль [Zeuzem et al., 2000; Heathcote et al., 2000; Lindsay et al., 2001]. Масштабные клинические испытания продемонстрировали, что эффективность комбинированных препаратов на основе ПЭГ-ИФН в 1,5-2 раза превышает эффективность стандартного интерферона. При этом уровень излечивания ВГС достигает значений 54-56% (табл.1), и одновременно улучшается качество жизни пациентов [Fried et al., 2002; Manns et al., 2001; Hadziyannis, 2004; Clark & Nelson, 2009].
Однако высокая стоимость ПЭГ-ИФН в значительной степени ограничивает их массовое применение. Другими неблагоприятными свойствами являются неоднородность химически модифицированных молекул ПЭГ-ИФН, необходимость значительно (до 10 раз) увеличивать дозировку препаратов на их основе [табл.1 и Pasut, 2009], а также накопление в организме производных ПЭГ, не подверженных биодеградации. Кроме того, около половины больных ВГС остаются невосприимчивы к курсу лечения ПЭГ-ИФН [Pasut, 2009].
Для получения пролонгированных производных ИФН также использованы следующие способы его биомодификации:
• генетическая гибридизация ИФН с долгоживущими белками крови человека, например сывороточным альбумином [Bain et al., 2006; Subramanian et al., 2007; Nelson et al., 2009a, 2009b; Zeuzem 2009, 2009], или фрагментом иммуноглобулина [Jones et al., 2004], или с фрагментом антитела, обеспечивающего нековалентное связывание с сывороточным альбумином человека непосредственно в кровотоке [Walker et al., 2010]. Однако препарат Albinterferon-alfa-2b (Human Genome Sciences Inc и Novartis AG), предложенный для лечения хронического гепатита С, не получил одобрения контролирующих организаций в США (FDA) и ЕС (ЕМА) [http://seekingalpha.com/article/258673-human-genome-sciences-evenly-poised-after-fda-approval];
• генетическая гибридизация ИФН с искусственными полипептидами, в которых содержатся сайты N-гликозилирования и преобладают повторы из остатков глицина, аспарагиновой кислоты и глутаминовой кислоты [US 20090298762];
• генетическая гибридизация ИФН с полианионным полипептидом из остатков глутаминовой кислоты (84 и 173 остатка) в клетках Е.coli [US 20020169125, AU 2002252429, WO 02077036]. Белок не секретируется и требует продолжительной и трудоемкой очистки как от других внутриклеточных белков, так и от клеточных эндотоксинов;
• генетическая гибридизация ИФН с С-концевым пептидом (СТР) β-субъединицы хорионического гонадотропина человека, содержащего 28 аминокислотных остатков, формирующих четыре сайта О-гликозилирования [US 20120015437]. Одна или несколько копий СТР, присоединяемых к С-концу молекул, существенно удлиняют время жизни терапевтических белков в плазме крови [US 2012035101, US 2012015437, US 2012004286, US 2011286967, US 2010317585, US 2010081614, US 5759818]. Использование СТР-технологии ограничено необходимостью получать модифицированные белки исключительно в клетках животных, обеспечивающих корректное О-гликозилирование;
• генетическое изменение природной последовательности ИФН с целью конструирования сайтов N-гликозилирования. Модифицированный таким образом ИФН, продуцируемый в культуре клеток СНО, содержит четыре или пять N-углеводных цепочек и обладает в 25 раз увеличенным временем жизни в кровотоке [US 2012134960]. Для него характерно увеличение противоопухолевой активности, но снижение специфической противовирусной активности in vitro. Такой способ получении пролонгирования, основанный на изменении природной последовательности ИФН, чреват нарушением иммунного статуса пациента, а его получение основано на использовании дорогостоящих клеточных культур.
Практическое воплощение вышеуказанных способов в большинстве случаев не позволяет оптимизировать процесс получения пролонгированного ИФН путем использования более продуктивных и/или более дешевых систем экспрессии, поскольку ограничено выбором клеток-хозяев, подходящих для биосинтеза модифицированного белка.
Таких ограничений лишен способ пролонгирования с использованием полипептидной технологии, которая предполагает генетическую гибридизацию (коньюгацию) белков с высокорастворимыми, химически и иммунологически инертными неструктурированными полипептидами (НП), способными в физиологических условиях имитировать поведение молекул ПЭГ. Такие НП в водных растворах при физиологических солевых, температурных и буферных условиях устойчивы к фолдингу (формированию третичной структуры), агрегации, неспецифической адсорбции и поддерживают стабильное неупорядоченное состояние типа “клубок”, даже будучи генетически коньюгированными с обычными структурированными белками. Постоянное изменение конформации НП, вызываемое термическим движением, приводит к более или менее постоянной усредненной ватообразной структуре, молекулярный размер которой зависит только от числа аминокислотных остатков в составе НП, их собственного размера (диаметра) и конформационной гибкости. В этой связи НП способны опосредовать значительное увеличение гидродинамического объема коньюгированных белков, вызывающее ослабление почечной фильтрации и удлиняющее время жизни белков в плазме крови [Binder & Skerra, 2012].
Использование НП для пролонгирования белков имеет преимущества перед химической модификацией с помощью ПЭГ, в частности:
• белки, модифицированные по этой технологии, могут быть экспрессированы и внутриклеточно, и в секретированом виде в различных типах клеток, включая бактерии и дрожжи, что позволяет значительно удешевить и ускорить их получение и очистку;
• модифицирующие НП обладают крайне низкой иммуногенностью и подобно ПЭГ способны экранировать чужеродные белки от распознавания иммунной системой;
• модифицирующие НП являются биоразлагаемыми, что значительно снижает риск появления токсичности или накопления в каких-либо органах (например, в почках или печени) или клетках (например, в макрофагах);
• генетически кодируемая последовательность НП гарантирует неизменность и точность модификации белка;
• поскольку внутренние последовательности НП, как правило, не взаимодействуют ни между собой, ни с последовательностями белка, с которым коньюгированы НП, модифицированные белки сохраняют специфическую активность на уровне немодифицированных аналогов;
• подбор размера пролонгирующего НП позволяет конструировать белки, обладающие медицински обоснованным уровнем пролонгирования.
В основных чертах эти характерные особенности свойственны трем известным типам НП, способным пролонгировать действие белков до 100 раз:
1) XTEN-полипептидам, содержащим случайное чередование 6 аминокислотных остатков аланина, глутаминовой кислоты, глицина, пролина, серина и треонина [ЕР 2402754, US 20110312881, WO 2011123830, WO 2011123813, US 20110151433, US 20100323956, WO 2010144502, WO 2010091122, СА 2748314, WO 2007103515, US 7846445, US 7855279; Geething et al., 2010; Schellenberger et al; 2009];
2) PAS-полипептидам, содержащим остатки пролина, аланина и серина [WO 2011144756, NZ 580670, US 20100292130, ЕР 2173890, WO 2008155134, Skerra, 2010];
3) НАР (или ОЯ8)-полипептидам, являющимися глицин-богатыми последовательностями [Schlapschy et al., 2007; WO 2007103515], содержащими остатки глицина (G) и серина (S).
Показано пролонгирование действия ИФН за счет использования НП PAS, наименьший размер которых составлял около 200 аминокислотных остатков [Skerra, 2010; ЕА 201000040].
У НАР-полипептидов наличие пролонгирующей активности в отношении ИФН не установлено, более того известен пример, доказывающий отсутствие пролонгирующей активности у НП НАР размером менее 200 аминокислотных остатков в отношении фрагмента одного из антител [Schlapschy et al., 2007].
В качестве ближайшего аналога заявляемого белка рассмотрим гибридный белок, обладающий пролонгированным действием в организме животных и представляющий собой гибридный белок PAS-ИФН, включающий в свой состав, начиная с N-конца (1) аффинную метку “Strep-tag II”, облегчающую очистку гибридного белка с использованием аффинной хроматографии со стрептавидином, (2) НП PAS, состоящий из 200 остатков пролина, аланина и серина, и (3) последовательность интерферона альфа-2b, имеющего массу 20,9 кДа, которая отличается от расчетной массы нативного интерферона альфа-2b человека - 19,3 кДа [ЕА 201000040].
Способ получения белка-ближайшего аналога осуществляют в клетках бактерий E.coli путем микробиологического синтеза с секрецией в периплазму и последующим осторожным отделением фракции периплазматических белков от белков цитоплазмы клеток, аффинной очистки целевого белка с использованием стрептавидина и доочистку его от клеточных эндотоксинов. При этом выход белка-аналога после аффинной очистки не превышал 0,1 мг/л/ОД.
Полученный белок-ближайший аналог демонстрировал специфическую активность на уровне немодифицированного ИФН и увеличенное время жизни в организмах крыс, подобно вариантам ПЭГ-ИФН.
Способ получения белка-ближайшего аналога путем культивирования бактерий E.coli в отличие от заявляемого не позволяет получать секретированный во внеклеточную среду целевой белок, а уровень продукции белка-аналога почти в 30 раз ниже уровня продукции заявляемого белка по заявляемому способу. При этом фактически выход белка-ближайшего аналога даже завышен, поскольку примененный для его очистки метод аффинной хроматографии со стрептавидином требует доочистки целевого белка от бактериальных эндотоксинов и, следовательно, приводит к дополнительным потерям.
Известно, что одной из главных оценок эффективности препаратов ИФН служит уровень излечивания (SVR) больных ВГС, который коррелирует с величиной разовой дозы, обусловленной специфической активностью ИФН, и «временем полувыведения» препаратов ИФН из организма [Pasut, 2009]. Анализ данных [Pasut, 2009], характеризующих препараты ПЭГ-ИФН в сравнении со стандартным ИФН (табл.1), позволяет полагать, что значительным терапевтическим потенциалом будет обладать белковый препарат, для которого характерно физиологически умеренное 3-4-кратное пролонгирование и высокая на уровне стандартного ИФН специфическая активность. Преимуществами такого препарата также могут быть облегченный по сравнению со стандартным ИФН режим приема, например 2 раза вместо 3 раз в неделю, при сохранении себестоимости на уровне стандартного ИФН.
| Таблица 1 | |||
| Сравнительные характеристики инъекционных форм ИФН [согласно Pasut, 2009] | |||
| Характеристика | Стандартный ИФН | ПЭГ-ИФН | |
| Pegasys | Peglntron | ||
| Специфическая (противовирусная) активность, % | 100 | 7 | 28 |
| Время полувыведения, ч | 4-16 | 61-110 | 27-39 |
| SVR (с рибавирином), % | 38-43 | 54-56 | |
| SVR (без рибавирина), % | 16-20 | 36-39 | 23 |
| Режим лечения ВГС (доз в неделю) | 3 | 1 | 1 |
| Размер 1 усредненной дозы, млн. ME | 3 | 2,5 | 6,7 |
| Размер 1 усредненной дозы, мкг | 15 | 180 | 120 (1,5 мкг/кг) |
Задача заявляемой группы изобретений - расширить арсенал белков на основе рекомбинантного интерферона альфа-2 человека, обладающих пролонгированным действием, и разработать способ их получения.
Задача решена путем разработки:
- гибридного белка GFN80, обладающего пролонгированным действием и представляющего собой рекомбинантный интерферон альфа-2 человека, слитый с N-конца с аминокислотной последовательностью полипептида S(G4S)16, где S - остаток серина, a G - остаток глицина;
- гибридного белка GFN100, обладающего пролонгированным действием и представляющего собой рекомбинантный интерферон альфа-2 человека, слитый с N-конца с аминокислотной последовательностью полипептида S(G4S)20, где S - остаток серина, а G - остаток глицина;
- способа получения гибридного белка GFN80 или GFN100 путем культивирования в подходящих условиях дрожжей Saccharomyces cerevisiae, трансформированных вектором экспрессии, который содержит область инициации репликации эндогенной 2-мкм плазмиды дрожжей Saccharomyces cerevisiae, а также промотор GAL1 дрожжей, контролирующий экспрессию гена, включающего последовательность ДНК SEQ ID NO:1 или SEQ ID NO:2, соответственно, с последующим выделением гибридного белка из культуральной жидкости, а также конструирования:
- штамма Saccharomyces cerevisiae ВКПМ Y-3927 - продуцента гибридного белка GFN80, полученного путем введения нуклеотидной последовательности SEQ ID NO:1 в составе плазмиды р71-81 в клетки реципиента, являющегося бесплазмидным производным штамма Saccharomyces cerevisiae ВКПМ Y-3550 [RU 2427645];
- штамма Saccharomyces cerevisiae ВКПМ Y-3928 - продуцента гибридного белка GFN100, полученного путем введения нуклеотидной последовательности SEQ ID NO:2 в составе плазмиды р71-82 в клетки реципиента, являющегося бесплазмидным производным штамма Saccharomyces cerevisiae ВКПМ Y-3550.
Этапы конструирования штаммов-продуцентов заявляемых гибридных белков
Этап 1. Синтезируют фрагмент ДНК, имеющий открытые «липкие» концы, идентичные «липким» концам, создаваемым рестриктазами BglII и BamHI, и кодирующий полипептид S(G4S)4, где S - остаток серина, a G - остаток глицина. Направленно клонируют этот синтетический фрагмент ДНК в подходящем лабораторном векторе, расщепленном по уникальным сайтам узнавания рестриктаз BglII и BamHI.
Этап 2. Используя рутинные методы генетической инженерии, осуществляют мультимеризацию оригинального синтетического фрагмента ДНК, клонированного на этапе 1, и получают плазмиды, содержащие фрагменты ДНК, кодирующие полипептиды S(G4S)16 и S(G4S)20, где S - остаток серина, а G - остаток глицина.
Этап 3. Конструируют вспомогательные плазмиды и целевые экспрессионные плазмиды р71-81 и р71-82, в составе которых осуществляют корректное слияние последовательностей ДНК, кодирующих промоторную область гена GAL1 дрожжей, лидерную пре-про область α-фактора дрожжей и аминокислотную последовательность S(G4S)16 или S(G4S)20, соответственно, и структурный ген зрелого интерферона альфа-2b человека.
Этап 4. Получают штамм-реципиент S. cerevisiae SCR8G1. С этой целью клетки музейного штамма S. cerevisiae ВКПМ Y-3550, содержащего рекомбинантную плазмиду, освобождают от содержащейся в них рекомбинантной плазмиды. Клоны штамма S. cerevisiae SCR8G1 селектируют по признаку отсутствия роста на агаризованной среде с глюкозой 20 мг/мл, детерминированного отсутствием в клетках штамма S. cerevisiae SCR8G1 рекомбинантной плазмиды, несущей функциональный аллель гена PGK1.
Этап 5. Получают заявляемые штаммы S. cerevisiae ВКПМ Y-3927 и S. cerevisiae ВКПМ Y-3928. С этой целью клетки штамма-реципиента S. cerevisiae SCR8G1 трансформируют соответственно рекомбинантными плазмидами р71-81 или р71-82, содержащими функциональный аллель гена PGK1. Трансформанты отбирают по способности расти при температуре 30°C на агаризованной среде с глюкозой 20 мг/мл.
Подтверждают способность полученных трансформантов секретировать целевые гибридные белки и депонируют их во Всероссийской коллекции промышленных микроорганизмов (ВКПМ).
В результате получают заявляемые штаммы:
- SCR-8G1/p71-81 (лаб.название GFN80-Sc:, Saccharomyces cerevisiae ВКПМ Y-3927)
- SCR-8G1/p71-82 (лаб.название GFN100-Sc:, Saccharomyces cerevisiae ВКПМ Y-3928)
Характеристика заявляемых штаммов-продуцентов гибридных белков
Описание штаммов-продуцентов
Заявляемые штаммы ВКПМ Y-3927 и ВКПМ Y-3928 содержат гены целевых гибридных белков GFN80 или GFN100 в составе рекомбинантных эписомных плазмид р71-81 или р71-82, соответственно, каждая из которых обеспечивает экспрессию гена целевого гибридного белка под контролем промотора дрожжей GAL1 и имеет следующие свойства:
- плазмида содержит: ориджин репликации эндогенной 2-мкм плазмиды дрожжей, т.е. способна поддерживаться в клетках дрожжей в эписомном многокопийном состоянии; гены оротидин 5-фосфат декарбоксилазы (URA3) и 3-фосфоглицерат киназы (PGK1) дрожжей, способные служить селективными маркерами, последовательность бактериальной плазмиды pUC19, а также экспрессионную кассету с геном гибридного белка GFN80 или GFN100;
- в состав экспрессионной кассеты входит последовательность ДНК промоторной области гена дрожжей GAL1, последовательность ДНК структурного гена MFα1, кодирующая пре-про лидерный пептид предшественника полового феромона (α-фактора) дрожжей, последовательность ДНК структурного гена целевого гибридного белка GFN80 или GFN100 и последовательность ДНК области терминации транскрипции гена CYC1 дрожжей. Секрецию целевого гибридного белка в клетках штамма-продуцента направляет N-концевая лидерная последовательность α-фактора дрожжей, удаляемая из состава целевого гибридного белка в процессе внутриклеточного транспорта. Сочетание сильного промотора и высокой дозы гена в составе многокопийной плазмиды в совокупности обеспечивают высокий уровень секреции целевых гибридных белков GFN80 или GFN100 в клетках заявляемых штаммов.
Заявляемые штаммы-продуценты S. cerevisiae ВКПМ Y-3927 и ВКПМ Y-3928 являются диплоидными прототрофными штаммами. Диплоидный статус клеток этих штаммов обеспечивает повышенную стабильность их характеристик. В геноме заявляемых штаммов присутствует гомозиготная мутация в гене 3-фосфоглицерат киназы, обеспечивающая генотип pgk1/pgk1. Эта мутация ограничивает способность бесплазмидных клеток заявляемых штаммов к росту на любых средах, содержащих любой единственный источник углерода, усваиваемый дрожжами S.cerevisiae. Присутствие функционального аллеля гена 3-фосфоглицерат киназы (PGK1) в составе эписомной экспрессионной плазмиды р71-81 или р71-82 обеспечивает селективный рост содержащих плазмиду клеток заявляемых штаммов в этих условиях и селективное поддержание плазмид в растущих клетках.
Клетки заявляемых штаммов содержат гомозиготную мутацию в гене GAL80 - генотип gal80::LEU2/gal80::LEU2. Мутация gal80 отвечает за инактивацию белка, репрессирующего промотор GAL1, что приводит к изменению регуляции и позволяет осуществлять галактозо-независимую активацию промотора GAL1 контролирующего экспрессию целевых гибридных белков.
Клетки заявляемых штаммов содержат в геноме ген протеиназы Кех2 дрожжей S.cerevisiae, секретируемой во внеклеточную среду, под контролем промотора GAL1 дрожжей, что способствует увеличению продукции целевых гибридных белков.
Клетки заявляемых штаммов содержат в геноме гомозиготную мутацию в гене YPS1 - генотип yps1::TRP1/ypsfile://l:/TRPl, приводящую к инактивации протеиназы Yps1, отвечающей за деградацию интерферона и, предположительно, интерферонсодержащих гибридных целевых белков [RU 2427645].
В связи с тем, что в клетках заявляемых штаммов синтез целевых гибридных белков осуществляется под контролем промотора GAL1, который репрессируется глюкозой, индукция секреции целевых гибридных белков в культуральную среду происходит при снижении концентрации сахара в среде до уровня менее 2 мг/мл.
Генотипические признаки Saccharomyces cerevisiae ВКПМ Y-3927:
а/α leu2/leu2 ura3/ura3 trp1/trp1 pgk1::URA3/pgk1::URA3 gal80::LEU2/gal80::LEU2 lys7/LYS7 his3/HIS3 his4/HIS4 yps1::TRP1/yps1v::TRP1 ATH1/ath1::(ADH1-G418, TDH3-KEX2A) STA2/STA2 suc0/SUC2)/р71-81
Клетки штамма ВКПМ Y-3927 содержат эписомную плазмиду р71-81. Saccharomyces cerevisiae ВКПМ Y-3928:
а/α leu2/leu2 ura3/ura3 trp1/trp1 pgk1::URA3/pgk1::URA3 gal80::LEU2/gal80::LEU2 lys7/LYS7 his3/HIS3 his4/HIS4 yps1::TRP1/yps1v::TRP1 ATH1/ath1::(ADH1-G418, TDH3-KEX2A) STA2/STA2 suc0/SUC2)/р71-82
Клетки штамма ВКПМ Y-3928 содержат эписомную плазмиду р71-82.
Культурально-морфологические признаки
При культивировании при температуре 28°C в течение 48-96 часов на агаризованных питательных средах заявляемые штаммы образуют колонии. При этом клетки заявляемых штаммов имеют округлую или овальную форму, 3-7 мкм в диаметре, почкуются. Почкование истинное, многостороннее, истинного мицелия не образуют.
Колонии имеют следующий вид:
1) на агаризованной среде YPD (состав в мас.%: бактопептон - 2, дрожжевой экстракт - 1, бактоагар - 2, глюкоза - 2, вода - остальное) - колонии белого цвета, непрозрачные, с ровным краем, матовой поверхностью, линзовидным профилем и сметанообразной консистенцией;
2) на агаризованной среде с крахмалом (состав в мас.%: пептон - 2, дрожжевой экстракт - 1, крахмал - 1, агар - 2, вода - остальное) - колонии белого цвета с узорчатым краем, матовой поверхностью, линзовидным профилем и крупитчатой консистенцией.
При росте в жидкой среде при температуре 28°C в течение первых 24 ч культивирования - жидкость мутная, осадок белый, не комкуется, пристеночных пленок не образует.
Физико-биохимические признаки
Заявляемые штаммы прототрофные, факультативные анаэробы, мезофилы. Рост возможен в интервале температур 10-37°С, оптимальная для роста температура 29±1°C, однако устойчивы к повышенной температуре, способны к росту при 37°C. Способны к росту при значениях рН 3,8-7,4 (оптимальный диапазон рН 4,7-5,5).
Ассимиляция источников углерода
Заявляемые штаммы сбраживают глюкозу, фруктозу, мальтозу, сахарозу, декстрины, крахмал. Не сбраживают лактозу, галактозу, инулин, ксилозу, арабинозу. Штаммы способны к росту в среде с крахмалом.
Ассимиляция источников азота
В качестве источников азота используют пептон, дрожжевой экстракт, аминокислоты, сернокислый аммоний, азотнокислый аммоний.
Синтез целевого белка
Заявляемые штаммы синтезируют гибридные целевые белки, в состав которых входит аминокислотная последовательность нативного интерферона альфа-2b человека. Полная активация синтеза целевых гибридных белков происходит при снижении концентрации сбраживаемого источника углерода в среде культивирования до неферментируемого уровня или при росте штаммов в средах, содержащих исключительно неферментируемые источники углерода. В этих условиях клетки штамма секретируют целевые гибридные белки в среду культивирования.
Условия и состав сред для длительного хранения штаммов
Суспензия клеток заявляемых штаммов хранится в 15%-ном растворе глицерина при минус 70°C.
Способ получения гибридных белков в общем виде
Для засева ферментера получают посевную культуру путем культивирования штамма-продуцента целевого гибридного белка в среде следующего состава, в мас.%: пептон 1-3; дрожжевой экстракт 0,5-3; глюкоза 1-3, вода - остальное, рН среды - естественный в течение 16-40 часов при температуре 22-32°C на орбитальной качалке 100-350 об/мин.
Посевной культурой засевают ферментер (0,5-1000 л), содержащий ферментационную среду следующего состава, в мас.%: пептон 1-3; дрожжевой экстракт 0,5-3, глюкоза или сахароза 1-4, вода - остальное, рН среды - естественный. Количество посевной культуры, вносимой в ферментер составляет 3-15% от объема ферментационной среды.
Ферментацию проводят при 22-32°C, аэрации 0,5-1000 л/мин и скорости перемешивания культуры 100-1500 об/мин. Через 16-30 ч после засева ферментера процесс проводят без подпитки или начинают подпитку 30-60% раствором глюкозы или сахарозы со скоростью 2-10 г/л/ч и устанавливают pH-статирование культуры в диапазоне рН 5,0-7,2. Общая продолжительность ферментации составляет 38-68 ч.
Продукция секретируемого целевого гибридного белка в таких условиях составляет не менее 0,12 г/л.
Очистку гибридного белка из среды культивирования дрожжей производят как описано [RU 2427645].
В результате получают не менее 0,05 г целевого гибридного белка из 1 л культуральной жидкости.
Пример 1. Конструирование рекомбинантной плазмиды pGS-4.
Синтезируют фрагмент ДНК, имеющий открытые «липкие» концы, идентичные «липким» концам, создаваемым рестриктазами BglII и BamHI, и кодирующий полипептид S(G4S)4, где S - остаток серина, a G - остаток глицина.
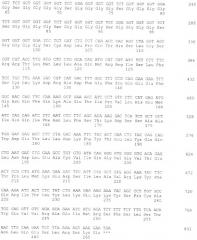
SGGGGSGGGGSGGGGSGGGGS
5'-GATCTGGTGGTGGTGGTTCTGGTGGTGGTGGTTCCGGAGGTGGTGGTTCTGGTGGTGGTG
ACCACCACCACCAAGACCACCACCACCAAGGCCTCCACCACCAAGACCACCACCACCTAG-5'
Рекомбинантную плазмиду pGS-4 конструируют на основе любого подходящего лабораторного вектора, например на основе модифицированного вектора pUC19Bgl, в котором сайт узнавания рестриктазы EcoRI замещен на сайт узнавания рестриктазы BglI. С этой целью синтетический фрагмент ДНК клонируют в выбранном векторе, расщепленном по сайтам BglII и BamHI таким образом, чтобы в составе результирующей плазмиды сайты клонирования были восстановлены.
В результате получают рекомбинантную плазмиду pGS-4, содержащую клонированный синтетический фрагмент ДНК.
Пример 2. Конструирование рекомбинантной плазмиды pGS-16.
Стадия 1. Рекомбинантную плазмиду pGS-4 расщепляют с использованием рестриктаз AatII и BamHI и образовавшиеся фрагменты рестрикции разделяют в геле. Меньший по размеру фрагмент ДНК элюируют из геля и называют фрагмент-1.
Стадия 2. Рекомбинантную плазмиду pGS-4 расщепляют с использованием рестриктаз AatII и BglII и образовавшиеся фрагменты рестрикции разделяют в геле. Больший по размеру фрагмент ДНК элюируют из геля и называют фрагмент-2.
Фрагменты 1 и 2, полученные на стадиях 1 и 2, соответственно, лигируют между собой и полученную плазмиду называют pGS-8.
Повторяют стадии 1 и 2 за исключением того, что на каждой стадии используют плазмиду pGS-8. В результате получают плазмиду pGS-16. Плазмида pGS-16 содержит BglII/BamHI фрагмент ДНК, кодирующий полипептид S(G4S)16, где S - остаток серина, а G - остаток глицина.
Пример 3. Конструирование рекомбинантной плазмиды pGS-20.
AatII/BamHI фрагмент-1 ДНК рекомбинантной плазмиды pGS-4, полученный как описано на стадии 1 примера 2, лигируют с AatII/BglII фрагментом-2 ДНК плазмиды pGS-16, полученным как описано на стадии 2 примера 2.
В результате получают плазмиду pGS-20. Плазмида pGS-20 содержит BglII/BamHI фрагмент ДНК, кодирующий полипептид S(G4S)20, где S - остаток серина, a G - остаток глицина.
Пример 4. Конструирование рекомбинантной плазмиды pUC18x-(Ser)IFN.
Для конструирования рекомбинантной плазмиды pUC18x-(Ser)IFN осуществляют лигирование двух фрагментов ДНК: 1) BamHI/XhoI фрагмента, заключающего векторную часть лабораторной плазмиды pUC18x, содержащей в составе модифицированного полилинкера сайт XhoI вместо сайта EcoRI; 2) BamHI/XhoI фрагмента ДНК, который получают в результате ПЦР-амплификации фрагмента ДНК плазмиды pUC18x-GAL1ppI-IFN2b [RU 2427645] с использованием праймеров N499 (5'-ataggatcctgtgatctgcctcaaacccac) и N169 (5-gagcggataacaatttcacacagg) и последующего открытия его липких концов с использованием рестриктаз BamHI и XhoI.
Плазмида pUC18x-(Ser)IFN заключает нуклеотидную последовательность структурного гена интерферона альфа-2b человека в составе BamHI/XhoI фрагмента ДНК.
Пример 5. Конструирование рекомбинантной плазмиды pUC18x-GAL1ppI-(Ser).
Плазмиду pUC18x-GAL1ppI-(Ser) конструируют путем замещения NcoI/XhoI фрагмента ДНК плазмиды pUC18x-GAL1ppI-IFN2b [RU 2427645] на двуцепочечный синтетический фрагмент ДНК, полученный в результате отжига соответствующих олигонуклеотидов:
5′-catggaaaaaagatctc
cttttttctagagagct-5′
В результате клонирования получают плазмиду pUC18x-GAL1ppI-(Ser), в составе которой в последовательности ДНК, слитой с промоторной областью гена GAL1 дрожжей и кодирующей лидерную пре-про область α-фактора дрожжей, сконструирован сайт узнавания рестриктазы BglII, формируемый кодоном аргинина, входящим в сайт узнавания протеиназы Кех2, и кодоном серина, следующим непосредственно за кодоном аргинина.
Пример 6. Конструирование рекомбинантной плазмиды р71-81.
Используют плазмиду pPDX3-IFN2b, отличающуюся от плазмиды pPDX2-IFN2b [RU 2427645] одиночной нуклеотидной заменой G на А в положении +211 относительно стартового ко дона ATG в последовательности ДНК структурного гена URA3 дрожжей [в кодоне 71 (GAG→AAG)], приводящей к инактивации сайта узнавания рестриктазы NcoI.
Конструирование производят путем одновременного направленного лигирования 4-х фрагментов ДНК, которыми являются:
HindIII/BglII фрагмент ДНК плазмиды pUC18x-GAL1ppI-(Ser), заключающий промоторную область гена GAL1 дрожжей, слитый с последовательностью ДНК, кодирующей лидерную пре-про область α-фактора дрожжей;
BglII/BamHI фрагмент ДНК плазмиды pGS-16, кодирующий полипептид S(G4S)16, где S - остаток серина, a G - остаток глицина;
BamHI/XhoI фрагмента ДНК плазмиды pUC18x-(Ser)IFN, заключающий нуклеотидную последовательность структурного гена интерферона альфа-2b человека;
XhoI/HindIII фрагмент ДНК, заключающий векторную часть плазмиды pPDX3-IFN2b.
В результате получают рекомбинантную плазмиду р71-81 размером 9352 п.о., в составе которой корректно слиты генетические элементы, кодирующие лидерную пре-про область α-фактора дрожжей, аминокислотную последовательность S(G4S)16 и последовательность нативного интерферона альфа-2b человека.
Пример 7. Конструирование рекомбинантной плазмиды р71-82.
Рекомбинантную плазмиду р71-82 конструируют как описано в примере 6, но вместо фрагмента ДНК плазмиды pGS-16 для лигирования используют BglII/BamHI фрагмент ДНК плазмиды pGS-20, кодирующий полипептид S(G4S)20, где S - остаток серина, a G - остаток глицина.
В результате получают рекомбинантную плазмиду р71 - 82 размером 9412 п.о., в составе которой корректно слиты генетические элементы, кодирующие лидерную пре-про область α-фактора дрожжей, аминокислотную последовательность S(G4S)20 и последовательность нативного интерферона альфа-2b человека.
Пример 8. Получение штамма-реципиента Saccharomyces cerevisiae SCR8G1.
Штамм-реципиент является бесплазмидным производным содержащего плазмиду штамма Saccharomyces cerevisiae ВКПМ Y-3550.
Для получения штамма-реципиента клетки штамма S. cerevisiae ВКПМ Y-3550 освобождают от содержащейся в них плазмиды путем культивирования в течение 4 суток при температуре 30°C на агаризованной среде YPGE следующего состава, в мас.%: бактопептон - 2, дрожжевой экстракт - 1, бактоагар - 2, этанол - 2, глицерин - 3, вода - остальное. На этой среде способностью к росту обладают и клетки штамма ВКПМ Y-3550, несущие плазмиду, в составе которой находится ген PGK1, и клетки штамма-реципиента SCR8G1, утратившие эту плазмиду. Затем смесь выросших клеток клонируют.
Утратившие плазмиду клоны селектируют по признаку отсутствия роста на агаризованной среде YPD следующего состава, в мас.%: бактопептон - 2, дрожжевой экстракт - 1, бактоагар - 2, глюкоза - 2, вода - остальное. В результате получают штамм-реципиент S. cerevisiae SCR8G1, который отличается от штамма S. cerevisiae ВКПМ Y-3550 отсутствием способности к росту на среде с глюкозой 20 мг/мл, детерминированной отсутствием в клетках штамма SCR8G1 плазмиды, несущей функциональный аллель гена PGK1.
Пример 9. Получение штамма ВКПМ Y-3927.
Штамм S. cerevisiae ВКПМ Y-3927 - продуцент белка GFN80 получают трансформацией клеток штамма-реципиента S. cerevisiae SCR8G1 рекомбинантной плазмидой р71-81.
Для подготовки к трансформации клетки исходного штамма S. cerevisiae SCR8G1 культивируют в течение 18-24 часов при температуре 28°C на агаризованной среде YPGE. Трансформацию выросших клеток плазмидой р71-82 проводят по методу Ito [Ito et al., 1983] за исключением того, что перед высевом на селективную среду трансформированные клетки инкубируют в течение 3 часов при температуре 30°C на шейкере с орбитальной скоростью 250 об/мин в жидкой среде YPGE. Трансформанты отбирают по способности расти при температуре 30°C на агаризованной среде YPD.
Оценивают уровень экспрессии белка GFN80 клетками полученных трансформантов. Для этого 3 независимо полученных клона трансформантов выращивают в течение 46 часов при температуре 30°C на шейкере с орбитальной скоростью 250 об/мин в жидкой среде YPD до стационарной фазы роста (до оптической плотности 45±5 опт. ед.). Уровень накопления заявляемого белка определяют в освобожденной от клеток среде культивирования. Отбирают клон, продуцирующий белок, имеющий подвижность в условиях электрофореза на уровне 25 килодальтон.
В результате получают штамм S. cerevisiae ВКПМ Y-3927 - продуцент белка GFN80.
Штамм-продуцент S.cerevisiae ВКПМ Y-3927 отличается от штамма-реципиента S. cerevisiae SCR8G1 способностью к росту на среде с глюкозой 20 мг/мл, а от штамма S. cerevisiae ВКПМ Y-3550 способностью к продукции белка GFN80, детерминированной введенной в состав штамма плазмидой р71-81.
Пример 10. Получение штамма ВКПМ Y-3928
Штамм S. cerevisiae ВКПМ Y-3928 - продуцент белка GFN100 получают, как описано в примере 9, за исключением того, что для трансформации используют рекомбинантную плазмиду р71-82.
Отбирают клон, продуцирующий белок GFN100, имеющий подвижность в условиях электрофореза на уровне 31 килодальтон.
В результате получают штамм S. cerevisiae ВКПМ Y-3928 - продуцент белка GFN100.
Штамм-продуцент S.cerevisiae ВКПМ Y-3928 отличается от штамма-реципиента S. cerevisiae SCR8G1 способностью к росту на среде с глюкозой 20 мг/мл, а от музейного штамма ВКПМ Y-3550 - способностью к продукции белка GFN100, детерминированной, введенной в состав штамма плазмидой р71-82.
Пример 11. Микробиологический синтез белка GFN8Q с использованием штамма ВКПМ Y-3927.
Для получения посевного материала штамм S. cerevisiae ВКПМ Y-3927 выращивают в среде YPD на качалке (250 об/мин) при температуре 28°C в течение 20-24 ч.
50 мл посевного материала используют для засева 3 л ферментера Anglicon, содержащего 950 мл среды 223 следующего состава, в мас.%: бактопептон - 2, дрожжевой экстракт - 2, сахароза - 3, вода - остальное. Ферментацию проводят при температуре 28°С, аэрации 1 л/мин и скорости перемешивания 1000 об/мин. Через 24 часа после засева ферментера осуществляют pH-статирование культуры на уровне pH 5,9, используя для подтитровки растворы 10% серной кислоты и 10% NaOH. Общее время ферментации составляет 46 ч.
Продукция зрелого секретируемого белка GFN80 штаммом S. cerevisiae ВКПМ Y-3927 в этих условиях составляет более 150 мг/л.
Пример 12. Микробиологический синтез белка GFN100 с использованием штамма ВКПМ Y-3928.
Микробиологический синтез белка GFN100 проводят, как описано в примере 11, но с использованием штамма S. cerevisiae ВКПМ Y-3928.
Продукция зрелого секретируемого белка GFN100 штаммом S. cerevisiae ВКПМ Y-3928 в этих условиях составляет более 120 мг/л.
Пример 13. Очистка заявляемого белка GFN80 и определение его специфической активности.
Выделение и очистку белка GFN80 из культуральной жидкости, полученной в результате микробиологического синтеза интерферона с использованием штамма ВКПМ Y-3927 (пример 11), проводят при 4-8°C, используя следующие этапы:
1. Культуральную жидкость, содержащую белок GFN80, отделяют от биомассы дрожжей с помощью центрифугирования при 8500g в течение 20 минут.
2. Дальнейшую очистку белка GFN80 из полученного центрифугата осуществляют, используя катионообменную хроматографию на носителе SP-Sepharose Fast Flow (GE Healthcare). Для этого полученный после отделения клеток раствор подкисляют уксусной кислотой до значения pH 4,3±0,1. Подкисленный раствор пропускают через колонку с SP-сефарозой, уравновешенной 50 мМ раствором натрий ацетатного буфера рН 4,3, содержащего 1 мМ ЭДТА (буфер А). После прохождения фильтрата через колонку и последующей промывки колонки буфером А белок GFN80 элюируют раствором 0,5 М NaCl в буфере А.
3. Тонкую очистку белка GFN80 из полученного элюата проводят с использованием метода препаративной обратно-фазовой Высокоэффективной жидкостной хроматографии (офВЭЖХ). Для этого раствор белка наносят на колонку с сорбентом Vydac C18, уравновешенную 0,2%-ным раствором трифторуксусной кислоты (буфер В). Белок GFN80 элюируют градиентом ацетонитрила в буфере В (по программе: от 0 мин до 15 мин - 0%В; от 15 мин до 40 мин - от 0% до 45%В; от 40 мин до 60 мин - 45%В). Элюат сразу же разводят в 5 раз 5 мМ натрий ацетатным буфером, pH 4,0 (буфер C).
4. Полученный разведенный раствор белка подвергают дополнительной очистке методом ионообменной хроматографии на колонке с сорбентом SP-Сефароза. Колонку уравновешивают буфером C, наносят раствор белка и промывают колонку этим же буфером. Белок GFN80 элюируют 0,5 М хлоридом натрия в буфере C.
Характеристика эффективности этапов выделения и очистки белка GFN80 из культураль