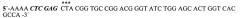Гибридный белок на основе рекомбинантного эритропоэтина человека, обладающий пролонгированным действием (варианты), и способ его получения
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к рекомбинантной продукции белков человека, и может быть использовано для получения гибридного рекомбинантного эритропоэтина человека. Конструируют нуклеотидные последовательности, кодирующие гибридные белки EPO-TR 1,6, EPO-TR 4 и EPO-TR 6. Белок ЕРО-TR 1,6 представляет собой рекомбинантный эритропоэтин человека, слитый с фрагментом TR 1,6 белка MUC1 человека. Белок EPO-TR 4 представляет собой рекомбинантный эритропоэтин человека, слитый с фрагментом TR 4 белка MUC1 человека. Гибридный белок EPO-TR 6 представляет собой рекомбинантный эритропоэтин человека, слитый с фрагментом TR 6 белка MUC1 человека. Гибридные белки получают путем роллерного культивирования в подходящих условиях модифицированной линии клеток млекопитающих СНО, содержащей кодирующую белок нуклеотидную последовательность с последующим выделением гибридного белка из культуральной жидкости. Изобретение позволяет получить гибридный рекомбинантный эритропоэтин человека, обладающий пролонгированным действием. 4 н.п. ф-лы, 4 ил, 7 табл., 9 пр.
Реферат
Изобретение относится к области биотехнологии, а именно к технологии получения с использованием методов генетической инженерии гибридных белков человеческого эритропоэтина (ЭПО), обладающих высокой биологической активностью и пролонгированным действием.
ЭПО является фактором роста и терминальной дифференцировки предшественников эритроцитов в костном мозге.
Синтез эритропоэтина - гормона, регулирующего образование эритроцитов, происходит в почках. Циркулирующий в кровеносной системе ЭПО связывается со специфическими рецепторами клеток-предшественников эритроцитов, вызывая их пролиферацию и дифференциацию. При ряде патологий, особенно при заболеваниях почек, синтез эндогенного ЭПО существенно снижается, что приводит к развитию тяжелых анемических состояний. Введение рекомбинантного ЭПО позволяет эффективно восстанавливать процесс образования эритроцитов, нормализуя тем самым состояние пациентов. В то же время, известно, что ЭПО, как и другие гликопротеины плазмы, быстро подвергается энзиматической деградации, лишаясь сиаловых кислот, что приводит к короткому времени циркуляции в организме и необходимости частого введения белка для достижения максимального клинического эффекта (J. Pharmacology and Exp. Therapeutics: 327, 2, 308-315; British J. of Cancer: 84, Supp.1, 3-10, 2001). Известны несколько стратегий повышения стабильности ЭПО in vivo, обусловленных двумя механизмами элиминации (выведения) ЭПО из организма. Это либо увеличение размеров молекулы ЭПО за счет введения дополнительных лигандов, что приводит к снижению почечного клиренса (скорости выведения ЭПО из организма (J.Biol.Chem: 263, 15064-15070, 1988)), либо введение в молекулу ЭПО дополнительных углеводных цепей, что приводит к большему числу сиаловых групп и снижает уровень элиминации ЭПО через экспрессируемые в клетках печени (гепатоцитах) рецепторы для асиалированных белков - ASGR (American J. Physiology: 227, 6, 1385-1388).
Молекула ЭПО имеет четыре карбогидратных цепи, три из которых связаны с пептидной цепью через азот аспарагина (N-гликозилирование), а одна - через кислород серина (O-гликозилирование). При этом гликолизильные цепи составляют около 40% от молекулярного веса молекулы (British J. of Cancer: 84, Supp.1, 3-10, 2001). Каждая из трех N-углеводных цепей состоит из 2-4 ветвей. Для O-углеводных цепей характерно наличие 1-2 ветвей. Каждая из углеводных цепей может завершаться остатком сиаловой кислоты. Максимальное количество сиаловых кислот в молекуле ЭПО равно 14, что придает всей молекуле ЭПО отрицательный заряд, лишает ее возможности связаться с ASGR-рецепторами гепатацитов и, соответственно, увеличивает время циркуляции в организме.
Как показано при создании коммерческого препарата на основе ЭПО "Aranesp" компании Amgen, введение в молекулу ЭПО двух дополнительных сайтов N-гликозилирования увеличивает время выведения гормона из организма в 3-4 раза (Exp. Hematology: 31, 290-299, 2003; US 7,217,689 В1).
Для получения белка пролонгированного действия - α-дарбэпоэтина использована технология генетической модификации белковой структуры ЭПО. Молекула модифицированного ЭПО (α-дарбэпоэтина) содержит 5 замен в аминокислотной последовательности, две из которых - замена аланина в позиции 30 и триптофана в позиции 88 на аспарагин являются дополнительными сайтами N-гликозилирования. Высокая степень гликозилирования обеспечивает α-дарбэпоэтину пролонгированную биологическую активность и клинический эффект даже при сниженной в два раза, по-сравнению с ЭПО, способности к аффинному взаимодействию со специфическим рецептором (US 7,217,689 B1; British J. of Cancer: 84, supp.1, 3-10, 2001).
При создании гибридного белка ЭПО-(СТР)3, который является ближайшим аналогом заявляемых белков рекоибинантного ЭПО с пролонгированным действием, показано, что введение в молекулу ЭПО дополнительных сайтов O-гликозилирования также увеличивает время циркуляции гормона в организме (US 20070190610 А1). В состав гибридного белка ЭПО-(СТР)3 входят три C-концевых пептида β-субъединицы хорионического гонадотропина человека (СТР), каждый из которых содержит по четыре сайта O-гликозилирования (Intern. J. Cell Biology: 2011, ID 275063; US 20070190610 А1). Два СТР пептида расположены на С-конце молекулы ЭПО и один - на N-конце (US 20070190610 А1). Таким образом гибридный белок ЭПО-(СТР)3 имеет в отличие от ЭПО 12 дополнительных сайтов O-гликозилирования, что обеспечивает снижение клиренса и увеличение времени циркуляции ЭПО-содержащего белка в организме, по сравнению с ЭПО. При этом время полувыведения белка для ЭПО-(СТР)3 близко к аналогичному параметру α-дарбэпоэтина, а аффинность взаимодействия с ЭПО-рецептором не снижена.
Задача заявляемой группы изобретений - расширить арсенал белков на основе рекомбинантного эритропоэтина человека, обладающих пролонгированным действием, и разработать способ получения таких белков.
Поставленная задача решена путем получения
- гибридного белка EPO-TR 1,6, обладающего пролонгированным действием, соответствующего аминокислотной последовательности SEQ ID NO 4 и представляющего собой рекомбинантный эритропоэтин человека, слитый с фрагментом TR 1,6 белка MUC 1 человека;
- гибридного белка EPO-TR 4, обладающего пролонгированным действием, соответствующего аминокислотной последовательности SEQ ID NO 5 и представляющего собой рекомбинантный эритропоэтин человека, слитый с фрагментом TR 4 белка MUC1 человека;
- гибридного белка EPO-TR 6, обладающего пролонгированным действием, соответствующего аминокислотной последовательности SEQ ID NO 6 и представляющего собой рекомбинантный эритропоэтин человека, слитый с фрагментом TR 6 белка MUC 1 человека и
- разработки способа получения гибридного белка EPO-TR 1,6 или EPO-TR 4 или EPO-TR 6 путем роллерного культивирования в подходящих условиях модифицированной линии клеток млекопитающих СНО, содержащей нуклеотидную последовательность SEQ ID NO 1 или SEQ ID NO 2 или SEQ ID NO 3 с последующим выделением гибридного белка из культуральной жидкости.
Заявляемые белки характеризуются тем, что не имеют лигандов на N-концевом участке молекулы ЭПО, а для создания дополнительных сайтов O-гликозилирования у заявляемых белков в качестве лиганда молекулы ЭПО использован фрагмент человеческого гликопептида MUC 1. Этот фрагмент представляет собой наиболее гликозилированный в молекуле MUC 1 пептидный участок (VNTR), состоящий из 20-120 повторов пептида TR. Каждый такой пептид TR состоит из 20 аминокислот и содержит пять потенциальных сайтов O-гликозилирования (Oncogene: 29, 20, 2893-2904, 2010; Glycobiology: 15 (2), 177-191, 2005). Заявляемые белки EPO-TR 1,6, EPO-TR 4 и EPO-TR 6 представляют собой ЭПО, слитый с фрагментами TR разной длины (1,6; 4 и 6, соответственно) на C-концевом участке молекулы ЭПО.
Этапы конструирования штаммов-продуцентов
Конструирование штаммов-продуцентов состоит из следующих этапов:
1. Получение генетических конструкций для экспрессии заявляемого белка EPO-TR 1,6 методом перекрывающейся полимеразной цепной реакции (SOE-PCR) с использованием в качестве матрицы структурной части гена ЭПО (NP_000790.2) и получение генетических конструкций для экспрессии заявляемого белка EPO-TR 4 или EPO-TR 6 путем полимеризации нуклеотидной последовательности мономерного пептида TR, содержащей на 5' и 3'-концах сайты рестрикции для эндонуклеаз II-го порядка BclI и BamHI, позволяющих получать полинуклеотидные фрагменты произвольной кратности.
2. Генетическая модификация клеточной линии СНО DG44 (Invitrogen, США), заключающаяся во встраивании в ДНК сайтов направленной интеграции гена интереса (FRT).
3. Конструирование экспрессионных векторов для получения заявляемых белков в клетках эукариот путем лигирования генетических конструкций в pcDNA5/FRT вектор (Invitrogen, США).
Штаммы-продуценты заявляемых белков СНО DG44 (FRT+/DHFR+)-EPO-TR 1,6 №1F7, СНО DG44 (FRT+/DHFR+)-EPO-TR 4 №1F7 и СНО DG44 (FRT+/DHFR+)-EPO-TR 6 №1F7 депонированы во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) и имеют номера: ВКПМ Н-136, ВКПМ Н-138 и ВКПМ Н-137, соответственно.
Способ в общем виде
Штамм-продуцент заявляемого белка ВКПМ Н-136 или ВКПМ Н-138 или ВКПМ Н-137 выращивают в виде адгезионной культуры в процессе роллерного культивирования. Для этого в роллерный флакон, площадью 850 см2, добавляют 250 мл культуральной среды ДМЕМ/F12 (ПанЭко, Россия), содержащей 8% фетальной сыворотки и 8 мМ L-глутамина, и засевают клетками штамма-продуцента в количестве 6,0-8,0×104 клеток на см2. Процесс культивирования проводят в течение 14 суток в CO2-инкубаторе с роллерной установкой в стандартных для адгезионных клеточных линий условиях: 5% CO2, температура 37°С, влажность не менее 90% и скорость 3-4 об/мин. Замену культуральной среды в роллерном флаконе на свежую того же состава проводят на 3, 5, 7, 9, 11, 14 сутки после посева штамма-продуцента. Собранные сливы культуральной жидкости освобождают от клеток центрифугированием в течение 20 мин при 400*g и хранят при температуре - 20°С до использования. Выход конечного продукта - белка EPO-TR 1,6 или EPO-TR 4 или EPO-TR 6 - составляет 20-40 мкг/мл.
Выделение заявляемого белка из культуральной жидкости проводят методом аффинной хроматографии (Аберкромби Д., Алленмарк С. и др. Аффинная хроматография. Методы: изд. Мир, 1988. - 278 с., под ред. П. Дина, У. Джонсона, Ф. Мидла, пер. с англ. Б.А. Клящицкого). На первом этапе собранные 1500 мл культуральной жидкости размораживают, фильтруют через мембрану с номинальным отсечением 0,45 мкм (Миллипор, США), добавляют твин-20 до конечной концентрации 0,02% по объему и азид натрия до 0,04% по объему. Подготовленную таким образом культуральную жидкость медленно наносят при температуре 4°С на предварительно уравновешенную колонку с сефарозой CL - 2В (Sigma, США), объемом 70 мл, с иммобилизованными методом периодатного окисления моноклональными антителами ЭПО-1-3, специфичными к ЭПО (RU2451071).
По окончании сорбции и исчерпывающей отмывки колонки 10 мМ фосфатным буфером с рН 7,4, содержащим 0,5 М хлорид натрия и 0,02% твина-20, осуществляют элюцию белка 200 мМ глициновым буфером с рН 2,2, содержащим 1М NaCl и твин-20 в концентрации 0,02%. Раствор элюированного белка, объемом 70-75 мл, немедленно нейтрализуют добавлением 700-750 мкл 3 М трисового буфера с рН 9,0. Выход выделенного белка EPO-TR 1,6 или ЕРО-TR 4 или EPO-TR 6 составляет не менее 70%.
Далее проводят ионообменную хроматографию выделенного белка на сорбенте MonoQ HR5/5 (Pharmacia, Швеция), в соответствии с методами выделения сиалированных изоформ ЭПО-содержащих рекомбинантных белков (US 20090092607; Биотехнология: №5, 38-59, 2012). Для этого полученный на первом этапе выделения раствор белка концентрируют до объема 3-5 мл, используя ячейки Amicon Ultra-15, при 4000tg в течение 15 мин и температуре 23°С. Полученный концентрат доводят до 50 мл 20 мМ трис-HCl буфером с рН 7,3 и повторно концентрируют до объема 5 мл таким же способом, а затем пропускают полученный концентрат через MonoQ HR5/5 со скоростью 0,5 мл/мин. Далее сорбент промывают 3 мл 20 мМ натрий ацетатного буфера с рН 4,5, для удаления слабосиалированных изоформ белка EPO-TR 1,6 или EPO-TR 4 или EPO-TR 6 с изоточками выше 4,5. Затем сорбент уравновешивают 3 мл 20 мМ трис-HCl буфера с рН 7,3 и элюируют фракцию сиалированных изоформ белка EPO-TR 1,6 или EPO-TR 4 или EPO-TR 6 градиентом ионной силы при 0,22-0,25 М хлорида натрия. Выход конечного продукта на данной стадии составляет 80-86% от нанесенного белка. Полученные таким образом образцы белков хранят при температуре -20°С в 0,05 М Na-фосфатном буфере с рН 7,4, содержащим 0,15 М хлорида натрия.
Изобретение иллюстрировано фигурами 1-4.
Фиг.1. Иммунохимическая характеристика заявляемых белков методом Вестерн блота с последующим проявлением моноклональными антителами к ЭПО (RU2451071) и конъюгата козьих анти-IgG(мыши) антител с пероксидазой.
- по вертикали:
маркеры молекулярного веса от 70 до 10 кД обозначены стрелками слева от фиг.1 (Precision Plus Protein Dual Color Standards, Biorad, США);
по горизонтали:
треки разделяемых белков, а именно:
1 - маркеры молекулярного веса;
2 - EPO-TR 6;
3 - EPO-TR 4;
4 - EPO-TR 1,6.
На Фиг.2-4:
По оси Х - дни забора крови и измерения показателей:
А) процента ретикулоцитов среди эритроцитарных клеток (RET, %),
Б) общего гемоглобина крови экспериментальных животных (HGB, г/дл),
В) гематокрита крови экспериментальных животных (НСТ, %).
По оси Y - величина RET, % или НОВ, г/дл или НСТ, % (каждая точка представлена средним значением ± SD при p<0,05), обозначенные:
- сплошной линией с незаштрихованным прямоугольным маркером для α-дарбпоэтина;
- сплошной линией с круглым маркером для стандарта рекомбинантного эритропоэтина EPO-BRP («Erythropoietin BRP» (EPO-BRP, E1515000));
- прерывистой линией для контроля фосфатного буфера, содержащего 0,1% бычьего сывороточного альбумина.
Фиг.2. Результаты измерения показателей крови экспериментальных животных в период со 2 по 15 день после подкожного введения 30 пмоль гибридного белка EPO-TR 1,6 в сопоставлении со EPO-BRP и α-дарбпоэтином;
- сплошной линией с заштрихованным прямоугольным маркером для гибридного белка EPO-TR 1,6;
Фиг.3. Результаты измерения показателей крови экспериментальных животных в период со 2 по 15 день после подкожного введения 30 пмоль гибридного белка EPO-TR 4 в сопоставлении с EPO-BRP и α-дарбпоэтином;
- сплошной линией с заштрихованным прямоугольным маркером для гибридного белка EPO-TR 4;
Фиг.4. Результаты измерения показателей крови экспериментальных животных в период со 2 по 15 день после подкожного введения 30 пмоль гибридного белка EPO-TR 6 в сопоставлении с рекомбинантным ЭПО (EPO-BRP) и α-дарбпоэтином;
- сплошной линией с заштрихованным прямоугольным маркером для гибридного белка EPO-TR 6;
Пример 1. Получение генетических конструкций для экспрессии заявляемых белков.
Для экспрессии белка EPO-TR 1,6 или EPO-TR 4 или EPO-TR 6 в клетках млекопитающих СНО DG44 (FRT+/DHFR+) используют экспрессионный вектор pcDNA5/FRT (Invitrogen, США). Этот вектор содержит: 1. CMV промотер, обеспечивающий высокий уровень экспрессии; 2. FRT сайты для направленной интеграции целевого гена в геном клеток-продуцентов; 3. Ген устойчивости к гигромицину для селекции стабильных клеточных штаммов-продуцентов.
Генетическая конструкция для экспрессии белка EPO-TR 1,6 (SEQ ID NO:1) получена методом перекрывающейся полимеразной цепной реакции (SOE-PCR) с использованием в качестве матрицы структурной части гена ЭПО (NP_000790.2) (Molecular cloning: 3 ed, ext. 13.36, N-Y, 2001), а для экспрессии белков EPO-TR 4 (SEQ ID NO:2) или EPO-TR 6 (SEQ ID NO:3) - путем полимеризации мономерных пептидов TR, содержащего на 5' и 3'-концах сайты рестрикции для эндонуклеаз рестрикции II-го порядка BclI и BamHI (Биоорганическая химия, 26, 6, 423-432, 2000) с последующим лигированием в экспрессионный вектор pcDNA5/FRT, содержащий ген ЭПО.
Для подтверждения корректности структуры полученные нуклеотидные последовательности SEQ ID NO:1 или SEQ ID NO:2 или SEQ ID NO:3 лигировали в клонирующий вектор pUC-57 (Invitrogen, США), используемый для трансформации клеток штамма E.coli ТОР10. Селекцию клонов E.coli TOP10 проводили по стандартной методике на чашках с X-gal/IPTG-агаром (blue/white - тест). Далее использовали процедуру секвенирования стандартными праймерами для вектора pUC-57. Затем, последовательность, кодирующую белок EPO-TR 1,6 или EPO-TR 4 или EPO-TR6, вырезают по сайтам рестрикции, очищают в агарозном геле и лигируют в экспрессионный вектор pcDNA5/FRT.
Для получения генетической конструкции, соответствующей нуклеотидной последовательности SEQ ID NO:1, методом перекрывающейся полимеразной цепной реакции (SOE-PCR) используют праймеры 1-4 (табл.1), (ЗАО «Евроген», Россия).
| Табл.1 | |
| Праймеры для конструирования SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3 |
| Подчеркнутые последовательности нуклеотидов 2, 3 и 4 перекрываются при амплификации. Внесенные сайты рестрикции выделены курсивом, старт-кодон выделен жирным шрифтом, стоп-кодон помечен звездочкой. | ||
| № праймера | Нуклеотидная последовательность | Сайты рестрикции |
| 1 | 5'-TTT GCT AGC ATG GGG GTG CAC GAA TGT CCT GCC-3' | NheI |
| 2 | 5'-CAC TGG TCA CGC CAT GTG CTG GCG GTG CGG TTG АТС CGT CCC CTG TCC TGC-3' | |
| 3 | 5'-TGC GGT TGA TCC CGG TGC CGG ACG GGT АТС TGG AGC ACT GGT CAC GCC AT-3' | |
| 4 | XhoI | |
| 5 | 5'-TTTT TGA TCA ACC GCA CGC CAG CAC ATG GCG TGA CCA GTG CT-3' | BclI |
| 6 | 5'-AAA AGG ATC CCG GTG CCG GAC GGG TAT CTG GAG CAC TGG TCA CGC CA-3' | BamHI |
| 7 | XhoI |
Для этого на первом этапе проводят 25 циклов амплификации с температурой отжига 47°С прямым праймером 1 и обратным праймером 2. Полученный и очищенный в агарозном геле продукт длиной 622 пар нуклеотидов (п.н.) используют для второго этапа амплификации с праймером 1 и обратным праймером 3 (25 циклов с температурой отжига 46°С). ПЦР продукт 657 п.н. используют для третьего этапа ПЦР с праймером 1 и обратным праймером 4 (25 циклов с температурой отжига 65°С). Полученный продукт SEQ ID NO:1 длиной 693 п.н. фосфорилируют с использованием ДНК киназы Т4 и лигируют по тупым концам в клонирующий вектор pUC-57 по сайту рестрикции SmaI для последующей идентификации. Идентифицированную конструкцию SEQ ID NO:1 вырезали из вектора pUC-57 по сайтам NheI и XhoI и лигируют в экспрессионный вектор pcDNA5/FRT, порезанный по тем же сайтам.
Полимеризацию мономерного пептида TR для генетических конструкций SEQ ID NO:2 или SEQ ID NO:3 осуществляют с использованием полученного ранее вектора pUC57-TR 1, в котором структура пептида фланкирована участками узнавания рестриктаз BclI и BamHI, позволяющими проводить полимеризацию мономера и получать полинуклеотидные фрагменты произвольной кратности (Биорган. химия: 26, 6, 423-432, 2000). Полученный в результате рестрикции из pUC57-TR 1 мономерный пептид TR, содержащий с 5' конца сайт рестрикции BclI, и с 3' конца сайт рестрикции BamHI достраивают комплементарными олигонуклеотидами с использованием праймеров 5 и 6 или 5 и 7 (Табл 1.), получая соответственно нуклеотидные последовательности TR 1 или TR 2. Последовательность TR1 клонируют в векторе pUC-57, идентифицируют и используют для полимеризации путем последовательных рестрикций - лигирования по BclI и BamHI.
Далее в эту лигазную смесь добавляют предварительно порезанную по BclI сайту и обработанную щелочной фосфатазой плазмиду pUC-TR 2, содержащую последовательность мономерного пептида TR со стоп-кодоном.
Лигазной смесью трансформируют клетки E.coli. В последующем скрининге выбирают ДНК-вставки, содержащие 4 или 6 повторов пептида TR. Идентифицированные ДНК, содержащие последовательности полимеров TR 4 и TR 6, вырезают по сайтам рестрикции BclI и XhoI, очищают в агарозном геле и лигируют в экспрессионный вектор pcDNA5/FRT, содержащий ген человеческого эритропоэтина, по сайтам BamHI и XhoI.
В результате получают нуклеотидную последовательность SEQ ID NO:1, длиной 693 п.н. или SEQ ID NO:2, длиной 828 п.н. или SEQ ID NO:3, длиной 948 п.н. и экспрессионный вектор pcDNA5/FRT, со встроенной нуклеотидной последовательностью SEQ ID NO:1 или SEQ ID NO:2 или SEQ ID NO:3, предназначенный для получения штамма-продуцента гибридного белка EPO-TR 1,6, соответствующего аминокислотной последовательности SEQ ID NO:4 или EPO-TR 4 - аминокислотной последовательности SEQ ID NO:5 или EPO-TR 6, с аминокислотной последовательности SEQ ID NO:6, соответственно. Расчетный молекулярный вес экспрессируемых белков EPO-TR 1,6, EPO-TR 4 и EPO-TR 6, охарактеризованный в программе Vector NTI.10 (Invitrogen, США), составляет 21,2 кД, 25,8 кД и 29,5 кД, соответственно.
Пример 2. Получение генно-модифицированной клеточной линии СНО DG44 (FRT+/HFR+) и штаммов-продуцентов заявляемых белков.
Генно-модифицированную линию клеток СНО DG44 (FRT+/DHFR+) получают путем трансфекции линии клеток СНО DG44 (Invitrogen, США) вектором pFRT/LacZeo/DHFR, содержащим кассету генов: ген дегидрофолатредуктазы (DHFR), слитый ген β-галактозидазы и маркера устойчивости к зеоцину (LacZeo), под контролем промотера pSV40Δ гены, а также сайт специфической гомологичной рекомбинации для Flp рекомбиназы (FRT).
Вектор pFRT/LacZeo/DHFR получают путем лигирования в вектор pcDNA5(FRT)LacZeo2, несущий FRT-последовательность для связывания дрожжевой рекомбиназы и слитый ген LacZeo (Invitrogen, США), структурной части гена DHFR мыши, взятой из вектора pOptiVEC (Invitrogen, США), и промоторной области SV40 вектора pCI-neo (Promega).
По окончании этапа двухмаркерной селекции линии клеток СНО DG44 (FRT+/DHFR+) (устойчивость к зеоцину и восстановление фенотипа dhfi^) и восстановления ростовых характеристик выполняют процедуру клонирования. Для конструирования штаммов-продуцентов выбирают клон линии СНО DG44 (FRT+/DHFR+), обладающий лучшими показателями транскрипционной активности и стабильности экспрессии гена lacZeo. Штаммы, экспрессирующие белок EPO-TR 1,6 или EPO-TR 4 или EPO-TR 6, получают в результате со-трансфекции линии СНО DG44 (FRT+/DHFR+) экспрессионным вектором pcDNA5/FRT, со встроенной нуклеотидной последовательностью SEQ ID NO:1 или SEQ ID NO:2 или SEQ ID NO:3 (Пример 1), и плазмидой pOG44 (Invitrogen, США), несущей ген дрожжевой рекомбиназы, в соотношении 1:9. Селекцию и клонирование полученных штаммов проводят при концентрации гигромицина 600 мкг/мл. Метотрексат-зависимую амплификацию клонированных штаммов проводят при концентрациях метотрексата 250-1000 мкМ и поддерживающей дозе гигромицина 50 мкг/мл. Содержание заявляемых белков в к.ж. оценивают использованием ИФА на ЕРО (Эритропоэтин-ИФА-Бест, ЗАО «Вектор-Бест», Россия).
В результате получены модифицированная линия клеток млекопитающих СНО DG44 (FRT+/DHFR+) и штаммы СНО DG44 (FRT+/DHFR+)-EPO-TR 1,6 №1F7, СНО DG44 (FRT+/DHFR+) - EPO-TR 4 №1F7 и СНО DG44 (FRT+/DHFR+) - EPO-TR 1,6 №1F7.
Пример 3. Экспрессия и очистка заявляемого белка EPO-TR 1,6.
Для получения белка EPO-TR 1,6 проводят роллерное культивирование штамма-продуцента СНО DG44 (FRT+/DHFR+) EPO-TR 1,6 №1F7. Роллерные флаконы, площадью 850 см 2, засевают клетками штамма-продуцента в количестве 4,0 тыс. клеток на см2. Культивирование проводят в среде ДМЕМ /F12 (ПанЭко, Россия), содержащей 8% фетальной сыворотки. Объем среды составляет 250 мл. Процесс роллерного культивирования проводят в СО2-инкубаторе с роллерной установкой при 37°С, 5% CO2, влажности >90% и скорости 3-4 об/мин. Замену культуральной среды в роллерном флаконе на свежую того же состава проводят на 3, 5, 7, 9, 11, 14 сутки после посева штамма-продуцента. Собранные сливы культуральной жидкости (к.ж.) освобождают от клеток центрифугированием в течение 20 мин при 400*g и хранят при температуре - 20°С. Определение количественного содержания белка EPO-TR 1,6 в культуральной жидкости проводят методом иммуноферментного анализа (Эритропоэтин-ИФА-Бест, ЗАО «Вектор-Бест») (табл.2). Содержание белка EPO-TR 1,6 в полученной культуральной жидкости составляет 29 мг/мл.
Для выделения белка EPO-TR 1,6 полученные в результате роллерного культивирования 1500 мл культуральной жидкости размораживают и фильтруют через мембрану с номинальным отсечением 0,45 мкм (Миллипор С.А.). Затем добавляют твин-20 до конечной концентрации 0,02% по объему и азид натрия до 0,04% по объему.
Выделение белка осуществляют методом аффинной хроматографии. Для сорбции белка EPO-TR 1,6 подготовленную таким образом культуральную жидкость медленно наносят при температуре 4°С на предварительно уравновешенную колонку с сефарозой CL - 2В (Sigma, США), объемом 70 мл, с иммобилизованными моноклональными антителами ЭПО-1-3, специфичными к ЭПО (RU2451071). По окончании сорбции и исчерпывающей отмывки колонки 10 мМ фосфатным буфером с рН 7,4, содержащим 0,5 М хлорид натрия и 0,02% твина-20, проводят элюцию белка EPO-TR 1,6 200 мМ глициновым буфером с рН 2,2, содержащим 1М NaCl и твин-20 в концентрации 0,02%. Раствор элюированного белка, объемом 71 мл, немедленно нейтрализуют добавлением 710 мкл 3 М трисового буфера с рН 9,0. Выход белка EPO-TR 1,6 после аффинной хроматографии составляет 79%.
Далее проводят ионообменную хроматографию выделенного EPO-TR 1,6 на сорбенте MonoQ HR5/5 (Pharmacia, Швеция), подготовленном в соответствии с инструкцией производителя. Для этого полученный на предыдущей стадии белок EPO-TR 1,6 концентрируют до объема 5 мл, используя ячейки Amicon Ultra-15, при 4000*g в течение 15 мин и температуре 23°С. Полученный концентрат доводят до объема 50 мл 20 мМ буфером трис-HCl с рН 7,3 и повторно концентрируют до объема 5 мл. Полученный объем пропускают через MonoQ HR5/5 со скоростью 0,5 мл/мин. Далее ионообменный сорбент промывают 3 мл 20 мМ натрий ацетатного буфера с рН 4,5, для удаления слабосиалированных изоформ белка EPO-TR 1,6 с изоточками выше 4,5.
| Табл.2 | |||
| Содержание белка EPO-TR 1,6 в к.ж. и в выделенном препарате | |||
| Клеточная линия штамма-продуцента | Содержание EPO-TR 1,6 в к.ж., мкг/мл | Содержание EPO-TR 1,6 в препарате после очистки, мг/мл | Молярная концентрация EPO-TR 1,6 в выделенном препарате, нМ/мл |
| 1 | 2 | 3 | 4 |
| СНО DG44(FRT+/DHFR+)-EPO-TR 1,6 | 29 | 2 | 35 |
Затем сорбент уравновешивают 3 мл 20 мМ трис-НСд буфера с рН 7,3 и элюируют фракцию кислых изоформ белка EPO-TR 1,6 при 0,22 М хлорида натрия. Объем элюата составляет 4 мл. Концентрацию очищенного белка EPO-TR 1,6 определяют методом Брэдфорд (BioRad Protein Assay, BioRad, США). Выделенная фракция кислых изоформ EPO-TR 1,6 составляет 86% от общего количества нанесенного на MonoQ HR5/5 белка EPO-TR 1,6. Очищенный образец белка EPO-TR 1,6 переводят в 0,05 М Na-фосфатный буферный раствор с рН 7,4, содержащий 0,15 М NaCl, доводя концентрацию белка в растворе до 2 мг/мл, и хранят при -20°С.
Иммунохимические свойства белка EPO-TR 1,6 характеризуют методом электрофореза в 12,5% полиакриламидном геле, содержащем додецилсульфат натрия, по стандартному протоколу Лэммли с последующим Вестерн блотом. Белок переносят на нитроцеллюлозную мембрану с размером пор 0,45 мкм в течение 30 минут при 5 мА/см2 (Biorad, США). Далее нитроцеллюлозу с перенесенным белком инкубируют при комнатной температуре в течение 1 ч в растворе, содержащем 3% молока для иммунноблотинга (Biorad, США), затем инкубируют с моноклональными антителами мыши к ЭПО 2А1 (RU2451071) в течение 2 ч, с последующей 3-кратной отмывкой фосфатным буфером с рН 7,2, содержащим 0,05% твина-20. Иммуноспецифическое проявление белка EPO-TR 1,6 выявляют после 2 ч инкубации с пероксидазным конъюгатом моноклональных антител козы к иммуноглобулину мыши (ООО «Сорбент», Россия) в разведении 1:3000 с использованием хромогенной субстратной смеси с тетраметилбензидином (Sigma, США).
Результаты идентификации белка EPO-TR 1,6 в Вестерн блоте представлены на Фиг.1, трек 4. Заявляемый белок EPO-TR 1,6 характеризуется молекулярной массой 55 кД, рассчитанной по маркерам молекулярного веса (Biorad, США), превышающей расчетный вес 21,2 кД (см. Пример 1), что свидетельствует о гликозилированности экспрессируемого белка.
Пример 4. Экспрессия и очистка заявляемого белка EPO-TR 4.
Получение белка EPO-TR 4 проводят так же, как белка EPO-TR 1,6 (пример 3), но с использованием штамма СНО DG44 (FRT+/DHFR+) EPO-TR 4 №1F7. При этом содержание белка EPO-TR 4 в полученной к.ж. составляет 20 мкг/мл.
Выделение белка EPO-TR 4 из к.ж. осуществляют аналогично процедуре, приведенной в примере 3, но получают 74 мл элюированного белка, который нейтрализуют добавлением 740 мкл 3 М трисового буфера с рН 9,0. Выход очищенного EPO-TR 4 после аффинной хроматографии составляет 76%.
Полученный раствор белка EPO-TR 4 концентрируют до объема 3 мл, используя ячейки Amicon Ultra-15, как в примере 3. Концентрат доводят до 50 мл 20 мМ буфером трис-HCl с рН 7,3 и повторно концентрируют до объема 3 мл. Ионообменную хроматографию выделенного EPO-TR 4 проводят аналогично процедуре, приведенной в примере 3. Выделенная фракция кислых изоформ EPO-TR 4 составляет 83% от общего количества нанесенного на MonoQ HR5/5 белка EPO-TR 4.
| Табл.3 | |||
| Содержание белка EPO-TR 4 в к.ж. и в выделенном препарате | |||
| Клеточная линия штамма-продуцента | Содержание EPO-TR 4 в к. ж., мкг/мл | Содержание EPO-TR 4 в препарате после очистки, мг/мл | Молярная концентрация EPO-TR 4 в выделенном препарате, нМ/мл |
| 1 | 2 | 3 | 4 |
| СНО DG44 (FRT+/DHFR+)-EPO-TR 4 | 20 | 2 | 33 |
Иммунохимические свойства белка EPO-TR 4 определяют как описано в примере 3. Результаты идентификации EPO-TR 4 представлены на Фиг.1, трек 3. Заявляемый белок EPO-TR 4 характеризуется молекулярной массой 60 кД, рассчитанной по маркерам молекулярного веса (Biorad, США), превышающей расчетный вес 25,8 кД (см. Пример 1), что свидетельствует о гликозилированности экспрессируемого белка.
Пример 5. Экспрессия и очистка заявляемого белка EPO-TR 6.
Получение белка EPO-TR 6 проводят так же, как в примере 3, но с использованием штамма-продуцента СНО DG44 (FRT+/DWR+) EPO-TR 6 №1F7. При этом содержание гибридного белка EPO-TR 6 в полученной к.ж. составляет 21 мкг/мл. Выделение белка EPO-TR 6 из к.ж. осуществляют аналогично примеру 3, но получают 75 мл элюированного белка, который нейтрализуют добавлением 750 мкл 3 М трисового буфера с рН 9,0. Выход EPO-TR 6 после аффинной хроматографии составляет 73%.
Полученный раствор белка EPO-TR 6 концентрируют до объема 3 мл, используя ячейки Amicon Ultra-15, и проводят ионообменную хроматографию выделенного EPO-TR 6, как описано в примерах 3. Выделенная фракция кислых изоформ EPO-TR 6 составляет 87% от общего количества нанесенного на MonoQ HR5/5 белка EPO-TR 6.
| Табл.4 | |||
| Содержание EPO-TR 6 в к.ж. и в выделенном препарате | |||
| Клеточная линия штамма-продуцента | Содержание EPO-TR 6 в к.ж., мкг/мл | Содержание EPO-TR 6 в препарате после очистки, мг/мл | Молярная концентрация EPO-TR 6 в выделенном препарате, нМ/мл |
| 1 | 2 | 3 | 4 |
| СНО DG44 (FRT+/DHFR+)-EPO-TR 6 | 21 | 2 | 28 |
Иммунохимические свойства белка EPO-TR 6 характеризуют как описано в примере 3.
Результаты идентификации EPO-TR 6 представлены на Фиг.1, трек 2. Заявляемый белок EPO-TR 6 характеризуется молекулярной массой 70 кД, рассчитанной по маркерам молекулярного веса (Biorad, США), превышающей расчетный вес 29,5 кД (см. Пример 1), что свидетельствует о гликозилированности экспрессируемого белка.
Пример 6. Оценка биологической активности заявляемых белков in vitro.
Биоактивность in vitro заявляемого белка EPO-TR 1,6 или EPO-TR 4 или EPO-TR 6 определяют по их способности связываться с рецептором ЭПО и таким образом инициировать пролиферацию чувствительной к ЭПО клеток линии UT-7/EPO. Скорость пролиферации клеток линии UT-7/EPO пропорциональна количеству гормона ЭПО (или его модификации), добавленного в среду (Blood, 1993, Vol 82, pp 456-464). Скорость пролиферации определяют с помощью колориметрического теста. Метод основан на реакции восстановления бесцветных тетразолиевых солей с образованием окрашенного соединения - формазана. Восстановление солей тетразолиума происходит только под воздействием ферментативной активности живых клеток - сукцината дегидрогеназы. Степень окрашивания пропорциональна количеству живых клеток и позволяет измерить степень клеточной пролиферации (Mosmann Т., J.Immunol.Methods, 1983, 65(1-2), Р. 55-63). В качестве субстрата для ферментативной реакции используют реакционную смесь для колориметрического измерения пролиферации клеток фирмы Promega (CellTiter 96R AQueous One Solution Cell Proliferation Assay), содержащую 3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2Н-тетразолиум (MTS) и феназин метосульфат (PMS) (Promega, Madison, WI, USA).
В качестве стандарта используют препарат рекомбинантного эритропоэтина человека - EPO-BRP.
Клетки линии UT-7/EPO выращивают в среде IMDM (ПанЭко, Россия) с добавлением 2 мМ L-глутамина (ПанЭко, Россия), 10% фетальной сыворотки (Invitrogen, США) и 1 МЕ/мл рекомбинантного ЭПО. Непосредственно перед проведением теста клеткам заменяют питательную среду на свежую без добавления ЭПО и инкубируют 24 часа для истощения концентрации гормона ЭПО в клетках. Истощенные таким образом клетки рассаживают в 96-луночном планшете (2*103 клеток/на лунку) в 75 мкл среды IMDM с 0,5% фетальной сыворотки. Далее в те же лунки добавляют по 25 мкл среды, содержащей от 0 до 500 пикомолей (пкМ) одного из заявляемых гибридных белков или стандарта рекомбинантного ЭПО. Планшеты со стимулированными клетками инкубируют в течение 72 часов при 37°С в инкубаторе с 5% CO2. Далее к клеткам добавляют по 20 мкл субстрата. Цветная реакция развивается в течение 2-х часов при 37°С, и поглощение (А) измеряют при длине волны 490 нм.
Расчет показателя ED50 (табл.5), который представляет собой концентрацию белка, вызывающую 50%-ый уровень пролиферации чувствительных клеток, производят в программе GraphPad PRISM.
| Таблица 5 | |
| ED50 для стандарта рекомбинантного эритропоэтина EPO-BRP и заявляемых белков EPO-TR 1,6, EPO-TR 4 и EPO-TR 6 | |
| Вид ЭПО-содержащего белка | ED50 (пкМ) |
| EPO-BRP | 18,18±1,09 |
| EPO-TR 1.6 | 8,18±1,12 |
| EPO-TR 4 | 8,656±1,07 |
| EPO-TR 6 | 10,01±1,14 |
Представленные в табл.5 данные позволяют заключить, что все заявляемые белки способны взаимодействовать с клеточными рецепторами к ЭПО и вызывать ЭПО-зависимую пролиферацию чувствительных клеток UT-7/EPO. Сопоставление величин ED50 для стандарта рекомбинантного ЭПО и заявляемых белков показывает, что для достижения одного и того же пролиферативного эффекта требуется значительно большее количество стандартного рекомбинантного ЭПО, чем заявляемых белков.
Таким образом, заявляемые белки EPO-TR 1,6, EPO-TR 4 и EPO-TR 6 обладают функциональными свойствами рекомбинантного ЭПО человека, то есть способны взаимодействовать с рецепторами к ЭПО и вызывать пролиферацию клеток in vitro.
Пример 7. Оценка биологической активности заявляемых белков in vivo.
Для оценки биологической активности гибридных белков EPO-TR 1,6, EPO-TR 4 и EPO-TR 6 in vivo используют в качестве модели мышей линии Balb/c (Brazilian Journal of Medical and Biological Research: 36, 1561-1569, 2003).
Каждый из заявляемых белков EPO-TR 1,6, EPO-TR 4 или EPO-TR 6 вводят подкожно группе из восьми животных. Объем введенного белка составляет 0,5 мл. Содержание биологически активного белка во введенном препарате составляет от 0,075 до 0,3 мкг в 1 мл фосфатно-солевого буфера (рН 7,2), содержащего 0,1% бычьего сывороточного альбумина. Данный диапазон концентраций позволяет получать линейную зависимость между количеством ретикулоцитов и дозой белка. Тот же буферный раствор с альбумином вводят подкожно контрольной группе животных.
Для построения калибровочной кривой отдельной группе животных вводят по 160, 80, 40 или 20 МЕ/мл стандарта рекомбинантного EPO-BRP. По истечении 4-х дней со дня инъекций в крови подопытных животных измеряют число ретикулоцитов в крови животных, взятой из орбитального синуса в пробирку с этилендиаминдиаминтетрауксусной кислотой (ЭДТА) (Microvette-200 ЭДТА, Sarstedt, Германия), и их процентное отношение к количеству зрелых эритроцитов (RET, %). Количественное определение гемопоэтической активности заявляемых белков EPO-TR 1,6, EPO-TR 4 или EPO-TR 6 в сравнении со стандартом рекомбинантного ЭПО проводят с использованием проточного гемоцитометра-анализатора ADVIA 120 (Bayer-Siemens) и программы обработки данных Multispecies Software 2120.
| Табл.6 | |
| Удельная биологическая активность заявляемых гибридных белков в сопоставлении со стандартом рекомбинантного ЭПО | |
| Вид ЭПО-содержащего белка | Удельная активность белка, МЕ/мг |
| EPO-BRP | 141120 |
| EPO-TR 1,6 | 648972±37264 |
| EPO-TR 4 | 1507278±22722 |
| EPO-TR 6 | 2399464±27643 |
Результаты, представленные в табл.6, показывают, что биологическая активность белка EPO-TR 1,6 в четыре раза, белка EPO-TR 4 - в десять раз, а белка EPO-TR 6 - в 15 раз выше удельной биологической активности рекомбинантного ЭПО. Таким образом, заявляемые гибридные белки EPO-TR 1,6, EPO-TR 4 или EPO-TR 6 in vivo характеризуются более высоким потенциалом стимуляции эритропоэза, чем рекомбинантный ЭПО.
Пример 8. Оценка стимуляции проесса кроветворения заявляемыми белками in vivo.
Для оценки биологических свойств белка Е PO-TR 1,6 или EPO-TR 4 или EPO-TR 6 проводят измерение основных показателей стимуляции гемопоэза в течение 15 дней после однократного подкожного введения группе из 8 экспериментальных животных 0,5 мл раствора, содержащего 0,05 М Na-фосфатный буфер с рН 7,4; 0,1% бычьего сывороточного альбумина и 300 пкМ белка EPO-TR 1,6 или EPO-TR 4 или EPO-TR 6. Контролями служат 8 экспериментальных животных после подкожного введения 0,5 мл раствора, содержащего 300 пкМ EPO-BRP или 300 пкМ α-дарбпоэтина, а также 8 животных после подкожного введения такого же буферного раствора, но не содержащего ни один биологически активный белок. Ежедневно в течение 15 дней после начала экспериментов в крови модельных животных измеряют уровень ретикулоцитов (RET), гемоглобина (HGB) и гематокрита (НСТ). Измерение параметров гемопоэза проводят в проточном гемоцитометре-анализаторе ADVIA 120 (Bayer-Siemens, Германия).
Результаты эксперимента, представленные на Фиг.2-4, показывают наличие эффекта стимуляции процесса кроветворения белками EPO-TR 1,6, EPO-TR 4 и EPO-TR 6, которое выражается в увеличении числа ретикулоцитов после инъекции, достигающее максимума на 4-е сутки (А), повышении показателей гемоглобина (Б) и гематокрита (