Липосомальная композиция и способ ее получения
Иллюстрации
Показать всеИзобретение относится к биотехнологии и химико-фармацевтической промышленности, в частности относится к липосомальным композициям и способам их получения. Липосомальная фармацевтическая композиция включает лекарственное вещество, липиды в виде фосфатидилхолина и холестерина, причем дополнительно содержит минорный положительно заряженный компонент, в качестве которого используют цетилпиридиний хлорид или стеарилэтаноламин. Благодаря осуществлению изобретения обеспечивается повышение биодоступности лекарственного (активного) вещества за счет активного транспорта к органам и тканям организма. 2 н . и 8 з.п. ф-лы, 3 ил., 5 пр.
Реферат
Заявляемое изобретение относится к биотехнологии и химико-фармацевтической промышленности и может быть использовано для создания систем, в частности, липосомальных композиций, осуществляющих направленную транспортировку физиологически активных веществ с целью повышения терапевтической активности лекарственных препаратов, а также обеспечивающих высокую эффективность и стабильность активного вещества в липосомах.
Липосомы представляют собой замкнутые, чаще всего сферические структуры, в которых водная сердцевина окружена липидным бислоем, содержащим молекулы фосфолипидов, полярные части которых обращены в водную фазу, а неполярные друг к другу (см. Бангэм А.Д. Развитие представлений о липосомах / А.Д. Бангэм // Липосомы в биологических системах: пер. с англ. / А.Д. Бангэм [и др.]; под ред. Г. Грегориадиса, А. Аллисона. - М., 1983. - С.13-35).
При формировании липосом водная сердцевина позволяет удерживать растворенные в ней вещества, а липидный бислой растворять гидрофобные соединения. Поэтому практически любое соединение может быть заключено в липосому независимо от его растворимости, размеров и электрического заряда (см. Липосомы и другие наночастицы как средство доставки лекарственных веществ / А.П. Каплун [и др.] // Вопросы медицинской химии. - 1999. - №1. - С.3-12).
В последнее время подтверждено, что часть проблем, накопившихся в медицине и фармакологии, связанных с применением лекарственных средств, может быть решена путем использования систем переносчиков для адресной доставки препаратов в очаги поражения. Это особенно важно в случае применения токсичных веществ, активных при лечении тяжелых патологий. Адресная доставка приводит к снижению эффективной терапевтической дозы препарата, следствием чего является и снижение токсического влияния препарата, особенно при длительном лечении (см. Gregoriadis G. // In: Drug carriers in Biology and Medicine/ Ed. Gregoriadis G. Akademic Press. - London, New York, san Francisco. - 1979. - P.287-341).
Растущий интерес к использованию средств доставки лекарственных препаратов непосредственно к очагам поражения привел к широкому кругу проводимых исследований в этой области в последние десятилетия. В результате было предложено много типов носителей лекарственных веществ, таких как макромолекулы, клетки, вирусы, синтетические частицы, эффективность которых определяется конкретными целями (см. Omid С. Farokhzad, Robert Langer, Nanomedicine: Developing smarter therapeutic and diagnostic modalities. Advanced Drug Delivery Reviews 58 (2006) 1456-1459).
Однако большинство из них имеют ограничения по диапазону и количеству лекарственных веществ, которые они могут связать, а также по способности предотвращать контактирование переносимых соединений с нормальным биологическим окружением. Кроме того, имеются трудности, связанные с токсичностью носителей, их доступностью и стоимостью, а также технологиями образования комплексов «лекарство-носитель».
Среди известных подходов к решению данной проблемы можно выделить включение лекарственных веществ в состав липосом. В качестве средств для направленной доставки лекарственных препаратов к очагам патологии липосомы начали широко изучаться в экспериментальной медицине и фармакологии уже в начале 70-х годов прошлого столетия (см. Грегориадис Г., Аллисон А.. Липосомы в биологических системах: пер. с англ./Бангхем А.Д. и др. - М.: Медицина. - 1983. - 383 с.).
Преимущества использования липосомальных лекарственных форм включают в себя:
- биосовместимость, вовлечение липидных компонентов в метаболизм, обеспечивающие снижение аллергических реакций на препарат;
- локальное действие за счет накопления липосом в очаге поражения;
- пролонгированное действие липосомальных форм препаратов за счет более медленного выведения лекарственного вещества из организма;
- возможность активного нацеливания на очаг поражения за счет присоединения к липосомальной мембране высокоаффинных лигандов.
В настоящее время липосомальные формы лекарственных препаратов достаточно широко применяют для лечения пациентов антибиотиками, противоопухолевыми, противовирусными препаратами, а также при использовании иммуномодуляторов, антител, рентгеноконтрастных, цитостатических и косметологических средств (см. Delivery of antiviral agents in liposomes / N. Duzgunes [et al.] // Methods Enzymol. - 2005. - №391. - P. 351-373).
Проведенные исследования выявили существенные преимущества введения липосомальной формы препаратов по сравнению с традиционной терапией. Вместе с тем, эти же исследования показали, что терапия с помощью липосомальных препаратов является более дорогостоящей по сравнению с традиционным лечением из-за дополнительных затрат на инкапсулирование активного вещества и сравнительно больших его потерь в процессе формирования липосом.
Таким образом, создание экономичных и эффективных технологий получения липосомальных лекарственных форм является актуальной задачей.
Из уровня техники известна фармацевтическая композиция, представляющая собой липосомальную эмульсию, образованную фосфолипидами в виде липосом со средним размером частиц 0,05-0,22 мкм и сульфатированными гликозаминогликанами, при этом в качестве сульфатированных гликозаминогликанов содержит натриевую соль кератансульфата и натриевую соль хондроитинсульфата, причем компоненты находятся в определенном соотношении в мас.%:
| Фосфолипид | 0,001-2 |
| Натриевая соль кератансульфата | 0,002-0,2 |
| Натриевая соль | 0,006-0,1 |
| Физиологический раствор | остальное |
при этом сульфатированные гликозаминогликаны находятся как внутри липосом, так и вне липосом, в физиологическом растворе (см. патент РФ на изобретение №2460517 «Фармацевтическая композиция для комплексного лечения заболеваний глазной поверхности у больных с первичной открытоугольной глаукомой», дата подачи 14.07.2011 г., опубликовано 10.09.2012 г.).
Известна биоцидная композиция на липосомальной основе, содержащая четвертичное аммонийное - дидецилдиметиламмоний галогенид в форме клатрата с мочевиной и липид (см. патент РФ на изобретение №2353395 «Биоцидная композиция на липосомальной основе», дата подачи 14.06.2007 г., опубликовано 27.04.2009 г.).
Известна липосомальная композиция, содержащая следующие ингредиенты, вес.ч.: паклитаксел - 2-5; фосфатид - 20-200; холестерин - 2-30; аминокислоты - 0,3-4; лиофилизированный эксципиент - 10-75. При этом способ получения данной композиции включает следующие операции: растворение паклитаксела, фосфатида, холестерина в изопропаноле или этаноле для получения прозрачного раствора, удаление растворителя для образования мембраны, затем добавление водного раствора аминокислот и лиофилизированного эксципиента с последующей гидратацией, обработкой ультразвуком или гомогенизацией для получения липосомального препарата паклитаксела (см. патент РФ на изобретение №2264807 «Липосомальная композиция с паклитакселом для лечения рака и способ ее получения», дата подачи 28.02.2001 г., дата публикации заявки 10.09.2004 г.).
Из уровня техники известен способ получения липосомальной композиции, включающий формирование смеси, содержащей, по крайней мере, один компонент липосомальной мембраны, воду и добавку, диспергирование смеси сводится к тому, что в качестве добавки используют либо субмикропорошок вещества нерастворимого в воде и в органическом растворителе, либо набухающие в воде полимер, либо жидкость, не смешивающуюся с водой и другими компонентами смеси (см. патент РФ №2104691 на изобретение «Способ получения липосомальной композиции (варианты)», дата подачи 20.02.1995 г., дата публикации заявки 27.02.1997 г.).
Известен способ получения липосомальной композиции, включающий формирование смеси липидов с липофильными и гидрофильными добавками, мелкодисперсным порошком и диспергирование, при этом на предварительном этапе подготовки жировой фазы ее обрабатывают аминосодержащими соединениями для перераспределения заряда, а также частично гидратируют липиды, затем вводят в необходимых количествах добавки, причем липосомы формируют на границе раздела двухфазной системы вода/нерастворимые в воде частицы (см. патент на изобретение №2311449 «Способ получения липосомальной композиции», дата подачи 20.12.2005 г., опубликовано 27.11.2007 г.).
Кроме того, известен способ получения сухих липосомальных препаратов, включающий в себя смешение фосфолипидов, порошкообразного носителя и биологически активного вещества и дальнейшую обработку полученной смеси, при этом в загрузочный бункер струйной мельницы засыпают композицию, состоящую из биологически активного вещества, фосфолипида из группы, включающей витол и лецитин ПРО, и водорастворимого порошкообразного носителя, и подвергают помолу в струйной мельнице при давлении не менее 2,5 атм. и расходе газа не менее 100 л/мин. с дальнейшим выделением фракции с размером частиц, меньшим чем 50 мкм. Как вариант, помолу подвергают смесь фосфолипидов и порошкообразного носителя, а затем добавляют к полученному продукту раствор биологически активного вещества в полярном растворителе, и подвергают суспензию лиофильному высушиванию, обрабатывая ее при необходимости перед сушкой ультразвуком при частоте 40 кГц (см. патент РФ №2437649 на изобретение «Способ получения сухих липосомальных препаратов», дата подачи 03.11.2008 г., опубликовано 27.12.2011 г.).
Наиболее близким техническим решением к заявляемой липосомальной композиции является композиция для доставки лекарственных или диагностических соединений, представляющая собой липосому, имеющую внутреннее пространство, отделенное от среды мембраной, включающей один или несколько липидов, причем внутреннее пространство включает анион, выбранный из полианионизированного моносахарида или полианионизированного дисахарида, и на липосоме создается трансмембранный градиент, эффективный для удерживания веществ внутри липосомы, при этом трансмембранный градиент может представлять собой градиент иона аммония или ион замещенного аммония, в качестве которого может быть использован, например, ион четвертичного аммония, а липид представляет собой фосфатидилхолин или холестерин.
Способ инкапсулирования вещества в липосому включает стадию контактирования композиции с веществом в течение времени, достаточного для того, чтобы указанное вещество стало инкапсулированным в этой липосоме, причем часть вещества, которая становится инкапсулированной в липосомах, составляет, по крайней мере, от 80% до 95%, а вещество является полностью катионным веществом, терапевтическим агентом или детектируемым маркером (см. патент РФ на изобретение №2424792 «Липосомы, используемые для доставки лекарственных средств, дата подачи 02.05.2005 г., опубликовано 27.07.2011 г., заявка PCT US 2005/15349 20050502).
Недостатки данного изобретения обусловлены невозможностью их использования для получения препаратов на основе сильных органических кислот, так как в этом случае образование солей между лекарственным веществом и четвертичными аммониевыми соединениями приводит к образованию кристаллических кластеров на ее поверхности, что, в свою очередь, снижает стабильность липосомальной суспензии.
Техническим результатом, на достижение которого направлено заявляемое изобретение, является повышение биодоступности лекарственного (активного) вещества за счет активного транспорта к органам и тканям организма.
При этом в качестве лекарственного вещества используют натриевую соль 2-метилтио-6-нитро-1,2-4-триазоло[5,1-c]-1,2,4-триазин-7-она, дигидрат (далее - Триазавирин).
Указанный технический результат достигается тем, что липосомальная фармацевтическая композиция, включающая лекарственное вещество, липиды в виде фосфатидилхолина и холестерина, согласно изобретению дополнительно содержит минорный положительно заряженный компонент, в качестве которого используют цетилпиридиний хлорид или стеарилэтаноламин, в качестве лекарственного вещества применяют натриевую соль 2-метилтио-6-нитро-1,2-4-триазоло[5,1-с]-1,2,4-триазин-7-она, дигидрат, вводимую в концентрированном забуференном физиологическом растворе, в качестве которого используют 0,1 М Na-фосфатной буфер (pH 7,4), компоненты которого находятся в определенном соотношении, г/л: Na2HPO4×12H2O - 29,00 г/л; NaH2PO4×H2O - 2,62 г/л; ЭДТА - 29,23 мг/л, при этом ингредиенты композиции находятся в определенных соотношениях, г/л:
| натриевая соль 2-метилтио-6-нитро-1,2-4-триазоло[5,1-с]-1,2,4-триазин-7-она, дигидрат, | 7,1-14,2 |
| положительно заряженный компонент | 0,16-0,75 |
| липиды | 25,00-75,00 |
| буферный раствор | остальное |
При этом липиды находятся в определенном соотношении, мас.%:
| фосфатидилхолин | 68,00-92,00 |
| холестерин | 8,00-32,00 |
При этом фосфатидилхолин представляет собой яичный фосфатидилхолин, очищенный методом колоночной хроматографии на окиси алюминия.
В заявляемом изобретении в качестве минорных положительно заряженных компонентов используют цетилпиридиний хлорид или стеарилэтаноламин, которые обеспечивают стабилизацию липосомальной мембраны.
Липосомальная фармацевтическая композиция может дополнительно содержать добавки, в качестве которых используют антиоксидант в количестве до 4,00 г/л.
В качестве антиоксиданта применяют DL-α-токоферол.
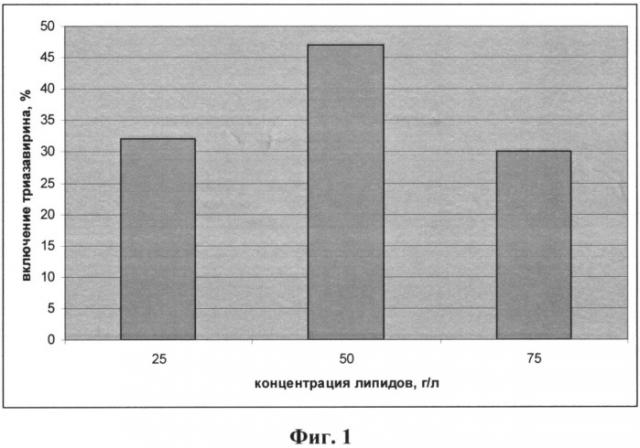
Оптимальная концентрация липидов в суспензии составляет 50 г/л, а лекарственного вещества (Триазавирина) 7.1 г/л. При этом лекарственное вещество распределено между липосомами и дисперсной фазой в соотношении 45 и 55 мас.%.
Способ получения липосомальной фармацевтической композиции, включающий введение лекарственного вещества в липосомы, согласно изобретению липиды, в качестве которых используют фосфатидилхолин и холестерин, минорные положительно заряженные компоненты, в качестве которых используют цетилпиридиний хлорид или стеарилэтаноламин, растворяют в неполярном растворителе, после чего растворитель удаляют, а полученную в результате липидную пленку охлаждают, высушивают в вакууме и добавляют в нее лекарственное вещество, в качестве которого используют натриевую соль 2-метилтио-6-нитро-1,2-4-триазоло[5,1-с]-1,2,4-триазин-7-она, дигидрат, вводимую в концентрированном забуференном физиологическом растворе - 0,1 М Na-фосфатной буфер (pH 7,4), компоненты которого находятся в определенном соотношении, г/л: Na2HPO4×12H2O - 29,00 г/л; NaH2PO4×H2O - 2,62 г/л; ЭДТА - 29,23 мг/л, при этом полученный состав гидратируют и перемешивают при температуре 50-60°C до образования однородной массы мультиламеллярных везикул, из которой путем импульсного облучения ультразвуком, проводимого одновременно с охлаждением, формируют суспензию липосом, которую затем стерилизуют с помощью ультрафильтрации.
Активное лекарственное вещество Триазавирин вводят в состав липидной композиции в концентрированном забуференном физиологическом растворе ОДМ Na-фосфатной буфер, содержащий 0,1мМ ЭДТА, pH 7,4 (1 л): 29,00 г Na2HPO4×12H2O; 2,62 г NaH2PO4×H2O; 29,23 мг ЭДТА. В композицию дополнительно могут быть введены добавки, в качестве которых применяют антиоксидант в количестве до 4,00 г/л. Благодаря такому способу получения липосомальной композиции достигается достаточно высокая степень включения лекарственного вещества Триазавирина в структуру липосом (до 45%) и повышается его липофильность, что позволяет наиболее эффективно доставлять лекарственное средство.
В этом случае для направленной доставки препарата в ткани организма не требуется проведения операций по модификации самого лекарственного вещества, которая заключается во введении алкильных остатков по N-атомам гетероциклического ядра и в результате приводит к изменению структуры активного действующего вещества, а это, в свою очередь, ведет к радикальным изменениям его фармакокинетического профиля. Кроме того, не требуется проведения значительного комплекса дополнительных исследований.
Триазавирин (H-форма), предназначенный для лечения и профилактики инфекционных заболеваний вирусной природы человека и животных, имеет повышенную кислотность (см. патент на изобретение №2294936 «Натриевая соль 2-метилтио-6-нитро-1,2-4-триазоло[5,1-с]-1,2,4-триазин-7-она, дигидрат, обладающая противовирусной активностью», дата подачи 29.06.2005 г., опубликовано 10.03.2007 г.), что позволяет ему легко образовывать соли с целым рядом основных соединений и, в том числе, эффективно осаждаться на положительно заряженных липосомальных мембранах, что, в свою очередь, позволяет добиваться высокой степени включения Тризавирина в структуру липосом без какой-либо его модификации, не применяя при этом каких-либо сложных и нетехнологичных процедур.
Технических решений, совпадающих с совокупностью существенных признаков заявляемого изобретения, не выявлено, что позволяет сделать вывод о соответствии заявляемого изобретения такому условию патентоспособности, как «новизна».
Заявляемые существенные признаки, предопределяющие получение указанного технического результата, явным образом не следуют из уровня техники, что позволяет сделать вывод о соответствии заявляемого изобретения такому условию патентоспособности, как «изобретательский уровень».
Условие патентоспособности «промышленная применимость» подтверждено на примерах конкретного применения.
Заявляемую липосомальную композицию получают следующим образом.
Хлороформный раствор липидов (фосфатидилхолина и холестерина), минорных компонентов, в качестве которых используют цетилпиридиний хлорид или стеарилэтаноламин, и добавки в виде антиоксиданта (DL-α-токоферол) упаривают на роторном испарителе при температуре 35°C до образования липидной пленки. К пленке липидов добавляют лекарственное вещество Триазавирин в буферном растворе в инертной атмосфере и встряхивают на миксере HF-1 при температуре 50-60°C до образования однородной смеси в течение 2-5 мин, в результате получая мультиламеллярные везикулы. Далее проводят импульсную обработку полученной смеси на погруженном ультразвуковом излучателе УЗДН-2Т при частоте 22кГц и силе тока 20 мА, причем обработку проводят импульсами в течение 30 секунд, чередуя одноминутными интервалами для охлаждения. Для получения липосом с диаметром менее 200 нм проводят 6 циклов облучения. Механические примеси центрифугируют при 5000 об/мин в течение 1 минуты. Полученную липосомальную композицию хранят при температуре 2-4°C.
Параметры полученных липосом оценивали с помощью электронной микроскопии на приборе JEOL JEM-100 СХ II. Для проведения эксперимента липосомальную композицию с концентрацией 50 г/л наносят на сеточки для электронной микроскопии, покрытые нитроцеллюлозной пленкой. После высушивания образцы просматривают под электронным микроскопом. Результаты оценки подтвердили, что заявляемая липосомальная композиция, получаемая заявляемым способом, обладает необходимыми для медицинского применения характеристиками, в частности, до 97% липосом имели диаметр менее 200 нм.
Основные параметры заявляемой липосомальной композиции приведены в таблице.
| Таблица | |
| Параметр | Значение |
| Триазавирин в готовой липосомальной суспензии, в т.ч. в составе липосом | 7,1-14,2 г/л2,6-4,4 г/л |
| Общая концентрация липидов в растворе | 25-75 г/л |
| Содержание антиоксиданта | 0-4 г/л |
| Содержание положительно заряженной добавки | 0,16-0,75 г/л |
| Степень включения препарата | до 45% |
| Средний размер частиц | <200 нм |
Степень включения Триазавирина определялась с помощью гель-фильтрации на колонке, заполненной гелем Sephadex G-50, с использованием буферного раствора в качестве элюента. В начальных фракциях элюируются липосомы, содержащие Триазавирин, а затем идет элюирование свободного Триазавирина. Измеряя оптическую плотность раствора, содержащего свободный Триазавирин, определяют степень его включения в состав липосом. Полученные результаты подтверждают высокий процент (до 45%) включения лекарственного вещества, что позволяет повысить его сродство к клеточным мембранам.
В качестве минорных положительно заряженных компонентов в составе липосомальной композиции используют вещества, стабилизирующие липидные мембраны липосом. Так, в качестве минорных положительно заряженных компонентов были использованы цетилпиридиний хлорид или стеарилэтаноламин. Было показано, что введение цетилпиридиний хлорида в состав липидной пленки в количестве 1 мас.% приводит к ингибированию перекисного окисления липидов на 36,3±1,3% по сравнению с контрольными образцами, не содержащими этот компонент. Кроме того, введение цетилпиридиний хлорида позволяет снизить агрегацию липосом в процессе хранения препарата. Другой положительно заряженный компонент - стеарилэтаноламин обладает схожими свойствами.
В качестве антиоксиданта применяют DL-α-токоферол, антиокислительное действие которого обусловлено его способностью взаимодействовать с радикалами липидов на стадии обрыва цепей. Максимальное антиоксидантное действие DL-α-токоферола достигается при использовании концентраций 0,04 мг/мг липосомальных липидов. В то же время увеличение концентрации DL-α-токоферола до 0,08 мг/мг приводит к противоположному эффекту: концентрация продуктов окисления увеличивается как без доступа кислорода, так и при длительной аэрации.
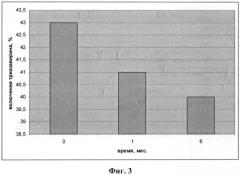
Основные параметры липосомальной композиции (размер липосом и содержание Триазавирина) незначительно изменялись при хранении в течение 6 месяцев, так, за шесть месяцев хранения липосомальной суспензии утечка лекарственного вещества не превысила 6,2%. Концентрация продуктов перекисного окисления липидов практически не изменилась в течение этого срока. Размеры липосом увеличивались от 100-250 нм до 250-500 нм в течение 6 месяцев, однако доля липосом с диаметром более 500 нм не превысила 23,1±1,3%.
Увеличение содержания холестерина в липидной пленке приводит к повышению ее микровязкости и снижению скорости агрегации липосом. В тоже время высокое содержание холестерина увеличивает скорость перекисного окисления липидов и снижает степень включения Триазавирина в состав липосом. При 20%-ном содержании холестерина в липидной пленке достигается наилучшее сочетание стабильности и емкости липосом по отношению к лекарственному препарату. Все вышеперечисленное позволяет говорить о возможности практического использования липосомальной лекарственной формы Триазавирина.
Заявляемое изобретение поясняется чертежами, где
Фиг.1 - диаграмма влияния концентрации липидов на степень включения Триазавирина в структуру липосом;
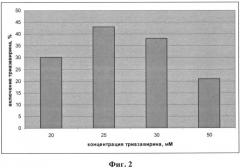
Фиг.2 - диаграмма влияния концентрации Триазавирина в липосомальной композиции на степень его включения в структуру липосом;
Фиг.3 - диаграмма влияния концентрации Триазавирина в липосомальной композиции на степень его включения в структуру липосом.
Осуществление заявляемого изобретения подтверждается примерами конкретного выполнения.
Пример 1
Получение липосомальной композиции, содержащей цетилпиридиний хлорид в качестве минорного положительно заряженного компонента.
Навески 750 мг очищенного яичного фосфатидилхолина, 200 мг холестерина, 40 мг антиоксиданта, в качестве которого используют DL-α-токоферола, и 10 мг минорного положительно заряженного компонента, в качестве которого используют цетилпиридиний хлорид, растворяют в 50 мл хлороформа. Полученный раствор упаривают на роторном испарителе в круглой колбе объемом 250 мл при средней скорости 50-60 об/мин вращения ротора и температуре 35°C. Полученную пленку быстро охлаждают до 0°C и высушивают в вакууме в течение 6 часов в защищенной от солнечных лучей колбе. Затем липидную пленку заливают 20 мл раствора Триазавирина (7,1 г/л, 25 мМ) в 0,1 М Na-фосфатном буфере, содержащем 0,1 мМ ЭДТА, pH 7,4 (29 г Na2HPO4×12H2O; 2,62 г NaH2PO4×H2O; 29,23 мг ЭДТА на 1 л раствора), и встряхивают на миксере HF-1 в атмосфере азота при температуре 50-60°C до образования однородной смеси в течение 2-5 мин. Далее проводят импульсную обработку полученной смеси на погруженном ультразвуковом излучателе УЗДН-2Т при частоте 22кГц и силе тока 20 мА, причем обработку проводят 6 циклами облучения по 30 секунд, чередуя одноминутными интервалами для охлаждения. Образовавшуюся суспензию мультиламеллярных везикул центрифугируют для отделения крупных агломератов на оборотах 4500 мин-1. Полученную липосомальную композицию пропускают через мембрану для ультрафильтрации с диаметром пор 400 нм и хранят при температуре 2-4°C.
Пример 2
Получение липосомальной композиции, содержащей стеарилэтаноламин в качестве минорного положительно заряженного компонента и повышенное содержание холестерина.
Навески 630 мг очищенного яичного фосфатидилхолина, 320 мг холестерина, 40 мг антиоксиданта, в качестве которого используют DL-α-токоферола, и 10 мг минорного положительно заряженного компонента, в качестве которого используют стеарилэтаноламин, растворяют в 50 мл хлороформа. Полученный раствор упаривают на роторном испарителе в круглой колбе объемом 250 мл при средней скорости 50-60 об/мин вращения ротора и температуре 35°C. Полученную пленку быстро охлаждают до 0°C и высушивают в вакууме в течение 6 часов в защищенной от солнечных лучей колбе. Затем липидную пленку заливают 20 мл раствора Триазавирина (7,1 г/л, 25 мМ) в 0,1 М Na-фосфатном буфере, содержащем 0,1 мМ ЭДТА, pH 7,4 (29 г Na2HPO4×12H2O; 2,62 г NaH2PO4×H2O; 29,23 мг ЭДТА на 1 л раствора), и встряхивают на миксере HF-1 в атмосфере азота при температуре 50-60°C до образования однородной смеси в течение 2-5 мин. Далее проводят импульсную обработку полученной смеси на погруженном ультразвуковом излучателе УЗДН-2Т при частоте 22 кГц и силе тока 20 мА, причем обработку проводят 6 циклами облучения по 30 секунд, чередуя одноминутными интервалами для охлаждения. Образовавшуюся суспензию мультиламеллярных везикул центрифугируют для отделения крупных агломератов на оборотах 4500 мин-1. Полученную липосомальную композицию пропускают через мембрану для ультрафильтрации с диаметром пор 400 нм и хранят при температуре 2-4°C.
Пример 3
Получение липосомальной композиции, содержащей цетилпиридиний хлорид в качестве минорного положительно заряженного компонента и пониженное содержание холестерина.
Навески 870 мг очищенного яичного фосфатидилхолина, 80 мг холестерина, 40 мг антиоксиданта, в качестве которого используют DL-α-токоферола, и 10 мг минорного положительно заряженного компонента, в качестве которого используют цетилпиридиний хлорид, растворяют в 50 мл хлороформа. Полученный раствор упаривают на роторном испарителе в круглой колбе объемом 250 мл при средней скорости 50-60 об/мин вращения ротора и температуре 35°C. Полученную пленку быстро охлаждают до 0°C и высушивают в вакууме в течение 6 часов в защищенной от солнечных лучей колбе. Затем липидную пленку заливают 20 мл раствора Триазавирина (7,1 г/л, 25 мМ) в 0,1 М Na-фосфатном буфере, содержащем 0,1 мМ ЭДТА, pH 7,4 (29 г Na2HPO4×12H2O; 2,62 г NaH2PO4×H2O; 29,23 мг ЭДТА на 1 л раствора), и встряхивают на миксере HF-1 в атмосфере азота при температуре 50-60°C до образования однородной смеси в течение 2-5 мин. Далее проводят импульсную обработку полученной смеси на погруженном ультразвуковом излучателе УЗДН-2Т при частоте 22 кГц и силе тока 20 мА, причем обработку проводят 6 циклами облучения по 30 секунд, чередуя одноминутными интервалами для охлаждения. Образовавшуюся суспензию мультиламеллярных везикул центрифугируют для отделения крупных агломератов на оборотах 4500 мин-1. Полученную липосомальную композицию пропускают через мембрану для ультрафильтрации с диаметром пор 400 нм и хранят при температуре 2-4°C.
Пример 4
Получение липосомальной композиции, содержащей цетилпиридиний хлорид в качестве минорного положительно заряженного компонента и повышенное содержание лекарственного вещества Триазавирин.
Навески 750 мг очищенного яичного фосфатидилхолина, 200 мг холестерина, 40 мг антиоксиданта, в качестве которого используют DL-α-токоферола, и 10 мг минорного положительно заряженного компонента, в качестве которого используют цетилпиридиний хлорид, растворяют в 50 мл хлороформа. Полученный раствор упаривают на роторном испарителе в круглой колбе объемом 250 мл при средней скорости 50-60 об/мин вращения ротора и температуре 35°C. Полученную пленку быстро охлаждают до 0°C и высушивают в вакууме в течение 6 часов в защищенной от солнечных лучей колбе. Затем липидную пленку заливают 20 мл раствора Триазавирина (14,2 г/л, 50 мМ) в 0,1 М Na-фосфатном буфере, содержащем 0,1 мМ ЭДТА, pH 7,4 (29 г Na2HPO4×12H2O; 2,62 г NaH2PO4×H2O; 29,23 мг ЭДТА на 1 л раствора), и встряхивают на миксере HF-1 в атмосфере азота при температуре 50-60°C до образования однородной смеси в течение 2-5 мин. Далее проводят импульсную обработку полученной смеси на погруженном ультразвуковом излучателе УЗДН-2Т при частоте 22кГц и силе тока 20 мА, причем обработку проводят 6 циклами облучения по 30 секунд, чередуя одноминутными интервалами для охлаждения. Образовавшуюся суспензию мультиламеллярных везикул центрифугируют для отделения крупных агломератов на оборотах 4500 мин-1. Полученную липосомальную композицию пропускают через мембрану для ультрафильтрации с диаметром пор 400 нм и хранят при температуре 2-4°C.
Пример 5
Получение липосомальной композиции, содержащей цетилпиридиний хлорид в качестве минорного положительно заряженного компонента, без добавления антиоксиданта.
Навески 850 мг очищенного яичного фосфатидилхолина, 140 мг холестерина и 10 мг минорного положительно заряженного компонента, в качестве которого используют цетилпиридиний хлорид, растворяют в 50 мл хлороформа. Полученный раствор упаривают на роторном испарителе в круглой колбе объемом 250 мл при средней скорости 50-60 об/мин вращения ротора и температуре 35°C. Полученную пленку быстро охлаждают до 0°C и высушивают в вакууме в течение 6 часов в защищенной от солнечных лучей колбе. Затем липидную пленку заливают 20 мл раствора Триазавирина (7,1 г/л, 25 мМ) в 0,1 М Na-фосфатном буфере, содержащем 0,1 мМ ЭДТА, pH 7,4 (29 г Na2HPO4×12H2O; 2,62 г NaH2PO4×H2O; 29,23 мг ЭДТА на 1 л раствора), и встряхивают на миксере HF-1 в атмосфере азота при температуре 50-60°C до образования однородной смеси в течение 2-5 мин. Далее проводят импульсную обработку полученной смеси на погруженном ультразвуковом излучателе УЗДН-2Т при частоте 22 кГц и силе тока 20 мА, причем обработку проводят 6 циклами облучения по 30 секунд, чередуя одноминутными интервалами для охлаждения. Образовавшуюся суспензию мультиламеллярных везикул центрифугируют для отделения крупных агломератов на оборотах 4500 мин-1. Полученную липосомальную композицию пропускают через мембрану для ультрафильтрации с диаметром пор 400 нм и хранят при температуре 2-4°C.
Заявляемое изобретение позволяет повысить биодоступность лекарственного (активного) вещества за счет активного транспорта к органам и тканям организма, а также увеличить срок хранения лекарственного препарата.
1. Липосомальная фармацевтическая композиция, включающая лекарственное вещество, липиды в виде фосфатидилхолина и холестерина, отличающаяся тем, что дополнительно содержит минорный положительно заряженный компонент, в качестве которого используют цетилпиридиний хлорид или стеарилэтаноламин, в качестве лекарственного вещества применяют натриевую соль 2-метилтио-6-нитро-1,2-4-триазоло[5,1-с]-1,2,4-триазин-7-она, дигидрат, вводимую в концентрированном забуференном физиологическом растворе, в качестве которого используют 0,1 М Na-фосфатной буфер (pH 7,4), компоненты которого находятся в определенном соотношении, г/л: Na2HPO4×12H2O 29,00 г/л; NaH2PO4×H2O 2,62 г/л; ЭДТА 29,23 мг/л, при этом ингредиенты композиции находятся в определенных соотношениях, г/л:
| натриевая соль 2-метилтио-6-нитро-1,2-4-триазоло[5,1-с]-1,2,4-триазин-7-она, дигидрат | 7,1-14,2 |
| положительно заряженный компонент | 0,16-0,75 |
| липиды | 25,00-75,00 |
| буферный раствор | остальное |
2. Липосомальная фармацевтическая композиция по п.1, отличающаяся тем, что дополнительно содержит добавки, в качестве которых используют антиоксидант в количестве до 4,00 г/л.
3. Липосомальная фармацевтическая композиция по п.1, отличающаяся тем, что липиды фосфатидилхолин и холестерин находятся в определенном соотношении, мас.%:
| фосфатидилхолин | 68,00-92,00 |
| холестерин | 8,00-32,00 |
4. Липосомальная фармацевтическая композиция по п.1, отличающаяся тем, что фосфатидилхолин представляет собой яичный фосфатидилхолин, очищенный методом колоночной хроматографии на окиси алюминия.
5. Липосомальная фармацевтическая композиция по п.2, отличающаяся тем, что в качестве антиоксиданта применяют DL-α-токоферол.
6. Способ получения липосомальной фармацевтической композиции по п.1, включающий введение лекарственного вещества в липосомы, отличающийся тем, что липиды, в качестве которых используют фосфатидилхолин и холестерин, минорные положительно заряженные компоненты, в качестве которых используют цетилпиридиний хлорид или стеарилэтаноламин, растворяют в неполярном растворителе, после чего растворитель удаляют, а полученную в результате липидную пленку охлаждают, высушивают в вакууме и добавляют в нее лекарственное вещество, в качестве которого используют натриевую соль 2-метилтио-6-нитро-1,2-4-триазоло[5,1-с]-1,2,4-триазин-7-она, дигидрат, вводимую в концентрированном забуференном физиологическом растворе (0,1 М Na-фосфатный буфер) (pH 7,4), компоненты которого находятся в определенном соотношении, г/л: Na2HPO4×12H2O - 29,00 г/л; NaH2PO4×H2O - 2,62 г/л; ЭДТА - 29,23 мг/л, при этом полученный состав гидратируют и перемешивают при температуре 50-60°C до образования однородной массы мультиламеллярных везикул, из которой путем импульсного облучения ультразвуком, проводимого одновременно с охлаждением, формируют суспензию липосом, которую затем стерилизуют с помощью ультрафильтрации.
7. Способ получения липосомальной фармацевтической композиции по п.6, отличающийся тем, что дополнительно вводят добавки, в качестве которых используют антиоксидант в количестве до 4,00 г/л.
8. Способ получения липосомальной фармацевтической композиции по п.6, отличающийся тем, что липиды фосфатидилхолин и холестерин находятся в определенном соотношении, мас.%:
| фосфатидилхолин | 68,00-92,00 |
| холестерин | 8,00-32,00 |
9. Способ получения липосомальной композиции по п.6, отличающийся тем, что фосфатидилхолин представляет собой яичный фосфатидилхолин, очищенный методом колоночной хроматографии на окиси алюминия.
10. Способ получения липосомальной композиции по п.7, отличающийся тем, что в качестве антиоксиданта применяют DL-α-токоферол.