Способ профилактики инфекционного конъюнктиво-кератита крупного рогатого скота
Иллюстрации
Показать всеИзобретение относится к ветеринарии и может быть использовано для профилактики инфекционного конъюнктиво-кератита крупного рогатого скота. Способ профилактики инфекционного конъюнктиво-кератита крупного рогатого скота включает вакцинацию вакциной ассоциированной против инфекционного конъюнктиво-кератита крупного рогатого скота на основе антигенов бактерий Moraxella bovis и герпесвируса типа I, при этом за 29-31 день до вакцинации животным вводят подкожно в область верхней трети шеи в дозе 0,045-0,055 мл/кг живой массы иммуностимулирующий препарат «Кероконвитин», полученный на основе цитотоксической сыворотки из крови лошадей-доноров путем гипериммунизации их антигеном, приготовленным из тканей глаз - конъюнктивы и роговицы крупного рогатого скота, переболевшего инфекционным конъюнктиво-кератитом. Ткани глаз крупного рогатого скота получают при забое животных. Изобретение позволяет на 40% по сравнению с использованием одной вакцины повысить эффективность профилактики инфекционного конъюнктиво-кератита крупного рогатого скота, обеспечивает более высокий иммунный статус организма животных. 3 табл., 1 пр., 2 ил.
Реферат
Изобретение относится к ветеринарии, в частности к ветеринарной хирургии (болезням глаз), и может быть использовано для профилактики инфекционного конъюнктиво-кератита крупного рогатого скота.
В ветеринарной медицине известно несколько разных способов профилактики инфекционного конъюнктиво-кератита крупного рогатого скота. Е.П. Копенкин [3] для профилактики в неблагополучных хозяйствах рекомендует с марта по сентябрь вводить в конъюнктивальных мешок глазные лекарственные пленки с антимикробными средствами 1-2 раза в месяц.
С.М. Воробьев [1] в неблагополучных хозяйствах с профилактической целью рекомендует применять глазные лекарственные пленки с фуракрилином и новокаином в сочетании с 3-4-х кратным инъекциями антигистаминной сыворотки в дозе 30 мл подкожно 1-3 дня до полного выздоровления. Для профилактики 1 раз в месяц зимой и 2 раза весной и летом применять глазные лекарственные пленки в сочетании с антигистаминной сывороткой. Однако в условиях беспривязного содержания вышеприведенный способ довольно трудоемок, так требует больших затрат времени и труда на выявление заболевших животных, их обездвиживание и проведение врачебных манипуляций. Также имеет значение многократность манипуляций: чем большее количество раз требуется что-то проделать, тем большие трудозатраты необходимы.
Шкиль Н.Н., Шкиль Н.А. [4] рекомендуют применять для профилактики полиэтиологического конъюнктиво-кератита в неблагополучных хозяйствах гомеопатические средство «Керавит». Препарат вводят внутримышечно за 3-5 дней до появлении первых признаков конъюнктиво-кератита 1 раз в день, повторно через 3-5 дней. Недостатком способа является сложность определения начала заболевания в условиях промышленного животноводства (первые клинические признаки можно установить только при индивидуальном обследовании, что очень трудозатратно), ввиду большой численности поголовья и беспривязного содержания. Кроме того животные в период пика заболевания содержатся на пастбище, что тоже затрудняет их индивидуальный осмотр.
С начала XX века различными учеными предпринимались попытки создания вакцин, профилактирующих инфекционные заболевании глаз животных. Для профилактики инфекционного конъюнктиво-кератита крупного рогатого скота, вызванного M. bovis, D. Hughes, G. Pugh [7] предложили формолвакцину из штаммов возбудителя. Но после вакцинаций довольно часто встречались случаи заболевания животных диплобациллярным конъюнктиво-кератитом.
Anon [6] получил хорошие результаты от применения вакцины «Piliguard Pinkeye» против диплобациллеза. Хороший профилактический эффект достигается предотвращением прикрепления возбудителя к слизистой оболочке глаза. Попытки производства вакцины против всех штаммов, которые встречаются на территории США, не дают должного эффекта из-за постоянной изменчивости основного возбудителя.
В нашей стране Х.З. Гаффаров и Л.В. Валебная [4] выделили и идентифицировали путем селекции штамм Moraxella bovis «Г97-ВНИВИ» (патент Российской Федерации №2145353), который используется для изготовления диагностикумов и вакцин против инфекционного конъюнктиво-кератита крупного рогатого скота. В настоящее время изготовленная на основе этого штамма вакцина прошла производственные испытания и применяется в ветеринарной практике.
Эта ассоциированная вакцина против инфекционного конъюнктиво-кератита крупного рогатого скота на основе антигенов бактерий Moraxella bovis и герпесвируса типа I. В состав вакцины входят инактивированные концентрированные антигены культур бактерий Moraxella bovis штаммов «I-97-ВНИВИ» и «ШЗ-01», штамма «Челябинск-2008» штамма «ТКА-ВИЭВ-В2, и гидроокись алюминия.
Вакцины разрабатываются с учетом многочисленных серотипов Moraxella bovis, но, несмотря на значительные затраты, связанные с научными разработками и производством вакцины, вакцинация не обеспечивает напряженного иммунитета против инфекции, что связанно с различной иммунореактивностью разных организмов.
Целью изобретения стало повышение эффективности специфической профилактики инфекционного конъюнктиво-кератита крупного рогатого скота вакциной ассоциированной против инфекционного конъюнктиво-кератита крупного рогатого скота на основе антигенов бактерий Moraxella bovis и герпесвируса типа I. Это достигается тем, что за 29-31 день до вакцинации животным вводят подкожно в область верхней трети шеи иммуностимулирующий препарат, с предложенным нами названием: «Кероконвитин» в дозе 0,045-0,055 мл на 1 кг живой массы.
Препарат представляет прозрачную, слегка опалесцирующую, соломенно-желтую с красноватым оттенком жидкость.
Проверка соответствия заявленного способа требованию новизны показывает, что из уровня техники не известны аналогичные способы профилактики инфекционного конъюнктиво-кератита крупного рогатого скота новым иммуностимулятором на фоне вакцинации известной вакциной. Заявленный способ соответствует требованию изобретательского уровня, так как для специалиста он явным образом не следует из уровня техники. Введение иммуностимулирующего препарата, полученного по принципу изготовления цитотоксической сыворотки из крови лошадей-доноров, путем гипериммунизации их антигеном, приготовленном из тканей глаза, не очевидно для специалиста. Применение иммуностимулирующего препарата оказывает стимулирующее воздействие не только на иммунную систему организма, но, что особенно важно, на иммунную систему тканей глаз.
Данное изобретение можно использовать в скотоводстве для профилактики инфекционного конъюнктиво-кератита крупного рогатого скота.
Технология получения «Кероконвитина» основывается на принципе цитотоксической сыворотки из крови лошадей-доноров путем гипериммунизации антигеном, приготовленным из тканей глаз.
Для этого берут ткань глаз (конъюнктиву и роговицу) от крупного рогатого скота (переболевшего инфекционным конъюнктиво-кератитом), полученных при забое на мясокомбинате, 3-4 раза отмывают физиологическим раствором и тщательно гомогенизируют до однородной массы, затем добавляют физиологический раствор в пятикратном размере (массе) по отношению к массе ткани и центрифугируют в течение 15-20 минут при 500 об/мин. (центрифуга марки ЦЛК 1 МРТУ-42763 №9394). Полученный таким образом антиген, стерилизованный методом тиндализации, вводят лошадям-донорам по схеме, предложенной Щербаковым Н.П. [5]: трехкратно в подкожную клетчатку в верхней трети шеи вводится антиген с интервалом 10 дней в возрастающих дозах. Вначале вводят 4,9-5,1 мл, затем 9,9-10,1 и последний раз 14,9-15,1 мл антигена. Через 10 суток после последней инъекции берется кровь первый раз, а через 47-49 часов повторно. После кровопускания продуценту предоставляется месячный физиологический отдых, по окончанию которого проводят очередной цикл гипериммунизации и взятия крови.
Количество забираемой крови зависит от живой массы лошади, привычки ее к кровопотерям (начальные циклы или последующие) и состояния здоровья животного.
У приученной к кровопотерям лошади количество забираемой крови должно равняться 1/50 живой массы, что в среднем составляет 8-9 литров крови. При втором кровопускании (через 47-49 часов) берут на 1 литр меньше крови по сравнению с первым кровопусканием.
Кровь берут в стерильные бутыли с 10%-ным раствором цитрата натрия из расчета 34,5-35,5 мл на 1 литр крови. Во время кровопускания кровь в бутыле беспрерывно встряхивают во избежание свертывания.
Цитрированную кровь обрабатывают на сепараторе. Плазму обирают в стерильные бутыли. Для дефибринирования в нее добавляют 30%-ный раствор хлорида кальция из расчета 1,3 мл на 1 л плазмы. Бутыли с плазмой закрывают и шуттелируют. Затем переносят в холодильную камеру, где выдерживают 20-24 ч. при температуре 4-8°C. Далее сыворотку отделяют от фибрина и консервируют добавлением 5%-ного раствора фенола из расчета 1:9. Препарат хранят расфасованным в стеклянные флаконы и бутылки по 100, 200 и 500 см3. Допускается другая фасовка, согласованная в установленном порядке. Хранят препарат в сухом, защищенном от света месте при температуре от 4-15C°. Срок годности - 4 года с даты изготовления.
Пример выполнения:
Для изучения эффективности способа профилактики против инфекционного конъюнктиво-кератита в марте 2012 года в ООО «ПЗК - Птицефабрика Челябинская. Петропавловский зерноводческий комплекс» провели опыт. Для этого сформировали 2 группы животных по типу пар-аналогов, по 5 голов в каждой. В опыте участвовали телята-герефорды 3х месячного возраста. Все животные находилась в одинаковых условиях кормления и содержания.
Первая группа животных служила контролем. Второй группе животных (опытной) 28 марта 2012 года подкожно в область верхней трети шеи ввели «Кероконвитин» в дозе 0,05 мл на 1 кг живой массы.
27 апреля и 25 мая 2012 года всем телятам хозяйства ввели согласно инструкции по применению подкожно в дозе 3 мл вакцину ассоциированную против инфекционного конъюнктиво-кератита крупного рогатого скота на основе антигенов бактерий Moraxella bovis (штамм «Челябинск-2008») и герпесвируса типа I, рекомендованную к регистрации в Российской Федерации ФГУ «ВГНКИ» (регистрационный номер ПВР - 1-4-7/02047). Наблюдения за животными проводили в течение 3х месяцев.
По сравнению с 2011 годом, заболеваемость среди взрослого скота в стаде на июнь 2012 года значительно снизилась в - 1,4 раза, молодняка - в 2,7 раз. Что свидетельствует об эффективности применения вакцинации против инфекционного конъюнктиво-кератита.
Клинические исследования на момент пика заболеваемости (июнь) в опытной и контрольной группах показали, что в контрольной группе у одного теленка было катарально-слизистое воспаление: конъюнктива отекшая, болезненная, ярко-розового цвета. У другого выявлен конъюнктиво-кератит на стадии изъязвления роговицы. При этом в опытной группе у всех телят не выявлено клинических признаков инфекционного конъюнктиво-кератита. Таким образом, заболеваемость в контрольной группы составила 40%, а в опытной группе заболевших животных не было.
«Кероконвитин», повышает резистентность организма и влияет на обменные процессы. Это подтверждают данные морфологического и биохимического исследования крови, приведенные в таблицах.
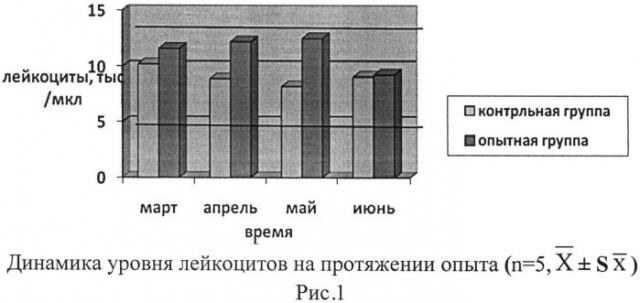
Лейкоциты - белые клетки крови, которые играют главную роль в специфической и неспецифической защите организма от внешних и внутренних патогенных агентов, а также в реализации типичных иммунологических и патологических процессов. Как видно на рисунке 1, динамическое понижение количества лейкоцитов в крови животных контрольной группы с марта по май указывает на снижение защитной функции организма.
Повышение числа лейкоцитов на 11% в июне наряду с повышением процента сегментоядерных нейтрофилов на 15% свидетельствует о наличии воспалительного процесса в организме, что подтверждается клинической картиной развития конъюнктиво-кератита.
Проведенная иммуностимуляция у животных опытной группы подтверждается повышением уровня лейкоцитов на 5% (p<0,05) в апреле и далее (рис.1), приводя к лейкоцитозу. В июне количество белых кровяных телец снизилось до границ нормы и стало почти на один уровень с данными контрольной группы.
Также повышение иммунного ответа характеризует достоверное (p<0,05) увеличение количества эозинофилов (таблица 1) в опытной группе в апреле на 75% по сравнению с мартом. При этом в контрольной группе такое повышение не наблюдается. В июне, когда естественная резистентность организма повысилась еще и за счет условий содержания, количество эозинофилов в обеих группах приблизилось к норме.
Содержание лимфоцитов в крови соответствовало в течение всего периода исследования физиологическим показателям, а колебания процентного соотношения зависят от увеличения количества нейтрофилов в лейкограмме.
В контрольной группе, начиная с апреля, наблюдался нейтрофильный лейкоцитоз со сдвигом ядра вправо, что характеризует наличие воспалительного процесса. В частности, наибольшее количество сегментоядерных нейтрофилов, указывающих на хроническое воспаление, наблюдалось в июне. Это подтверждается данными клинического осмотра.
В июне наиболее приближенной к норме можно считать лейкограмму опытной группы, что указывает на хорошее физиологическое состояние организма и достаточно высокий уровень состояния иммунной системы.
На это же указывает исследование показателей фагоцитарных реакций.
Фагоцитарный показатель - это количество лейкоцитов, принявших участие в фагоцитозе. Как видно из таблицы 2, фагоцитарный показатель в опытной группе в апреле значительно возрос (в 4 раза), что является следствием иммуностимуляции. В контрольной группе он возрос в 2 раза, что указывает на повышение качества иммунного ответа (рис 2).
В дальнейшем количество лейкоцитов, принимающих участие в фагоцитозе продолжало повышаться в контрольной и опытной группах (в 2 раза и на 2%), по причине вакцинации всего поголовья. В июне активность лейкоцитов несколько снизилась, но при этом в опытной группе достоверно (p<0,05) выше, чем в контрольной (на 23%). Это свидетельствует о более высоком иммунном статусе у телят, которым предварительно перед вакцинацией вводили «Кероконвитин».
Схожая динамика прослеживается и при исследовании таких показателей, как фагоцитарный индекс (табл.2) (среднее количество фагоцитированных микробов на 1 лейкоцит) и фагоцитарное число (среднее количество фагоцитированных бактерий на 1 лейкоцит от общего числа подсчитанных). Эти показатели говорят, что фагоцитарная сила, т.е. способность поглощать микробные клетки у лейкоцитов в крови опытной группы значительно выше, чем у лейкоцитов в крови контрольной группы.
Из таблицы 3 мы видим, что уровень общего белка сыворотки крови у животных данной породы значительно выше средней нормы по крупному рогатому скоту (на 66%), что говорит об интенсивности обменных процессах у телят герефордов, находящихся на откорме.
Исходя из полученных данных (табл.3) уровень альбуминов в опытной группе до начала опыта был ниже, чем в контрольной на 5%. После введения «Кероконвитина» он достоверно возрос относительно начала опыта на 9,5% (p<0,05). И в дальнейшем держался на достаточно высоком уровне, что характеризует положительную динамику работы печени. При этом в контрольной группе уровень альбуминов хоть и соответствовал норме, но был несколько ниже (на 3% к концу опыта).
В крови α-глобулиновая фракция белков выполняет транспортную функцию, переносят питательные вещества по организму и участвует в иммунном ответе. Достоверное (p<0,05) снижение α-глобулинов (на 30 и 43%) вместе с понижением уровня гемоглобина в апреле у обеих групп соответствует интенсивности увеличения массы организма. В последующем динамика повышения и понижения уровня α-глобулинов различна и соответствует возрастным изменениям. Но в опытной группе наблюдается несколько больший уровень процентного соотношения этой фракции (на 8% в мае и 6% в июне).
При этом уровень γ-глобулинов в сыворотке крови животных контрольной группы был на верхней границе нормы. Это говорит о наличии инфекционного и воспалительного процесса в организме телят, не подвергавшихся иммуностимуляции. В июне, когда в контрольной группе были отмечены случаи заболевания конъюнктиво-кератитом, уровень γ-глобулинов был на 7,7% выше, чем в опытной. При этом уровень γ-глобулинов в сыворотке крови после иммуностимуляции у опытной группы, в апреле достоверно (p<0,05) повысился на 9,3%, что указывает на повышение гуморального иммунитета.
У всех животных на протяжении опыта содержание β-глобулинов в сыворотке крови имеет незначительные колебания, из-за возрастных изменений, находясь при этом в пределах нормы. Лишь у телят контрольной группы в мае количество β-глобулинов превышало норму в связи с уменьшением процента альбуминов в крови.
Таким образом, препарат-иммуностимулятор «Кероконвитин», приготовленный на основе тканей глаз крупного рогатого скота, переболевшего инфекционным конъюнктиво-кератитом, в дозе 0,05 мл на 1 кг живой массы действует стимулирующе на иммунную систему организма, тем самым обеспечивает более высокий иммунный статус животного и более высокую эффективность (на 40%) от предполагаемого способа профилактики по сравнению со способом профилактики с применением только одной вакцины.
Экономическая эффективность способа профилактики инфекционного конъюнктиво-кератита на рубль затрат составляет 442,6 руб, тогда как экономическая эффективность на рубль затрат при применении только вакцины составляет 169,5 руб. Это означает, что при использовании предложенного способа профилактики инфекционного конъюнктиво-кератита, экономическая эффективность на 160% больше, чем при способе профилактики с применением одной вакцины.
Список литературы:
1. Воробьев, С.М. Иммунокоррекция при лечении риккетсиозного конъюнктиво-кератита у крупного рогатого скота: Автореф. дис. на соиск. уч. степ. канд. вет. наук. Троицк, 2001. - 25 с.
2. Гафаров, Х.З. Морфологические и биохимические особенности штамма Moraxella bovis / Х.З. Гафаров, Л.В. Валебная // Мат. Междун. науч. конференции, поев. 70-летию образования зооинж. факультета. - Казань. 2000. - С.35-36.
3. Копенкин, Е.П. Диагностика, лечение и профилактика инфекционного и инвазионного кератоконъюнктивитов крупного рогатого скота [Текст]. / Е.П. Копенкин // Автореферат дис. на. соиск. уч. степ. док. вет. наук. Москва, 2000. - 48 с.
4. Шкиль Н.Н. Профилактика кератоконъюнктивита крупного рогатого скота с применением лекарственных веществ в сверхнизкой концентрации / Н.Н. Шкиль, Н.А. Шкиль // Актуальные проблемы инфекционных и незаразных патологий животных. Сб. науч. тр. / Омск: Вариант-Омск, 2010. - С.192-194.
5. Щербаков Н.П. Лечение и профилактика гнойно-некротических болезней пальцев у крупного рогатого скота и копытной гнили овец. / Автореф. на соиск. уч. ст. док. вет наук. Санкт-Петербург, 1994. - 25 с.
6. Anon. USDA Licenses first pink eye vaccine for cattle health care // Beef, 1985, t.21, p.69.
7. Hughes, D.E., Pugh G.W. // Am. J. Vet. Res.: 1975, Mar. vol.36(3): p.263-265.
| Таблицы: | ||||||||
| Таблица 1. | ||||||||
| Гематологические показатели телят (n=5, X ¯ ± S x ¯ ) | ||||||||
| показатель | 29.03.2012 | 29.04.2012 | 29.05.2012 | 26.06.2012 | ||||
| Контрольная группа | Опытная группа | Контрольная группа | Опытная группа | Контрольная группа | Опытная группа | Контрольная группа | Опытная группа | |
| эритроциты (млн/мкл) | 6,08±1,03 | 6,17±0,58 | 4,17±0,25* | 4,66±0,78* | 5,23±0,34 | 5,42±0,4 | 5,01±0,42 | 4,26±0,16 |
| лейкоциты (тыс/мкл) | 10,22±2,82 | 11,6±3,24 | 8,9±1,45 | 12,2±1,91* | 8,2±3,43 | 12,15±3,57 | 9,075±3,48* | 9,26±2,91 |
| Базофилы, % | 0,4±0,55 | 0,6±0,55 | 0 | 1±0,71 | 0,4±0,55 | 0,8±0,45 | 0 | 0 |
| Эозинофилы, % | 2,8±1,3 | 1,6±1,82 | 2,75±1,71 | 2,8±1,3* | 2,8±1,48 | 2,4±1,14 | 3,5±2,08 | 3,4±1,34 |
| Палочкоядерные нейтрофилы, % | 2,2±0,84 | 1,6±1,52 | 2±0,82 | 3,2±0,84 | 1,8±0,84 | 1,8±0,84 | 1,5±1,29 | 1,8±0,84 |
| Сегментоядерные нейтрофилы, % | 33,2±Н,02 | 27,6±4,16 | 47±4,69* | 24,6±2,7 | 36,4±11,48 | 27,2±9,36 | 41,75±21,17* | 33,4±5,37 |
| Лимфоциты, % | 59±12,92 | 6654±6,54 | 46,75±9 | 66±2,35 | 57±11,05 | 65,4±8,41 | 51±18,28 | 58,4±5,94 |
| Моноциты, % | 2,4±0,89 | 2,2±1,3 | 2±1,82 | 2,4±1,52 | 1,6±1,14 | 2,4±1,14 | 2,25±0,96 | 3±0,71 |
| *p<0,05 |
| Таблица 2. | ||||||||
| Показатели клеточного звена иммунитета телят (n=5, X ¯ ± S x ¯ ) | ||||||||
| Показатель | 29.03.2012 | 29.04.2012 | 29.05.2012 | 26.06.2012 | ||||
| Контрольная группа | Опытная группа | Контрольная группа | Опытная группа | Контрольная группа | Опытная группа | Контрольная группа | Опытная группа | |
| Фагоцитарный показатель | 21,6±6,84 | 17,2±4,38 | 42,4±6,9 | 92,8±3,03* | 83,2±15,27* | 94,4±2,97 | 65,5±8,7 | 85,6±6,4* |
| Фагоцитарный индекс | 2,06±1,3 | 2,18±2,2 | 2,92±0,25 | 3,88±0,04 | 2,68±0,75 | 3,86±0,67 | 3,1±0,2 | 3,79±0,64 |
| Фагоцитарное число | 0,48±0,3 | 0,38±0,14 | 1,24±0,25 | 3,59±0,13 | 2,32±0,99 | 3,66±0,91 | 2,02±0,35 | 3,26±0,63 |
| *p<0,05 |
| Таблица 3. | ||||||||
| Показатели белкового обмена в сыворотке крови телят(n=5, X ¯ ± S x ¯ ) | ||||||||
| 29.03.2012 | 29.04.2012 | 29.05.2012 | 26.06.2012 | |||||
| показатель: | Контрольная группа | Опытная группа | Контрольная группа | Опытная группа | Контрольная группа | Опытная группа | Контрольная группа | Опытная группа |
| Общий белок, г/л | 86,0±0,37 | 81,2±0,2 | 100,0±0,12* | 91,0±0,12* | 98,0±0,32 | 93,6±0,41 | 100,3±0,13 | 93,6±0,33 |
| белковые альбумины, % | 52,3±1,66 | 49,75±2,98 | 51,88±2,19 | 54,46±1,01* | 49,33±0,98 | 53,57±2,31 | 50,89±2,42 | 52,58±1,75 |
| α-глобулины, % | 15,3±2,01 | 18,6±2,24 | 10,6±1,49* | 10,1±1,58* | 11,3±1,69 | 12,3±1,54 | 10,7±1,12 | 11,4±0,81 |
| β-глобулины, % | 11,1±1,25 | 13,5±1,48 | 17,0±0,66 | 16,0±1,46 | 17,1±1,34 | 16,2±1,43 | 13,7±1,85 | 13,6±1,32 |
| γ-глобулины, % | 21,3±1,46 | 18,2±0,83 | 20,5±1,61 | 20,0±1,35 | 22,2±0,75 | 21,1±0,4 | 24,49±2,2 | 22,6±3 |
| *p<0,05 |
Способ профилактики инфекционного конъюнктиво-кератита крупного рогатого скота, включающий вакцинацию вакциной ассоциированной против инфекционного конъюнктиво-кератита крупного рогатого скота на основе антигенов бактерий Moraxella bovis и герпесвируса типа I, отличающийся тем, что за 29-31 день до вакцинации животным вводят подкожно в область верхней трети шеи в дозе 0,045-0,055 мл/кг живой массы иммуностимулирующий препарат, полученный на основе изготовления цитотоксической сыворотки из крови лошадей-доноров путем гипериммунизации их антигеном, приготовленным из тканей глаз - конъюнктивы и роговицы крупного рогатого скота, переболевшего инфекционным конъюнктиво-кератитом, полученных при забое животных.