Новые 5-модифицированные пиримидиновые нуклеозиды - ингибиторы роста mycobacterium tuberculosis
Иллюстрации
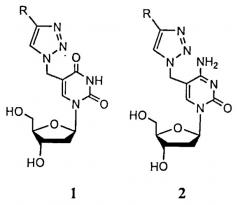
Показать всеИзобретение относится к новым 5-[(4-алкил)-1,2,3-триазол-1-ил]метильным производным 2'-дезоксиуридина и 2'-дезоксицитидина, подавляющим рост Mycobacterium tuberculosis, включая лекарственно устойчивые штаммы, имеющим формулы 1 и 2, соответственно
где R=CnH2n+1, n=8, 10, 12.
1 табл., 12 пр.
Реферат
Область техники.
Изобретение относится к области молекулярной биологии, микробиологии и медицины, а именно к применению новых производных нуклеозидов для подавления роста микобактерий. Более конкретно, изобретение относится к области биологически активных соединений и касается разработки новых 5-алкилоксиметильных производных 2′-дезоксиуридина и 2′-дезоксицитидина - эффективных ингибиторов роста Mycobacterium tuberculosis, включая лекарственно устойчивые штаммы.
Проблема разработки противобактериальных препаратов актуальна на протяжении всего периода существования человечества. Туберкулез (ТБ) - одно из наиболее распространенных инфекционных заболеваний, в настоящее время около трети мировой популяции (более двух миллиардов человек) инфицированы Mycobacterium tuberculosis. По данным ВОЗ, около 9 миллионов человек заболевает ежегодно, более 2 миллионов человек в год умирает от ТБ; из них 10% инфицированы ВИЧ. Заражение ВИЧ повышает шанс реактивации латентной формы туберкулеза, и в то же время вызывает быстрое развитие ТБ вскоре после (ре)инфицирования. Риск перехода латентной формы туберкулеза в активную для больных СПИДом достигает 50%, а для остального населения - всего 10%. В настоящее время в схему химиотерапии может входить до десяти и более противотуберкулезных препаратов. В конце 1980-х годов частота случаев ТБ в мире стала расти. В 1993 году ВОЗ объявила в связи с ТБ о глобальной критической ситуации. Особо следует отметить новые штаммы Mycobacterium tuberculosis: с широкой лекарственной устойчивостью (XDR) и множественной лекарственной устойчивостью (МЛУ), на которые стандартные схемы химиотерапии практически не действуют. Для России ТБ представляет одну из важнейших проблем, поскольку на сегодняшний день его распространенность составляет 190,5 случая на 100 тысяч населения, заболеваемость 85,1 на 100 тысяч населения, смертность 17,9 на 100 тысяч [Туберкулез в России. ООО «РПЦ Прима», М., 2009 г.].
Предшествующий уровень техники.
Противотуберкулезная активность нуклеозидов до недавнего времени не была выявлена. В последнее время появились сообщения о нескольких группах модифицированных нуклеозидов, продемонстрировавших на экспериментальных моделях заметное антимикобактериальное действие [Rai D., Johar M., Manning Т., Agrawal В., Kunimoto D.Y., Kumar R. Design and Studies of Novel 5-Substituted Alkynylpyrimidine Nucleosides as Potent Inhibitors of Mycobacteria // J. Med. Chem. 2005, 48, 7012-7017., Van Daele I, Munier-Lehmann H, Froeyen M, Balzarini J, Van Calenbergh S. Rational design of 5′-thiourea-substituted alpha-thymidine analogues as thymidine monophosphate kinase inhibitors capable of inhibiting mycobacterial growth //J Med Chem. 2007; 50: 5281-92, Gupte A., Boshoff H, I., Wilson D.J., Neres J., Labello N.P., Somu R.V., Xing C., Barry III C.E., Aldrich C.C. // J. Med. Chem. 2008, 51, 7495-7507].
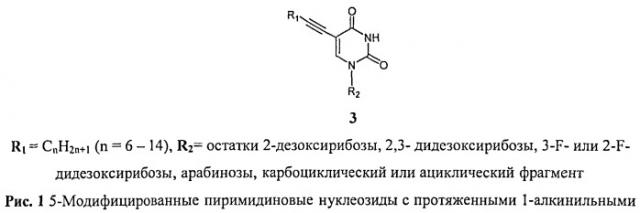
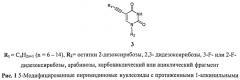
Наиболее близкими к заявляемому, являются 5-модифицированные пиримидиновые нуклеозиды с протяженными 1-алкинильными заместителями формулы 3, которые обладают ингибирующей активностью в отношении Mycobacterium tuberculosis и Mycobacterium bovis in vitro [Rai D., Johar M., Manning Т., Agrawal В., Kunimoto D.Y., Kumar R. Design and Studies of Novel 5-Substituted Alkynylpyrimidine Nucleosides as Potent Inhibitors of Mycobacteria // J. Med. Chem. 2005, 48, 7012-7017., Rai D., Johar M., Srivastav N.C., Manning Т., Agrawal В., Kunimoto D.Y., Kumar R. Inhibition of Mycobacterium tuberculosis, Mycobacterium bovis, and Mycobacterium avium by novel dideoxy nucleosides // J. Med. Chem. 2007, 50, 4766-4774, Johar M., Manning Т., Tse C., Desroches N., Kunimoto D.Y., Agrawal В., Kumar R. Growth inhibition of Mycobacterium bovis, Mycobacterium tuberculosis and Mycobacterium avium in vitro: effect of 1-beta-D-2′-arabinofuranosyl and 1-(2′-deoxy-2′-fluoro-beta-D-2′-riboruranosyl) pyrimidine nucleoside analogs // J. Med. Chem. 2007, 50, 3696-3705, Srivastav N.C., Manning Т., Kunimoto D.Y., Kumar R. // Bioorganic & Medical Chemistry, 15, 2007, 2045-2053, Srivastav, N.C.; Shakya, N.; Bhavanam, S.; Agrawal, A.; Tse, C.; Desroches, N.; Kunimoto, D.Y.; Kumar, R. //Bioorg Med Chem Lett. 2012, 22, 1091-1094. Antimycobacterial activities of 5-alkyl (or halo)-3′-substituted pyrimidine nucleoside analogs и Matyugina E.; Khandazhinskaya, A.; Chernousova, L.; Andreevskaya, S.; Smimova, Т.; Chizhov, A.; Karpenko, I.; KochetkovS.; Alexandrova, L. The synthesis and antituberculosis activity of 5′-nor carbocyclic uracil derivatives. Bioorg Med Chem. 2012, 20].
Недостатком данной группы соединений является их низкая растворимость и использование для их получения малодоступного и дорогостоящего тетракис(трифенилфосфин)палладия (0) и специально очищенного диметилформамида, а также многократное применение колоночной хроматографии на специфических сорбентах.
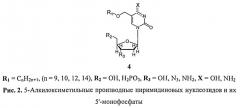
Ранее нами была продемонстрирована способность ингибировать рост M.tuberculosis рядом производных 2′-дезоксинуклеозидов формулы 4, в которых протяженный линейный додецильный или тетрадецильный заместитель был введен в 5 положение пиримидинового основания через оксиметильную группу [Л.А. Александрова, Э.Р. Шмаленюк, С.Н. Кочетков, В.В. Ерохин, Т.Г. Смирнова, С.Н. Андреевская, Л.Н. Черноусова. Новые 5 модифицированные пиримидиновые нуклеозиды - ингибиторы роста микобактерий // Acta Naturae 2010, 3, 89-92]. Однако антимикобактериальная активность изученных соединений была довольно низкой (МИК100 50-100 мкг/мл), а их 5′-монофосфатные производные оказались неактивными. В то же время, ранее нами был получен 5-триазолилметил-2′-дезоксиуридин, обладавший невысокими цитотоксичностью и антигерпетической активностью, анти-ТБ-активность которого изучена не была (Иванов А.В., Симонян А.Р., Беланов Е.Ф., Александрова Л.А. Синтез и антивирусная активность новых 5-замещенных производных 2′-дезоксиуридина. Биоорган. Химия, 2005, 31, 616-622). Синтезу 5-триазолидных производных (2′-дезокси)уридина посвящено большое число обзоров [например: Amblard, F.; Cho, J.H.; Schinazi, R.F. Cu(I)-Catalyzed Huisgen Azide-Alkyne 1,3-Dipolar Cycloaddition Reaction in Nucleoside, Nucleotide, and Oligonucleotide Chemistry. Chem. Rev. 2009, 109, 4207-4220], однако анти-ТБ-активность полученных соединений изучена не была.
Раскрытие изобретения.
Техническим результатом изобретения является нахождение новых химических соединений на основе 2′-дезоксипиримидиновых нуклеозидов, обладающих способностью эффективно ингибировать рост Mycobacterium tuberculosis, включая лекарственно устойчивые штаммы. Указанный технический результат достигается тем, что согласно изобретению предложены новые соединения на основе 2′-дезоксипиримидиновых нуклеозидов, а именно 5-[(4-алкил)-1,2,3-триазол-1-ил]метильные производные 2′-дезоксиуридина и 2′-дезоксицитидина, подавляющие рост Mycobacterium tuberculosis, включая лекарственно устойчивые штаммы, имеющие формулы 1 и 2, соответственно.
где R=CnH2n+1, n=8, 10, 12
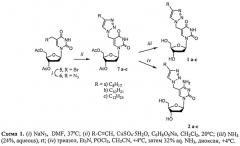
5-Алкилтриазолидометильные производные 2′-дезоксиуридина 1 и 2′-дезоксицитидина 2 синтезируют в соответствии со схемой 1.
Исходный 5-азидометил-3′,5′-ди-O-ацетилтимидин 6 получают азидированием 5-броммометил-3′,5′-ди-O-ацетилтимидина 5 по разработанному нами ранее методу [Зарытова В.Ф., Комарова Н.И., Левина А.С., Табатадзе Д.Р., Халимская Л.М., Александрова Л.А. Синтез олигонуклеотидов, содержащих модифицированный по С-5 дезоксиуридин с алифатической аминогруппой. Биоорган. Химия, 1991, 17, №8, 1059-1065; Levina, A.S.; Tabatadse, D.R.; Khalimskaya, L.M.; Prichodko, T.A.; Shishkin, G.V.; Alexandrova, L.A.; Zarytova, V.P.; Oligonucleotide derivatives bearing reactive and stabilizing groups attached to C5 of deoxyuridine, Bioconjugale Chem., 1993, 4, 319-325].
1,3-Диполярная циклоконденсация азида 6 с подходящими ацетиленами в двухфазной системе хлористый метилен-вода при катализе Cu(I), полученной in situ из медного купороса и аскорбината натрия по методу [Lee, B.-Y.; Park, S.R.; Jeon, H.B.; Kim, R.S. A new solvent system for efficient synthesis of 1,2,3-triazoles. Tetrahedron Lett., 2006, 47, 5105-5109], приводит к получению 5-алкилтриазолидометильные производных 3′,5′-диацетил-2′-дезоксиуридина 7а-7с. Деблокированием синтонов 7а-7с приводит к 5-алкилтриазолидометильным производным 2′-дезоксиуридина 1а-1с.
5-Алкилтриазолидометильные производные 2′-дезоксицитидина 2а-2с получают по методу Divakar и Reese [26] конденсацией синтонов 7а-7с с фосфо-трис.триазолидом с последующей обработкой водным раствором аммиака.
Ниже приведены примеры синтеза заявляемых соединений.
Пример 1. 5-Октилтриазолидометил-3′,5′-ди-О-ацетил-2′-дезоксиуридин (7a).
К раствору азида 6 (182 мг, 0.5 mmol) и 1-децина (104 мг, 134 мкл, 0.75 mmol) в 2 мл CH2Cl2 добавили CuSO4×5H2O (12.4 мг, 0.05 mmol), аскорбинат натрия (30 мг, 0.15 mmol) и 2 мл H2O. Смесь перемешивали 17 ч. при комнатной температуре, затем добавили 5 мл CH2Cl2, органический слой промыли водой (3×2 мл), высушили над Na2SO4 и упарили в вакууме. Остаток очищали на колонке с силикагелем в CH2Cl2-этанол, 20:1. Выход 237 мг, 94%, в виде белой аморфной массы. 1H-NMR (DMSO-d6): δ 0.83 (m, 3H, -(CH2)7CH3), 1.23 (m, 10Н, -CH2CH2(CH2)5CH3), 1.56 (m, 2H, -CH2CH2(CH2)5CH3), 2.03 (s, 3Н, 2′-Ас), 2.06 (s, 3Н, 5′-Ас), 2.36 (m, 2H, Н-2′), 2.61 (m, 2H, -CH2CH2(CH2)5CH3), 4.20 (m, 2H, Н-5′), 4.25 (m, 1H, Н-4′), 5.12 (s, 2H, 5-CH2), 5.21 (m, 1H, Н-3′), 6.13 (t, J=7 Hz, 1H, Н-1′), 7.90 (s, 1H, CH).
Пример 2. 5-Децилтриазолидометил-3′,5′-ди-O-ацетил-2′-дезоксиуридин (7b). Получен по описанному выше методу из азида 6 и 1-додецина с выходом 245 мг, 92% в виде белой аморфной массы. 1H-NMR (DMSO-d6): δ 0.80 (m, 3Н, -(CH2)9CH3), 1.20 (m, 14H, -CH2CH2(CH2)7CH3), 1.60 (m, 2H, -CH2CH2(CH2)7CH3), 2.05 (s, 3Н, 2′-Ас), 2.10 (s, 3Н, 5′-Ас), 2.41 (m, 2H, Н-2′), 2.64 (m, 2H, -CH2CH2(CH2)7CH3), 4.19 (m, 2H, Н-5′), 4.28 (m, 1H, Н-4′), 5.10 (s, 2H, 5-CH2), 5.18 (m, 1H, Н-3′), 6.17 (1, J=7 Hz, 1H, Н-1′), 7.84 (s, 1H, CH).
Пример 3. 5-Додецилтриазолидометил-3′,5′-ди-O-ацетил-2′-дезоксиуридин (7c). Получен по описанному выше методу из азида 6 и 1-тетрадецина с выходом 266 мг, 95% в виде белой аморфной массы. 1H-NMR (DMSO-d6): δ 0.78 (m, 3Н, -(CH2)11CH3), 1.19 (m, 18H, -CH2CH2CH2(CH2)9CH3), 1.63 (m, 211, -CH2CH2(CH2)9CH3), 2.10 (s, 3H, 2′-Ac), 2.12 (s, 3Н, 5′-Ac), 2.43 (m, 2H, H-2′), 2.61 (m, 2H, -CH2CH2(CH2)9CH3), 4.17 (m, 2H, H-5′), 4.30 (m, 1H, H-4′), 5.11 (s, 2H, 5-CH2), 5.18 (m, 1H, H-3′), 6.12 (t, J=7 Hz, 1H, Н-1′), 7.85 (s, 1H, CH).
Пример 4. 5-Октилтриазолидометил-2′-дезоксиуридин (1a). 5-Октилтриазолидометил-3′,5′-ди-O-ацетил-2′-дезоксиуридина (7a, 61 мг, 0.12 ммоль) растворяли в диоксане (3 мл), добавляли 24% водный аммиак (1 мл). Через 21 час упаривали, остаток растворяли в хлороформе, наносили на колонку с силикагелем (3×15), элюировали системой растворителей хлороформ-метанол (9:1). Выход 48 мг, 94% в виде белой аморфной массы. 1H-NMR (DMSO-d6): δ 0.83 (m, 3Н, -(CH2)7CH3), 1.24 (m, 10Н, -CH2CH2(CH2)5CH3), 1.55 (m, 2H, -CH2CH2(CH2)5CH3), 2.11 (m, 2H, H-2′), 2.60 (m, 2H, -CH2CH2(CH2)5CH3), 3.51 (m, 2H, H-5′), 3.79 (m, 1H, H-4′), 4.25 (m, 1H, H-3′), 5.12 (m, 2H, 5-CH2), 6.12 (t, J=1 Hz, 1H, Н-1′), 7.72 (s, 1H, H-6), 8.10 (s, 1H, CH), 11.50 (s, 1H, NH). 13C-NMR (DMSO-d6): δ 13.88 (-(CH2)7CH3), 22.01-31.20 (-(CH2)7CH3), 46.13 (5-CH2), 61.18 (С-5′), 70.13 (С-3′), 85.30 (С-1′), 87.46 (С-4′), 100.17 (С-5), 121.48 (CH), 143.03 (С-6), 147.00 (-C-C8H17), 153.12 (C-2), 163.19 (С-4). MS (ESI) рассчитано для C20H31N5O5 422.2398 (M+H), найдено 422.2406, рассчитано для C20H31N5O5 444.2217 (M+Na) найдено 444.2224.
Пример 5. 5-Децилтриазолидометил-27-дезоксиуридин (1b). Получен деблокированием 5-децилтриазолидометил-3′,5′-ди-O-ацетил-2′-дезоксиуридина (7b) по описанному выше методу с выходом 55 мг, 97% в виде белой аморфной массы. 1H-NMR (DMSO-d6): δ 0.84 (m, 3Н, -(CH2)9CH3), 1.25 (m, 14H, -CH2CH2(CH2)7CH3), 1.55 (m, 2H,, -CH2CH2(CH2)5CH3), 1.98 (m, 2H, H-2′), 2.59 (m, 2H, -CH2CH2(CH2)7CH3), 3.55 (m, 2H, H-5′), 3.78 (m, 1H, H-4′), 4.29 (m, 1H, H-3′), 5.29 (m, 2H, 5-CH2), 6.10 (t, J=7 Hz, 1H, Н-1′), 7.75 (s, 1H, H-6), 8.00 (s, 1H, CH). 13C-NMR (DMSO-d6): δ 13.83 (-(CH2)9CH3), 22.21-31.43 (-(CH2)9CH3), 46.33 (5-CH2), 61.22 (С-5′), 70.11 (С-3′), 85.37 (С-1′), 87.50 (С-4′), 100.11 (С-5), 121.40 (CH), 143.00 (С-6), 147.00 (-C-C10H21), 153.09 (C-2), 163.22 (С-4). MS (ESI) рассчитано для C22H35N5O5 450.2711 (M+H), найдено 450.2715, рассчитано для C22H35N5O5 472.2530 (M+Na) найдено 472.2536.
Пример 6. 5-Додецилтриазолидометил-2′-дезоксиуридин (1c). Получен деблокированием 5-додецилтриазолидометил-3′,5′-ди-O-ацетил-2′-дезоксиуридина (7c) по описанному выше методу с выходом 55 мг, 95% в виде белой аморфной массы. 1H-NMR (DMSO-d6): δ 0.82 (m, 3Н, -(CH2)11CH3), 1.22 (m, 16H, -CH2CH2(CH2)9CH3), 1.55 (m, 2H, -CH2CH2(CH2)9CH3), 1.99 (m, 2H, H-2′), 2.57 (m, 2H, -CH2CH2(CH2)9CH3), 3.59 (m, 2H, H-5′), 3.77 (m, 1H, H-4′), 4.22 (m, 1H, H-3′), 5.33 (m, 2H, 5-CH2), 6.08 (t, J=1 Hz, 1H, Н-1′), 7.79 (s, 1H, H-6), 7.97 (s, 1H, CH). 13C-NMR (DMSO-d6): δ 13.90 (-(CH2)11CH3), 22.27-31.50 (-(CH2)11CH3), 46.41 (5-CH2), 61.25 (С-5′), 70.18 (С-3′), 85.39 (С-1′), 87.54 (С-4′), 100.13 (С-5), 121.43 (CH), 143.12 (С-6), 147.17 (-C-C11H23), 153.11 (С-2), 163.27 (С-4). MS (ESI) рассчитано для C24H39N5O3 478.3024 (M+H), найдено 478.3017, рассчитано для C22H35N5O5 C24H39N5O5 500.2843 (M+Na) найдено 500.2834.
Пример 7. 5-Октилтриазолидометил-2′-дезоксицитидин (2a). К раствору 5-октилтриазолидометил-3′,5′-ди-O-ацетил-2′-дезоксиуридина (7a, 171 мг, 0.34 ммоль) в безводном ацетонитриле (3 мл), охлажденному до -15°C, добавляли свежеприготовленный раствор фосфотристриазолида (полученного из триазола (0,24 г, 3,46 ммоль), триэтиламина (0,48 мл, 3,5 ммоль) и оксохлоридфосфора (0,1 мл, 1,16 ммоль) в ацетонитриле (3 мл). Смесь выдерживали 15 ч при +4°C, упаривали, остаток растворяли в этилацетате (5 мл) и промывали водным раствором NaHCO3 2×2 мл и водой 2×2 мл. Органический слой сушили сульфатом натрия, упаривали. Остаток растворяли в диоксане (3 мл) и приливали 1 мл 34% водного раствора аммиака. Через 20 часов при +4°C реакционную смесь упаривали, остаток очищали на колонке (3×15 см) с силикагелем. Элюировали системой растворителей хлороформ-метанол (8:1). Выход 54 мг, 38% в виде белой аморфной массы. 1H-NMR (DMSO-d6): δ 0.83 (m, 3H, -(CH2)7CH3), 1.24-1.28 (m, 10Н, -CH2CH2(CH2)5CH3), 1.55 (m, 2H, -CH2CH2(CH2)5CH3), 1.93-2.38 (m, 2H, H-2′), 2.66 (m, 2H, -CH2CH2(CH2)5CH3), 3.55 (m, 2H, H-5′), 3.79 (m, 1H, H-4′), 4.19 (m, 1H, H-3′), 5.39 (m, 2H, 5-CH2), 6.09 (t, J=7 Hz, 1H, Н-1′), 6.79 (s, 1H, H-6), 8.01 (s, 1H, CH). 13C-NMR (DMSO-d6): δ 13.88 (-(CH2)7CH3), 22.01-31.20 (-(CH2)7CH3), 46.13 (5-CH2), 61.18 (С-5′), 70.13 (С-3′), 85.30 (С-1′), 87.46 (С-4′), 100.17 (С-5), 121.48 (CH), 143.03 (С-6), 147.00 (-C-C8H17), 153.12 (С-2), 163.18 (С-4). MS (ESI) рассчитано для C20H32N6O4 421.2535 (M+H), найдено 421.2548, рассчитано для C20H32H6O4 443.2377 (M+Na) найдено 443.2368.
Пример 8. 5-Децилтриазолидометил-2′-дезоксицитидин (7b). Получен из 5-децилтриазолидометил-3′,5′-ди-O-ацетил-2′-дезоксиуридина (7b) по описанному выше методу с выходом 49 мг, 32% в виде белой аморфной массы. 1H-NMR (DMSO-d6): δ 0.83 (m, 3H, -(CH2)9CH3), 1.23 (m, 14H, -CH2CH2(CH2)7CH3), 1.55 (m, 2H,, -CH2CH2(CH2)7CH3), 1.95-2.21 (m, 2H, H-2′), 2.58 (m, 2H, -CH2CH2(CH2)7CH3), 3.53 (m, 2H, H-5′), 3.81 (m, 1H, H-4′), 4.22 (m, 1H, H-3′), 5.31 (m, 2H, 5-CH2), 6.11 (t, J=1 Hz, 1H, H-1′), 7.79 (s, 1H, Н-6), 8.05 (s, 1H, CH). 13C-NMR (DMSO-d6): δ 13.86 (-(CH2)9CH3), 22.02-31.23 (-(CH2)9CH3), 46.13 (5-CH2), 61.17 (С-5′), 70.14 (С-3′), 85.34 (С-1′), 87.49 (С-4′), 100.24 (С-5), 121.50 (CH), 143.04 (C-6), 147.00 (-C-C10H21), 153.64 (C-2), 163.25 (C-4). MS (ESI) рассчитано для C22H36N6O4 449.2871 (М+Н), найдено 449.2871.
Пример 9. 5-Додецилтриазолидометил-2′-дезоксицитидин (7c). Получен из 5-додецилтриазолидометил-3′,5′-ди-O-ацетил-2′-дезоксиуридина (7c) по описанному выше методу с выходом 66 мг, 41% в виде белой аморфной массы. 1H-NMR (DMSO-d6): δ 0.84 (m, 3Н, -(CH2)11CH3), 1.25 (m, 18H, -CH2CH2(CH2)9CH3)9CH3), 1.54 (m, 2H,, -CH2CH2(CH2)9CH3), 1.94-2.22 (m, 2H, H-2′), 2.58 (m, 2H, -CH2CH2(CH2)9CH3), 3.54 (m, 2H, H-5′), 3.82 (m, 1H, H-4′), 4.24 (m, 1H, H-3′), 5.32 (m, 2H, 5-CH2), 6.12 (t, J=1 Hz, 1H, H-1′), 7.79 (s, 1H, H-6), 8.05 (s, 1H, CH). 13C-NMR (DMSO-d6): δ 13.86 (-(CH2)11CH3), 22.02-31.23 (-(CH2)11CH3), 46.13 (5-CH2), 61.17 (С-5′), 70.14 (С-3′), 85.34 (С-1′), 87.49 (C-4′), 100.24 (С-5), 121.50 (CH), 143.04 (С-6), 147.00 (-С-С12H25), 153.64 (C-2), 163.25 (C-4). MS (ESI) рассчитано для C24H40N6O4 477.3179 (М+Н), найдено 477.3184, рассчитано для C24H40N6O4 499.3003 (M+Na) найдено 499.3002.
Пример 10. Химическая стабильность соединений (1a-1c или 2a-2c). Реакционную смесь объемом 75 мкл, содержащую 3 мкл 25 mM раствора соединений (1a-1c или 2a-2c) и 72 мкл буферного раствора, инкубировали при 37°C. Отбирали аликвоты реакционной смеси объемом 15 мкл через 5 мин, 1, 3, 5, 7, 24 часа и анализировали методом ВЭЖХ в следующих условиях: преколонка С-18 (40 µм, 4×5 мм), колонка Nucleosil C-8 (5 µм, 4×150 мм); градиент 80% CH3CN в 5 mM натрий-фосфатном буфере (pH 5.16): 0%, 5 мин, 0→5%, 5 мин; 5→15%, 15 мин; 15→100%, 10 мин. Скорость элюции 0,5 мл/мин, поглощение детектировали на UV-детекторе при λ=264 нм. Соединения были устойчивы к химическому гидролизу более 24 часов при трех различных значениях pH:2,2 (буферный раствор глицин-HCl); 7,4 (фосфатно-солевой буфер) и 9,0 (буферный раствор глицин-NaOH).
Пример 11. Ферментативная стабильность соединений (1a-1c или 2a-2c). Реакционную смесь, содержащую 3 мкл 25 mM тестируемых соединений и 72 мкл FBS (фетальной сыворотки теленка), инкубировали при 37°C. Через определенные интервалы времени отбирали аликвоты объемом 15 мкл. Реакцию останавливали добавлением холодного MeOH до 70% объемного содержания, выдерживали в течение 20 мин при -20°C. Кислотонерастворимую фракцию отделяли центрифугированием (ц/ф Эппендорф 5415D, 13400 об/мин, 10 мин). Супернатант отбирали, упаривали на установке Speed-Vac. Полученные пробы анализировали методом ВЭЖХ в условиях, приведенных выше. Все соединения были стабильны в условиях ферментативного гидролиза более 24 часов.
Пример 11. Цитопатическое действие заявляемых соединений (1a-1c или 2a-2c) в культуры клеток Vero. Токсичность соединений оценивали по МТТ-тесту [Niks M, Otto М. Towards an optimized MTT assay. J Immunol Methods. 1990 12; 130(1):149-51]. Наращенный монослой культуры клеток Vero (0,8×106 клеток/мл) рассаживали с трех разведением на 96-луночный планшет в объеме 100 мкл и инкубировали с соединениями, растворенными в среде DMEM в интервале концентраций 0.5-200 мкг/мл в течение 72 часов (5% CO2, 90% влажность, 37°C). Затем отбирали среду, содержащую изучаемые соединения, и в каждую лунку планшета вносили 100 мкл раствора MTT (0,5 мг/мл) в DMEM. Инкубировали 4 часа (5% CO2, 90% влажность, 37°C). По окончании инкубации среду удаляли, к окрашенным клеткам добавляли 100 мкл смеси iPrOH/0,04M HCl. Планшет выдерживали в темноте при комнатной температуре в течение 30 мин. Показания оптической плотности (OD) считывали на планшетном ридере Chameleon при 595 нм.
Пример 12. Микробиологические исследования заявляемых соединений (1a-1c и 2a-2c).
Микобактериальные штаммы. Для проведения испытаний препаратов использовали чувствительный к противотуберкулезным препаратам лабораторный штамм M.tuberculosis H37Rv и МЛУ-штамм M.tuberculosis MS-115, устойчивый к действию 5 противотуберкулезных препаратов 1-й группы (рифампицину, изониазиду, стрептомицину, этамбутолу и пиразинамиду). Микобактерии были переведены в суспензию одиночных клеток в одинаковой фазе роста и стандартизованы по КОЕ [Андреевская С.Н., Черноусова Л.Н., Смирнова Т.Г., Ларионова Е.Е., Кузьмин А.В. // Пробл. туб. и болезн. легк. 2006. №12. С.43-48]. В работе использовали обогащенную жидкую питательнную среду Дюбо (Difco).
Оценка эффективности препаратов. Изучение влияния препаратов на рост микобактериального штамма проводили на автоматической системе детекции роста Bactec MGIT 960 (BD, USA) стандартным методом (Franzblau SG, Witzig RS, McLaughlin JC, Torres P, Madico G, Hernandez A, Degnan MT, Cook MB, Quenzer VK, Ferguson RM, Oilman RH. 1998. Rapid, low-technology MIC determination with clinical Mycobacterium tuberculosis isolates by using the microplate Alamar Blue assay. J. Clin. Microbiol. 36:362-366) в течение 42 дней. Микобактериальную суспензию в объеме 500 мкл инокулировали в 7,9 мл питательной среды. Конечная концентрация M.tuberculosis в образце составляла 105-106 КОЕ/мл. Каждую из концентраций, включая контрольные пробирки без препарата, исследовали при трех повторах.
Антимикобактериальное действие препаратов оценивали по динамике роста M. tuberculosis H37Rv в присутствии различных концентраций препаратов по сравнению с ростом штамма на среде, не содержащей препаратов. Детекция роста проводилась каждый час автоматически и регистрировалась с помощью программного обеспечения Epicenter (BD, USA). Рост микобактериальных клеток выражался в относительных единицах флюоресценции (ОЕФ).
| Таблица 1 | ||||||
| Токсичность и антитуберкулезная активность 5-модифицированных производных 2′-дезоксипиримидиновых нуклеозидов | ||||||
| Соед. | R | Токсичность CD50, мкг/мл Vero | Активность (H37Rv) | Активность (MS115) | ||
| MIC50 мкг/мл | MIC100 мкг/мл | MIC50 мкг/мл | MIC100 мкг/мл | |||
| 1a | C8H17 | >100 | 17 | 40 | 15 | <40 |
| 1b | C10H21 | >100 | 6 | 10 | 7 | 10 |
| 1c | C12H25 | >100 | 9 | 40 | 10 | <40 |
| 2a | C8H17 | >100 | 25 | 40 | 23 | <40 |
| 2b | C10H21 | >100 | 27 | 40 | 25 | <40 |
| 2c | C12H25 | >100 | 8 | 20 | 9 | 20 |
| Изониазид* | >100 | <0.5 | 0.5 | Н.а. | ||
| Рифампицин* | >100 | <1 | 2 | Н.а. | ||
| Офлоксоцин | >100 | <1 | 2 | <1 | 2 | |
| СВ50 - максимальная концентрация соединения, вызывающая гибель не более 50% культивируемых клеток в сравнении с контролем - клетками, инкубируемыми без тестируемого соединения в культуральной среде.MIC50 - концентрации соединения, при котором рост микобактерий ингибируется на 50%MIC100 - концентрации соединения, при котором рост микобактерий ингибируется на 100%Н.а. - не активен*Стрептомицин, этамбутол и пиразинамид также не обладали активностью на штамме MS-115 |
Анализ таблицы показывает, что заявляемые новые химические соединения на основе 2′-дезоксипиримидиновых нуклеозидов, а именно 5-[(4-алкил)-1,2,3-триазол-1-ил]метильные производные 2′-дезоксиуридина и 2'-дезоксицитидина обладают антимикобактериальным действием, в частности, в отношении лабораторного штамма М.tuberculosis H37R.V и МЛУ-штамма M.tuberculosis MS-115 устойчивого к действию 5 противотуберкулезных препаратов 1-й группы (рифампицину, изониазиду, стрептомицину, этамбутолу и пиразинамиду)
Промышленная применимость.
Изобретение может быть использовано в медицине и ветеринарии, лечебных учреждениях и научно-исследовательских лабораториях.
5-[(4-Алкил)-1,2,3-триазол-1-ил]метильные производные 2'-дезоксиуридина и 2'-дезоксицитидина, подавляющие рост Mycobacterium tuberculosis, включая лекарственно устойчивые штаммы, имеющие формулы 1 и 2, соответственно где R=CnH2n+1, n=8, 10, 12