Способ профилактики и снижения деструкции белков скелетных мышц при их атрофии, вызванной гипокинезией и/или гравитационной разгрузкой
Иллюстрации
Показать всеИзобретение относится к медицине и может быть использовано для предотвращения атрофии скелетных мышц при их функциональной разгрузке путем действия на организм блокатора кальпаинов 1-го типа. Для этого в качестве фактора, снижающего экспрессию кальпаинов 1-го типа, используют введение в мышцу препарата PD150606 (синоним (2Z)-3-(4-iodophenyl)-2-mercapto-2-Propenoic acid, 3-(4-iodophenyl)-2-mercapto-(Z)-2-propenoic acid, эмпирическая формула C9H7IO2S), блокирующего в мышцах кальпаины 1 типа и, в частности, снижающего в мышцах экспрессию мРНК µ-кальпаина. Изобретение обеспечивает предупреждение атрофии мышц, а также возможность в течение более длительного времени осуществлять это предупреждение за счет блокирования кальпаиновой протеолитической системы, приводящей к распаду белка при функциональной разгрузке мышц, что ведет к предотвращению в них атрофических процессов. 6 ил.
Реферат
Изобретение относится к медицине, более точно к физиологии, космической медицине и может найти применение при устранении негативного последствия гипокинезии или гравитационной разгрузки.
Сократительные и цитоскелетные белки скелетных мышц при гипокинезии и гравитационной разгрузке подвергаются деструкции. В то время как начальные физиологические события, сопровождающие атрофию, были хорошо исследованы (снижение мышечной силы, напряжения), немного известно о триггерах или молекулярных сигнальных событиях, лежащих в основе этого процесса. Атрофия мышц обусловлена снижением в ней белкового синтеза и резким увеличением белкового распада (S.Kandarian и др., 2004). Известны 4 протеолитические системы, включенные в распад мышечных белков: лизосомальная (аутофаги/лизосомы), каспазная, кальпаиновая, убиквитин-протеасомная. Степень вовлечения каждой из этих систем в развитие атрофии при различных ее моделях (кахексия, сепсис, денервация, иммобилизация, вывешивание) разная. В последнее время считается, что при функциональной разгрузке мышц каспазная система практически не задействована. Около 70% от объема мышечного волокна занимают сократительные белки, и эта фракция при атрофии снижается быстрее, чем многие другие (Baldwin KM и др., 1990). Какая из протеолитических систем задействована в распаде сократительных белков - до недавнего времени оставалось неизвестным. S. Cohen с соавторами в 2009 г. обнаружили, что ЕЗ лигаза MuRF-1 участвует в убиквитинировании толстых филаментов при атрофии. Остается неизвестным, как может приступить к работе убиквитин-протеасомная система, если толстые филаменты защищены от убиквитирования в миофибриллах связанными белками? На этот вопрос ответа до сих пор не получено. Мы полагаем, что доступность толстых филаментов для убиквитирования может обеспечить кальпаиновая система. Работа кальпаиновой системы при мышечной разгрузке исследована недостаточно. Можно предположить, что кальпаины могут служить начальным звеном, запускающим дальнейшее убиквитинирование белков при функциональной разгрузке мышц. Известны работы где применяли блокирование кальпаинов на культуре мышечных клеток (Nozaki К. И др., 2010), при сепсисе мышц (Callahan LA, Supinski GS, 2009) и некоторых других случаях, в которых сигнальные пути, задействованные в белковой деградации, отличны от процессов, вызывающих атрофию при функциональной разгрузке мышц. Блокирование кальпаинов при функциональной разгрузке мышц у животных применяли в нескольких работах, где исследовали изменение функциональных характеристик мышц и изменение мышечной массы. Однако во всех этих работах использовали трансгенных животных, с повышенной экспрессией кальпастатина (естественного ингибитора кальпаинов) (1, 2, 3). Другие авторы использовали ингибитор кальпаина calpeptin для исследования эффектов предотвращения, или снижения разрушения некоторых белков мышц от повреждений вызванных экспериментальной аллергией (4), различными другими заболеваниями, а также эксцентрической нагрузкой (5). Введение ингибиторов кальпаинов животным неоднократно использовали для исследований, проводимых на сетчатке глаза, сердце (6,7) и других органах. Наиболее близким способом (прототипом), направленным на предотвращения атрофии скелетных мышц при их функциональной разгрузке, можно считать способ, где животным вводили L-аргинин (патент РФ №2444354).
Недостатком этого известного способа является то, что L-аргинин нельзя вводить в течение длительного времени, т.к. в этом случае активность собственной мышечной NO-синтазы снижается, что уменьшает выработку собственной NO мышцами.
Техническим результатом заявленного способа является повышение эффективности способа за счет более высокой степени предупреждения атрофии мышц, а также возможность в течение более длительного времени осуществлять это предупреждение.
Этот технический результат обеспечивается следующим техническим эффектом: способ обеспечивает блокирование кальпаиновой протеолитической системы, приводящей к распаду белка при функциональной разгрузке мышц, что ведет к предотвращению в них атрофических процессов.
Указанный технический результат достигается тем, что в известном способе профилактики и снижения деструкции скелетных белков скелетных мышц при их атрофии, вызванной гипокинезией и/или гравитационной разгрузкой путем введения препаратов, в качестве препарата вводят блокатор кальпаинов PD150606.
Способ осуществляют следующим образом
Для выполнения поставленной задачи нами была проведена предварительная работа по подбору специфического ингибитора кальпаинов мышц, его концентрации и метода введения препарата in vivo. Эта работа была необходима, т.к. специфический ингибитор кальпаинов PD150606 применялся ранее только в экспериментах с культурами ткани, и известна единичная работа, в которой этот препарат вводился крысам за 30 минут до забоя. Оригинальность нашего подхода заключалась в том, что до нас длительного введения ингибитора кальпаинов in vivo в мышцы не применяли. На подготовительном этапе мы использовали 23 самца крыс Wistar и определили концентрацию PD150606, и частоту внутримышечного введения препарата для блокирования синтеза µ-кальпаина и тестирования некоторых маркеров сигнальных путей мышц. При этом мы также убедились, что после 3-х дней эксперимента животные, которым препарат вводился внутримышечно, по основным физиологическим показателям не отличались от крыс без введения препарата. Для проведения эксперимента 21 самец крыс Wistar были случайным образом распределены в 3 группы (по 7 крыс в каждой): интактный контроль (гр. К, вес крыс 226±13 г); вторую группу крыс вывешивали 3 дня таким образом, чтобы их передние конечности опирались на пол, а задние конечности его не касались (гр. В, вес крыс 207±7 г); третью группу вывешивали с введением ингибитора кальпаинов PD150606 (гр. PD, вес крыс 215±9 г, введение препарата внутримышечно в 10% DMSO дважды в день (в концентрации 3 мг/кг в день). Крыс забивали сверхдозой нембутала (75 мг/кг веса), m.soleus немедленно замораживали в жидком азоте и хранили при -85°С. Определяли методом ПЦР в реальном времени уровень мРНК µ-кальпаина, белков теплового шока (Hsp90 и 70), nNOS, ЕЗ лигаз (атрогена-1 и MuRFl), элонгационного фактора eEF2k (ингибирующего функцию белкового синтеза). Методом фореза в полиакриламидном геле и иммуноблота определяли маркеры сигнальных путей протеинового синтеза Akt-mTOR-S6K и MAPK/Erk: pAkt, pFOXO3, pP90, а также уровень конъюгированного убиквитина.
Электрофорез в ПЛАГ.
С каждой пробы m.soleus были сделаны срезы толщиной 20 мкм (10-15 мг) и немедленно прогомогенизированы в течение 25 мин в 100 мкл буфера содержащего 50 мМ Трис-HCl (рН 8), 150 мМ NaCl, 0,1% ДДС-Na, 10 мМ ЭДТА, 50 мМ бета-глицерофосфат, 0,5 мМ DTT, 5 мМ ЭГТА, 10 мкг/мл апротинин, 10 мкг/мл леупептин, 1 мМ PMSF, 50 мМ NaF, 1 мМ Na3VO4, 10 мкг/мл пепстатин; 0,1% Тритон Х-100. Затем образцы центрифугировали при 20000xg в течение 15 мин. Часть суперпатапта отбирали для определения концентрации общего белка с помощью RC DC Protein Assay (Bio-Rad Laboratories, США). Электрофорез проводили в 10% разделяющем и 5% концентрирующем акриламидном геле. Образцы загружались из расчета 40 мкг общего белка в каждой пробе на дорожку и нормировались относительно уровня GAPDH, содержащегося в той же пробе.
Вестернблоттинг.
Электроперенос белков производился в буфере (25 мМ Трис рН 8,3, 192 мМ глицин, 20% метанола, 0,04% ДДС-Na) на нитроцеллюлозную мембрану при 100 мА при температуре +4°С в системе mini Trans-Blot (Bio-Rad Laboratories, США) в течение 2 часов. Мембраны блокировали в растворе 5% сухого молока (Bio-Rad Laboratories, США) в TBST. Для выявления были использованы первичные моноклональные антитела: анти-pAkt (Abeam, 1:1000), анти-Р-р90 (Abeam, 1:800), aHTи-pFOXO3 (Santa Cruz, 1:1000), антиубиквитин (Abeam, 1:1000). Были использованы вторичные антитела: GAM Bio-Rad Laboratories, США 1:50000 и GAR Santa Cruz, 1:1000). Вестернблоттинг был повторен не мене 3 раз. Анализ белковых полос производился с помощью денситометра GS-800 (Quantity-One™ software, BioRad). Для каждой группы были подсчитаны как Mm (средняя±стандартная ошибка).
Анализ экспрессии генов.
Обратная транскрипция. Тотальная РНК была экстрагирована из 10 мг замороженной m.soleus при помощи RNeasy Micro Kit (QIAGEN, Germany). Все образцы РНК были обработаны протеиназой К и ДНКазой I. Концентрация РНК была определена при длине волны 260 нм. Затем водный раствор выделенной РНК был заморожен при -84°С для последующего проведения обратной транскрипции. Для обратной транскрипции использовали водный раствор 1 мкг РНК, олиго(dT)15, случайные гексануклеотиды d(N)6, обратную транкскриптазу MMLV. Обратную транскрипцию проводили при 37°C в течение 60 мин согласно стандартному протоколу. Все образцы были проанализированы не менее 3-х раз и все реакции измерены с помощью детектирующего амплификатора iQ5 Multicolor Real-Time PCR Detection System (Bio-Rad Laboratories, США), Р-актин и GAPDH использовали в качестве референсных генов. Праймеры, использованные для проведения ПЦР-РВ: 5′-GAGGCAGAGGAAGAGAAAGG-3′ и 5′-ATGGGCTTCGTCTTATTCAG-3′ для HSP90P; 5′-CCTCCGATTTCAGCTCAG-3′ и 5′-CGAAGGCGTAGAGATTCCAG-3′ для HSP70; 5′-CTACGATGTTGCAGCCAAGA-3′ и 5′-GGCAGTCGAGAAGTCCAGTC-3′ для MAFbx; 5′-GCCAATTTGGTGCTTTTTGT-3′ и 5′-AAATTCAGTCCTCTCCCCGT-3′ для MuRF-1; 5′-CATGGCTAAGAGCAGGAAGG-3′ и 5′-CGAAGTCTGCAGGTCTAGGG-3′ для calpainl; 5′-AGAAGCTGGTGACAGGCAGT-3′ и 5′-GGGTTCTTGTCCAGTCCAAA-3′ для cEFk; 5′-AGTCCCCTGCTTCGTGAGAG-3′ и 5′-CACCCGAAGACCAGAACCAT-3′ для nNOS; 5′-CACCAAGAAGGTCAAACAGGA-3′ и 5′-GCAAGAACTTTATTCAAAGTGCAA-3′ для биквитина, 5′-ACGGCAAGTTCAACGGCACAGTCAA-3′ и 5′-GCTTTCCAGAGGGGC-CATCCACA-3′ для GAPDH; 5′-TCATGAAGTGTGACGTTGACATCC-3′ и 5′-GTAAAA-CGCAGCTCAGTAACAGTC-3′ для P-actin. Для оценки относительных изменений в уровне экспрессии специфического гена в пробе мы использовали следующую формулу: ΔCt=Ct(реф)-Ct(тест), где Ct(реф) - точка пересечения базовой линии и графика амплификации референсного гена в пробе, а Ct(тест) - точка пересечения базовой линии и графика амплификации изучаемого гена в той же пробе. Далее определяли в каждой группе среднее значение ΔCt и его стандартную ошибку. Изменение уровня экспрессии анализируемого гена в экспериментальных группах оценивали относительно контрольного уровня по формуле: ΔΔCt=ΔCt(группа)-ΔCt(контроль).
Статистическая обработка данных.
Все данные приводились как М±m, где М - среднее арифметическое значение; m - стандартная ошибка среднего значения. Статистическая обработка данных производилась с помощью программы Origin Pro v.8.0 SR5. Все выборки были проверены на принадлежность к нормально распределенной совокупности. Достоверность отличий между группами определялась с помощью двуфакторного дисперсионного анализа (ANOVA) с последующим вычислением значения критерия Ныомена-Кейлса для множественных сравнений. Достоверность различий между группами также определялась по непарному t-критерию Стьюдента при вероятности нулевой гипотезы р<0.05.
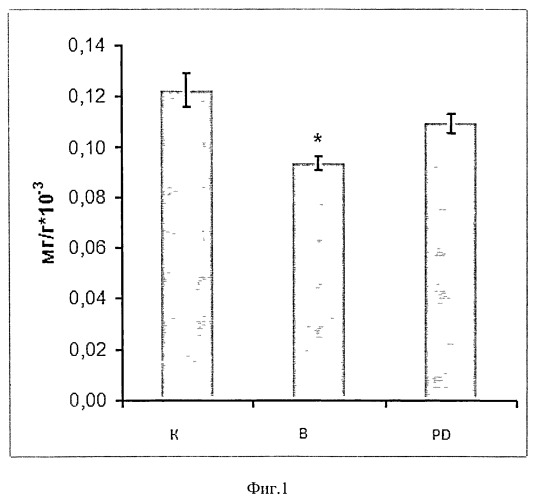
Мы обнаружили, что после введения вывешенной группе крыс ингибитора кальпаинов (гр. PD) у нее не наблюдалось снижения веса m.soleus, как и индекса сухого веса мышцы к весу крысы (г) после 3-х дней эксперимента (в отличие от группы, вывешенной без препарата), Фиг.1. Вес m.soleus составлял 106±8 и 114±7 в группах К и PD против 86±5 (р<0,05) в группе В соответственно. что свидетельствует об адекватном действии препарата на мышцу.
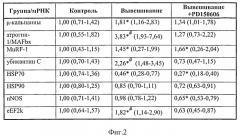
В группе PD, вывешенной с введением препарата, мы не отметили повышения уровня экспрессии мРНК µ-кальпаина (в отличие от группы, вывешенной без введения ингибитора), Фиг.2.
Мы тестировали работу звеньев системы протеасомной деградации (ЕЗ лигаз atrogin-1/MAFbx и MuRF-1) и обнаружили отсутствие увеличения уровня экспрессии мРНК Е3-лигазы атрогена-1 (MAFbx) в группе с введением блокатора кальпаина (в отличие от solcus крыс, вывешенных без препарата Фиг.2). В то же время уровень экспрессии мРНК Е3-лигазы MURF-1 в группе PD повысился так же, как и в группе вывешивания без введения препарата (Фиг.2).
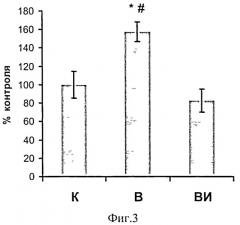
Содержание убиквитинированных белков (как и экспрессия мРНК убиквитина) в soleus крыс, которым вводили ингибитор кальпаинов, не отличалось от группы контроля (в отличие от группы вывешивания, где оно было существенно повышено (р<0,05), (Фнг.2, 3).
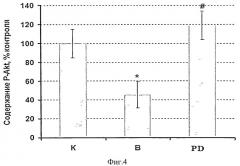
Для того чтобы оценить состояние белкового метаболизма мышцы мы тестировали не только экспрессию кальпаина, систему ее протеасомной деградации (Е3 лигазы - atrogin-1 и MuRF-1) и уровень конъюгировашюго убиквитина, но и протеинового синтеза (маркеры сигнальных путей Akt-mTOR-S6K - pAkt и pFOXO3), а также уровень экспрессии элонгационного фактора eEF2k, и P-p90S6k связанные с работой сигнального пути MAPK/Erk. Мы обнаружили снижение содержания фосфорилированных белков pAkt и pFOXO3 в m.soleus крыс, вывешенных без введения препарата (р<0,05), в то время как в группе PD снижение уровня этих белков было полностью предотвращено (Фиг.4, 5).
Мы обнаружили, что содержание рибосомальной P-p90S6k после 3-х дней вывешивания снижено в m.soleus обеих групп (Фиг.6). Следовательно, эта рибосомальная киназа, работающая ассоциировано с MAPK/Erk сигнальным путем, вряд ли напрямую регулируется кальпаинами. Уровень экспрессии мРНК элонгационного фактора eEF2k (ингибирующего функцию белкового синтеза) был заметно понижен в мышце животных, которым при вывешивании вводили препарат (Фиг.2). В то же время как у вывешенных без препарата животных он существенно превышал уровень контрольной группы (Фиг.2). В наших предыдущих исследованиях, выполненных в рамках программы РФФИ, мы показали, что работа таких регуляторных белков, как nNOS и белков теплового шока Hsp90 и 70, которые выполняют защитную функцию для цитоскелетных белков, может регулироваться кальпаинами. Поэтому мы определили их экспрессию при ингибировании кальпаинов во время функциональной разгрузки мышц. Мы обнаружили снижение уровня мРНК Hsp70 в группе вывешивания (гр.В, р<0,05, Фиг.2), там, где концентрация кальпаинов была также существенно повышена (Фиг.2). В то же время в мышце, в которую вводился ингибитор кальпаинов, мы обнаружили существенное снижение как экспрессии Hsp70, так и nNOS (Фнг.2), что может быть связано с отсутствием необходимости в увеличении защитной реакции клетки от разрушения белка.
Такая же тенденция прослеживается при определении экспрессии мРНК Hsp90 (Фнг.2).
Для исследования роли кальпаинов в запуске убиквитин-протеасомиой системы и регулировании анаболических сигнальных путей мы блокировали работу кальпаинов в мышце при вывешивании крыс. Тестировали систему протеасомной деградации (ЕЗ лигазы) и регуляторный белок pFOXO3, а также маркеры системы протеинового синтеза (Akt-mTOR-S6K и MAPK/Erk сигнальных путей). Если наша гипотеза верна, то блокирование кальпаинов может предотвратить или снизить содержание убиквитинированных белков, экспрессию Е3-лигаз, а также может предотвратить снижение анаболических процессов в мышце, затормозив тем самым развитие в ней атрофических процессов. При введении ингибитора кальпаинов мы обнаружили у этих крыс как отсутствие снижения веса m.soleus, так и отсутствие снижения индекса сухого веса мышцы по сравнению с группой контроля (в отличие от мышц крыс, вывешенных без ингибитора), (Фиг.1). Это свидетельствует о предотвращении развития атрофических процессов. Экспрессия µ-кальпаина в m.soleus этой группы также не отличалась от контроля (Фиг.2), в то время как в группе вывешивания (В) она была существенно повышена. Можно заключить, что блокирование работы кальпаинов достигло своей цели и привело к изменению его экспрессии при вывешивании животных. Наша гипотеза о взаимосвязи работы кальпаиновой и убиквитин-протеасомной систем распада белка оправдалась, т.к. как количество убиквитинированных белков, так и экспрессия их мРНК в группе PD не отличалась от уровня контроля, в то время как в группе «вывешивание» они были существенно повышены (Фиг.2,3). Одновременно в группе В было повышено и содержание Е3-лигаз atrogin-1 /muscle atrophy F-box (MAFbx), и мышечно-специфичного RING finger 1 (MuRFl) (Фиг.2). Ранее показано, что такие Е3-лигазы, как атрогин-1 и MuRFl, которые задействованы в процессах протеасомной деградации белков, начинают особенно интенсивно активироваться при функциональной разгрузке мышц (Jackman, R.W., and Kandarian, S.C., 2004, Dupont-Versteegden, E.E. et all, 2006). Именно поэтому они были выбраны маркерами протеасомной деградации в нашей работе. Однако мы видим, что в группе PD предотвращено увеличение экспрессии мРНК в m.soleus только атрогена-1 (Фиг.2), тогда как экспрессия MuRFl в этой группе повышена так же, как и в группе, вывешенной без введения ингибитора кальпаина (Фиг.2). Экспрессия atrogin-1 /MAFbx может регулироваться транскрипционным фактором forkhead box О (Foxo), который в норме фосфорилируется и (таким образом) инактивируется Akt. Если фосфорилирования не происходит - Foxo транслоцируется в ядро и индуцирует транскрипцию обоих Е3 лигаз - atrogin-1 и MuRFl (Sandri et al., 2004; Stitt et al., 2004). В нашем эксперименте уровень как pFOXO3 и pAkt были существенно снижены в группе вывешивания без препарата (В), фиг.4, 5, в то время как группы контроля и PD существенно не различались между собой по этим показателям. Можно предположить, что FOXO3 фосфорилировался Akt и не поступал в ядро для индуцирования транскрипции атрогена-1. В то же время экспрессия MuRFl регулируется не только FOXO3, но и nF-kapaB. И его повышенный в группе PD уровень мог обеспечиваться этим фактором. Изменения в экспрессии Е3-лигазы атрогена-1 и содержании фосфорилированных белков pAkt и рРОХО3 свидетельствует о взаимосвязи между работой кальпаиновой и убиквитин-протеасомной систем, а также о взаимной регуляции работы кальпаинового и Akt-mTOR-S6K сигнальных путей. Akt-mTOR-S6K хорошо известен как главный путь регуляции синтеза белка на уровне инициации трансляции [Bodine SC и др., 2001]. Содержание рибосомальной P-p90S6k (маркера MAPK/Erk анаболического сигнального пути) было достоверно снижено в обеих вывешенных группах (Фиг.6), по сравнению с группой контроля, что свидетельствует об отсутствии согласования в работе анаболического MAPK/Erk сигнального пути и кальпаиновой протеолитической системы. В то же время экспрессия мРНК элонгационного фактора eEF2k имела явную тенденцию к снижению в мышце вывешенных животных с введением ингибитора кальпаинов по сравнению с группой контрольных животных, тогда как у вывешенных крыс (В) его содержание было достоверно повышено (р<0,05, Фиг.2); eEF2k занимается фосфорилированием фактора eEf2, что приводит к ингибированию процессов элонгации и тормозит процессы синтеза белка. То, что повышения мРНК eEF2k в группе PD (по сравнению с контрольными животными) не обнаружено, свидетельствует о том, что в условиях блокирования активности кальпаинов мышц при функциональной разгрузке снимаются препятствия для синтеза белка.
Мы определяли также содержание мРНК белков теплового шока 90/70 и nNOS в нашем эксперименте. Недавно на культуре клеток С2С12 показано, что nNOS и Hsp90 являются субстратами кальпаинов и резкое снижение уровня этих белков при разгрузке мышц может быть связано с активированием кальпаинов. Ранее мы показали, что кальпаины могут регулировать in vivo содержание белков теплового шока 90/70 в мышце и активность nNOS при ее функциональной разгрузке (Ломоносова и др., 2011, 2012; Lomonosova et all, 2012). Мы также обнаружили, что nNOS имеет отношение к поддержанию белкового метаболизма мышц. Белки теплового шока синтезируются в скелетной мышце в большом количестве, их уровень быстро увеличивается при различных стрессах, что обеспечивает защиту клеток (Soti С. et all,2005). Однако при функциональной разгрузке мышц уровень Hsp90/70 падает на 70-75% (параллельно атрофии мышцы) (Takashi Sakurai и др., 2005, Lomonosova et all, 2012). После 3-х дней вывешивания содержание Hsp70 (в группе В) в нашем эксперименте было также снижено (Фиг.2). Однако для нас было неожиданным то, что уровень экспрессии мРНК Hsp70 и nNOS в группе с введением ингибитора кальпаинов был существенно ниже, чем у контрольных животных (Фиг.2), а уровень Hsp90 имел тенденцию к снижению. Мы полагаем, что такое снижение может быть связано с отсутствием необходимости в увеличении защитной реакции клетки от разрушения белка при блокировании кальпаинов. Итак, мы показали, что имеется взаимодействие между работой кальпаиновой и убиквитин-протеасомной системами при разгрузке мышц, увеличение концентрации кальпаинов при разгрузке мышц ведет к повышению убиквитинирования белков, увеличению экспрессии Е3-лигазы атрогина-1. Мы обнаружили, что кальпаин связан с регуляцией белкового синтеза, контролируемым не только анаболическим Akt-mTOR-S6K сигнальным путем, но и другими факторами, регулирующими белковый синтез на уровне элонгации. Концентрация кальпаина имеет также отношение к регуляции экспрессии nNOS и Hsp70 в мышце. Блокирование кальпаинов при функциональной разгрузке мышцы ведет к снижению защитной реакции клетки от разрушения белка, что выражается в уменьшении экспрессии мРНК белков теплового шока и nNOS.
Вывод: Введение блокатора кальпаинов PD150606 при функциональной разгрузке мышц предотвращает развитие их атрофии.
Краткое описание чертежей
Фиг.1. Индекс сухого веса мышцы к весу крысы (в граммах). Отношение сухого веса m.soleus к массе тела животного у вывешенных (В) и вывешенных с введением PD150606 (PD) крыс оценивали относительно контрольного (К) уровня. Результаты приведены в виде М±m (n=7 для каждой группы). * - достоверные отличия от К, р<0,05.
Фнг.2. Уровень мРНК µ-кальпаинов в m.soleus у вывешенных (В) и вывешенных с введением PD150606 (PD) крыс оценивали относительно контрольного (К) уровня. Результаты приведены в виде медианы и интерквартильной широты (0,25-0,75). * -достоверные отличия от К, р<0,05, # - достоверные отличия от PD, р<0,05.
Фиг.3. Содержание убиквитированных белков у вывешенных (В) и вывешенных с введением PD150606 (PD) крыс оценивали относительно контрольного (К) уровня. Результаты приведены в виде М±m (n=7 для каждой группы). * - достоверные отличия от К, р<0,05, # - достоверные отличия от PD, р<0,05.
Фиг.4. Содержание фосфорилированного белка pAkt у вывешенных (В) и вывешенных с введением PD150606 (PD) крыс оценивали относительно контрольного (К) уровня. Результаты приведены в виде М±m (n=7 для каждой группы). * - достоверные отличия от К, р<0,05, # - достоверные отличия от PD, р<0,05.
Фиг.5. Содержание фосфорплированного белка pFOXO3 у вывешенных (В) и вывешенных с введением PD150606 (PD) крыс оценивали относительно контрольного (К) уровня. Результаты приведены в виде М±m (n=7 для каждой группы). * - достоверные отличия от К, р<0,05.
Фнг.6. Содержание фосфорилированного белка рибосомальной киназы P-p90S6k у вывешенных (В) и вывешенных с введением PD150606 (PD) крыс оценивали относительно контрольного (К) уровня. Результаты приведены в виде М±m (n=7 для каждой группы). * - достоверные отличия от К, р<0,05.
Литература
1. Salazar JJ, Michele DE, Brooks SV. Inhibition of calpain prevents muscle weakness and disruption of sarcomere structure during hindlimb suspension. J. Appl Physiol. 2010. Jan; 108(1):120-7.
2. Tidball JG, Spencer MJ.. Expression of a calpastatin transgene slows muscle wasting and obviates changes in myosin isoform expression during murine muscle disuse. J Physiol 545: 819-828, 2002.
3. Otani K, Han DH, Ford EL, Garcia-Roves PM, Ye H, Horikawa Y, Bell GI, Holloszy JO, Polonsky KS. Calpain system regulates muscle mass and glucose transporter GLUT4 turnover. J Biol Chem. 2004 May 14; 279(20):20915-20.
4. Park S, Nozaki K, Guyton MK, Smith JA, Ray SK, Banik NL. Calpain inhibition attenuated morphological and molecular changes in skeletal muscle of experimental allergic encephalomyelitis rats. J. Neurosci Res. 2012 Nov; 90(11):2134-45
5. Zhang ВТ, Yeung SS, Allen DG, Qin L, Yeung EW. Role of the calcium-calpain pathway in cytoskeletal damage after eccentric contractions. J. Appl Physiol. 2008 Jul; 105(1):352-7
6. Das A, Guyton MK, Smith A, Wallace G 4th, McDowell ML, Matzelle DD, Ray SK, Banik NL. Calpain inhibitor attenuated optic nerve damage in acute optic neuritis in rats. J Neurochem. 2013 Jan; 124(1):133-46.
7. Zhang CM, Gao L, Zheng YJ, Yang HT. Berbamine protects the heart from ischemia/rcperfusion injury by maintaining cytosolic Ca(2+) homeostasis and preventing calpain activation. Circ J. 2012; 76(8): 1993-2002.
8. Ma XW, Li Q, Xu PT, Zhang L, Li H, Yu ZB. Tetanic contractions impair sarcomeric Z-disk of atrophic soleus muscle via calpain pathway. Mol Cell Biochem. 2011 Aug; 354(1-2):171-80.
Способ предотвращения атрофии скелетных мышц при их функциональной разгрузке путем действия на организм блокатора кальпаинов 1-го типа, отличающийся тем, что в качестве фактора, снижающего экспрессию кальпаинов 1-го типа, используют введение в мышцу препарата PD150606 (синоним (2Z)-3-(4-iodophenyl)-2-mercapto-2-Propenoic acid, 3-(4-iodophenyl)-2-mercapto-(Z)-2-propenoic acid, эмпирическая формула C9H7IO2S), блокирующего в мышцах кальпаины 1 типа и, в частности, снижающего в мышцах экспрессию мРНК µ-кальпаина.