Фосфолипидный флуоресцентный зонд и тест-система для определения активности фосфолипазы а2 в сыворотке крови
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к фосфолипидному флуоресцентному зонду, и может быть использовано в медицине. Указанный фосфолипидный флуоресцентный зонд, характеризующийся следующим названием 1-[13-(4,4-дифтор-1,3,5,7-тетраметил-4-бора-3а,4а-диаза-s-индацен-8-ил)тридеканоил]-2-(10-{[(2-гидроксинафтил-1)азофенил-4]азофенил-4}деканоил)-sn-глицеро-3-фосфохолин, используют в составе тест-системы для определения активности фосфолипазы А2 группы IIA (секФЛА2(IIA)) в сыворотке крови, которая также содержит везикулярную фосфолипидную матрицу для включения зонда, состоящую из фосфатидилхолина, лизофосфатидилхолина и фосфатидилглицерина, буферный раствор и фосфолипазу А2 пчелиного яда в качестве стандарта. Изобретение позволяет достоверно определять активность секФЛА2(IIA)в сыворотке крови человека в клинических условиях. 2 н.п. ф-лы, 5 ил., 5 пр.
Реферат
Настоящее изобретение относится к фосфолипидным флуоресцентным зондам, которые могут быть использованы в качестве субстратов для фосфолипаз А1 и А2, а также к тест-системе для определения активности различных представителей фосфолипазы А2(группы IB, IIА, IIC, IID, IIЕ, IIF, III, V, X, ХIIА), в том числе в сыворотке крови человека.
Основной фосфолипазой А2, присутствующей в крови при воспалении, является фосфолипаза А2 группы IIА (секФЛА2(IIА)). Поэтому определение активности секФЛА2(IIА) в крови является весьма актуальным, поскольку в последние годы установлено резкое возрастание активности данного фермента при различных заболеваниях, в том числе сердечно-сосудистых [J Am Coll Cardiol. 2005;46(7):1249-57]. Многочисленные исследования показали, что контроль активности секФЛА2(IIА) позволяет более точно диагностировать различные осложнения атеросклероза, такие как инфаркт, инсульт и т.д. Повышение активности этого фермента в крови пациентов в течение 2-х дней после острого инфаркта миокарда является свидетельством развития повторного инфаркта миокарда. Стабильное повышение активности секФЛА2(IIА) в крови пациентов после коронарной ангиопластики (операция по расширению просвета артерии) является показателем рестеноза (повторного сужения просвета сосуда), который развивается в течение 3-6 месяцев после операции [Mol Cell Biochem. 2005; 270:107-113]. Таким образом, данные об активности секФЛА2(IIА) в крови человека могут дать представления о том, как будут развиваться события после вмешательства кардиохирургов. Так как в настоящее время начинают применять лекарства на основе ингибиторов активности секФЛА2(IIА), измерение активности этого фермента в крови важно и для контроля за применением лекарственных препаратов.
В настоящее время тест-системы для определения активности секФЛА2(IIА) в клинической практике не существует. Присутствующий на рынке набор для определения активности секФЛА2(IIА), производимый фирмой Cayman chemical, не предназначен для клинических исследований, так как не позволяет проводить исследования в образцах крови человека. Этот набор реактивов позволяет определять активность секФЛА2(IIА) колориметрическим методом в образцах, очищенных от различных примесей, в том числе от тиолов, в большом количестве присутствующих в плазме крови человек, поскольку данные примеси влияют на интерференцию при измерении абсорбции.
Сотрудниками Института экспериментальной кардиологии РКНПК Минздравсоцразвития РФ разработан метод определения активности секФЛА2(IIА) в крови человека на основе радиоактивного субстрата [Mol Cell Biochem. 2005; 270:107-113]. Однако применение радиоактивности затрудняет его клиническое использование.
Применение флуоресцентно-меченых фосфатидилхолинов - субстратов секФЛА2(IIА) человека - представляется наиболее рациональным при создании диагностикума для определения активности этого фермента в сыворотке крови человека. Одним из подходов является дизайн синтетических аналогов фосфатидилхолина с модифицированными жирнокислотными цепями, одна из которых несет флуоресцентную группу, а другая - группировку-тушитель флуоресценции. Ввиду близости обеих группировок испускание флуорофора затушено (эффект проявляется на расстояниях менее 5-7 нм). Под действием фосфолипазы А2 одна из жирнокислотных групп отщепляется и, вследствие расхождения флуорофора и тушителя, интенсивность флуоресценции возрастает пропорционально фосфолипазной активности, которую можно получить, считывая испускание образца на флуориметре (или, что проще и дешевле, на флуоресцентном ридере). Такой подход уже применялся для определения активности ряда ферментов из различных природных источников (см., например, Anal. Biochem. 1994, 219,1-8; Anal. Biochem. 1999, v. 276, 27-35; Science. 2001, 292 (5520), 1385-1388). Так, аналог фосфатидилхолина, меченный BODIPY-алкильным (BODIPY=4,4-дифтор-4-бора-3а,4а-диаза-в-индацен) остатком с простой эфирной связью в sn-1 положении и несущий N-(2,4-динитрофенил)-8-аминооктаноильный остаток в sn-2 положении, оказался хорошим субстратом для сывороточной ацетилгидролазы фактора активации тромбоцитов (чувствительность 6 мкмоль мин(-1) мг(-1)) [Anal. Biochem. 1999, 276, 27-35]. В той же работе показано, что аналоги фосфатидилэтаноламина, несущие в sn-2 положении BODIPY-пентаноильную группу, а по аминогруппе полярной головки - 2,4-динитрофенильную группу-тушитель, являются хорошими субстратами для цитозольной фосфолипазы А2 (8 и 15 мкмоль мин(-1) мг(-1)). Минимальные количества детектируемых ферментов были 0.1 нг и 50 нг, соответственно. Один из указанных субстратов был успешно применен для визуализации активности фосфолипазы А2 в живых эмбрионах полосатого данио (известного больше как zebrafish) [Science. 2001, 292 (5520), 1385-1388]. Флуорофоры группы BODIPY имеют отличные спектральные характеристики - узкие длинноволновые максимумы поглощения и испускания, высокая чувствительность и устойчивость, независимость параметров флуоресценции от полярности окружения и пр. и получили к настоящему времени широкое применение. Сейчас BODIPY - большое семейство флуорофоров, различающихся заместителями в положениях 1,3,5,7 и 8 (заместители в положениях 2 и 6, как и отсутствие заместителей, снижают квантовый выход флуоресценции).
Аналогом зонда, представленного в настоящем изобретении, является флуоресцентно-меченый фосфатидилхолин производства фирмы Invitrogen (США) Red/Green BODIPY®PC-A2(KaT.№A10072)-1-O-(6-BODIPY®558/568-аминогексил)-2-BODIPY®FL С5-sn-глицеро-3-фосфохолин. В составе тест-системы EnzChek® Phospholipase А2 Assay Kit (Кат. №№El0217, El0218) указанный зонд позволяет детектировать активность фосфолипазы А2 пчелиного яда на уровне 0.05 Ед/мл (0.05 мкмоль субстрата х мин(-1) х мл(-1)). Данный набор предназначен для работы с клетками и клеточными лизатами. Недостатком зонда фирмы Invitrogen является то, что между флуорофором и местом расщепления молекулы зонда ферментом располагаются всего четыре метиленовых звена. Такое небольшое расстояние затрудняет образование фермент-субстратного комплекса, что понижает чувствительность детектирования фермента. Недостатком зонда фирмы Invitrogen является также то, что его BODIPY-группы способны образовывать нефлуоресцирующие димеры, а также эксимеры, испускающие по сравнению с мономерами в более длинноволновой области. И в том и в другом случае флуоресценция BODIPY оказывается затушенной.
Другими аналогами зонда, представленного в настоящем изобретении, являются пиренсодержащие фосфолипиды. Их предложено использовать для непрерывного мониторинга активности липаз и фосфолипаз, в том числе в сыворотке [Patent US4668623 (А) - 1987-05-26US]. В ранних работах Clin. Chem. 1985, 31, 714-717] использовали подходы, основанные на возрастании флуоресценции мономера пиренильного флуорофора, высвобождающегося в результате гидролиза исходных фосфолипидов, флуоресценция которых обусловлена, в основном, эксимерами пирена. Эксимеризация связана со склонностью к ассоциации пространственно сближенных остатков пирена. Однако затем было показано, что изменение соотношения интенсивности флуоресценции эксимер/мономер обусловлено посторонними физико-химическими факторами, а не действием фермента. В связи с этим, те же авторы [Anal. Biochem. 1988, 170, 248-255] разработали субстрат, несущий пиренил и группировку-тушитель - 1-пальмитоил-2-[6- (пирен-1-ил)гексаноил]-sn-глицеро-3-фосфо-N-тринитрофенил)аминоэтанол; под действием панкреатической секФЛА2(IIА) зонд расщепляется с высвобождением в водную фазу пиренилгексановой кислоты, что сопровождается разгоранием флуоресценции мономера пиренила. Однако в литературе отсутствуют сведения о применении данного зонда для измерений активности секФЛА2(IIА) в сыворотке, что может быть связано, например, с низким сродством данного субстрата к ферменту или с присутствием альбумина и других компонентов сыворотки.
Для измерения активности фосфолипазы А2 в присутствии альбумина была разработана тест-система с использованием фосфолипидов, несущих в sn-2-положении 10-пиренилдеканоильный остаток, в том числе - 1-пальмитоил-2-[10-(пирен-1-ил)деканоил]-sn-глицеро-3-монометилфосфатидовой кислоты (PFA) [Anal. Biochem. 1989, 177, 103-109]. В водной среде такие фосфолипиды образуют везикулы с минимальной флуоресценцией мономера (за счет эксимеризации пиренила). Высвобождающаяся в результате ферментативного расщепления 10-пиренилдекановая кислота «растворяется» в реакционной среде только в присутствии альбумина, который связывает жирные кислоты с высоким сродством. При этом наблюдается усиление флуоресценции пиренильного мономера. Тест-система с PFA позволяет измерять пикомолярные количества фосфолипидов, гидролизуемых в минуту под действием фермента из поджелудочной железы или из ядов, и может быть использована для оценки активности секФЛА2(IIА) в необработанных экстрактах с низкой удельной активностью. Фактически это единственный метод определения секФЛА2(IIА) в сыворотке крови, который применяется сегодня (например, J Am Coll Cardiol. 2005, 46, 1249 -1257). Чувствительность детектирования по фосфолипазе А2 из пчелиного яда - 0.0001 Ед/мл.
Недостатком описанной выше тест-системы для измерения активности секФЛА2(IIА) в присутствии альбумина [Anal. Biochem. 1989, 177, 103-109] является то, что ключевой зонд PFA не отличается стабильностью. Возможно, это одна из причин, по которой данная тест-система не получила широкого применения: судя по публикациям, она используется одним и тем же коллективом авторов [JAm Coll Cardiol. 2005, 46, 1249 -. Thromb. Vase. Biol. 2007, 27, 1177-1183].
Недостатком тест-системы для измерения активности секФЛА2(ИА) в присутствии альбумина [Anal. Biochem. 1989, 177, 103-109] является следующее: содержание альбумина в сыворотках различных пациентов значительно варьирует, что может приводить к артефактам при использовании метода, основанного на связывании с этим белком. Возможно, именно по этой причине данная тест-система не получила широкого применения.
Недостатком тест-системы фирмы Invitrogen является то, что она не предназначена для измерений активности секФЛА2(IIA) в сыворотке крови.
Таким образом, ни один из описанных флуоресцентных зондов и тест-системы с их использованием не обеспечивают возможности достоверно определять активность секФЛА2(IIA) в сыворотке крови человека в клинической практике.
Задачей настоящего изобретения было синтезирование устойчивого фосфолипидного флуоресцентного зонда для использования в тест-системе, позволяющей определять активность секФЛА2(IIA) в сыворотке крови человека в клинических условиях.
Другой задачей изобретения была разработка тест-системы, позволяющей определять активность секФЛА2(IIA) в сыворотке крови человека в клинических условиях.
Для решения поставленных задач, во-первых, синтезирован фосфолипидный флуоресцентный зонд следующего названия: 1-[13-(4,4-дифтор-1,3,5,7-тетраметил-4-бора-3а,4а-диаза-s-индацен-8-ил)тридеканоил]-2-(10-{[(2-гидроксинафтил-1)азофенил-4]азофенил-4}деканоил)-sn-глицеро-3-фосфохолин (далее BODIPY-ФХ),
во-вторых, предложена тест-система для определения активности секФЛА2(IIA) в сыворотке крови человека, включающая вышеописанный зонд, везикулярную матрицу, состоящую из фосфатидилхолина, лизофосфатидилхолина и фосфатидилглицерина, буферный раствор и фосфолипазу A2 пчелиного яда в качестве стандарта.
Предложенный зонд BODIPY-ФХ обладает хорошей стабильностью. Предлагаемый в настоящем изобретении зонд имеет большое расстояние между хромофором-тушителем (а также флуорофором) и местом расщепления молекулы зонда ферментом, что обеспечивает повышенное сродство секФЛА2(IIA) к зонду и оптимальную работу фермента: это расстояние более чем в два раза превышает таковое у зонда фирмы Invitrogen (девять метиленовых звеньев против четырех). Среди известных производных BODIPY для 1,3,5,7-тетраметил BODIPY (Me4-BODIPY-8) образование эксимеров достоверно показано не было [J. Lipid Res. 2007, 48, 1518-1532]. Поэтому с флуорофором Me4-BODIPY-8 позволяет получить еще более высокую, чем аналог фирмы Invitrogen, чувствительность детектирования фосфолипазы А2 пчелиного яда - 0.01 Ед/мл и менее.
Предлагаемая в настоящем изобретении тест-система базируется на разгорании флуоресценции продукта ферментативной реакции, продолжающего быть связанным с везикулярной матрицей. Поэтому влияние флуктуации содержания альбумина (и других, менее массовых компонентов сыворотки) на процесс разгорания флуоресценции становится минимальным.
Ниже приведена принципиальная схема синтеза зонда BODIPY-ФХ:
Синтез зонда включает Схемы 1-3:
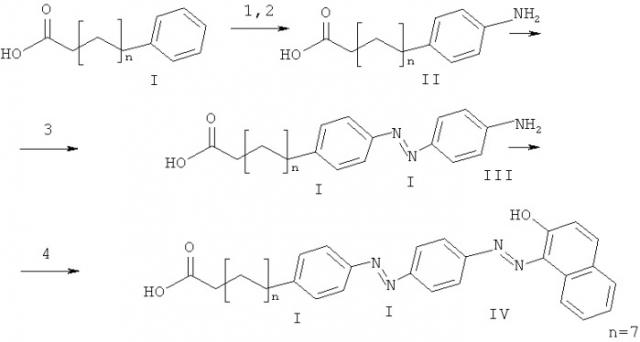
Схема 1. Получение несущей остаток тушителя ω-(судан-III)-декановой кислоты (IV). 1. HNO3/H2SO4, петролейный эфир; 2. H2/Pd-C, метанол; 3. NaNO2, анилин ацетонитрил/вода; 4. NaNO2, 2-нафтол ацетонитрил/вода.
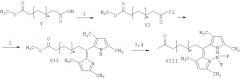
Схема 2. Получение флуоресцентной BODIPY-меченой кислоты (VIII) (m=9). 1. SOCl2 в сухом хлороформе, ДМФА; 2. 2,4-диметилпиррол, хлороформ; 3. триэтиламин, эфират BF3.
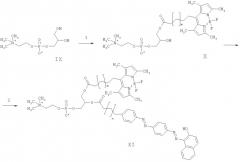
Схема 3. Получение флуоресцентного зонда (XI) (n=7, m=9). 1. Дибутилоксид олова, хлорангидрид кислоты VIII, изопропанол 2. диметиламинопиридин, диизопропилкарбодиимид, сухой хлороформ.
Тест-система с использованием вышеописанного зонда включает везикулярную фосфолипидную матрицу, буферный раствор и фосфолипаза А2 пчелиного яда в качестве стандарта.
Предлагаемое изобретение иллюстрируется следующими Фиг.1 - Фиг.5.
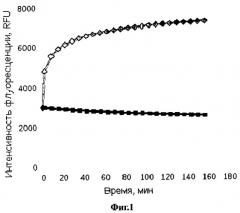
На Фиг.1 представлены контрольные показатели флуоресценции субстрата без добавления сыворотки (синие квадраты): к 170 мкл суспензии субстрата добавлено 30 мкл буфера (8 лунок); интенсивность фоновой флуоресценции субстрата с добавлением сыворотки (красные ромбы): к 170 мкл суспензии субстрата добавлено 10 мкл буфера и 20 мкл сыворотки крови непосредственно перед измерением. Представлены средние значения (n=8) для одного репрезентативного эксперимента.
На Фиг.2 приведены результаты изучения кинетики ферментативной реакции в зависимости от активности добавленной к сыворотке фосфолипазы А2 пчелиного яда. Средние значения (n=3) изменения интенсивности флуоресценции зонда во время ферментативной реакции в сыворотке крови (10%) в зависимости от активности добавленной фосфолипазы А2 пчелиного яда. Светло-зеленые восьмерки соответствуют активности фермента - 0,8 ед/мл, черные бантики соответствуют активности - 0,6 ед/мл, голубые треугольники соответствуют активности - 0,4 ед/мл, коричневые треугольники соответствуют активности - 0,2 ед/мл, зеленые треугольники соответствуют активности - 0,12 ед/мл, желтые треугольники соответствуют активности - 0,08 ед/мл, красные ромбы соответствуют активности - 0,04 ед/мл, синие квадраты соответствуют активности - 0,02 ед/мл. Значения фоновой флуоресценции F0, полученные из контрольного опыта в сыворотке (см. Фиг.1), были вычтены из каждого значения для соответствующего времени.
На Фиг.3 показана зависимость интенсивности флуоресценции зонда BODIPY-ФХ в 10%-ной сыворотке от активности добавленной фосфолипазы А2 пчелиного яда: через 13 мин (a, R2=0,99) и 33 мин (б, R2=0,98) после начала измерений. Приведены средние значения ± SD (n=3) репрезентативного эксперимента.
На Фиг.4 приведены средние значения (n=2) изменения интенсивности флуоресценции в системе с зондом BODIPY-ФХ в растворе альбумина (синие квадраты) (конечная концентрация 5 мг/мл; исходный раствор 50 мг/мл разведен в 10 раз остальными компонентами тест-системы) в ходе ферментативной реакции в зависимости от активности фосфолипазы А2 пчелиного яда (зеленые треугольники соответствуют активности фермента - 0,1 ед/мл, желтые треугольники соответствуют активности - 0,06 ед/мл, красные ромбы соответствуют активности - 0,02 ед/мл). По оси ординат приведены показания ридера, по оси абсцисс - время инкубации.
На Фиг.5 приведены средние значения (n=2) изменения интенсивности флуоресценции в системе с зондом BODIPY-ФХ в различных образцах 10%-ной сыворотки (красные ромбы - сыворотка 1, желтые треугольники - сыворотка 2, зеленые треугольники - сыворотка 3, коричневые треугольники - сыворотка 4), и в растворе альбумина (конечная концентрация 5 мг/мл) (синие квадраты). По оси ординат приведены показания ридера, по оси абсцисс - время инкубации.
Предлагаемое изобретение иллюстрируется следующими примерами: Пример 1. Синтез фосфолипидного флуоресцентного зонда BODIPY-ФХ:
а)ω-(судан III)-декановая кислота
К раствору четырех граммов ω-фенилдекановой кислоты (I) (получена ацилированием бензола избытком себациновой кислоты по Фриделю-Крафтсу в присутствии SiCl4 с последующим восстановлением кето-группы по Хуангу-Минлону) в петролейном эфире добавляли нитрующую смесь (азотная кислота - серная кислота, 1:1). Через час реакционную смесь выливали в стакан со льдом. После таяния льда органический слой отделяли и промывали водой. Растворитель удалили на роторном испарителе. Остаток хроматографировали на силикагеле 60 (Merck) в хлороформе. Получали 4.2 г воскоподобной желтой массы - смеси ω-орто- и ω-паранитрофенилдекановых кислот (ТСХ-контроль), которые использовали дальше без дополнительной очистки.
Смесь ω-орто- и ω-паранитрофенилдекановых кислот растворяли в метаноле и добавляли катализатор (5% палладий на угле). Через полученную суспензию пропускали ток водорода. Уголь отфильтровывали. Остаток упаривали и хроматографировали на силикагеле 60 (Merck) в градиенте метанола (1 → 5%) в хлороформе. Выделяли 1.6 г желтых кристаллов ω-(4-амино)фенилдекановой кислоты (II).
85 мг ω-(4-амино)-фенилдекановой кислоты (II) и 166 мг пара-толуолсульфокислоты суспендировали в 5 мл ацетонитрила и охлаждали в ледяной бане до 0°С. Водный раствор нитрита натрия (24 мг) добавляли к суспензии амина при интенсивном перемешивании и охлаждении. Затем добавляли 90 мкл анилина и перемешивали. Смесь выдерживали в бане, при комнатной температуре разбавляли эфиром (20 мл), промывали 0.1 N НСl и водой. Органический слой сушили над сульфатом натрия, растворитель удалили на роторном испарителе. Остаток сушили под вакуумом, хроматографировали на силикагеле 60 (Merck) в хлороформе. Получали 66 мг (55%) желтых кристаллов ω-(4-(4- аминофенил)-азо-фенил))декановой кислоты (III) 1Н-ЯМР (СНСl3) δ, м. д.: 7.80 (дд, J = 21.1, 8.4 Hz, 4Н), 7.30 (д, J = 8.1 Hz, 2Н), 6.76 (д, J = 8.6 Hz, 2Н), 2.40 - 2.32 (м, 2Н), 1.66 (м, J = 7.4 Hz, 4Н), 1.41 - 1.23 (м, 12Н).
66 мг ω-(4-(4-амино-фенил)-азо-фенил))декановой кислоты (III) и 92 мг пара-толуолсульфокислоты суспендировали в 5 мл ацетонитрила и охлаждали в ледяной бане до 0°С. При перемешивании добавляли водный раствор нитрита натрия (13 мг), затем 78 мг 2-нафтола. Смесь оставляли в бане, затем при комнатной температуре разбавляли 20 мл бензола и промывали 0.1 N НСl и водой. Органический слой сушили над сульфатом натрия, растворитель удаляли на роторном испарителе. Остаток очищали хроматографией в хлороформе на силикагеле 60 (Merck). Получали 40 мг ω-(судан-III)-декановой кислоты (IV). 1Н-ЯМР (CD3OD) δ, м. д.: 8.53 (дд, J = 11.2, 8.0 Hz, 1Н), 8.03 (дд, J = 25.5, 8.7 Hz, 2H), 7.85 (дд, J = 8.3, 4.1 Hz, 2H), 7.83 (дд, J = 25.9, 8.2 Hz, 2H), 7.78 (м, III), 7.61 (м, 1Н), 7.41 (m, 1H), 7.34 (дд, J = 8.0, 5.3 Hz, 2H), 6.78 (дд, J = 12.6, 9.5 Hz, 1H), 2.40 - 2.32 (м, 2H), 1.66 (м, 4H), 1.41-1.23 (м, 12H).
Жирная кислота с флуоресцентной меткой BODIPY
1.4 г монометилового эфира тетрадекановой кислоты V растворяли в 10 мл тионилхлорида и добавляли 10 мкл диметилформамида. Через 5 ч реакционную смесь упаривали на роторном испарителе. Полученный хлорангидрид (VI) растворяли в 20 мл сухого хлороформа и охлаждали до 0°С, при перемешивании прибавляли 1.1 г 2,4-диметилпиррола. К полученному раствору добавляли 2 мл триэтиламина и затем 1.5 мл эфирата трехфтористого бора. Смесь перемешивали еще 4 ч, упаривали на роторном испарителе и хроматографировали на силикагеле 60 (Merck) в градиенте петролейный эфир-хлористый метилен (0 → 20%). Выделяли 500-600 мг метил-13-(4,4-дифтор-1,3-5,7-тетраметил-4-бора-3а,4а-диаза-8-индацин-8-ил)-тридеканоата VII (метиловый эфир o-BODIPY-тридекановой кислоты) в виде красных кристаллов. 1Н-ЯМР (CDCl3) δ, м. д.: 1.25 (14Н, м), 1.48 (м, 2Н), 1.62 (м, 4Н), 2.30 (м, 2Н), 2.41 (с, 6Н), 2.51 (с, 6Н), 2.93 (т, 2Н), 3.67 (с, 3Н), 6.05 (с, 2Н, аром.) Эфир VII омыляли в системе изопропанол-0.1 N КОН, 5:2. Раствор нейтрализовали 0.1 N НСl, упаривали на роторном испарителе и экстрагировали этилацетатом. ω-BODIPY-тридекановую кислоту (VIII) 1-[13-(4,4-дифтор-13,5,7-тетраметил-4-бора-3а,4а-диаза-8-индацен-8-ил)тридеканоил]-2-(10-{[(2-гидроксинафтил-1)азофенил-4]азофенил-4}деканоил)-sn-глицеро-3-фосфохолин (1-ω-ВODIPY-тридеканоил-sn-2-ω-судан-III-деканоил-глицерофосфохолин, BODIPY-ФХ) (XI) 210 мг ω-BODIPY тридекановой кислоты (VIII) растворяли в 2 мл SOCl2 и перемешивали 5 ч при комнатной температуре. Избыток SOCl2 удаляли на роторном испарителе. ~400 мг кадмиевого аддукта глицерофосфохолина (Avanti, США) растворяли в воде и перемешивали со смолой Хелекс-100 (BioRad). Смолу отфильтровывали, раствор упаривали, остаток подвергали лиофильному высушиванию. К полученному глицерофосфохолину (IX) добавляли 250 мг растертого дибутилоксида олова и 10 мл изопропанола. Кипятили 1 ч. После охлаждения добавляли триэтиламин и хлорангидрид ω-BODIPY-тридекановой кислоты. Через несколько часов реакционную смесь разбавили водой и экстрагировали хлороформом. Экстракт упаривали на роторном испарителе и хроматографировали сначала на окиси алюминия в градиенте метанола (0 → 30%) в хлороформе, а затем на обращенной фазе (RP-18, Merck) в системе хлороформ-метанол-вода (1:8:1). Получали 60 мг аморфного оранжево-красного sn-1-ω-BODIPY тридеканоил глицерофосфохолина (X). 1H-ЯМР (CDCl3/CD3OD) δ, м. д.: 1.21 (14H, м), 1.37 (м, 2H), 1.52 (м, 4H), 2.33 (м, 2H), 2.45 (с, 6H), 2.51 (с, 6H), 2.93 (т, 2H), 3.17 (с, 9H), 3.59 (м, 2H), 4.01 (уш. м, 2H), 4.11 (м, 1H), 4.26 (уш. м 2H), 4.35 (м 1H), 5.19 (м, 1H) 6.18 (с, 2H, аром.)
10 мг sn-1-ω-BODIPY тридеканоил глицрофосфохолина (X), 15 мг ω-(судан-III)-декановой кислоты (IV) и 30 мг диметиламинопиридина растворили в 3 мл сухого хлороформа, добавили 50 мкл N,N′-диизопропилкарбодиимида. Перемешивали несколько часов. Смесь профильтровали и выпарили на роторном испарителе. Остаток хроматографировали на силикагеле 60 (Merck) в системе хлороформ-метанол 8:2, получили 12 мг амофного фосфатидилхолина (XI). 1H-ЯМР (CDCl3/CD3OD) δ, м. д.: 1.33 (26H, м), 1.41 (м, 2H), 1.60 (м, 8H), 2.34 (м, 2H), 2.40 (с, 6H), 2.40-2.32 (м, 2H), 2.52 (с, 6H), 2.97 (т, 2H), 3.21 (с, 09H), 3.59 (м, 2H), 4.02 (уш. м, 2H), 4.17 (м, 1H), 4.28 (уш. м 2H), 4.37 (м 1H), 5.19 (м, 1H) 6.15 (с, 2H, аром.), 6.78 (дд, J=12.6, 9.5 Hz, 1H), 7.34 (дд, J=8.0, 5.3 Hz, 2H), 7.41 (м, 1H), 7.59 (м, 1H), 7.76 (м, 1H), 7.83 (дд, J=25.7, 8.3 Hz, 2H), 7.87 (дд, J=8.3,4.1 Hz, 2H), 7.99 (дд, J=25.6, 8.9 Hz, 2H), 8.57 (дд, J=11.3, 8.0 Hz, 1H).
Пример 2. Матрица для получения субстрата фосфолипазы A2 на основе зонда BODIPY-ФХ
Везикулярную фосфолипидную матрицу для включения зонда BODIPY-ФХ, обеспечивающую высокую степень тушения флуоресценции субстрата, с одной стороны, и эффективную работу фосфолипазы - с другой, готовили из смеси фосфатидилхолин - лизофосфатидилхолин - фосфатидилглицерин, 45:45:10 (мольн.). Соотношение зонд - матрица равнялось 1/300 (мольн.). Для приготовления субстрата смешивали соответствующие аликвоты растворов фосфолипидов и зонда BODIPY-ФХ в органических растворителях (смеси хлороформ-метанол), удаляли растворители на роторном испарителе, высушивали при 5 Па не менее 30 мин. К полученной липидной пленке добавляли соответствующее количество буфера (например, 0.1 М Трис-HCl, pH 8.0, 5 мМ CaCl2, 0.1М NaCl). Суспензию обрабатывали на ультразвуковой бане в течение 20-30 мин.
Пример 3. Измерение активности фосфолипазы A2 из пчелиного яда в присутствии сыворотки крови человека
Измерения проведены в 96-луночном планшете на флуоресцентном ридере (Perkin Elmer Fusion Alpha-FP HT Multimode Microplate Reader), настройки ридера соответствуют настройкам для флуоресцеина (ex=485 нм, em=535 нм). Конечный объем образца в лунке 200 мкл, 24 измерения каждые 5 мин.
Общая схема: к 170 мкл субстрата (начальная концентрация зонда 1,069 мкМ) непосредственно перед измерением добавляли 20 мкл сыворотки крови и 10 мкл раствора фосфолипазы A2 пчелиного яда заданной активности. Итого: 200 мкл раствора, 10% (по объему) сыворотки, конечная концентрация зонда 0.909 мкМ (9.09×10-7 М), активность фосфолипазы A2 пчелиного яда от 0.02 до 0.8 ед/мл (всего 8 различных активностей ФЛА2, в трех повторах).
При взаимодействии субстрата с сывороткой крови без добавления фермента наблюдалось увеличение флуоресценции, возможно, из-за реорганизации липидной матрицы и изменений в упаковке молекулы флуоресцентного зонда, либо из-за наличия собственной фосфолипазы A2 (Фиг.1). Для построении калибровочного графика при определении активности ФЛА2 пчелиного яда в присутствии сыворотки учитывали эти изменения. Проводили контрольные измерения фоновой флуоресценции образца и затем вычитали их для каждого времени из полученных значений для добавленной активности фермента. Средние значения (n=3) изменения интенсивности флуоресценции зонда во время ферментативной реакции в сыворотке крови (10%) в зависимости активности добавленной к сыворотке фосфолипазы A2 пчелиного яда приведены на Фиг.2. Значения фоновой флуоресценции F0, полученные из контрольного опыта в сыворотке (Фиг.1), были вычтены из каждого значения для соответствующего времени.
Примечание. Кривые изменения сигнала (Фиг.2) не выходят из нуля, т.к. начало измерения не совпадало с моментом смешения реагентов. На процесс добавления к субстрату плазмы и раствора фермента уходило ~ 1-2 мин после чего планшет помещали в ридер и начинали измерения, в то же время именно в начале ферментативная реакция шла с наибольшей скоростью.
Построение калибровочных графиков для двух временных точек (13 и 33 мин, Фиг.3) подтверждало линейную зависимость интенсивности флуоресценции (после вычитания фона) от активности фермента (f(x) = 5517.99х+441.34 - для 13 минут и (f(x) = 6926.44х+950.16 - для 33 минут).
Пример 4
Применение фосфолипазы А2 пчелиного яда в качестве стандарта.
Общая схема: к 180 мкл субстрата непосредственно перед измерением добавляли 20 мкл сыворотки крови, в несколько лунок вместо сыворотки добавляли по 20 мкл раствора фосфолипазы А2 пчелиного яда заданных концентраций в стандартном растворе альбумина (50 мг/мл - концентрация, моделирующая усредненную сывороточную).
Для оценки активности секФЛА2(IIА) в образцах сыворотки сопоставляли наклоны полученных кривых возрастания флуоресценции с таковыми для различных активностей фосфолипазы А2 пчелиного яда.
Пример 5. Пример измерения активности секФЛА2(IIА) в сыворотке крови человека
Общая схема. Для получения кривых возрастания флуоресценции для разных активностей стандартного раствора фосфолипазы А2 пчелиного яда к 165 мкл субстрата (начальная концентрация зонда 1,1 мкМ) в буфере с 1 мМ ЭДТА непосредственно перед измерением добавляли 20 мкл раствора альбумина (50 мг/мл) и 10 мкл буфера с активностью фермента в интересующем интервале активностей (не менее 3 различных активностей, в 2 повторах), а затем 5 мкл 80 мМ раствора СаСl2 (до конечной концентрации 2 мМ). В данном эксперименте вводили 0.02, 0.06 и 0.1 ед/мл фермента. Итого: 200 мкл раствора, конечная концентрация зонда 0.909 мкМ (9.09 х 10-7 М). Проводили 15 измерений через каждые 5 мин.
Как показано на Фиг.4, сигнал от системы в альбумине со временем практически не изменяется (ок. 2000 RFU, relative fluorescence units); в присутствии фермента сигнал резко возрастает, пропорционально активности ФЛА2 пчелиного яда По оси ординат приведены показания ридера.
Для измерений в образцах сыворотки к 165 мкл субстрата (начальная концентрация зонда 1,1 мкМ) в буфере с 1 мМ ЭДТА непосредственно перед измерением добавляли 20 мкл сыворотки крови и 10 мкл буфера, а затем 5 мкл 80 мМ раствора СаСl2. Итого: 200 мкл раствора, 10% (по объему) сыворотки, конечная концентрация зонда 0.909 мкМ (9.09 х 10-7 М). В данном эксперименте тестировали 4 образца сыворотки. Проводили 15 измерений через каждые 5 мин.
Как видно на Фиг.5, во всех образцах сыворотки система показывает некоторое возрастание флуоресценции. Это свидетельствует о наличии в сыворотках активности секФЛА2(ПА), однако существенно меньшей, чем 0.02 ед/мл.
Важным с точки зрения клинической может быть интервал активностей от 0.001 до 0.01 ед/мл. Судя по Фиг.4, предлагаемая тест-система позволяет надежно детектировать активности секФЛА2(IIА) в несколько раз меньшие, чем 0.02 ед/мл, что необходимо для определения активности секФЛА2(IIА) в клинических условиях.
Таким образом, предложенный зонд и тест-система на его основе позволяют определять активность секФЛА2(IIА) в сыворотке крови человека в клинических условиях
1. Фосфолипидный флуоресцентный зонд следующего названия: 1-[13-(4,4-дифтор-1,3,5,7-тетраметил-4-бора-3а,4а-диаза-s-индацен-8-ил)тридеканоил]-2-(10-{[(2-гидроксинафтил-1)азофенил-4]азофенил-4}деканоил)-sn-глицеро-3-фосфохолин.
2. Тест-система для определения активности фосфолипазы A2 группы IIA (секФЛА2(IIA)) в сыворотке крови, включающая зонд по пункту 1, везикулярную фосфолипидную матрицу для включения зонда, состоящую из фосфатидилхолина, лизофосфатидилхолина и фосфатидилглицерина, буферный раствор и фосфолипазу A2 пчелиного яда в качестве стандарта.