Биомаркер для отбора пациентов и соответствующие способы
Иллюстрации
Показать всеНастоящее изобретение касается способов для индукции иммунного ответа на антиген у пациента для лечения заболеваний человека путем введения иммуногенной композиции, где указанный пациент является выбранным из популяции пациентов, представляющих интерес. Настоящее изобретение дополнительно касается способов для определения, является ли или не является субъект чувствительным к развитию профилактического или терапевтического иммунного ответа после такого лечения. 3 н. и 15 з.п. ф-лы, 4 ил.
Реферат
Настоящее изобретение относится к области иммунологии и, в частности, к иммунотерапии пациента, направленной против заболеваний, вызванных, например, инфекцией или различными видами рака. В частности, изобретение относится к способам для прогнозирования является ли пациент или не является ли он чувствительным к развитию профилактического или терапевтического иммунного ответа после такой иммунотерапии. Настоящее изобретение относится к способам и композициям для повышения индекса выживаемости пациентов, которые подвергаются лечению с помощью иммуногенной композиции, в частности, вакцины.
Традиционные методики вакцинации, вовлекающие введение в животную систему антигена (например, пептидов, белков), которые могут индуцировать иммунный ответ, и таким образом, например, защищать указанное животное от инфекции, являются известными давно. Такие методики дополнительно включают разработку как живых, так и инактивированных вакцин. Живые вакцины представляют собой аттенуированные непатогенные варианты инфекционного агента, которые являются способными к примированию иммунного ответа, направленного против патогенного варианта инфекционного агента.
Многочисленные группы исследователей изучали также применение вакцин в качестве потенциального терапевтического способа лечения рака различных типов. Такой специфический тип вакцинной стратегии в общем случае называется иммунотерапией.
В последние годы был достигнут прогресс в разработке рекомбинантных вакцин, в частности, рекомбинантных живых вакцин, в которых чужеродные антигены, представляющие интерес, кодируются и экспрессируются с помощью вектора. Среди них векторы на основе рекомбинантных вирусов были продемонстрированы как многообещающие и такие, которые играют важную роль в разработке новых вакцин. Множество векторов были исследованы на их способность экспрессировать белки из чужеродных патогенов или опухолевой ткани, а также индуцировать специфические иммунные ответы против этих антигенов in vivo. В общем случае, эти основанные на генах вакцины могут стимулировать мощные гуморальные и клеточные иммунные ответы, вирусные векторы могут также представлять собой эффективную стратегию как для доставки генов, кодирующих антиген, так и для способствования и усиления презентации антигена. Для того чтобы использоваться в качестве носителей вакцин идеальные вирусные векторы должны быть безопасными и способными к эффективной презентации необходимых специфических для патогена антигенов иммунной системе. Кроме того, векторная система должна соответствовать критериям, которые позволяют осуществлять ее получение на промышленной основе. Некоторые вирусные вакцинные векторы являются известными на сегодняшний день, все они обладают относительными преимуществами и ограничениями в зависимости от предлагаемого применения (для обзора рекомбинантных вирусных вакцин смотри, например, Harrop и Carroll, 2006, Front Biosci., 11, 804-817; Yokoyama и др., 1997, J Vet Med Sci.,59, 311-322).
После наблюдения, сделанного в начале 1990-ых, что векторы на основе плазмидной ДНК могут непосредственно трансфецировать клетки животных in vivo, были предприняты значительные усилия ученых для разработки методик вакцинации на основе применения ДНК плазмид для индукции иммунного ответа, путем непосредственного введения в животных ДНК, которая кодирует антигены. Такие методики, которые, как правило, именуются ДНК вакцинацией использовались в настоящее время для индукции протективных иммунных ответов в большом количестве моделей заболевания. Для обзора ДНК вакцин смотри Reyes-Sandoval и Ert, 2001 (Current Molecular Medicine, 1, 217-243).
Однако общая проблема в области вакцин заключается в идентификации средств индукции достаточного сильного иммунного ответа у вакцинированных индивидуумов для защиты и/или лечения инфекции и заболевания и, таким образом, в продлении выживания пациента, имеющего заболевание, например, рак.
Так, например, основные усилия в последние годы были направлены на открытие новых лекарственных средств, которые действуют путем стимуляции определенных ключевых аспектов иммунной системы, которые будут служить для повышения иммунного ответа, индуцированного с помощью вакцин. Большинство из этих соединений, которые называются модификаторами иммунного ответа (IRM) или адъювантами, как выяснилось, действуют с помощью основных механизмов иммунной системы через Toll-подобные рецепторы (TLR) для индукции биосинтеза различных важных цитокинов (например, интерферонов, интерлейкинов, фактора некроза опухоли, и т.д., смотри, например, Schiller и др., 2006, Exp Dermatol., 15, 331-341). Такие соединения были продемонстрированы как такие, которые стимулируют быстрое высвобождение определенных дендритных клеток, цитокинов, имеющих происхождение от моноцитов/макрофагов, а также являются способными к стимулированию В клеток для секреции антител, которые играют важную роль в противовирусной и противоопухолевой активности IRM соединений.
Альтернативно, были предложены стратегии вакцинации, большинство из которых основываются на режиме вакцинации примирования - бустер-инъекции, В соответствии с этими протоколами "примирования - бустер-инъекции" иммунная система сначала индуцируется путем введения пациенту примирующей композиции, а потом активизируется путем введения второй композиции для стимуляции (смотри, например, ЕР 1411974 или US 20030191076).
Было показано, что функциональная активация и понижающая регуляция цитотоксичности клеток естественных киллеров (NK) может играть основную роль в репродуктивном выходе (Nitrivalas и др., 2001, Human Reproduction, 16, 855-861). В частности, Thum и др, 2004, Human Reproduction, 19, 2395-2400, оценивали влияние абсолютного количества специфического маркера экспрессии, находящегося на клетках естественных киллеров периферической крови (NK), на значения имплантации и самопроизвольного аборта после лечения на основе in vitro оплодотворения (IVF). Авторы определили, что повышение абсолютного количества активированных клеток NK в периферической крови ассоциируется со сниженным значением имплантации эмбриона при IVF лечении. Кроме того, женщины с высоким абсолютным значением клеток NK в периферической крови, которые являлись способными достигать беременности, имели более высокое значение самопроизвольных абортов.
В настоящее время заявителем было идентифицировано новое средство и стратегия вакцинации. В соответствии с первым воплощением настоящее изобретение относится к способу лечения пациента от заболевания человека путем введения иммуногенной композиции, включающей, по крайней мере, один антиген, где указанный пациент является выбранным из популяции пациентов, которая состоит из пациентов, обладающих низкими уровнями активированных NK клеток.
Настоящее изобретение, таким образом, относится к способу лечения пациента с заболеванием человека путем введения иммуногенной композиции, включающей, по крайней мере, один антиген, при этом указанный способ включает следующие этапы:
- выбор одного пациента из популяции пациентов, которая состоит из пациентов, обладающих низкими уровнями активированных NK клеток,
- введение указанному выбранному пациенту указанной иммуногенной композиции.
В соответствии с другим воплощением настоящее изобретение относится к способу индукции иммунного ответа (то есть, усиленного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции, где указанный пациент является выбранным из популяции пациентов, которая состоит из пациентов, обладающих низкими уровнями активированных NK клеток.
В соответствии с другим воплощением настоящее изобретение относится к способу индукции иммунного ответа (то есть, усиленного иммунного ответа), по крайней мере, на один антиген у пациента для лечения заболевания человека путем введения иммуногенной композиции, где указанный пациент является выбранным из популяции пациентов, которая состоит из пациентов, обладающих низкими уровнями активированных NK клеток.
В соответствии с другим воплощением настоящее изобретение относится к способу индукции иммунного ответа (то есть, усиленного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции, где указанный пациент является выбранным из популяции пациентов, которая состоит из пациентов, обладающих низкими уровнями активированных NK клеток и где указанный повышенный иммунный ответ является врожденным иммунным ответом. Врожденный иммунный ответ представляет собой начальную иммунную защиту организма от патогенов и вызывается разнообразными клетками, включая клетки, презентирующие антиген или "АРС". Эти клетки экспрессируют поверхностные и цитоплазматические рецепторы, которые узнают молекулы чужеродного происхождения (например, бактериальные и вирусные нуклеиновые кислоты, белки, углеводы). При определении этих сигналов дендритные клетки и макрофаги вызывают защитную реакцию, которая включает высвобождение цитокинов (включая интерфероны, TNF-.альфа., и IL-12) и хемокинов, которые привлекают клетки, такие, как незрелые дендритные клетки, макрофаги, NK клетки и гранулоциты, к сайту антигенного стимула. Врожденный иммунный ответ, таким образом, обеспечивает неспецифическую защиту, в то время, как организм генерирует адаптивный ответ.
Настоящее изобретение, таким образом, относится к способу индукции иммунного ответа (то есть, усиленного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции, при этом указанный способ включает следующие этапы:
- выбор одного пациента из популяции пациентов, которая состоит из пациентов, обладающих низкими уровнями активированных NK клеток,
- введение указанному выбранному пациенту указанной иммуногенной композиции.
В соответствии с другим воплощением настоящее изобретение относится к способу индукции иммунного ответа, по крайней мере, на один антиген (то есть, усиленного иммунного ответа), у пациента для лечения заболевания человека путем введения иммуногенной композиции, при этом указанный способ включает следующие этапы:
- выбор пациента из популяции пациентов, которая состоит из пациентов, обладающих низкими уровнями активированных NK клеток,
- введение указанному выбранному пациенту указанной иммуногенной композиции.
В соответствии с другим воплощением настоящее изобретение относится к способу индукции иммунного ответа (то есть, усиленного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции, где указанный повышенный иммунный ответ является врожденным иммунным ответом, при этом указанный способ включает следующие этапы:
- выбор пациента из популяции пациентов, которая состоит из пациентов, обладающих низкими уровнями активированных NK клеток,
- введение указанному выбранному пациенту указанной иммуногенной композиции.
В соответствии с другим воплощением настоящее изобретение относится к способу индукции иммунного ответа (то есть, усиленного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции, при этом указанный способ включает следующие этапы:
- измерение у пациента уровней активированных NK клеток, и
- введение пациенту указанной иммуногенной композиции, если указанный пациент обладает низкими уровнями активированных NK клеток.
В соответствии с другим воплощением настоящее изобретение относится к способу индукции иммунного ответа на, по крайней мере, один антиген (то есть, усиленного иммунного ответа), у пациента для лечения заболевания человека путем введения иммуногенной композиции, при этом указанный способ включает следующие этапы:
- измерение у пациента уровней активированных NK клеток, и
- введение пациенту указанной иммуногенной композиции, если указанный пациент обладает низкими уровнями активированных NK клеток.
В соответствии с другим воплощением настоящее изобретение относится к способу индукции иммунного ответа (то есть, усиленного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции, где указанный повышенный иммунный ответ является врожденным иммунным ответом, при этом указанный способ включает следующие этапы:
- измерение у пациента уровней активированных NK клеток, и
- введение пациенту указанной иммуногенной композиции, если указанный пациент обладает низкими уровнями активированных NK клеток.
В соответствии с другим воплощением настоящее изобретение относится к способу прогнозирования, является ли пациент или не является ли он чувствительным к развитию терапевтического или профилактического иммунного ответа путем введения иммуногенной композиции, при этом указанный способ включает этапы:
- получения образца крови от пациента; и
- измерение уровней активированных NK клеток, где низкие уровни активированных NK клеток свидетельствуют о том, что пациент предполагается как такой, который обладает повышенной чувствительностью к развитию профилактического или терапевтического иммунного ответа.
В соответствии с другим воплощением настоящее изобретение относится к способу отбора пациента, чувствительного к развитию профилактического или терапевтического иммунного ответа путем введения иммуногенной композиции, при этом указанный способ включает этапы:
- получения образца крови от пациента; и
- измерение уровней активированных NK клеток, где низкие уровни активированных NK клеток свидетельствуют о том, что пациент обладает повышенной чувствительностью к развитию профилактического или терапевтического иммунного ответа.
В соответствии с другим воплощением настоящее изобретение относится к способу прогнозирования, является ли пациент или не является ли он способным отвечать позитивно на лечение, включающее введение иммуногенной композиции, при этом указанный способ включает этапы:
- получения образца крови от пациента; и
- измерение уровней активированных NK клеток, где низкие уровни активированных NK клеток свидетельствуют о том, что пациент предполагается как такой, который обладает повышенной чувствительностью к развитию профилактического или терапевтического иммунного ответа.
В соответствии с другим воплощением настоящее изобретение относится к способу отбора пациентов, способных отвечать позитивно на лечение, включающее введение иммуногенной композиции, при этом указанный способ включает этапы:
- получения образца крови от пациента; и
- измерение уровней активированных NK клеток, где низкие уровни активированных NK клеток свидетельствуют о том, что пациент обладает повышенной чувствительностью к развитию профилактического или терапевтического иммунного ответа.
В соответствии с другим воплощением настоящее изобретение относится к ех-vivo способу для определения, будет ли пациент терапевтически отвечать на способ лечения, включающий введение иммуногенной композиции, где способ определения включает этапы:
- получения образца крови от пациента; и
- измерение уровней активированных NK клеток, где низкие уровни активированных NK клеток свидетельствуют о том, что пациент будет развивать профилактический или терапевтический иммунный ответ на иммуногенную композицию.
В соответствии с другим воплощением настоящее изобретение относится к ех-vivo способу для определения будет ли пациент терапевтически отвечать на способ лечения рака путем введения иммуногенной композиции, где способ тестирования включает этапы:
- получения образца крови от пациента; и
- измерение уровней активированных NK клеток, где низкие уровни активированных NK клеток свидетельствуют о том, что пациент будет отвечать терапевтически на способ лечения рака.
Как используется в данной заявке во всем описании, неопределенные артикли используются в том смысле, что они означают "по крайней мере, одно", "по крайней мере, первое", "одно или более" или "множество" указанных соединений или этапов, если в контексте не указано иное. Например, термин "клетка" включает множество клеток, включая их смеси. В частности, "по крайней мере, один" и "один или более" означает число, которое равно одному или более, чем одному, с особым предпочтением для одного, двух или трех.
Термин "и/или" при использовании где-либо в данной заявке включает значения "и", "или" и "все" или любую другую комбинацию элементов, связанную указанными терминами.
Термин "около" или "приблизительно", как используется в данной заявке, означает величину в пределах 20%, предпочтительно в пределах 10%, и более предпочтительно в пределах 5%.
Термины "пациент", "субъект" относятся к позвоночному, в частности, к представителям видов млекопитающих и включают, но без ограничения таковыми, домашних животных, спортивных животных, приматов, включая людей.
Как используется в данной заявке, термин "лечение" или "осуществление лечения" охватывает профилактику и/или терапию. В соответствии с этим иммуногенные композиции или способы в соответствии с настоящим изобретением не являются ограниченными терапевтическими применениями и могут использоваться с профилактическими целями. Таковое охватывается в данной заявке термином "для развития профилактического или терапевтического иммунного ответа". "Профилактика" не ограничивается предотвращением непосредственных заболеваний (например, инфекционных заболеваний), он дополнительно охватывает предотвращение долгосрочных последствий этих инфекций, таких, как цирроз или рак.
"Эффективное количество" или "достаточное количество" активного соединения представляет собой количество, достаточное для того, чтобы вызвать выгодные или желательные результаты, включая клинические результаты. Эффективное количество может вводиться при использовании одного или более введений. "Терапевтически эффективное количество" представляет собой количество для достижения выгодных клинических результатов, включая, но без ограничения, ослабление одного или более симптомов, ассоциированных с вирусной инфекцией, а также предотвращение заболевания (например, предотвращение одного или более симптомов инфекции).
Термины "пациент, выбранный из популяции пациентов, которая состоит из пациентов, обладающих низкими уровнями активированных NK клеток" будут применяться для обозначения пациента, для которого уровень активированных NK клеток является измеренным так, как представлено в данной заявке, и который обладает низкими уровнями активированных NK клеток. Когда количество исследуемых пациентов является большим, чем 1, то указанные пациенты образуют популяцию пациентов.
Как используется в данной заявке, термины "активированные NK клетки" означает клетки лимфоцитов, которые экспрессируют CD 16, CD56 и CD69 антигены поверхности клеток. В соответствии с предпочтительным воплощением указанные активированные NK клетки также не экспрессируют поверхностного CD3 антигена. Для обзора, пожалуйста, обратитесь к Vivier и др., 2008, Nature Immunology, 9, 503-510. Альтернативно, активированные NK клетки могут быть дополнительно определены на основе экспрессии и/или продукции IL27 (Villarino и др, 2005, J ImmunoL, 174, 7684-91), Lyl08 (Zhong и Veilette, 2008, JBC, 283(28), 19255-64), перворина (Morissette и др., 2007. Respir Res., 8, 62), гранзима В (Ida и др, 2003, Eur J ImmunoL, 33, 3284-92), IL21/21R (Frederiksen и др, 2008, Cancer Immunol Immunother., 57, 1439-49; Dodds и др., 2008. Cancer Immunol Immunother., октябрь), CXCR1 (Inngjerdingen и др., 2001, Blood., 97, 367-75), CD244 (Gao и др., J Immunol. 2006 Mar 1; 176(5): 2758-64), IL15R и/или гранулизина. Эти термины широко используются в области техники.
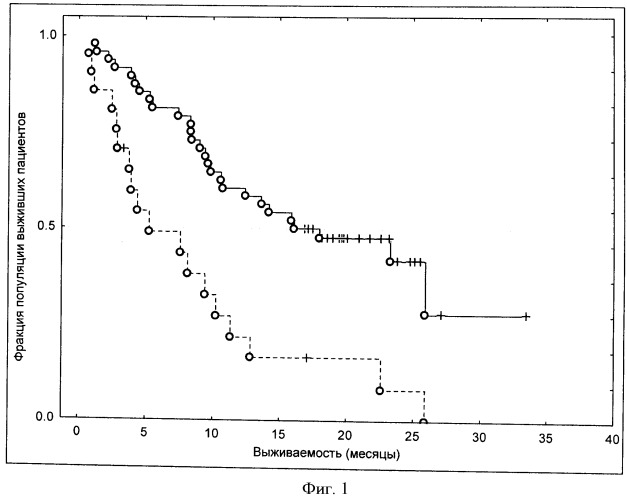
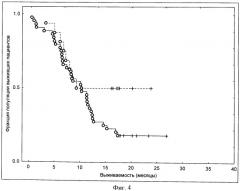
В соответствии со специальными воплощениями термины "пациент будет отвечать терапевтически" означают, что указанный пациент обладает повышением коэффициента выживаемости (смотри для примера раздел примеров).
В соответствии с данным изобретением уровни активированных NK клеток могут определяться, например, с помощью проточной цитометрии (например, с помощью проточной цитофлуориметрии), анализа лизиса клеток-мишеней, и, в частности, с помощью проточной цитометрии на основе 3 или более цветов (например, Beckton Dickinson, Beckman Coulter). Смотри, например, Ntrivalas и др, 2001, Human Reproduction, 16, 855-861; Borrego и др, 1993, Eur. J. ImmunoL, 23, 1039-1043.
В соответствии с изобретением уровни активированных NK клеток могут быть определены на образцах общей крови или на изолированных мононуклеарных клетках периферической крови (РВМС) [например, с помощью очистки мононуклеарных клеток периферической крови (РВМС) с использованием фиколла и гипака (Bennett & Breit 1994, J Leukoc BioL, 56(3), 236-40), или при использовании Sigma Accuspin™ системы (Sigma-Aldrich Ltd.) в соответствии с инструкциями производителя, и других подобных методик].
В соответствии с одним воплощением изобретения уровень активированных NK клеток определяется при использовании антител.
В соответствии с одним специфическим воплощением изобретения указанные антитела представляют собой моноклональные антитела.
В соответствии с одним специфическим воплощением изобретения указанные антитела являются меченными, например, с помощью флуоресцентной, радиоактивной метки, фермента, биотина или с помощью любых других способов, предназначенных для того, чтобы обеспечить клетки, меченные с помощью указанных антител, способные к определению. Такие методики широко используются и являются известными в области техники.
В соответствии с одним предпочтительным воплщением изобретения уровни активированных NK клеток определяют при использовании антител, специфических для CD16, CD56 и/или CD69, предпочтительно с помощью антител, специфических для CD16, CD56 и CD69. Альтернативно, указанные уровни активированных NK клеток дополнительно определяют при использовании антител, специфических для CD3.
Таким образом, например, уровни активированных NK клеток определяются путем забора периферической крови и инкубации клеток с моноклональными антителами (например, с анти-CD3, анти-CD4, анти-CD8, анти-CD19, анти-CD56, анти-CD69 и/или анти-CD16). Потом уровни активированных NK клеток определяют с помощью прибора, который производится Instrumentation Laboratory-Beckman Coulter, с He-Ne пучком лазерного излучения, который распознает длины волн четырех различных флуорохромов (флуоресцеин изотиоцианат FITC, фикоэритрин PE/RD1, ECD, PC5/PE).
Уровни активированных NK клеток могут выражаться либо в (i) процентах (%) лимфоцитов периферической крови, которые экспрессируют CD16, CD56 и CD69 поврехностные антигены клеток, либо в (ii) абсолютном количестве активированных NK клеток на микролитр цельной периферической крови. В соответствии с одним воплощением указанные лимфоциты периферической крови были изолированы из цельной крови и хранились в замороженном состоянии до анализа.
Как используется в данной заявке, термины "низкие уровни активированных NK клеток" означают либо (i) уровни активированных NK клеток, составляющие менее, чем приблизительно 5%, преимущественно менее, чем приблизительно 4,5%, предпочтительно менее, чем приблизительно 4% и даже более предпочтительно менее, чем приблизительно 3,5%, и даже более предпочтительно менее, чем приблизительно 3,45% или (ii) менее, чем приблизительно 75, предпочтительно менее, чем приблизительно 60, и более предпочтительно менее, чем приблизительно 50 активированных NK клеток, в частности, менее, чем приблизительно 35 активированных NK клеток, предпочтительно тех, которые присутствуют в популяции мононуклеарных клеток, на микролитр цельной периферической крови.
Как используется в данной заявке, термины "иммуногенная композиция" "вакцинная композиция", "вакцины" или подобные термины могут использоваться попеременно и означают агент, приемлемый для стимулирования/индукции/повышения иммунной системы человека для ослабления настоящего состояния или для защиты от, или для снижения настоящего или будущего вреда или инфекций (включая вирусные, бактериальные и паразитарные инфекции), например, сниженную пролиферацию опухолевых клеток или выживание, сниженную репликацию патогена или распространение у пациента, или способное к определению снижение нежелательного(ых) симптома(ов), ассоциированного(ых) с состоянием, продление выживания пациента. Указанные иммуногенные композиции могут содержать (i) весь или часть, по крайней мере, одного меченного антигена и/или (ii) по крайней мере, один рекомбинантный вектор, экспрессирующий in vivo всю или часть, по крайней мере, одной гетерологичной нуклеотидной последовательности, в частности гетерологичной нуклеотидной последовательности, кодирующей весь или часть, по крайней мере, одного меченного антигена. В соответствии с альтернативным воплощением иммуногенная композиция в соответствии с изобретением включает (iii) по крайней мере, один модификатор иммунного ответа, один или в комбинации с (i) и/или (ii). Примеры таких модификаторов иммунного ответа (IRM) включают CpG олигонуклеотиды (смотри US 6,194,388; US 2006094683; WO 2004039829, для примера), липополисахариды, комплексы полиинозиновой:полицитидиловой кислоты (Kadowaki, и др., 2001, J. Immunol. 166, 2291-2295), а также полипептиды и белки, известные как такие, которые индуцируют продукцию цитокинов дендритными клетками и/или моноцитами/макрофагами. Другие примеры таких модификаторов иммунного ответа (IRM) представляют собой малые органические молекулы, такие, как имидазохинолинамины, имидазопиридинамины, 6,7-конденсированные циклоалкилимидазопиридинамины, имидазонафтиридинамины, оксазолхинолинамины, тиазолхинолинамины и 1,2-соединенные мостиковой связью имидхиназолинамины (смотри, например, US 4,689,338; US 5,389,640; US 6,110,929; и US 6,331,539).
Как используется в данной заявке, термин "антиген" относится к любому веществу, включая комплексный антиген (например, опухолевые клетки, инфицированные вирусом клетки, и тому подобное), который является способным представлять собой мишень для иммунного ответа. Антиген может быть мишенью, например, для опосредованного клетками и/или гуморального иммунного ответа, который вызывается у пациента. Термин "антиген" охватывает, например, все или часть вирусных антигенов, специфических для опухоли и связанных с опухолью антигенов, бактериальные антигены, паразитарные антигены, аллергены и подобные им:
- Вирусные антигены включают, например, антигены из вирусов гепатита А, В, С, D и Е, ВИЧ, вирусов герпеса, цитомегаловируса, вируса ветряной оспы, папилломавирусов, вируса Эпштейна-Барра, вирусов гриппа, вирусов парагриппа, аденовирусов, вирусов Коксаки, пикорнавирусов, ротавирусов, респираторно-синцитиальных вирусов, вирусов оспы, риновирусов, вируса коревой краснухи, паповавируса, вируса паротита, вируса кори; некоторые неограничивающие примеры вирусных антигенов включают следующие: антигены, которые имеют происхождение от ВИЧ-1, такие, как tat, nef, gp120 или gp160, gp40, p24, gag, env, vif, vpr, vpu, rev или их часть и/или их комбинации; антигены, которые имеют происхождение от вирусов герпеса человека, такие, как gH, gL gM gB gC gK gE или gD или или их часть и/или их комбинации, или предраннего белка, такого, как ICP27, ICP47, ICP4, ICP36 из HSV1 или HSV2; антигены, имеющие происхождение от цитомегаловируса, в частности, цитомегаловируса человека, такого, как gB или его производные; антигены, имеющие происхождение от вируса Эпштейна-Барра, такие, как gp350 или его производные; антигены, имеющие происхождение от вируса ветряной оспы, таких, как gp1, 11, 111 и IE63; антигены, имеющие происхождение от вируса гепатита, такие, как антиген вируса гепатита В, гепатита С или гепатита Е (например, env белок Е1 или Е2, коровый белок, NS2, NS3, NS4a, NS4b, NS5a, NS5b, p7, или часть и/или комбинации HCV); антигены, имеющие происхождение от папилломавирусов человека (например, HPV6, 11, 16, 18, например, LI, L2, Е1, Е2, Е3, Е4, Е5, Е6, Е7, или их часть и/или их комбинации); антигены, имеющие происхождение от вирусных патогенов, таких, как респираторно-синцитиальный вирус (например, F и G белки или их производные), вирус парагриппа, вирус кори, вирус паротита, флавивирус (например, вирус желтой лихорадки, вирус лихорадки Денге, вирус клещевого энцефалита, вирус японского энцефалита) или вирус гриппа (например, НА, NP, NA, или М белки, или их части и/или их комбинации);
- Специфические для опухоли или связанные с опухолью антигены включают, но без ограничения, таковые карциномы, лимфомы, бластомы, саркомы и лейкемии. В частности, примеры включают рак молочной железы, рак предстательной железы, рак толстого кишечника, рак чешуйчатых клеток, мелкоклеточный рак легких, немелкоклеточный рак легких, гастро-интестинальный рак, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак желчного или мочевого пузыря, гепатому, колоректальный рак, карциному эндометрия, карциному слюнных желез, почечный рак, рак печени, вульвалярный рак, рак щитовидной железы, печеночную карциному и различные типы рака головы и шеи, ренальный рак, злокачественную меланому, ларингеальный рак, рак предстательной железы. Раковые антигены представляют собой антигены, которые потенциально могут стимулировать явные специфические для опухоли иммунные ответы. Некоторые из этих антигенов кодируются, хотя необходимым образом не экспрессируются, нормальными клетками. Эти антигены могут характеризоваться как такие, которые в норме являются молчащими (то есть, не экспрессируются) в нормальных клетках, как такие, которые экспрессируются только на низких уровнях или на определенных стадиях, и такие, которые временно экспрессируются как эмбриональные и фетальные антигены. Другие раковые антигены кодируются мутантными клеточными генами, такими, как онкогены (например, активированный ras онкоген), супрессорные гены (например, мутант р53), слитые белки, имеющие происхождение от внутренних делеций или хромосомных транслокаций. Другие раковые антигены могут кодироваться вирусными генами, такими, которые несут РНК и ДНК опухолевых вирусов. Некоторые неограничивающие примеры специфических для опухоли и связанных с опухолью антигенов включают MART-1/Melan-A, gp100, дипептидил пептидазу IV (DPPIV), белок, который связывает аденозиндезаминазу (ADAbp), циклофиллин b, колоректальный ассоциированный антиген (CRC)-C017-1A/GA733, карциноэмбриональный антиген (СЕА) и его иммуногенные эпитопы САР-1 и САР-2, etv6, amil, специфический для предстательной железы антиген (PSA) и его иммуногенные эпитопы PSA-1, PSA-2, и PSA-3, специфический для предстательной железы мембранный антиген (PSMA), Т-клеточный рецептор/СО3-зета цепь, MAGE-семейство опухолевых антигенов (например, MAGE-A1, MAGE-A2, MAGE-A3, MAGE-А4, MAGE-A5, MAGE-A6, MAGE-A7, MAGE-A8, MAGE-A9, MAGE-A10, MAGE-АН, MAGE-A12, MAGE-Xp2 (MAGE-B2), MAGE-Хр3 (MAGE-B3), MAGE-Xp4 (MAGE-В4), MAGE-C1, MAGE-C2, MAGE-C3, MAGE-C4, MAGE-C5), GAGE-семейство опухолевых антигенов (например, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7, GAGE-8, GAGE-9), BAGE, RAGE, LAGE-1, NAG, GnT-V, MUM-1, CDK4, тирозиназа, р53, MUC семейство (например, MUC-1), HER2/neu, p21ras, RCAS1, альфа-фетопротеин, Е-кадгерин, альфа-катенин, бета-катенин и гамма-катенин, pl20ctn, gp100.sup.Pmel 117, FRAME, NY-ESO-1, cdc27, белок аденоматозного полипоза толстой кишки (АРС), фодрин, коннексин 37, Ig-идиотип, р15, gp75, GM2 и GD2 ганглиозиды, вирусные продукты, такие, как белки папилломавируса человека, Smad семейство опухолевых антигенов, Imp-1, PI А, кодируемый EBV ядерный антиген (EBNA)-1, гликогенфосфорилаза мозга, SSX-1, SSX-2 (HOM-MEL-40), SSX-1, SSX-4, SSX-5, SCP-1 и СТ-7, и с-erbВ-2;
- бактериальные антигены включают, например, антигены из Mycobacteria, которые вызывают туберкулез и проказу, пневмококки, аэробные грамм-негативные бациллы, микоплазму, стафилококковые инфекции, стрептококковые инфекции, сальмонеллу, хламидии, нейссерии;
- другие антигены включают, например, антигены из возбудителя малярии, лейшманиоза, трипаносомоза, токсоплазмоза, шистоматоза, филяриоза;
- аллергены относятся к веществам, которые могут индуцировать аллергический или астматический ответ у чувствительного пациента. Список аллергенов является громадным и может включать пыльцу, яды насекомых, пыль из шерсти животных, споры грибов и лекарственные средства (например, пенициллин). Примеры природных, животных и растительных аллергенов включают, но без ограничения, белки, специфические для следующих видов: собачьи (Canis familiar-is); Dermatophagoides (например, Dermatophagoides farinae); кошачьи (Felis domesticus); амброзия (Ambrosia artemiisfolia); плевел (например, Lolium perenne или Lolium multiflorum); криптомерия (Cryptomeria japonica); альтернария (Altemaria altemata); Alder; ольха (Ainus gultinoasa); береза (Betula verrucosa); дуб (Quercus alba); маслины (Olea europa); полынь (Artemisia vulgaris); подорожник (например, Plantago lanceolata); постенница (например, Parietaria officinalis или Parietaria judaica); тараканы (например, Blattella germanica); пчелы (например, Apis multiflorum); кипарис (например, Cupressus sempervirens, Cupressus arizonica и Cupressus macrocarpa); можжевельник (например, Juniperus sabinoides, Juniperus virginiana, Juniperus communis и Juniperus ashei); туя (например, Thuya orientalis); кипарисовик (например, Chamaecyparis obtusa); американский таракан (например, Periplaneta americana); житняк (например, Agropyron repens); рожь (например, Secale cereale); пшеница (например, Triticum aestivum); ежа (например, Dactylis glomerata); овсянница (например, Festuca elatior); мятлик (например, Poa pratensis или Роа compressa); овес (например, Avena sativa); бухарник (например, Holcus lanatus); Anthoxanthum (например, Anthoxanthum odoratum); райграс (например, Arrhenatherum elatius); полевица (например, Agrostis alba); тимофеевка (например, Phleum pratense); фалярис (например, Phalaris arundinacea); паспалум (например, Paspalum notatum); сорго (например. Sorghum halepensis); и костер (например, Bromus inermis).
В соответствии с одним специфическим воплощением указанный антиген кодируется гетерологичной нуклеотидной последовательностью и экспрессируется in vivo с помощью рекомбинантного вектора.
В частном предпочтительном воплощении гетерологичная нуклеотидная последовательность кодирует один или более из всех или части антигенов HBV-PreS1 PreS2 и поверхностные env белки, коровые и polHIV-gpl20 gp40,gpl60, p24, gag, pol, env, vif, vpr, vpu, tat, rev, nef; HPV-E1, E2, E3, E4, E5, E6, E7, E8, LI, L2 (смотри, например, WO 90/10459. WO 98/04705, WO 99/03885); HCV env белок El или Е2, коровые белки, NS2, NS3, NS4a, NS4b, NS5a, NS5b. p7 (смотри, например, WO 2004111082, W02005051420); Muc-1 (see например, US 5,861,381; US 6,054,438; WO 98/04727; WO 98/37095).
В соответствии с вариантами изобретения иммуногенная композиция содержит, по крайней мере, два антигена или гетерологичную нуклеотидную последовательность, которая кодирует, по крайней мере, два антигена, или, по крайней мере, две гетерологичные нуклеотидны последовательности, которые кодируют, по крайней мере, два антигена, или любую их комбинацию.
В соответствии с другим специальным воплощением указанная гетерологичная нуклеотидная последовательность в соответствии с настоящим изобретением кодирует весь или часть HPV антигена(ов), выбранных из группы, которая состоит из Е6 раннего кодирующего участка HPV, E7 раннего кодирующего участка HPV и их производных и комбинаций.
HPV антиген, кодируемый рекомбинантным вектором в соответствии с изобретением, является выбранным из группы, состоящей из HPV Е6 полипептида, HPV E7 полипептида или обоих HPV Е6 полипептида и HPV E7 полипептида. Настоящее изобретение охватывает применение HPV E6 полипептида, который, связываясь с р53, изменяется или, по крайней мере, значительно уменьшается, и/или применение любого HPV E7 полипептида, который, связываясь с Rb, изменяется или, по крайней мере, значительно уменьшается, (Monger и др., 1989, EMBO J.8, 4099-4105; Crook и др., 1991, Cell 67, 547-556; Heck и др., 1992, Proc. Natl. Acad. Sci. USA 89, 4442-4446; Phelps и др., 1992, J.Virol. 66, 2148-2427). Неонкогенный вариант HPV-16 Е6, который является приемлемым для цели настоящего изобретения, получают путем делегирования одного или более аминокислотных остатков, которые размещаются от положения приблизительно 118 до положения приблизительно 122 (+1 представляет собой первый остаток метионина природного Е6 полипептида HPV-16), с особым предпочтением для полной делеции остатков от 118 до 122 (СРЕЕК). Неонкогенный вариант HPV-16 E7, который является приемлемым для цели настоящего изобретения, получают путем делегирования одного или более аминокислотных остатков, которые размещаются от положения приблизительно 21 до положения приблизительно 26 (+1 представляющий собой первый остаток метионина природного E7 полипептида HPV-16), с особым предпочтением для полной делеции остатков от 21 до 26 (DLYCYE). В соответствии с предпочтительным воплощением один или более раннего(их) полипептида(ов) HPV-16, которые используются в изобретении, является(являются) дополнительно модифицированными так, что улучшают презентацию МНС класса I и/или МНС класса II, и/или стимулируют анти-HPV иммунитет.Е6 и E7 полипептиды HPV пердставляют собой ядерные белки, и ранее было показано, что мембранная презентация позволяет улучшить их терапевтическую эффективность (смотри, например, WO 99/03885). Таким образом, может быть желательным модифицировать, по крайней мере, один из ранних полипептидов HPV для прикрепления к клеточной мембране.