Новое производное индазола или его соль и промежуточное соединение для их получения, а также антиоксидант с их использованием, и применение производных индазола или его соли
Иллюстрации
Показать всеИзобретение относится к соединению формулы (1), антиоксиданту, содержащему соединение формулы (1) или его соль в качестве активного ингредиента, и к применению соединения формулы (1) или его соли для получения антиоксиданта. Также изобретение относится к соединению формулы (2), которое является промежуточным для получения соединения формулы (1). Технический результат - соединение формулы (1), проявляющее антиоксидантные свойства. 4 н.п. ф-лы, 1 табл., 13 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новому производному индазола или его соли, а также промежуточному соединению для их получения. Настоящее изобретение также относится к антиоксиданту, содержащему в качестве активного ингредиента по крайней мере одно производное индазола или его соль. Далее, настоящее изобретение также относится к применению такого производного индазола или его соли для получения антиоксидантов.
Уровень техники
В последние годы показано, что перекисное окисление липидов в биологическом теле и сопровождающие его радикальные реакции вызывают различные отрицательные эффекты в биологическом теле за счет нарушений в мембране, нарушений в клетке и т.п. В связи с этим предпринимались различные попытки применения в лекарствах антиоксидантов или агентов, подавляющих перекисное окисление липидов, проводилось множество исследований по антиоксидантам.
Например, такие типичные антиоксиданты, как витамин С, витамин Е, полифенолы и им подобные, используются в пищевых продуктах и косметике. Также СОД (супероксиддисмутаза) или подобные ферменты, которые превращают активный кислород в молекулы кислорода и пероксида водорода, хорошо известны как антиоксиданты. Кроме того, эдаравон используется как терапевтическое средство для предотвращения увеличения зоны инфаркта после церебрального инфаркта с помощью антиоксидантного действия, и известно, что пробукол и подобные вещества, которые являются терапевтическими средствами при гиперлипидемии, подавляют окисление ЛПНП (липопротеинов низкой плотности) и оказывают тормозящее влияние на развитие атеросклероза. Тем не менее, немногое из этого удовлетворительно работает на практике из-за низкой активности, побочных эффектов и подобного.
С другой стороны, Европейская патентная публикация № 1679308 (Патентный документ 1) описывает группу соединений, представленную общей формулой, включающей соединения, представленные следующей формулой (1). Патентный документ 1 раскрывает, что такая группа соединений обладает активностью, ингибирующей Rho-киназу и полезна как терапевтическое средство при глаукоме и т.п. Европейская патентная публикация No. 1870099 (Патентный документ 2) описывает средство, обладающее защитными свойствами для нейронов сетчатки, включающее в качестве активного ингредиента группу соединений, представленных общей формулой, включающей соединения, представленные следующей формулой (1):
Тем не менее, в этих Патентных документах 1 и 2 недостаточно раскрыта информация о самом соединении, представленном формулой (1), а также в них отсутствуют описание и предположения по применению соединения, представленного формулой (1) выше, в качестве антиоксиданта.
Документы предшествующего уровня техники
Патентные документы
Патентный документ 1: Европейская патентная публикация № 1679308.
Патентный документ 2: Европейская патентная публикация № 1870099.
Сущность изобретения
Задачи, подлежащие решению посредством изобретения
Очень интересным предметом является поиск нового антиоксиданта и создание нового соединения, обладающего таким действием и эффектом, или его соли и промежуточного соединения для получения такого нового соединения.
Средства решения задач
Авторы настоящего изобретения прилагали значительные усилия к поиску антиоксиданта и в результате достигли успеха в получении нового производного индазола, представленного формулой (1), или его соли и обнаружили, что такое новое соединение обладает превосходным антиоксидантным действием в системе измерения микросомального перекисного окисления липидов с использованием микросом печени крысы. В частности, настоящее изобретение представляет собой следующее.
Настоящее изобретение представляет антиоксидант, который содержит в качестве активного ингредиента по меньшей мере одно соединение, представленное следующей формулой (1), или его соль. Далее в настоящем документе соединение, представленное следующей формулой (1), или его соль называется «Соединение по изобретению (1)».
Настоящее изобретение также относится к самому соединению по изобретению (1).
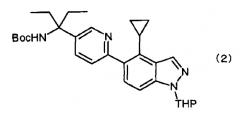
Кроме того, настоящее изобретение также относится к соединению, представленному следующей формулой (2), или его соли. Далее в настоящем документе соединение, представленное следующей формулой (2), которое является промежуточным соединением для получения соединения по изобретению (1) или его соли, называется «соединение по изобретению (2)», и соединение по изобретению (1) и соединение по изобретению (2) в общем называются «соединение по изобретению».
(где Boc представляет трет-бутоксикарбониловую группу, THP представляет тетрагидропиранильную группу).
Настоящее изобретение также относится к применению, по меньшей мере, одного из соединений, представленных формулой (1), или их фармацевтически приемлемой соли для получения антиоксиданта.
Эффекты изобретения
Соединение по изобретению (1) продемонстрировало превосходное антиоксидантное действие в системе измерения микросомального перекисного окислении липидов с использованием микросом печени крысы. То есть, соединение по изобретению (1) полезно в качестве антиоксиданта. Кроме того, также предусматривается применение, по меньшей мере, одного из соединений, представленных формулой (1), или их фармацевтически приемлемой соли для получения антиоксиданта.
Способы осуществления изобретения
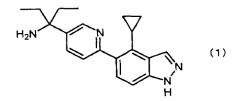
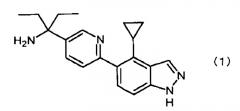
Соединение по изобретению (1) представляет собой 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин, которое является производным индазола, представленным следующей формулой (1) и его солью, а соединение по изобретению (2) представляет собой 1-{6-[4-циклопропил-1-(тетрагидропиран-2-ил)-1H-индазол-5-ил]пиридин-3-ил}-1-этилпропилкарбаминовой кислоты трет-бутиловый сложный эфир, который является промежуточным соединением для получения соединения по изобретению (1), представленный следующей формулой (2), и его соль:
«Соль» соединения по изобретению представляет собой предпочтительно фармацевтически приемлемую соль, и, например, перечислены соли неорганических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, йодистоводородная кислота, азотная кислота, серная кислота или фосфорная кислота, соли органических кислот, таких как уксусная кислота, трифторуксусная кислота, щавелевая кислота, малоновая кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, лимонная кислота, винная кислота (D-изомер, L-изомер, мезо-изомер), адипиновая кислота, глюконовая кислота, глюкогептонная кислота, глюкуроновая кислота, бензойная кислота, фталевая кислота, терефталевая кислота, молочная кислота, гиппуровая кислота, глутаминовая кислота, аспарагиновая кислота, 1,2-этандисульфоновая кислота, изетионовая кислота, лактобионовая кислота, олеиновая кислота, памовая кислота, полигалактуроновая кислота, стеариновая кислота, таниновая кислота, метансульфоновая кислота, этансульфоновая кислота, трифторметансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, лаурилсульфат сложный эфир, метилсульфат, нафталинсульфоновая кислота или сульфосалициловая кислота, соли щелочных металлов, таких как литий или калий, соли щелочноземельных металлов, таких как кальций или магний, и соли четвертичного аммония, так какие аммиак. Предпочтительно, перечислены соли, которые образует хлористоводородная кислота, бромистоводородная кислота, азотная кислота, серная кислота, фосфорная кислоты, фумаровая кислота, малеиновая кислота, янтарная кислота, лимонная кислота, винная кислота (D-изомер, L-изомер, мезо-изомер) или метансульфоновая кислота, и особенно предпочтительно, перечислены соляная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, винная кислота (L-изомер) и метансульфоновая кислота. Соединение по изобретению (1) может образовывать соль в любом соотношении с неорганической кислотой, органической кислотой, щелочным металлом, щелочноземельным металлом или т.п., и каждая из таких солей или их смесь подразумевается в настоящем изобретении.
В случае гидратов и/или сольватов соединения по настоящему изобретению гидраты и/или сольваты также входят в объем соединения по настоящему изобретению. В случае кристаллического полиморфизма и группы кристаллических полиморфизмов (системы кристаллических полиморфизмов) соединения по изобретению такие кристаллические полиморфизмы и группы кристаллических полиморфизмов (системы кристаллических полиморфизмов) также входят в объем соединения по изобретению. Здесь группа кристаллических полиморфизмов (система кристаллических полиморфизмов) означает кристаллические формы на соответствующих этапах и (в течение) всего процесса, когда кристаллические формы различным образом изменяются в соответствии с условиями и состоянием производства, хранения и т.п. таких кристаллов (здесь состояние включает состояние лекарственной формы).
Предпочтительные конкретные примеры соединения по изобретению могут включать следующие соединения и их соли:
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин,
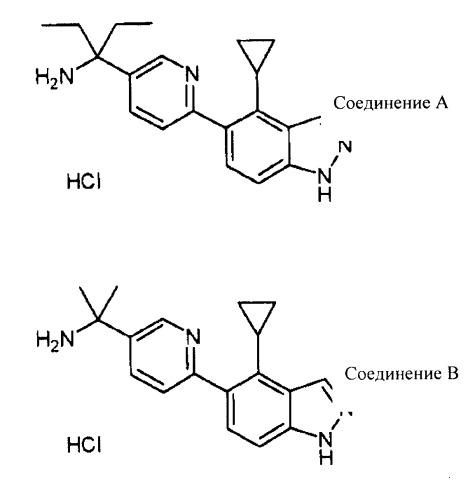
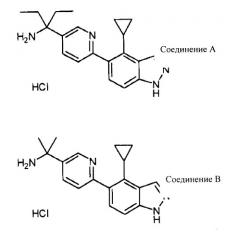
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин гидрохлорид (далее в настоящем документе также обозначаемый как «соединение А»),
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин гидробромид,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин сульфат,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин фосфат,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин фумарат,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин малеат,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин сукцинат,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин L-тартрат,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин метансульфонат,
- 1-{6-[4-циклопропил-1-(тетрагидропиран-2-ил)-1H-индазол-5-ил]пиридин-3-ил}-1-этилпропилкарбаминовой кислоты трет-бутиловый сложный эфир.
Более предпочтительные конкретные примеры соединения по изобретению могут включать следующие соединения и их соли:
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин 1 гидрохлорид,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин 2 гидрохлорид,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин 3 гидрохлорид,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин 1 гидробромид,
- 1-[6-(4-циклопропил-IH-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин 2 гидробромид,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин 3 гидробромид,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин 1 сульфат,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин 1 фосфат,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин 0,5 фумарат,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин 1 фумарат,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин 1,5 фумарат,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин 0,5 малеат,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин 1 малеат,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин 1,5 малеат,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин 0,5 сукцинат,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин 1 сукцинат,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин 1,5 сукцинат,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин 0,5 л-тартрат,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин 1 л-тартрат,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин 1,5 л-тартрат,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин 1 метансульфонат,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин 2 метансульфонат,
- 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин 3 метансульфонат,
- 1-{6-[4-циклопропил-1-(тетрагидропиран-2-ил)-1H-индазол-5-ил]пиридин-3-ил}-1-этилпропилкарбаминовой кислоты трет-бутиловый сложный эфир.
Тогда как конкретный способ получения соединения по изобретению будет описан детально в разделе «Пример» [Пример получения] ниже как типичный способ получения, после получения соединения по изобретению (2) в соответствии со способом, описанным в WO 2007/142323, с соединения снимается защита обычно применяемым способом и/или превращением в соль одновременно и/или после снятия защиты, чтобы получить соединение по изобретению (1).
Тогда как подробности будут раскрыты в описанном позже в разделе «фармакологический тест», соединение по изобретению (1) продемонстрировало превосходное антиоксидантное действие в системе измерения микросомального перекисного окислении липидов с использованием микросом печени крысы. Другими словами, соединение по изобретению (1) полезно в качестве антиоксиданта. По настоящему изобретению также предусматривается применение соединения, представленного вышеуказанной формулой (1), или его соли для получения антиоксиданта.
Полезное применение антиоксиданта по настоящему изобретению включает не только медицинские, но также косметические, пищевые, промышленные (такие как краски) и т.д. применения. Оно полезно предпочтительно как лекарственное средство, более предпочтительно как лекарственное средство, полезное для профилактики или лечения заболеваний, при которых антиоксидант считается эффективным, особенно предпочтительно как лекарственное средство для профилактики или лечения сердечно-сосудистых заболеваний, таких как атеросклероз, артериосклероз, инфаркт миокарда, аритмия, хроническая почечная недостаточность, нефрит, гипертензия и гиперлипидемия; заболеваний краниальной нервной системы, таких как интракраниальное кровоизлияние, церебральный инфаркт, субарахноидальное кровоизлияние, ишемическое реперфузионное повреждение, болезнь Альцгеймера, болезнь Паркинсона и деменция; заболеваний пищеварительной системы, таких как язва желудка, воспалительное заболевание кишечника, рефлюкс-эзофагит, язвенный колит, болезнь Крона, диабет, панкреатит, гепатит, цирроз печени и неалкогольный стеатогепатит; заболеваний дыхательной системы, таких как пневмония, эмфизема, легочный фиброз, хроническое обструктивное заболевание легких и астма; воспалительных/аутоиммунных заболеваний, таких как коллагеновая болезнь, ревматизм, болезнь Бехчета и сепсис; кожных заболеваний, таких как атопический дерматит, кожное воспаление, псориаз и ожог; инфекций, таких как герпетическая инфекция и СПИД; рака; антираковой терапии, такой как адриамицин-индуцированная кардиотоксичность; офтальмологических воспалительных заболеваний, таких как воспаление роговицы, конъюнктивит, склерит и блефарит; сухость глаз; птеригий; катаракта; заболеваний глаз, связанные с окислительным стрессом, такие как зрительное утомление; заболеваний сетчатки, таких как возрастная дегенерация желтого пятна, возрастной отек желтого пятна (сухого типа, мокрого типа) и диабетическая ретинопатия; и глаукомы.
Антиоксидант по настоящему изобретению может быть представлен в составе одного препарата и/или смешанного препарата с применением обычно используемой техники, в то время как другой активный ингредиент и/или добавка (предпочтительно, другой фармацевтически приемлемый активный ингредиент и/или добавка) добавляется по мере необходимости.
Антиоксидант по настоящему изобретению может быть введен пациенту перорально или парентерально, когда он применяется для профилактики или лечения заболевания, при котором антиоксидант считается эффективным, и как формы введения перечислены пероральное введение, топическое введение в глаз (например, введение глазных капель, введение в конъюктивальный мешок, введение в стекловидное тело, субконъюктивальное введение и субтеноновое введение), внутривенное введение, трансдермальное введение и т.п., и антиоксидант находится в составе дозированной формы, подходящей для введения, вместе с фармацевтически приемлемой добавкой по мере необходимости. Как дозированная форма, подходящая для перорального введения, перечислены, например, таблетка, капсула, гранула, мелкозернистая гранула, порошок и т.п., и как дозированная форма, подходящая для парентерального введения, перечислены, например, инъекция, глазные капли, глазная мазь, пластырь, гель, интеркалятор и т.п. Их можно получить с использованием обычных методов, которые, как правило, используются в этой области. Антиоксидант по настоящему изобретению также может быть получен в дозированной форме, включающей DDS (СДЛС, систему доставки лекарственного средства), такой как дозированная форма для интраокулярного имплантата и микросферы помимо вышеперечисленных дозированных форм.
Например, таблетка может быть получена с помощью соответствующего выбора и использования эксципиента, такого как лактоза, глюкоза, D-маннит, кальция гидрогенфосфат безводный, крахмал или сахароза; дезинтегранта, такого как карбоксиметилцеллюлоза, карбоксиметилцеллюлоза кальция, кроскармеллоза натрия, кросповидон, крахмал, частично желированный крахмал, или гидроксипропилцеллюлоза с низкой степенью замещения; смазывающее средство, такое как гидроксипропилцеллюлоза, этилцеллюлоза, гуммиарабик, крахмал, частично желированный крахмал, поливинилпирролидон или поливиниловый спирт; лубрикант, такой как стеарат магния, стеарат кальция, тальк, водный диоксид кремния или отвержденное масло; покрывающее средство, такое как очищенная сахароза, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, метилцеллюлоза или пирролидон; корригирующее вещество, такое как лимонная кислота, аспартам, аскорбиновая кислота или ментол.
Инъекцию можно получать, отбирая и используя по мере необходимости средство, обеспечивающее изотоничность, такое как хлорид натрия; буфер, такой как фосфат натрия; поверхностно-активное вещество, такое как полиоксиэтилен сорбитан моноолеат; загуститель, такой как метилцеллюлоза и т.д.
Глазные капли можно получать, отбирая и используя по мере необходимости средство, обеспечивающее изотоничность, такое как хлорид натрия или концентрированный глицерин; буфер, такой как фосфат натрия или ацетат натрия; поверхностно-активное вещество, такое как полиоксиэтилен сорбитан моноолеат, полиоксил стеарат 40 или полиоксиэтилен-отвержденное касторовое масло; стабилизатор, такой как цитрат натрия или эдетат натрия; и консервант, такой как хлорид бензалкония или парабен, и pH может варьировать в пределах приемлемого для офтальмического состава, и, как правило, предпочтительно в пределах от 4 до 8. Также глазную мазь можно получать, используя обычно используемую основу, такую как так как белый петролатум или парафиновое масло.
Интеркалятор можно получать, перетирая и смешивая биодеградируемые полимеры, такие как гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, карбоксивиниловый полимер или полиакриловая кислота вместе, с активным ингредиентом с последующим формованием под давлением полученного порошка, и эксципиент, связывающее средство, стабилизатор и преобразователь pH можно использовать по мере необходимости.
Состав для интраокулярного имплантата можно получать, используя биодеградируемый полимер, например, биодеградируемый полимер, такой как полимолочная кислота, полигликолевая кислота, сополимер молочной кислоты и гликолевой кислоты, или гидроксипропилцеллюлозу.
Доза антиоксиданта по настоящему изобретению может варьировать соответствующим образом в зависимости от дозированной формы, тяжести состояния, возраста, массы тела пациента, которому вводится действующее вещество, решения врача и т.д., однако в случае перорального введения, как правило, от 0,01 до 5000 мг, предпочтительно от 0,1 до 2500 мг и более предпочтительно от 0,5 до 1000 мг можно вводить в сутки взрослому однократной дозой или в несколько приемов. В случае инъекции, как правило, от 0,0001 до 2000 мг можно вводить взрослому однократной дозой или в несколько приемов. Далее, в случае глазных капель или интеркалятора, вещество, содержащее активный ингредиент с концентрацией от 0,000001 до 10% (масс./об.), предпочтительно от 0,00001 до 1% (масс./об.), более предпочтительно от 0,0001 до 0,1% (масс./об.) можно вводить один или несколько раз в сутки. В случае пластыря, пластырь, содержащий от 0,0001 до 2000 мг, может быть прикреплен к взрослому, и в случае состава для интраокулярного имплантата, состав для интраокулярного имплантата, содержащий 0,0001 до 2000 мг для взрослого может быть имплантирован в глаз.
Примеры получения, примеры фармакологического теста и примеры дозированных форм, представленные ниже, даны для лучшего понимания по настоящему изобретению, а не для ограничения объема настоящего изобретения.
Примеры получения
<Пример 1: Синтез 1-{6-[4-циклопропил-1-(тетрагидропиран-2-ил)-1H-индазол-5-ил]пиридин-3-ил}-1-этилпропилкарбамидной кислоты трет-бутилового сложного эфира>
В раствор 4-циклопропил-1-(тетрагидропиран-2-ил)-5-(4,4,5,5-тетраметил[1,3,2]диоксаборанил-1H-индазола (130 г, 353 ммоль, см. WO 2007/142323) в толуоле (720 г) добавляли этанол (140 мл), воду (140 мл), фосфат калия дигидрат (230 г, 933 ммоль) и 2-бромо-5-(1-трет-бутоксикарбониламино-1-этилпропил)пиридин (100 г, 291 ммоль, см. WO 2005/035506) в потоке газа аргона. Реакционный раствор аэрировали в течение 10 минут с газом аргоном. Затем в потоке газа аргона добавляли 20% масс. трициклогексилфосфин/толуол раствор (10 мл, 6,22 ммоль) и ацетат палладия (700 мг, 3,11 ммоль), и нагревали и перемешивали при 75°C в течение 6 часов.
После окончания реакции в реакционный раствор добавляли воду (200 мл) и разделяли. Органический слой промывали насыщенным физиологическим раствором (300 мл) и прогоняли через целит (торговое название) (20 г) и затем концентрировали при пониженном давлении. К полученному остатку добавляли гептан (1000 мл) и полученное твердое вещество собирали фильтрацией и промывали гептаном. Полученное твердое вещество сушили при пониженном давлении при 48°C, чтобы получить 1-{6-[4-циклопропил-1-(тетрагидропиран-2-ил)-1H-индазол-5-ил]пиридин-3-ил)-1-этилпропилкарбаминовой кислоты трет-бутиловый сложный эфир (пример соединения 1) (104 г), представленный следующей формулой, в виде белого порошка (выход 66%).
Масс-спектр (CI, масса/заряд): 505([M+H]+).
1H-ЯМР спектр (CDCl3): δ 0,50-0,55 (м, 2H), 0,75-0,87 (м, 8H), 1,40 (уш.с, 9H), 1,63-2,37 (м, 10H), 2,53-2,66 (м, 1H), 3,71-3,79 (м, 1H), 4,01-4,07 (м, 1H), 4,81 (уш.с, 1H), 5,72 (дд, J=9,3, 2, 7, 1H), 7,47-7,59 (м, 3H), 7,68 (дд, J=8,2, 2,4 Гц, 1H), 8,21 (с, 1H), 8,69 (дд, J=2,4, 0,7 Гц, 1H).
<Пример 2: Синтез 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин гидрохлорида>
К 1-{6-[4-циклопропил-1-(тетрагидропиран-2-ил)-1H-индазол-5-ил]пиридин-3-ил}-1-этилпропилкарбамидной кислоты трет-бутиловому сложному эфиру (Пример соединения 1, 100 г, 198 ммоль) добавляли этанол (250 мл), воду (11 мл) и 38% масс. раствор хлористого водорода в этаноле (179 мл) и перемешивали при температуре от 30 до 43°C в течение 5 часов в потоке газа аргона.
Реакционный раствор охлаждали до 12°C, перемешивали в течение 0,3 часа при той же температуре. Осажденное твердое вещество собирали фильтрацией, и затем промывали этанолом (100 мл). К полученному твердому веществу (90 г) добавляли этанол (270 мл) и нагревали до 75°C. Затем добавляли воду (35 мл) и нагревали и перемешивали в течение 0,5 часа. Реакцию охлаждали до 10°C и полученное твердое вещество собирали фильтрацией, промывали этанолом (200 мл) и затем сушили при 40°C в течение 10 часов, чтобы получить белое твердое вещество (71 г).
К полученному твердому веществу (70 г) добавляли смешанный раствор (234 мл) этанола/воды = 2/1 (об./об.) и нагревали и перемешивали при температуре от 70°C до 75°C в течение 0,5 часов в потоке газа аргона. Реакцию охлаждали до 10°C, осажденное твердое вещество собирали фильтрацией и промывали 90 мл этанола. Сушкой при 50°C в течение 2 часов 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин гидрохлорид (Пример соединения 2) (46 г) получали в виде белого порошка (выход 62%).
Температура плавления: >250°C (разложение).
Масс-спектр (CI, масса/заряд): 321([M+H]+).
1H-ЯМР спектр (CD3OD): δ 0,44-0,50 (м, 2H), 0,97-1,04 (м, 8H), 2,16-2,54 (м, 5H), 7,58-7,69 (м, 2H), 8,38-8,41 (м, 2H), 8,73 (дд, J=8,5, 2,4 Гц, 1H), 9,02 (дд, J=2,4, 0,5 Гц, 1H).
<Пример 3: Синтез 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин гидробромида>
К 1-{6-[4-циклопропил-1-(тетрагидропиран-2-ил)-1H-индазол-5-ил]пиридин-3-ил}-1-этилпропилкарбамидной кислоты трет-бутиловому сложному эфиру (Пример соединения 1, 2,1 г, 4,2 ммоль) добавляли этанол (20 мл) и 48% масс. раствора бромида водорода (10 мл), нагревали и перемешивали в течение 4 часов при 40°C. Растворитель отгоняли при пониженном давлении и к остатку добавляли при 50°C этанол (10 мл) и воду (2 мл). После охлаждения водным льдом осажденное твердое вещество собирали фильтрацией и промывали этанолом, чтобы получить белое твердое вещество (883 мг).
К полученному белому твердому веществу (530 мг) добавляли этанол (5 мл) и воду (200 мкл) и нагревали и перемешивали при 70°C в течение 0,5 часа. После охлаждения до комнатной температуры осажденное твердое вещество собирали фильтрацией, промывали этанолом и затем сушили при 60°C в течение 1,25 часа, чтобы получить 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин гидробромид (Пример соединения 3) (273 мг) в виде белого порошка (выход 22%).
Температура плавления: >221-223°C (разложение).
Масс-спектр (CI, масса/заряд): 321([M+H]+).
1H-ЯМР спектр (CD3OD): δ 0,45-0,50 (м, 2H), 0,97-1,04 (м, 8H), 2,17-2,53 (м, 5H), 7,60 (д, J=8,8 Гц, 1H), 7,65-7,69 (м, 1H), 8,39-8,42 (м, 2H), 8,72 (дд, J=8,8, 2,4 Гц, 1H), 9,02 (дд, J=2,4, 0,5 Гц, 1H).
<Пример 4: Синтез 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламина>
К 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин гидрохлориду (Пример соединения 2, 30,0 г, 76,3 ммоль) добавляли н-бутанол (300 мл) и 4M водный раствор гидроксида натрия (370 мл) и перемешивали при комнатной температуре в течение 1,5 часов. Органический слой разделяли, промывали водой (150 мл) и затем органический слой концентрировали, чтобы получить твердое вещество (22,6 г).
К полученному твердому веществу (22,6 г) добавляли метанол (160 мл) и увеличивали температуру до 60°C. Воду (160 мл) добавляли при той же температуре, и после перемешивания в течение 0,5 часов, перемешивание проводили в течение 1 часа при температуре от 10 до 15°C. После фильтрации реакционного раствора полученное твердое вещество промывали смешанным холодным раствором (46 мл) метанола/воды = 1/1 (об./об.). Сушкой в течение 11 часов при 80°C при пониженном давлении 1-[6-(4-циклопропил)-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин (Пример соединения 4) (21,5 г), представленный следующей формулой, получали в виде белого порошка (выход 88%):
Температура плавления: 208°C.
Масс-спектр (CI, масса/заряд): 321 ([M+H]+).
1H-ЯМР спектр (CD3OD): δ 0,41-0,47 (м, 2H), 0,79-0,86 (м, 8H), 1,75-2,04 (м, 4H), 2,28-2,37 (м, 1H), 7,42-7,49 (м, 2H), 7,62 (дд, J=8,3, 0,7.Гц, 1H), 7,93 (дд, J=8,3, 2,4.Гц, 1H), 8,24 (д, J=0,7 Гц, 1H), 8,67 (дд, J=2,4, 0,7 Гц, 1H).
<Пример 5: Синтез 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин L-тартрата>
К раствору 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламина (Пример соединения 4, 4,0 г, 12 ммоль) в этаноле (160 мл) добавляли по каплям раствор L-винной кислоты (2,8 г, 19 ммоль) в этаноле (85 мл) при комнатной температуре в течение 0,5 часа и перемешивали при той же температуре в течение 0,67 часа. Реакционный раствор охлаждали до 10°C и осажденное твердое вещество собирали фильтрацией. После промывания этанолом (40 мл) твердое вещество сушили при пониженном давлении при 40°C в течение 1 часа, затем температуру повышали до 60°C и сушили при пониженном давлении в течение 11 часов, чтобы получить 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин L-тартрат (Пример соединения 5) (5,4 г) в виде белого твердого вещества (выход 92%).
Температура плавления: 215-216°C.
Масс-спектр (CI, масса/заряд): 321([M+H]+).
1H-ЯМР спектр (CD3OD): δ 0,41-0,46 (м, 2H), 0,83-0,89 (м, 2H), 0,95 (т, J=7,4 Гц, 6H), 2,10 (дкв., J=14,8, 7,4 Гц, 2H), 2,26 (дкв., J=14,8, 7,4 Гц, 2H), 2,34-2,42 (м, 1H), 4,40 (с, 2H), 7,46-7,52 (м, 2H), 7,81 (дд, J=8,3, 0,5 Гц, 1H), 7,97 (дд, J=8,3, 2,7 Гц, 1H), 8,27 (д, J=0,7 Гц, 1H), 8,66-8,67 (м, 1H).
<Пример 6: Синтез 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин малеата>
К раствору малеиновой кислоты (11 мг, 0,095 ммоль) в тетрагидрофуране (110 мкл) добавляли раствор 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин (Пример соединения 4, 10 мг, 0,031 ммоль) в тетрагидрофуране (800 мкл) и оставляли на 6 суток при комнатной температуре. Осажденное твердое вещество собирали фильтрацией и сушили при пониженном давлении при 50°C, чтобы получить 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин малеат (Пример соединения 6) (11 мг) в виде белого твердого вещества (выход 71%).
Температура плавления: 174-178°C.
1H-ЯМР спектр (CD3OD): δ 0,41-0,46 (м, 2H), 0,83-0,90 (м, 2H), 0,96 (т, J=7,5 Гц, 6H), 2,10 (д.кв., J=14,8, 7,5 Гц, 2H), 2,21-2,42 (м, 3H), 6,27 (с, 3H), 7,46-7,53 (м, 2H), 7,82 (дд, J=8,5, 0,6 Гц, 1H), 7,94 (дд, J=8,5, 2,7 Гц, 1H), 8,27 (с, 1H), 8,65-8,66 (м, 1H).
<Пример 7: Синтез 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин фумарата>
К раствору фумаровой кислоты (11 мг, 0,095 ммоль) в тетрагидрофуране (275 мкл) добавляли раствор 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламина (Пример соединения 4, 10 мг, 0,031 ммоль) в тетрагидрофуране (667 мкл) и оставляли на 3 суток при комнатной температуре. Осажденное твердое вещество собирали фильтрацией и сушили при пониженном давлении при 50°C, чтобы получить 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин фумарат (Пример соединения 7) (8,8 мг) в виде белого твердого вещества (выход 75%).
Температура плавления: 257°C.
1H-ЯМР спектр (CD3OD): δ 0,41-0,46 (м, 2H), 0,82-0,94 (м, 8H), 1,94-2,07 (м, 2H), 2,18 (д.кв., J=14,8, 7,3 Гц, 2H), 2,31-2,41 (м, 1H), 6,68 (с, 1H), 7,45-7,51 (м, 2H), 7,76 (дд, J=8,3, 0,7 Гц, 1H), 7,95 (дд, J=8,3, 2,4 Гц, 1H), 8,26 (д, J=0,7 Гц, 1H), 8,66 (дд, J=2,4, 0,7 Гц, 1H).
<Пример 8: Синтез 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин сукцината>
К раствору янтарной кислоты (11 мг, 0,093 ммоль) в тетрагидрофуране (275 мкл) добавляли раствор 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламина (Пример соединения 4, 10 мг, 0,031 ммоль) в тетрагидрофуране (667 мкл) и оставляли на 6 суток при комнатной температуре. Осажденное твердое вещество собирали фильтрацией и сушили при пониженном давлении при 50°C, чтобы получить 1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этилпропиламин сукцинат (Пример соединения 8) (6,9 мг) в виде белого твердого вещества (выход 58%).
Температура плавления: 218°C.
1H-ЯМР спектр (CD3OD): δ 0,41-0,46 (м, 2H), 0,82-0,90 (м, 8H), 1,94 (д.кв., J=14,6, 7,3 Гц, 2H), 2,11 (д.кв., J=14,6, 7,3 Гц, 2H), 2,30-2,40 (м, 1H), 2,51 (с, 2H), 7,44-7,51 (м, 2H), 7,72 (д, J=8,3 Гц, 1H), 7,94 (дд, J=8,3, 2,4 Гц, 1H), 8,25 (д, J=0,7 Гц, 1H), 8,66 (д, J=2,4 Гц, 1H).
Пример фармакологического теста
1. Тест антиоксидантного действия в микросомах печени крысы
Антиоксидантное действие тестируемого соединения оценивали с использованием системы измерения перекисного окисления липидов в микросомах. Этот тест определяет количество реактивных соединений тиобарбитуровой кислоты (TBARS), которые получают в ходе реакции перекисного окисления липидов, обусловленной добавлением никотинамидадениндинуклеотидфосфорной кислоты и сернокислого железа к микросоме. К этой системе добавляют тестируемое соединение и оценивают действие подавления тестируемым веществом образования TBARS как антиоксидантное действие. Этот способ представляет собой общий способ для измерения антиоксидантного действия соединения или ему подобных. (Ссылочная документация: Yakugaku Zasshi 119, 93-99 (1999), Biochimica et Biophysics Acta, 1046, (1990) 207-213, Chemistry & Biology Experiment line 2, lipid peroxidation experimental method (Hirokawa shoten).)
<Приготовление реагентов для тестирования антиоксидантного действия, приготовление раствора тестируемого соединения и способ оценки>
Приготовление реагентов
Приготовление буферного раствора
Буферный раствор был приготовлен перемешиванием для получения 25 мМ трис(гидроксиметил)аминометана (Трис) (pH 7,4) и 150 мМ хлорида калия (KCl).
2) Приготовление 5 мМ раствора сернокислого железа
Сернокислое железо (FeSO4•7H2O) растворяли в дистиллированной воде, чтобы приготовить 5 мМ раствор.
3) Приготовление раствора 50 мМ никотинамидадениндинуклеотидфосфорной кислоты
Никотинамидадениндинуклеотидфосфорную кислоту (НАДФ) растворяли в дистиллированной воде, чтобы приготовить 50 мМ раствор.
4) Приготовление 200 мМ раствора этилендиаминтетрауксусной кислоты
Этилендиаминтетрауксусную кислоту (ЭДТА) растворяли в дистиллированной воде, чтобы приготовить 200 мМ раствор.
5) Микросома печени крысы
Использовали пять мкл коммерчески доступной микросомы печени крысы [XENOTECH, номер по каталогу R1000 (20 мг белок/мл)].
Приготовление раствора тестируемого соединения
Как тестируемое соединение использовали соединение A, которое представляет собой соединение по изобретению [1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-этиленпропиламин гидрохлорид (Пример соединения 2)], и соединение B, имеющее сходную структуру соединения [1-[6-(4-циклопропил-1H-индазол-5-ил)пиридин-3-ил]-1-метилэтиламин гидрохлорид (синтезированное в соответствии со способом, описанным в Европейской Патентной публикации No. 1679308)]. Десять мМ растворов тестируемого соединения было приготовлено растворением 1,3 мг соединения A в 0,315 мл диметилсульфоксида (ДМСО) и растворением 2,15 мг соединения B в 0,554 мл диметилсульфоксида (ДМСО):
Способ оценки
1) Раствор тестируемого соединения (5 мкл) помещали в реакционную пробирку.
2) Раствор буфера (480 мкл) помещали в реакционную пробирку.
3) Затем в каждую реакционную пробирку добавляли 5 мкл микросом печени крысы, перемешанных и предварительно выдержанных в термостате (37°C) в течение 5 минут.
4) 50 мМ раствор никотинамидадениндинуклеотидфосфорной кислоты (5 мкл) добавляли в каждую реакционную пробирку, так что конечная концентрация составляла 500 мкМ.
5) Раствор 5 мМ сернокислого железа (5 мкл) добавляли в каждую реакционную пробирку, так что конечная концентрация составляла 50 мкМ, и реакция начиналась.
6) Дав реакции пройти в течение 20 минут, в каждую реакционную пробирку добавляли 200 мМ раствор этилендиаминтетрауксусной кислоты (25 мкл), так что конечная концентрация составляла 10 мМ, чтобы остановить реакцию, и оставляли в ледяной воде.
7) Уровень образования побочных продуктов перекисного окисления липидов (TBARS) в растворе после окончания реакции измеряли, используя коммерчески доступный измерительный комплект для TBARS [Cayman, номер по каталогу 10009055].
Как группу реакций нелипидного перекисного окисления, тест проводили, добавляя дистиллированную воду вместо никотинамидадениндинуклеотидфосфорной кислоты и сернокислого железа, и измеряли уровень образования TBARS. Количество примеров каждой группы n=2 и уровень подавления образования TBARS (%) рассчитывали из среднего значения n=2 в соответствии со следующей формулой 1 и IC50 тестируемого соединения измеряли с помощью нелинейной регрессии пакета статистического анализа (EXSAS).
Формула 1
уровень подавления образования TBARS (%)=[1-(Tx-T0)/(Tn-T0)]×100
где T0: TBARS-уровень образования в группе реакций нелипидного перекисного окисления (мкМ);
Tn: TBARS-уровень образования в группе с добавленным контрольным раствором (мкМ);
Tx: TBARS-уровень образования в группе с добавленным тестируемым соединением (мкМ).
Способ добавления соединения
- Группа с добавленным тестируемым соединением: добавляли раствор соединения, растворенный в растворе диметилсульфоксида (ДМСО).
- Группа с добавленным контрольным раствором и группа нелипидного перекисного окисления: добавляли раствор диметилсульфоксида (ДМСО).
| Таблица 1 | |
| IC50 | |
| Соединение A | 3,8 мкМ |
| Соединение B | >100 мкМ |
Обсуждение
По этим результатам, соединение А про