Пиримидинзамещенные производные пурина, фармацевтическая композиция на их основе, способ ингибирования протеинкиназ, способ лечения или профилактики заболеваний, чувствительных к ингибированию протеинкиназ и способ лечения пролиферативных заболеваний
Иллюстрации
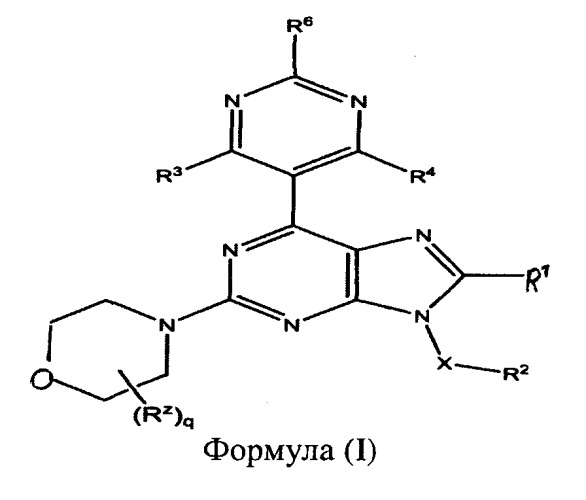
Показать всеИзобретение относится к соединениям пурина формулы (I):
где R1 выбран из группы, включающей Н, галоген и С1-С6алкил, R2 выбран из группы, включающей Н, CN, необязательно замещенный С1-С12алкил, необязательно замещенный С3-С12циклоалкил, необязательно замещенный С2-С12гетероциклоалкил, необязательно замещенный С6-С18арил, необязательно замещенный С1-С12алкилокси, COR8, COOH, COOR8, CONR8R9 и ацил, причем если R2 представляет собой необязательно замещенный С6-С18арил, указанный необязательный заместитель выбран из F и СН3, если R2 представляет собой необязательно замещенный С1-С12алкил, указанный необязательный заместитель выбран из СН3, ОСН3 и O-С(СН3)3, если R2 представляет собой необязательно замещенный С3-С12циклоалкил, указанный необязательный заместитель представляет собой СН3; если R2 представляет собой необязательно замещенный С2-С12гетероциклоалкил, указанный необязательный заместитель выбран из группы, состоящей из СООС(СН3)3, СО(СН2)2СН3, COPh и CO(5-метилтиофен-2-ил), R3 и R4 каждый независимо выбран из группы, включающей Н, С1-С6алкил и OR8, R6 выбран из группы, включающей Н, ОН, OR8, СН2ОН, NH2 и NR8R9, или R8 и R9, когда взяты вместе с атомами, к которым они присоединены, формируют циклическую группу, каждый R8 и R9 независимо выбран из группы, включающей Н и С1-С12алкил; каждый R2 независимо представляет собой C1-С6алкил, q представляет собой целое число, выбранное из группы, включающей 0 и 1, Х представляет собой группу формулы (CR10 2)m, каждый R10 независимо выбран из группы, включающей Н и C1-C6 алкил, m представляет собой целое число, выбранное из группы, включающей 0, 1, 2 и 3, причем С2-С12гетероциклоалкил содержит по меньшей мере один гетероатом, выбранный из группы, состоящей из О, N и S, в по меньшей мере одном кольце, причем каждое кольцо является от 3-х до 10-членным, или их фармацевтически приемлемые соли или N-оксиды. Соединения могут быть полезными в качестве лекарств для обработки множества пролиферативных заболеваний или нарушений, включая опухоли и раковые образования, так же как и других нарушений или заболеваний, связанных с PI3K и/или mTOR киназами. 5 н. и 26 з.п. ф-лы, 3 табл., 5 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к соединениям пурина, которые могут использоваться в качестве ингибиторов киназ. В частности, настоящее изобретение относится к 2-(морфолин-4-ил), 6-(пиримидин-5-ил) замещенным производным пурина, способам их получения, фармацевтическим композициям, включающим указанные соединения, и использованию указанных соединений при лечении некоторых заболеваний/физиологических состояний, связанных с киназами.
Уровень техники
Поиск ингибиторов киназ показал себя плодотворной областью для исследования полезных фармацевтически активных веществ. Киназы, которые также известны как фосфотрансферазы, являются ферментами, которые передают фосфорнокислые группы от высокоэнергетических молекул донора (например, АТФ) к определенным целевым молекулам (обычно называемым субстратами) в процессе, который называют фосфорилированием. Одна из наиболее больших групп киназ - протеинкиназы, которые действуют на и модифицируют активность определенных белков.
В результате указанной активности протеинкиназы вовлечены во многие клеточные процессы, такие как передача сигналов и подвержение клетки биохимическим реакциям в метаболизме. Определенные клеточные сигнальные процессы были определены как важные во многих заболеваниях, поэтому эффективное ингибирование определенных процессов передачи сигналов клетки обладает потенциалом для остановки развития указанных физиологических условий. Соответственно, киназы представляются привлекательными для лекарственных химиков, поскольку условия для ингибиторов киназы потенциально позволяют контролировать определенные сигнальные процессы, приводя таким образом к контролю определенных заболеваний.
Одно семейство киназ, связанных с нежелательными физиологическими условиями в организме, является семейством фосфатидилинозитол 3-киназ (PI3K), которые вовлечены в широкий диапазон клеточных событий, таких как миграция клеток, клеточная пролиферация, онкогенная трансформация, выживание клеток, сигнальная трансдукция и внутриклеточное перемещение белков. Указанное семейство киназ недавно было центром крупного исследования, направленного на развивающиеся методы лечения для ряда симптомов, таких как пролиферативные заболевания, например рак, иммунные и воспалительные заболевания, заболевания, вызываемые чрезмерной неоваскуляризацией и отторжением трансплантата.
Семейство фосфатидилинозитол 3-киназ (PI3K) - группа ферментов, которые производят фосфатидилинозитоловые ″вторичные мессенджеры″. Эти липиды впоследствии включаются в широкий диапазон физиологических процессов. В клетках млекопитающих большое семейство PI3K было разделено на три класса, называемые как I, II и III, у каждого из которых есть свои собственные особенности с точки зрения молекулярной структуры и субстрат-специфичности. Предпочтительным субстратом in vivo для класса I PI3K является фосфатидилинозитол-4,5 бифосфат, который фосфорилируется с получением фосфатидилинозитол-3,4,5 трифосфата. Далее класс I подразделен на классы IA и IB PI3K-киназ. Класс ферментов IA состоит из любой из ′каталитических′ субъединиц (р110 α, р110 β, или р110 δ), связанных в комплекс с любой из ′регулирующих′ субъединиц (р85 α, р85 β или р55 γ). Существует только один фермент класса IB PI3K, он состоит из р110 γ каталитической и р101 регуляторной субъединиц. Есть также три класса II PI3K-киназ (CII α, CII β, и CII γ) и один класс III PI3K-киназ (Vps34).
Класс I PI3K-киназ являются наиболее изученными членами семейства и являются ключевыми участниками множества внутриклеточных сигнальных путей, которые интегрируют множество сигналов, инициированных многими факторами роста. Ферменты IA класса активируются тирозинкиназами (например, рецепторами фактора роста), антиген-рецепторами и цитокиновыми рецепторами, в то время как класс ферментов IB активируется рецепторами, сопряженными с G-белками′ (GPCR рецепторы). В ответ на активацию PI3K-киназы генерируют липидные вторичные мессенджеры, которые связываются с и активизируют определенные белки в различных путях трансдукции сигнала. Пути трансдукции сигнала остаются активными до дефосфорилирования вторичных липидных мессенджеров PI3K ферментами фосфатаз, в частности онкоген-PTEN.
Сигнальный путь PI3K крайне важен для многих аспектов роста клеток и выживания через его регулирование широко расходящихся физиологических процессов, которые включают развитие клеточного цикла, дифференцирование, транскрипцию, трансляцию и апоптоз. Конститутивная активация пути PI3K вовлечена и в патогенез и в прогрессирование широкой разновидности раковых новообразований, и сейчас есть быстро накапливающиеся данные, которые окончательно демонстрируют, что передача сигналов PI3K часто дерегулирована при раковых заболеваниях. Считается, что дерегуляция передачи сигналов PI3K происходит двумя различными способами. Первым является увеличение передачи сигналов PI3K в результате активации генных мутаций, увеличения и сверхэкспрессии PI3K-киназ или обратных рецепторов, которые активизируют PI3K-киназы. Например, PI3K α каталитическая субъединица увеличена и сверхэкспрессируется при раке яичек и раке шейки матки. Точно так же обратные рецепторы тирозинкиназ, которые активизируют PI3K, обычно мутируют, возрастает их количество и сверхэкспрессируются, например, EGFR при раке груди, яичек или легких.
Кроме того, активация эффекторов, влияющих на PI3K, может также способствовать дерегуляции пути PI3K, например Akt/PKB (протеинкиназа В) сверхэкспрессирована и активирована при раке груди, раке поджелудочной железы и раке яичек. Кроме того, члены Ras-семейства, которые вовлечены в активацию PI3K, часто мутируют, например, при колоректальном раке и раке поджелудочной железы. Второй механизм разрегуляции PI3K включает потерю фосфатазы супрессора опухоли PTEN, которая происходит при многих агрессивных опухолях головного мозга, эндометриальном раке и раке молочной железы, а также при меланоме.
Одним из специфичных клеточных сигнальных путей, опосредованных семейством PI3K киназ, является путь фосфатидилинозитол 3-киназный (PI3K)/Akt путь. Этот путь критически вовлечен в опосредование продолжительности жизни клетки и является главным сигнальным компонентом, регулирующимся тирозинкиназами рецептора клеточного роста (RTK-киназы). RTK-киназы фактора клеточного роста активируют класс-IA PI3K, который является гетеродимером, состоящим из р85 регулирующей и р110 каталитической субъединиц. Малый GТРазный Ras-белок может также рекрутировать и активизировать PI3K через прямое связывание с р110. В клеточной мембране PI3K катализирует генерацию липидного вторичного мессенджера фосфатидилинозитол-3,4,5-трифосфата (РIP3). Впоследствии, PIP3 включает другие влияющие молекулы - в частности серин-треониновые киназы Akt и PDK1, посредством связывания с их плекстрин-гомологичными (РН) доменами. В мембране Akt частично активируется посредством фосфорилирования треонина в 308 положении в его петле активации PDK1. Дополнительное фосфорилирование по серину 473 в С-конце Akt приводит к ее полной активации. Akt в свою очередь регулирует широкий диапазон целевых белков, один из которых является относящейся к млекопитающему целью Рапамицина (известный как mTOR). Уровни PIP3 в клетке строго отрегулированы, и действие некоторых липидных фосфатаз быстро его уменьшает. Особенно интересна фосфатаза PTEN, которая преобразовывает PIP3 обратно в PIP2 и таким образом отключает передачу сигналов PI3K. Сигнальный путь PI3K-Akt регулирует множество нормальных клеточных процессов, включая клеточную пролиферацию, продолжительность жизни клеток, клеточный рост и подвижность - процессы, которые важны для образования опухолей.
Роль пути PI3K/Akt в онкогенезе была также экстенсивно исследована, и было установлено, что мутации или альтернативная экспрессия большинства компонентов указанного пути были широко вовлечены во многие раковые образования. Амплификация гена р110 происходит при некоторых случаях рака яичек человека, также увеличение Akt найдено при раке яичников, груди и раке ободочной кишки. Кроме того, активирование мутаций в р85 было обнаружено при раке яичников и раке ободочной кишки. Наиболее важный белок PTEN был идентифицирован как главный супрессор человеческих опухолей, и мутации потери функции в гене PTEN чрезвычайно распространены при спорадической глиобластоме, меланоме, раке простаты, эндометриальных карциномах, и значительный процент опухолей груди, рака легких и лимфомы также несут мутации PTEN. Таким образом, через множество механизмов, высокий процент человеческих раковых образований обладает активированной передачей сигналов PI3K. Значительно, что показана важная роль mTOR при онкогенной трансформации, вызванной PI3K и Akt.
В дополнение к основательным коррелятивным данным, представленным выше, прямое доказательство участия разрегулированной PI3K сигнализации при раке получено на генетических моделях мышей. Например, у мышей с конститутивно активизированной р85 регуляторной субъединицей PI3K развивается злокачественная лимфома, когда совпадает с р53-нокаутированными мышами. Также, ретровиральное введение Akt и Ras вызывало развитие глиобластом у мышей. Объединенные, все эти данные дают твердую проверку правильности для развития новых противораковых стратегий на PI3K-киназы. Действительно недавний интерес к ингибиторам PI3K, связанный со многими соединениями, развивающийся и теперь, продемонстрировал противоопухолевую активность на моделях животных. Наиболее передовые соединения теперь проходят клинические испытания фазы I. Соответственно соединения, которые являются ингибиторами PI3K, как ожидали бы, покажут интересную биологическую активность, поскольку у ингибиторов PI3K есть потенциал для блокировки PI3K/Akt сигнального пути и, таким образом, создания основы для терапии в заболеваниях, включающих разрегуляцию этого пути.
Кроме того, изоформы PI3k-киназ р110 δ и р110 γ регулируют различные аспекты иммунных и воспалительных ответов. Следовательно, есть большой интерес к роли передача сигналов PI3k-киназ в области иммунных и воспалительных заболеваний, так же как и в области отторжения трансплантатов.
Другая область, которая вызвала интерес, была область серин-треониновых протеинкиназ. Одной из серин-треониновых протеинкиназ, которая вызвала значительный интерес, является mTOR.
mTOR - серин-треониновая протеинкиназа с молекулярной массой 289 килодальтон, которая является PI3K-подобной киназой, связанная с митогенетическими стимулами и питательным статусом при клеточном росте и делении. mTOR была обнаружена во время исследований, проводимых для понимания механизма действия рапамицина. После входа в клетки рапамицин связывается с его внутриклеточной мишенью FKBP12, и затем образовавшийся комплекс связывается и специфично ингибирует mTOR. mTOR была поэтому также названа FKBP-RAP ассоциированный белок (FRAP), RAP FKBP12 (RAFT1) мишень и RAP мишень (RAPT1). Клетки, ответственные за отторжение органа, прекращают расти из-за способности рапамицина замедлять анаболические сигналы, скоординированные mTOR. Так как ингибирование роста клеток представляет собой эффективную цель для лечения рака, проектирование новых лекарств, которые ингибируют mTOR, потенциально будет иметь терапевтическое значение.
У человека mTOR опосредует анаболические сигналы из 2 источников, а именно питательные вещества, которые проходят в клетку, и активированные рецепторы фактора роста. mTOR существует по крайней мере в двух различных комплексных соединениях: рапамицин-чувствительное комплексное соединение, называемое как mTOR комплекс 1 (mTORC1), определяемый его взаимодействием со вспомогательным белковым ″раптором″ (регулирующий вспомогательный белок mTOR). Нормальная активация mTOR приводит к увеличению трансляции белка, потому что mTORC1 фосфорилирует и активизирует регуляторы трансляции: эукариотический инициирующий фактор 4Е-связывающий белок 1 и рибосомную р70 S6 киназу. Таким образом, ингибируя mTOR, рапамицин вызывает уменьшение фосфорилирования этих эффекторов и снижение синтеза белка, эффективно блокируя предростовые действия mTOR.
Второе комплексное соединение, mTOR комплекс 2 (mTORC2), является рапамицин-нечувствительным и определяется его взаимодействием с ″риктором″ (рапамицин-нечувствительный компаньон mTOR). mTORC2 вовлечен в регулирование киназы про-выживания Akt/PKB, фосфорилируя ее по положению S473. Вместе с фосфорилированием PDK1 по положению Т308 фосфорилирование S473 необходимо для полной активации Akt. Недавние исследования указывают, что пролонгированная обработка рапамицином в некоторых клетках также подавляет трансляцию и функцию TORC2 по ингибированию Akt и что это свойство рапамицина способствует антиапоптотическим эффектам препарата. mTOR - также один из главных даунстрим эффекторов пути фосфатидилинозитол 3-киназ (PI3K)/Akt, и поэтому ингибирование mTOR обеспечивает дальнейшую возможность ингибировать, по крайней мере частично, путь PI3K/Akt.
Дополнительный метаболический путь, на который влияет mTOR, который особенно важен при почечной клеточной карциноме, включает в себя гипоксия-индуцируемый фактор (HIF). Обычно, при заболевании фон Гиппеля-Линдау в чистых клетках рака почки можно наблюдать, что происходит накопление чувствительных к кислороду факторов транскрипции HIF-1 и HIF-2. Накопление этих факторов приводит к увеличенной стимуляции фактора роста эндотелия сосудов (VEGF), фактора роста тромбоцитов и трансформирующего фактора роста. Этот эффект увеличивается активацией mTOR, который стимулирует и функцию стабилизации белка и функцию трансляции белков и, таким образом, увеличивает активность HIF-1.
Также было установлено, что продукты гена туберозно-склерозного комплекса TSC1 и TSC2 функционируют вместе, ингибируя mTOR-зависимую передачу сигналов старения. Мутации этих генов происходят при туберозном склерозе, и потеря их функции представляет собой еще один путь, который приводит к увеличенной активности mTOR и увеличивает продуцирование VEGF. TSC2 также регулирует HIF. Таким образом, исследования, оценивающие воздействие TSC1 и TSC2 мутаций, демонстрируют связь увеличенного VEGF и активизированных mTOR путей, приводящих к регенерации тканей.
В настоящее время четыре mTOR ингибитора были проверены в клинических исследованиях: прототип рапамицина и три рапамицин производных, CCI-779 (темсирлимус), RAD001 (эверолимус) и АР23573. Рапамицин, который также называют сирлимус, является естественным антибиотиком, продуцированным Streptomyces hygroscopicus. Первоначально он был разработан как фунгицидный препарат, направленный против Candida albicans, Cryptococcus neoformans и Aspergillus fumigatus. Позже рапамицин был исследован как иммунодепрессивный агент, и эти исследования помогли в понимании механизма его действия. Как противораковое средство рапамицин показал способность ингибирования роста нескольких крысиных и человеческих линий раковых клеток с дозозависимым характером, а также в культурах ткани и в моделях ксенотрансплантата. Для шестидесяти линий опухолевых клеток, скринированных в Национальном Онкологическом институте США, общая чувствительность к препарату была замечена при дозах менее чем 2000 нанограммов/мл, наиболее достоверных в клеточных линиях опухоли при лейкемии, опухоли яичников, раке груди, раке центральной нервной системы и мелкоклеточном раке легкого. Кроме того, рапамицин ингибирует онкогенную трансформацию клеток человека, вызванную PI3K или Akt, и показывает ингибирование метастатического роста опухоли и антиангиогенные эффекты in vivo на моделях мыши.
Основанные на этих доклинических результатах были проведены клинические испытания рапамицина в качестве лекарства от рака, а также были разработаны аналоги рапамицина с более благоприятными фармацевтическими свойствами. CCI-779, более растворимое в воде эфирное производное рапамицина, было идентифицировано исследователями фармацевтической компании Вайет Айерст (Wyeth Ayerst) как нецитотоксический агент, который задерживал пролиферацию опухолевых клеток. В нетоксичных дозах CCI-779 сам продемонстрировал противоопухолевую активность или в комбинации с цитостатическими агентами во множестве моделей рака человека, таких как глиомы, рабдомиосаркома, примитивная нейроэктодермальная опухоль, такая как медуллобластома, линии клеток рака органов, расположенных в области головы и шеи, простаты, рака молочной железы и рака поджелудочной железы. Обработка мышей CCI-779 замедляет активность p70S6K и уменьшает неопластическую пролиферацию. Как с рапамицин, PTEN-дефицитные человеческие опухоли более чувствительны к CCI-779-зависимому ингибированию роста, чем PTEN-экспрессирующие клетки. В частности, исследования in vitro в группе восьми человеческих клеточных линий рака молочной железы показали, что шесть из восьми изученных линий рака ингибировались CCI-779 с IC50 в диапазоне ниже наномолярного. Две линии, однако, показали резистентность с IC50>1 мкМ. Восприимчивые клеточные линии были эстроген-рецептор положительными или сверхэкспрессирующими HER-2/Neu, или у них отсутствовал продукт гена супрессора опухоли PTEN. Основная токсичность CCI-779 включала дерматологическую токсичность и умеренную миелосупрессию (главным образом тромбоцитемию).
RAD001, 40-O-(2-гидроксиэтил)-рапамицин, является другим аналогом рапамицина, который можно принимать перорально. Его противоопухолевая активность была исследована в различных человеческих линиях раковых клеток in vitro и в моделях ксенотрансплантата in vivo с IC50 в пределах от 5-1800 нМ. В данной модели были показаны p70S6K ингибирование и противоопухолевые эффекты с оптимальным действием, достигнутым при приеме 2,5 мг/кг/день при меланоме, раке легких, раке поджелудочной железы и карциноме ободочной кишки. Точно так же RAD001 продемонстрировал зависимую от концентрации противоопухолевую активность в сингенной модели карциномы поджелудочной железы крысы с нерегулярным планом дозирования. RAD001 также показал антиангиогенную активность и ингибирование пролиферации эндотелиальных сосудистых клеток человека. Токсичность, о которой сообщают для RAD001, включает гиперхолестеринемию, гипертриглицеридемию, умеренную лейкоцитопению и тромбоцитопению. В исследованиях фазы I, выполненных на пациентах с развитым раком, RAD001 показал хороший профиль безопасности с умеренной токсичностью смягчения кожи и слизистой токсичностью до 30 мг еженедельно. Предварительные результаты эффективности показали объективный ответ у пациентов с немелкоклеточной карциномой легкого.
АР23573 - наиболее новый аналог рапамицина, о котором сообщают в клинических исследованиях. Это - содержащее фосфор соединение, синтезированное при помощи моделируемых вычислительных исследований. АР23573, как открыли, был устойчив в органических растворителях, водных растворах при множестве значений рН и в плазме и цельной крови, in vitro и in vivo и обладал сильным ингибированием разнообразных человеческих линий опухолевых клеток как in vitro так и в ксенотрансплантатах, внедренных в чистых мышей, один или в комбинации с цитостатическими или целенаправленными агентами. В клинических исследованиях фазы I AP23573 назначали внутривенно ежедневно в течение 5 дней каждые 2 недели. Дозолимитируемая токсичность - 3 ротовых мукозита серьезной степени, случившиеся во время первого цикла. Другие побочные эффекты более мягки, включая меньшинство более мягких случаем мукозита, усталость, тошноту, сыпь, анемию, нейтрофилопению, диарею, гиперлипидемию и тромбоцитопению. Предварительная противоопухолевая активность наблюдалась при всех значениях доз.
Таким образом существует множество исследований, которые демонстрируют, что mTOR ингибиторы могут улучшить выживание больного раком. Однако рапамицин и его аналоги не показали универсальную противоопухолевую активность в ранних клинических исследованиях. Ответы на лечение варьируются среди различных типов рака от низкого, от меньше чем 10% у пациентов с глиобластомами и поздней стадии рака клеток почки, до высокого, приблизительно для 40% у пациентов с лимфомой из клеток мантийной зоны. Знание статуса PTEN и PI3K/Akt/mTOR-связанного метаболического пути могло бы помочь при выборе типов опухоли, которые ответят на mTOR ингибиторы. Кроме того, вследствие того что много типов опухоли до сих пор не отвечают на терапию только рапамицин производными, важно продолжить поиск факторов, предсказывающих устойчивость или чувствительность к mTOR ингибиторам. Особенно интересными будут молекулы, которые непосредственно ингибируют активность mTOR киназы, предполагается, что такие молекулы будут ингибировать и mTORC1 и mTORC2. Такой ингибитор мог бы быть полезным для лечения опухолей с увеличенным фосфорилированием Akt и мог бы уменьшать рост, пролиферацию и эффекты выживания, которые связаны с активацией Akt. Если mTOR-риктор - главный активатор Akt-зависимых процессов выживания клеток, такой препарат мог бы запустить апоптоз в опухолевых клетках, которые адаптированы к Akt-зависимым регулирующим механизмам.
Кроме того, mTOR ингибиторы показали высокую эффективность при профилактике резекции органов после трансплантации посредством воздействия на иммунные реакции, демонстрируя потенциал для обработки аутоиммунных и воспалительных заболеваний наравне с раком.
Принимая во внимание роль изоформ РВК-киназы в качестве ключевых компонентов нисходящих сигнальных путей ангиогенных факторов роста, таких как VEGF, FGF и PDGF, так же как и ангиогенных цитокинов, и принимая во нимание роль mTOR в регулировании сосудистого эндотелиального фактора роста (VEGF), PI3K-киназные и mTOR ингибиторы обладают потенциалом для лечения заболеваний, обусловленных патологической неоваскуляризацией. Это происходит во время опухолегенеза, воспалительных состояниях, таких как ревматоидный артрит и глазные неоваскулярные заболевания, например возрастная макулярная дегенерация (AMD), ретинальные сосудистые заболевания (окклюзия вен и диабетическая ретинопатия) и другие всевозможные пролиферативные сосудистые нарушения.
mTOR и PI3K были идентифицированы как протеинкиназы, которые вовлечены во многие нарушения, и соединения, которые направлены на одну или несколько этих киназ, должны показать полезную биологическую активность. Соответственно, соединения, которые являются mTOR и/или PI3K ингибиторами, есть потенциал для разработки на их основе биологически активных соединений, которые, как ожидается, будут иметь улучшенные полезные фармацевтические свойства при лечении пролиферативных заболеваний, таких как рак, иммунные и воспалительные заболевания, заболевания, вызванные чрезмерной неоваскуляризацией, и отторжение трансплантата органа.
Составы, которые ингибируют и mTOR и PI3K одновременно, как ожидается, обеспечат сильный антипролиферативный, ангиогенный и противоопухолевый эффекты, так как эти соединения действуют сразу на нескольких этапах PI3K/Akt/mTOR метаболического пути. Несколько ингибиторов этого типа в настоящее время исследуются в клинических условиях впервые (например, BEZ235, XL765, GDC0941, РХ866, SF1126).
Раскрытие изобретения
Существующее изобретение предусматривает пиримидинзамещенные производные пурина формулы (I):
где:
R1 выбран из группы, включающей: Н, галоген или необязательно замещенный C1-C6 алкил;
R2 выбран из группы, включающей Н, галоген, OH, NO2, CN, NH2, необязательно замещенный С1-С12 алкил, необязательно замещенный C2-C12 алкенил, необязательно замещенный C2-C12 алкинил, необязательно замещенный C2-C12 гетероалкил, необязательно замещенный С3-С12 циклоалкил, необязательно замещенный С3-С12 циклоалкенил, необязательно замещенный C2-C12 гетероциклоалкил, необязательно замещенный C2-C12 гетероциклоалкенил, необязательно замещенный C6-C18 арил, необязательно замещенный С1-С18 гетероарил, необязательно замещенный С1-С12 алкилокси, необязательно замещенный C2-C12 алкенилокси, необязательно замещенный C2-C12 алкинилокси, необязательно замещенный С2-С10 гетероалкилокси, необязательно замещенный С3-С12 циклоалкилокси, необязательно замещенный С3-С12 циклоалкенилокси, необязательно замещенный C2-C12 гетероциклоалкилокси, необязательно замещенный C2-C12 гетероциклоалкенилокси, необязательно замещенный C6-C18 арилокси, необязательно замещенный C1-C18 гетероарилокси, необязательно замещенный С1-С12алкиламино, SR8, SO3H, SO2NR8R9, SO2R8, SONR8R9, SOR8, COR8, COOH, COOR8, CONR8R9, NR8COR9, NR8COOR9, NR8SO2R9, NR8CONR8R9, NR8R9 или арил;
R3 и R4 каждый независимо выбраны из группы, включающей Н, F, Cl, Br, OH, необязательно замещенный С1-С6алкил, OR8, OCOR8, CH2OH, NH2, NR8R9, NR8COR9 и NR8SO2R9;
R6 выбран из группы, включающей Н, OH, OR8, O P g O , OCOR8, CH2OH, NH2, NR8R9, N R 8 P g N , N ( P g N ) 2 , NR8COR9 и NR8SO2R9;
каждый R8 и R9 независимо выбраны из группы, включающей Н, необязательно замещенный С1-С12 алкил, необязательно замещенный C2-C12 алкенил, необязательно замещенный C2-C12 алкинил, необязательно замещенный C2-C10 гетероалкил, необязательно замещенный С3-С12 циклоалкил, необязательно замещенный С3-С12 циклоалкенил, необязательно замещенный C2-C12 гетероциклоалкил, необязательно замещенный C2-C12 гетероциклоалкенил, необязательно замещенный C6-C18 арил и необязательно замещенный С1-С18 гетероарил; или
R8 и R9, когда взяты вместе с атомами, к которым они присоединены, формируют необязательно замещенную циклическую часть;
P g O представляет собой защитную группу для кислорода;
каждый P g N представляет собой независимо защитную группу для азота;
каждый Rz независимо выбран из группы, включающей C1-C6 алкил, гало-C1-C6 алкил, гидрокси-C1-C6 алкил, C1-C6 алкилокси C1-C6 алкил, циано C1-C6 алкил, аминоС1-C6алкил, С1-C6алкиламиноС1-С6алкил, и ди(С1-C6алкил)aминoC1-C6алкил;
q представляет собой целое число, выбранное из группы, включающей 0, 1, 2, 3 и 4;
X представляет собой группу формулы (CR10 2)m;
каждый R10 независимо выбран из группы, включающей: Н и необязательно замещенный C1-С6 алкил;
m является целым числом, выбранным из группы, включающей 0, 1, 2, 3 и 4;
или их фармацевтически приемлемую соль, N-оксид или пролекарство.
Как с любой группой структурно связанных соединений, которые обладают специфической полезностью, некоторые воплощения вариантов соединений Формулы (I) особенно полезны в их практическом применении по настоящему изобретению.
В различных воплощениях q представляет собой целое число, выбранное из группы, включающей 0, 1, 2, 3 и 4. В некоторых воплощениях q равно 4. В некоторых воплощениях q равно 3. В некоторых воплощениях q равно 2. В некоторых воплощениях q равно 1. В некоторых воплощениях q равно 0.
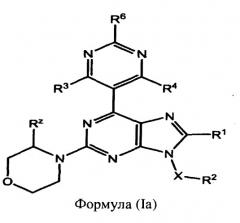
В некоторых воплощениях, где q отлично от 0, каждый Rz может быть выбран из группы, включающей F, Cl, Br, метил, трифторометил и этил. Rz заместитель может быть присоединен в 2, 3, 5 или 6 положении морфолинового кольца и при условиях, когда есть множественные Rz заместители, каждый Rz заместитель находится независимо от других таким образом, чтобы где есть многократные Rz заместители, тогда два из Rz заместителей могли быть расположены на том же самом углероде на морфолиновом кольце, или каждый заместитель может находиться на различных атомах углерода.
В некоторых воплощениях q равно 1, и Rz заместитель находится в 3 положении морфолинового кольца. Это предусматривают соединения формулы (Ia):
или их фармацевтически приемлемая соль или пролекарство;
где R1, R2, R3, R4, R6, Rz и Х определены выше.
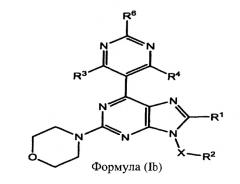
В некоторых воплощениях соединений изобретения q равно 0. Это предусматривают соединения формулы (Ib):
или их фармацевтически приемлемые соли или пролекарства;
где R1, R2, R3, R4, R6 и Х определены выше.
В некоторых воплощениях R3 выбран из группы, включающей Н, OR8 и необязательно замещенный C1-С6 алкил.
В некоторых воплощениях R3 представляет собой OR8, где R8 представляет необязательно замещенный C1-С6 алкил. Примеры групп R3 этого типа включают метокси, трифторометокси, этокси, изопропокси, пропокси или бутокси. В некоторых воплощениях R3 представляет собой метокси.
В некоторых воплощениях R3 представляет собой необязательно замещенный C1-С6алкил. Примеры групп R3 этого типа включают метил, трифторометил, этил, пропил, изопропил или бутил. В некоторых воплощениях R3 представляет собой метил.
В некоторых воплощениях R3 выбран из группы, включающей Н, метокси или метил. В некоторых воплощениях R3 представляет собой Н.
В некоторых воплощениях R4 выбран из группы, включающей Н, F, Cl, Br, ОН и NH2. В некоторых воплощениях R4 представляет собой Н.
В некоторых воплощениях соединений, в особенности соединений формулы (I), (Ia) и (Ib), R3 и R4 оба представляют собой Н.
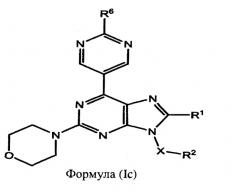
В некоторых воплощениях изобретения q равно 0, R3 представляет собой Н, и R4 представляет собой Н. Это предусматривают соединения формулы (Ic):
или их фармацевтически приемлемые соли или пролекарства;
где R1, R2, R6 и Х, как определено выше.
В некоторых воплощениях соединений, содержащих группу R8, R8 выбран из Н или C1-С6алкил. В некоторых воплощениях R8 представляет собой метил. В некоторых воплощениях R8 представляет собой Н.
В некоторых воплощениях соединений, содержащих группу R9, R9 выбран из Н или C1-С6алкил. В некоторых воплощениях R9 представляет собой метил. В некоторых воплощениях R9 представляет собой Н.
Как заявлено выше, Х представляет собой группу формулы (CR10 2)m. В некоторых воплощениях соединений формулы (I), (Ia), (Ib) и (Ic) m выбрано из группы, включающей 0, 1 и 2. В некоторых воплощениях m представляет собой 0 или 1. В некоторых воплощениях m представляет собой 0. В некоторых воплощениях m представляет собой 1.
В некоторых воплощениях q равно 0, R3 представляет собой Н, R4 представляет собой Н, и m представляет собой 0. Это предусматривают соединения формулы (II):
или их фармацевтически приемлемые соли или пролекарства;
где R1, R2 и R6, как определено выше.
В некоторых воплощениях q равно 0, R3 представляет собой Н, R4 представляет собой Н, и m представляет собой 1. Это предусматривают соединения формулы (III):
или их фармацевтически приемлемые соли или пролекарства;
где R1, R2, R6 и R10, как определено выше.
В некоторых воплощениях соединений формулы (I), (Ia), (Ib), (Ic) и (III) каждый R10 представляет собой Н. В других воплощениях каждый R10 независимо представляет собой необязательно замещенный C1-С6алкил. В некоторых воплощениях один R10 представляет собой Н и другой СН3. В некоторых воплощениях один R10 представляет собой Н, и другой R10 представляет собой Н или необязательно замещенный C1-С6алкил.
В некоторых воплощениях соединений формулы (I), (Ia), (Ib), (Ic) и (III) m представляет собой 1, один R10 представляет собой Н, и Х представляет собой группу формулы:
В некоторых воплощениях изобретения R3 и R4 представляют собой Н, m представляет собой 1, q равно 0, и один R10 представляет собой Н. Это предусматривают соединения формулы (IV):
или их фармацевтически приемлемые соли или пролекарства,
где R1, R2, R6 и R10, как определено выше.
В некоторых воплощениях соединений, содержащих R10, в особенности соединений формулы (I), (Ia), (Ib), (Ic), (III) и (IV), R10 выбран из группы, включающей Н, C1-С6галоалкил, C1-С6гидроксиалкил и C1-С6алкил. В некоторых воплощениях R10 выбран из группы, включающей метил, этил, пропил, изопропил и бутил. В некоторых воплощениях R10 выбран из группы, включающей Н, метил и этил.
В некоторых воплощениях соединений изобретения, в особенности соединений формулы (I), (Ia), (Ib), (Ic), (II), (III) и (IV), R1 выбран из группы, включающей Н, Br, метил, этил, изопропил, пропил, 3,3-пропил-этан, бутил, изобутил, 3,3-бутил-этан, 2-бутил-этил, пентил и гексил. В некоторых воплощениях R1 выбран из группы, включающей Н, метил и этил. В некоторых воплощениях R1 представляет собой Н. В некоторых воплощениях R1 представляет собой метил. В некоторых воплощениях R1 представляет собой этил. В некоторых воплощениях R1 представляет собой Br.
В некоторых воплощениях соединений изобретения, в особенности соединений формулы (I), (Ia), (Ib), (Ic), (II), (III) и (IV), R6 выбран из группы, включающей Н, NH2 и NR8R9, где R8 и R9, как определено выше. В некоторых воплощениях R6 представляет собой NH2.
В некоторых воплощениях соединений изобретения, в особенности соединений (I), (Ia), (Ib), (Ic), (II), (III) и (IV), R2 выбран из группы, включающей Н, циано, необязательно замещенный С1-С12алкил, необязательно замещенный С2-С12 алкенил, необязательно замещенный С2-С12гетероалкил, необязательно замещенный С3-С12 циклоалкил, необязательно замещенный С2-С12гетероциклоалкил, необязательно замещенный С6-С18арил и необязательно замещенный С1-С18гетероарил.
В некоторых воплощениях R2 представляет собой необязательно замещенный С6-С18арил. В некоторых воплощениях R2 представляет собой необязательно замещенный С6-С18 арил, представляет собой группу формулы:
где р представляет собой целое число, выбранное из группы, включающей 0, 1, 2, 3, 4 и 5;
каждый R13 независимо выбран из группы, включающей Н, галоген, ОН, NO2, CN, NH2, необязательно замещенный С1-С12алкил, необязательно замещенный С2-С12алкенил, необязательно замещенный С2-С12алкинил, необязательно замещенный C2-C1гетероалкил, необязательно замещенный С3-С12циклоалкил, необязательно замещенный С2-С12 гетероциклоалкил, необязательно замещенный С2-С12гетероциклоалкенил, необязательно замещенный С6-С18арил, необязательно замещенный С1-С18гетероарил, необязательно замещенный С1-С12алкилокси, необязательно замещенный С2-С12алкенилокси, необязательно замещенный С2-С12алкинилокси, необязательно замещенный С2-С10гетероалкилокси, необязательно замещенный