Композиция, на основе гидрофобных агентов и способ ее получения(варианты)
Иллюстрации
Показать всеПредложены: композиция для лечения рака, включающая (а) конъюгат, содержащий (i) полипетидный вектор, содержащий аминокислотную последовательность, имеющую по меньшей мере 70%-ную идентичность по отношению к AngioPep-2 (SEQ ID NO: 97); и (ii) паклитаксел или аналог паклитаксела, конъюгированные с указанным полипетидом; (б) необязательный агент, регулирующий тоничность; (в) буферный агент; (г) наполнитель; (д) полиоксиэтиленовый эфир жирной кислоты; и (е) 0,01-8% DMSO (варианты), способы ее получения (варианты), способ лечения рака, контейнер, содержащий указанную композицию и набор, включающий контейнер с данной композицией. Изобретение отличается тем, что заявленные конъюгаты (например, ANG 1005), могут пересекать гемато-энцефалический барьер, характеризоваться повышенным поглощением клетками, на которые они нацелены, проявлять повышенную стабильность или в меньшей степени удаляться из клетки, а композиции на их основе могут растворяться в водном растворе, отличаются стабильностью с минимальным разложением при температурах между 40°C и 50°C. 10 н. и 43 з.п. ф-лы, 3 ил., 28 табл.
Реферат
Предпосылки создания изобретения
Данное изобретение относится к составам на основе паклитаксела и аналогов паклитаксела или их конъюгатов, а также других гидрофобных агентов.
Из-за нерастворимости в водном растворе гидрофобные агенты, такие как паклитаксел и аналоги паклитаксела, обычно или солюбилизируются в неводных буферах или в буферах с поверхностно-активными веществами или присоединяются к гидрофильным фрагментам для повышения растворимости в водном растворе до введения пациенту. Паклитаксел выпускается в продажу в виде состава, в котором каждый миллилитр содержит 6 мг паклитаксела, 527 мг очищенного Cremophor®′ a EL (полиоксиэтилированного касторового масла) и 49,7% (об/об) дегидратированного спирта, USP, и этанола. Перед введением состав на основе паклитаксела разбавляют смесью хлорид натрия / декстроза или декстрозой в растворе Рингера. Так как Cremophor® может вызывать гиперчувствительность (например, анафилактические реакции), пациентам, принимающим паклитаксел, предварительно вводят дексаметазон для уменьшения возникновения этих реакций. Из-за этих реакций паклитаксел вводят через 4 ч для того, чтобы свести к минимуму гиперчувствительность пациентов.
Из-за высокой вероятности возникновения побочных эффектов вследствие наличия Cremophor′a в стандартных составах на основе паклитаксела были разработаны альтернативные композиции. Abraxane представляет собой состав на основе паклитаксела, в котором паклитаксел связан с альбумином. Были также предложены липосомальные составы на основе паклитаксела.
Поскольку существующие составы на основе гидрофобных агентов, таких как паклитаксел, или содержат нежелательные эксципиенты, или их трудно изготавливать, существует необходимость в создании новых составов на основе этих агентов.
Сущность изобретения
Согласно первому аспекту данное изобретение относится к композиции, содержащей (a) гидрофобный агент, паклитаксел, аналог паклитаксела или конъюгат (например, ANG 1005), включающий (i) полипептидный вектор; и (ii) терапевтический агент, выбранный из группы, состоящей из паклитаксела и аналога паклитаксела, при этом терапевтический агент сопряжен с полипептидом, или другой гидрофобный агент, описанный в данной заявке; (b) необязательный агент, регулирующий тоничность (например, хлорид натрия или любой агент тоничности, описанный в данной заявке); (c) буферный агент (например, глицин, молочную кислоту или лимонную кислоту, или любой буферный агент, описанный в данной заявке); (d) наполнитель (например, маннит, сорбит или любой наполнитель, описанный в данной заявке); и (e) солюбилизирующий агент (например, полиоксиэтиленовый эфир жирной кислоты, такой как описанный в данной заявке Solutol HS 15, или любой солюбилизирующий агент, описанный в данной заявке), например, когда солюбилизирующим агентом не является Cremophor. Полипептидный вектор может включать аминокислотную последовательность, по существу идентичную (например, по меньшей мере, на 70%, 80%, 90%, 95% или 100% идентичную) аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NOS: 1-105 и 107-116 (например, AngioPep-1 (SEQ ID NO: 67); AngioPep-2 (SEQ ID NO: 97) или AngioPep- (SEQ ID NO: 112)). Согласно некоторым вариантам буферный агент поддерживает раствор при pH менее 6 (например, при pH равном 4-6).
Согласно некоторым вариантам композиция также включает 0,01-10% (например, Менее чем 8%, 6%, 5%, 4%, 3%, 2%, 1%, 0,75%, 0,5%, 0,2% или 0,1%) DMSO. Согласно некоторым вариантам композиция по существу не содержит Cremophor (то есть в ней нет Cremophor). Композиция может быть растворена в воде.
Согласно некоторым вариантам композиция включает агенты в количествах, указанных в любой из Таблиц 1-4.
| Таблица 1 | |
| Соединение | Процентное сод. (по весу без воды) |
| ANG 1005 | 0,1-5% |
| Агент тоничности | 0-15% |
| Буферный агент | 1-10% |
| Наполнитель | 0-15% |
| Solutol HS 15 | 40-75% |
| DMSO | 0,01-10% |
| Таблица 2 | |
| Соединение | Процентное сод. (по весу без воды) |
| ANG 1005 | 1,8-2,3% |
| Агент тоничности | 9-11% |
| Буфер | 4,5-6% |
| Наполнитель | 8-10% |
| Solutol HS 15 | 69-75% |
| DMSO | 0,2-1% |
| Таблица 3 | |
| Соединение | Процентное сод. (по весу без воды) |
| ANG 1005 | 1,8-4,0% |
| Буфер | 0,1-6% |
| Наполнитель | 2-10% |
| Solutol HS 15 | 80-95% |
| DMSO | 0,2-1% |
| Таблица 4 | |
| Соединение | Процентное сод. (по весу без воды) |
| ANG 1005 | 2,0-3,0% |
| Буфер | 0,5-6% |
| Наполнитель | 4-7% |
| Solutol HS 15 | 85-95% |
| DMSO | 0,2-0,6% |
В этих композициях агент, регулирующий тоничность, если он содержится, может представлять собой хлорид натрия, буферный агент может быть глицином, молочной кислотой или лимонной кислотой и/или наполнитель может быть маннитом. Композиция может содержать примерно 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1,0%, 1,1%, 1,2%, 1,3%, 1.4%, 1,5%, 1,6%, 1,7%, 1,8%, 1,9%, 2,0%, 2,1%, 2,2%, 2,3%, 2,4%, 2,5%, 2,6%, 2,7%, 2,8%, 3,0%, 3,2%, 3,5%, 4,0% или 5,0% ANG 1005, или любой интервал между этими величинами. ANG 1005 может быть растворен в достаточном количестве Solutol′a HS 15 и/или DMSO, и этот состав может быть далее растворен в водном растворе.
Описанные выше композиции могут находиться в контейнере, который может быть герметичным. Контейнер может быть частью набора, который включает также инструкции по применению (например, при введении композиции для лечения любой болезни из числа описанных в данной заявке).
Согласно другому аспекту данное изобретение предусматривает способ введения композиции согласно аспектам, описанным выше, пациентам, страдающим от болезни, например, любой болезни, описанной в данной заявке, такой как рак (например, рак яичника, мозга, легкого, печени, селезенки или почки).
Способ включает введение пациенту композиции в количестве, которое достаточно для лечения или профилактики болезни.
Согласно некоторым вариантам рак представляет собой рак мозга, выбранный из группы, состоящей из глиобластомы, астроцитомы, глиомы, медулобластомы и олигодендромы, нейроглиомы, эпендимомы и менингиомы.
Согласно другому аспекту данное изобретение предусматривает способ приготовления фармацевтической композиции. Этот способ включает (а) растворение гидрофобного агента в первом солюбилизирующем агенте (например, DMSO или любом таком агенте, описанном в данной заявке) с образованием смеси; (б) добавление второго солюбилизирующего агента (например, полиоксиэтиленового эфира жирной кислоты, такого как Solutol HS 15, или любого солюбилизирующего агента, описанного в данной заявке) к смеси со стадии (а); (в) возможное добавление воды и буферного агента к этой смеси; (г) лиофилизацию смеси со стадии (в); при этом лиофилизация приводит к уменьшению по меньшей мере на 5% (например, на 10%, 20%, 30%, 50%, 75%, 90%, 95% или 99%) количества первого солюбилизируюшего агента (например, до конечного содержания менее, чем 0,2%, 0,4%, 0,6%, 0,8%, 1,0%, 1,5%, 2%, 3%, 4%, 5%, 8% от общего веса лиофилизированного продукта).
Согласно некоторым вариантам лиофилизация недостаточно снижает количество второго солюбилизирующего агента.
Согласно некоторым вариантам гидрофобный агент включает паклитаксел или аналог паклитаксела. Гидрофобный агент может включать или может представлять собой конъюгат, включающий (а) полипептидный вектор и (б) агент, описанный в данной заявке (например, паклитаксел и его аналоги), при этом этот агент сопряжен с вектором.
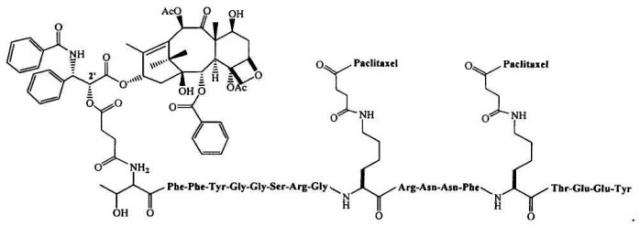
Полипептидный вектор может включать аминокислотную последовательность, по существу идентичную аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NOS: 1-105 и 107-116 (например, AngioPep-1 (SEQ ID NO: 67); AngioPep-2 (SEQ ID NO: 97) или AngioPep-7 (SEQ ID NO: 112)). Согласно конкретным вариантам конъюгат представляет собой ANG 1005. Согласно некоторым вариантам вода и буферный агент добавляются на стадии (в) и стадия (г) лиофилизации включает (i) замораживание смеси; (ii) сушку замороженного продукта при первой температуре и давлении, достаточных для удаления части (например, по меньшей мере 50%, 60%, 70%, 80%, 90%, 95%, 99%, 99,5%, 99,9% или 99,99%) воды; и (iii) сушку продукта при второй температуре и давлении, достаточных для удаления по меньшей мере части (например, 10%, 20%, 30%, 50%, 75%, 90%, 95% или 99%) первого растворителя.
Смесь со стадии (б) можно отфильтровать перед осуществлением стадии лиофилизации (в) или она может быть помещена в сосуд или контейнер перед осуществлением стадии лиофилизации (в). Способ может также включать ресуспендирование лиофилизированного продукта со стадии (в).
Согласно другому аспекту данное изобретение предусматривает способ получения фармацевтической композиции, включающий стадии: (а) растворения в DMSO конъюгата, включающего паклитаксел или аналог паклитаксела, сопряженного с полипептидным вектором, с образованием при этом смеси; (б) добавления к этой смеси Solutol′a HS 15; (в) добавления к смеси воды, буферного агента и необязательно соли или наполнителя; и (г) лиофилизации смеси при условиях, которые приводят к удалению воды и DMSO из смеси. Solutol HS 15 может быть смешан с водой, буферным агентом и, возможно, с агентом, регулирующим тоничность, или наполнителем до добавления к смеси, при этом вода, буферный агент и, возможно, агент, регулирующий тоничность, добавляются в количестве, которое поддерживает растворимость конъюгата в смеси. Буферный агент может поддерживать рН раствора равным величине, находящейся между 4 и 6. DMSO может быть подкислен до рН между 3,5 и 4,5 до проведения стадии растворения (а). Согласно некоторым вариантам лиофилизация не приводит к существенному снижению количества Solutol′a HS 15 в смеси. Конъюгат может включать любой из полипептидов (например, AngioPep-2), описанный в данной заявке. Согласно конкретным вариантам конъюгат политаксел - полипептид представляет собой ANG 1005.
Согласно другому аспекту настоящее изобретение охватывает фармацевтическую композицию, полученную любым из методов, описанных в данной заявке.
Под "буферным агентом" подразумевают любое соединение или группу соединений, способных поддерживать величину рН (например, любую величину из 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10,0, 10,5, 11,0, 11,5, 12,0, 12,5, 13,0 и 13,5) раствора в конкретном интервале после добавления агентов, которые могут изменять величину рН. Примеры буферных агентов описаны в данной заявке.
Под "агентом, регулирующим тоничность" подразумевают любой агент, который меняет осмолярность водного раствора (например, до любой величины в любом интервале между 10, 20, 50, 75, 100, 150, 200, 250, 300, 400, 500, 750, 1000, 1500 или 2000 мМ). Дополнительные агенты, регулирующие тоничность, описаны в данной заявке.
Под "наполнителем" подразумевают соединение, которое изменяет физическую форму химической композиции после дегидратации или стадии лиофилизации. Примеры наполнителей также описаны в данной заявке.
Под "солюбилизирующим агентом" подразумевают любой растворитель, способный растворять конкретное соединение (например, гидрофобное соединение, такое как соединение или конъюгат, содержащие паклитаксел или аналог паклитаксела). Примеры таких солюбилизирующих агентов также описаны в данной заявке.
Под "вектором" подразумевают соединение или молекулу, такую как полипептид, которые могут быть транспортированы в клетку конкретного типа (например, в печени, легких, почке, селезенке или мышце) или через ВВВ. Вектор может быть присоединен к агенту (ковалентно или нет) или сопряжен с агентом и, следовательно, может быть способен транспортировать этот агент в клетку конкретного типа или через ВВВ. Согласно некоторым вариантам вектор может быть связан с рецепторами, находящимися в раковых клетках или эндотелиальных клетках мозга и, следовательно, могут транспортироваться в раковые клетки или через ВВВ путем трансцитоза. Вектор может представлять собой молекулу, для которой могут быть достигнуты высокие уровни трансэндотелиального транспорта без влияния на целостность клеток или ВВВ. Вектор может быть полипептидом или пептидомиметиком и может быть природного происхождения или может быть получен методом химического синтеза, или при помощи рекомбинантной генетической технологии.
Под "конъюгатом" подразумевают вектор, связанный с агентом. Сопряжение может быть по природе химическим, например, с применением линкера, или может быть по природе генетическим, например, с использованием рекомбинантной генетической технологии, например, в белке слияния с, например, молекулой репортера (например, зеленого флуоресцентного белка, β-галактозидазы, Histag и т.д.).
Под вектором или конъюгатом, который "эффективно транспортирован в клетку конкретного типа" подразумевают вектор или конъюгат, который способен аккумулироваться (или благодаря увеличенному транспорту в клетку, уменьшенному выходу из клетки или их комбинации) в клетке такого типа по меньшей мере на 10% (например, на 25%, 50%, 100%, 200%, 500%, 1000%, 5000% или 10000%) больше, чем или в контрольном веществе, или, в случае конъюгата, по сравнению с несопряженным агентом.
Под "по существу чистым" или "выделенным" подразумевают соединение (например, полипептид или конъюгат), которое было отделено от других химических компонентов. Обычно соединение считается по существу чистым, когда оно, по меньшей мере на 30% по весу свободно от других компонентов. Согласно некоторым вариантам препарат по меньшей мере на 50%, 60%, 75%, 85%, 90%, 95%, 96%, 97%, 98% или 99% по весу свободен от других компонентов. Очищенный полипептид может быть получен, например, путем экспрессии рекомбинантного полипептида, кодирующего такой полипептид, или путем химического синтеза полипептида. Степень чистоты можно измерить соответствующим методом, например, методом хроматографии на колонке, методом электрофореза на полиакриламидном геле или методом HPLC.
Фармацевтическая композиция, которая "по существу свободна" от вещества является композицией, в которой количество вещества меньше, чем 5%, 4%, 3%, 2%, 1%, 0,5%, 0,3%, 0,2%, 0,1%, 0,05% или 0,01% от веса сухой композиции.
Под "по существу идентичным" подразумевают полипептид или нуклеиновую кислоту, характеризующуюся, по меньшей мере, 35%, 40%, 50%, 55%, 60%, 65%, 70%, 75%, 85%, 90%, 95% или даже 99% идентичности по отношению к последовательности аминокислоты или нуклеиновой кислоты. Для полипептидов длина последовательностей сравнения обычно составляет, по меньшей мере, 4 (например, по меньшей мере, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 50 или 100) аминокислот. Для нуклеиновых кислот длина последовательностей сравнения обычно составляет, по меньшей мере, 60 нуклеотидов, предпочтительно, по меньшей мере, 90 нуклеотидов и более предпочтительно 120 нуклеотидов или полную длину. Следует иметь в виду, что между аминокислотами аналогов, которые идентичны или сходны с аминокислотами первоначального полипетида, могут быть гэпы. Гэпы могут не содержать аминокислот, могут включать одну или более аминокислот, которые не являются идентичными или сходными с первоначальным полипептидом. Биологически активные аналоги векторов (полипептидов) по изобретению также охвачены данным изобретением. Процентное содержание идентичности может быть определено, например, при помощи n алгоритмов GAP, BESTFIT или FASTA в Wisconsin Genetics Software Package Release 7.0, с применением весов гэпов по умолчанию.
Под "фрагментом" подразумевают полипептид, происходящий из части первоначальной или родительской последовательности или из аналога указанной или родительской последовательности. Фрагменты охватывают полипептиды, содержащие усеченные части одной или более аминокислот, причем усечение может происходить из аминоконца (N-конца), карбоксильного конца (С-конца) или из внутренней части белка. Фрагмент может включать ту же самую последовательность, что и соответствующая часть первоначальной последовательности. Функциональные фрагменты вектора (полипептида), описанные в данном описании, также охватываются данным изобретением. Фрагменты могут представлять собой по меньшей мере 5 (например, по меньшей мере 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 25, 28, 30, 35, 40, 45, 50, 60, 75, 100 или 150) аминокислот. Согласно изобретению фрагменты могут включать, например, полипептид из 7, 8, 9 или 10 аминокислот. Фрагменты могут содержать любую из модификаций, описанных в данном описании, (например, замещенные аминокислоты, полученные ацетилированием, амидированием).
Под "аминокислотой неприродного происхождения" подразумевают аминокислоту, которая не получена в природе или обнаружена у млекопитающего.
Под "агентом" подразумевают соединение, например, антитело или терапевтический агент, маркер, трейсер или соединение, дающее возможность получить изображение.
Под "терапевтическим агентом" подразумевают агент, обладающий биологической активностью. В некоторых случаях терапевтический агент применяют для лечения симптомов болезни, физического или умственного состояния, травмы, инфекции, он включает противораковые агенты, антибиотики, антиангиогенные агенты и молекулы, которые проявляют активность в отношении центральной нервной системы.
Под "лекарством с малой молекулой" подразумевают лекарство, имеющее молекулярный вес равный 1000 г/мол или менее (например, менее, чем 800, 600, 500, 400 или 200 г/мол).
Под "субъектом" подразумевают человека или животное (например, млекопитающее).
Под "лечением" болезни, расстройства или состояния у субъекта подразумевают уменьшение, по меньшей мере, одного симптома болезни, расстройства или состояния при введении терапевтического агента этому субъекту.
Под "профилактическим лечением" болезни, расстройства или состояния у субъекта подразумевают уменьшение частоты возникновения (например, предотвращение) болезни, расстройства или состояния при введении терапевтического агента этому субъекту.
Под "раковым заболеванием" подразумевают любую пролиферацию клеток, уникальной особенностью которой является потеря нормального контроля, которая может привести к нерегулируемому росту, отсутствию дифференциации или способности поражать ткани и метастазировать. Рак может развиться в любой ткани или любом органе. Раковые болезни включают, без ограничения, рак мозга, печени, легких, почки или селезенки. Другие виды рака также описаны в данной заявке.
Под "введением" подразумевают способ доставки, включающий, без ограничения, оральное, внутриартериальное, интраназальное, интраперитонеальное, внутривенное, внутримышечное, подкожное, трансдермальное введение или per os (пероральное). Дневная доза может быть разделена на одну, две или более доз в подходящей форме, которая вводится один, два или более раз в течение определенного периода.
Под "терапевтически эффективным" или "эффективным количеством" подразумевают количество терапевтического агента, достаточное для улучшения, уменьшения, профилактики, задержки, подавления или остановки любого симптома болезни или состояния, которое подвергается лечению. Терапевтически эффективное количество этого агента необязательно излечивает болезнь или состояние, но будет обеспечивать лечение болезни или состояния таким образом, что у пациента вспышка болезни или состояния задерживается, затрудняется или предотвращается или симптомы болезни или состояния ослабляются, или срок проявления болезни или состояния изменяется, или, например, они становятся менее серьезными, или выздоровление ускоряется.
Если "интервал" или "группа веществ" упоминаются по отношению к конкретной характеристике (например, температуре, концентрации, времени и т.п.), данное изобретение относится и явно подразумевает каждый и специфический член и комбинацию подгрупп или интервалов. Так, например, в отношении длины от 9 до 18 аминокислот следует понимать, что явно имеется в виду каждая и каждая индивидуальная величина длины, например, длина из 18, 17, 15, 10, 9 аминокислот и любого числа между ними. Следовательно, если не упомянуто иное, каждый интервал, упомянутый в данной заявке, охватывается данным изобретением. Например, в выражении длины от 5 до 19 аминокислот имеются в виду длины, включающие 5 и 19 аминокислот. Это так же применяется по отношению к другим параметрам, таким как последовательности, длина, концентрации, элементы и т.п.
Последовательности, участки, части, определенные в данной заявке, каждая(-ый) включает каждую и каждую индивидуальную последовательность, каждый участок и каждую часть, описанные при этом, а также каждую и каждую возможную подпоследовательность, подчасть и каждый подучасток, независимо от того, определены ли такие подпоследовательность, подчасть и каждый подучасток как положительно включающие конкретные возможности, как исключающие конкретные возможности или их комбинации. Например, исключительным определением участка может быть следующее: "при условии, что указанный полипептид не короче, чем 4, 5, 6, 7, 8 или 9 аминокислот". Другим примером отрицательного ограничения является следующий: последовательность, включающая SEQ ID NO: X с исключением полипептида SEQ ID NO: H; и т.д. Дополнительный пример отрицательного ограничения представляет собой следующее: при условии, что указанный полипепетид не является (не включает или не состоит из) SEQ ID NO: Z.
Другие примеры и преимущества данного изобретения будут очевидными из следующих подробного описания, рисунков и формулы изобретения.
Краткое описание рисунков
На Фигуре 1 представлено схематическое описание примера способа приготовления фармацевтической композиции, включающей ANG 1005.
На Фигуре 2 приведен график, показывающий профили HPLC для воссозданного ANG 1005 для инъекции, разбавленного в D5W до 1,0 мг/мл, в условиях клинического применения в зависимости от времени.
На Фигуре 3 приведен график, показывающий профили HPLC для центрифугированного осадка, собранного для образца с концентрацией 2,0 мг/мл при хранении в течение примерно 6 ч, и солюбилизированного в DMSO.
Подробное описание изобретения
Авторы разработали фармацевтические композиции, пригодные для гидрофобных терапевтических агентов, включая паклитаксел и аналоги паклитаксела или их конъюгаты (например, ANG 1005) и способы приготовления и введения фармацевтических композиций с указанным составом. Гидрофобные терапевтические агенты (например, паклитаксел) часто солюбилизируются (и в действительности это часто требуется) в гидрофобных растворителях. Растворители, обычно применяемые для паклитаксела, включают Cremophor и DMSO, которые могут плохо переноситься пациентами. В частности, Cremophor может вызывать анафилактические реакции, что требует предварительной обработки агентами, такими как кортикостероиды. Для того, чтобы избежать применения таких плохо переносимых растворителей, мы разработали новые составы, содержащие, например, конъюгат полипетид - паклитаксел, ANG 1005. Составы, описанные в данной заявке, обладают тем преимуществом, что они могут быть приготовлены без применения Cremophor′a, могут быть получены с содержанием минимальных концентраций DMSO, приводят к низкой степени разложения и обеспечивают высокую активность активного агента и могут быть изготовлены стандартными методами. Композиции, которые не содержат плохо переносимых растворителей, можно вводить пациентам в высоких дозах, их можно вводить более быстро (например, в случае внутривенного введения), их можно вводить более часто или можно избежать необходимости предварительной обработки агентами (например, кортикостероидами) для того, чтобы увеличить переносимость таких эксципиентов.
Разработка состава для ANG 1005
При разработке нового состава для гидрофобного агента ANG 1005 авторы вначале определяли его растворимость в различных растворителях и комбинациях растворителей. Как показано в Примере 1 и как в случае паклитаксела, ANG 1005 имеет низкую растворимость в водных растворах, но очень хорошо растворяется в DMSO (120 мг/мл). ANG 1005 также растворяется в Solutol HS 15 (BASF, Parsippany, N.J.) с этанолом при температуре 75°C (6 мг/мл). Из-за его низкой токсичности и совместимости с лекарством Solutol HS 15 был выбран в качестве солюбилизирующего агента. Однако растворение в Solutol HS 15 само по себе привело к значительному разложению ANG 1005. Для растворения ANG 1005 Solutol HS 15 нагревали до, по меньшей мере, 65°C. Кроме того, мы заметили, что нагревание не буферированного Solutol′а от 25°С до 50°C приводило к повышению его pH от 6,0 до 9,0. Таким образом, комбинация высокой температуры и высокого pH, по всей видимости, приводит к наблюдаемой нестабильности ANG 1005 в этих условиях.
Для того, чтобы избежать избыточного разложения, ANG 1005 вначале растворяли в подкисленном DMSO (pH 3,5-4,0) перед добавлением при 50°C Solutol′a (см пример 2). Для дополнительной стабилизации ANG 1005 мы подкисляли Solutol HS 15 путем предварительного смешения с глициновым буфером при pH равном 5,0, что позволило поддерживать растворимость ANG 1005. Этот прием позволяет свести к минимуму разложение ANG 1005. Можно добавлять до 20% (например, 1%, 5%, 10% или 15%) буфера к Solutol перед добавлением ANG 1005, что не влияет на растворимость ANG 1005, в то время, как добавление большего количества буфера с Solutol приводит к неполной солюбилизации.
Для обеспечения стабильности ANG 1005 состав разбавляли в водном растворе при pH равном 5,0 (добавление буфера, глицина), так как авторы заметили, что ANG 1005 становится гораздо более нестабильным при pH равном 6,0 и выше. Применяли и другие буферы в этом интервале pH, включая ацетат и фосфат, но они были менее совместимы с составом. Мы также пытались стабилизировать ANG 1005 путем уменьшения конечного значения pH до 4,0, но полученный лиофилизированный осадок не воссоздается до прозрачного раствора.
Пример состава на основе ANG 1005 приведен в Таблице 5 ниже.
| Таблица 5: | |||
| Функция компонента в составе на основе ANG 1005 для инъекции | |||
| Компонент | Цель | Количество/партия | Количество/в сосуде |
| ANG 1005 | API | 60 г | 120 мг |
| Хлорид натрия, USP | Осмолярность | 290 г | 580 мг |
| Глицин | Буфер | 150 г | 300 мг |
| Маннит | Наполнитель | 260 г | 520 мг |
| Solutol HS 15 | Солюбилизация API | 2000 мл | 4 мл |
| DMSO | Солюбилизация API, предв. лиофилизация | 500 мл1 | 1 мл1 |
| HCl | Регулировка pH | До нужного pH | |
| Вода для инъекции, USP | Растворитель | До 10 л1 | до 20 мл1 |
| 1 удаление при лиофилизации |
Были также добавлены наполнители для облегчения воссоздания лиофилизированного продукта. Оценивали составы, содержащие и маннит, и сорбит. Маннит приводил к получению осадка с превосходными свойствами.
Лиофилизация
Так как препарат, содержащий DMSO/Solutol/буфер, включал нежелательно высокие количества DMSO и не был стабильным в достаточной степени, был разработан протокол лиофилизации для снижения количества DMSO и для повышения стабильности ANG 1005. Проводили серию альтернативных циклов лиофилизации для уменьшения содержания DMSO (то есть повышение температуры и увеличение времени повторной сушки; см. Пример 3). Условия лиофилизации описаны подробно ниже. Проводили первый протокол лиофилизации и эта процедура привела к концентрации DMSO, превышающей 1%. Подробности этой процедуры приведены в Таблице 6.
| Таблица 6 | |||
| Цикл лиофилизации для состава на основе ANG 1005 для инъекции | |||
| Стадия | Температура | Вакуум | Время выдержки |
| Загрузка | ≤ -40°C | Атмосферное давл. | H/O |
| Замораживание | ≤ -40°C | Атмосферное давл. | 3±1 ч |
| Первая сушка | ≥ -25°C | 50 мТ | 90±1 ч |
| Вторая сушка | ≥ 22°C | 50 мТ | 9±1 ч |
| Закупоривание | ≥ 22°C | 5-10 мм Hg | H/O |
Авторы смогли снизить концентрацию DMSO еще больше, до величины менее 1%, путем применения оптимизированного двухстадийного способа сушки. Вкратце, после стадии замораживания продукта проводили лиофилизацию при температуре хранения и в течение времени достаточного для удаления большей части воды из продукта. Температуру хранения затем повышали и продукт сушили при температуре, пригодной для удаления DMSO. Точные условия будут зависеть от объема образца, который подвергается сушке, величины давления и применяемой температуры, а также используемых состава и буферов. На основании процедуры, описанной в данной заявке специалист в данной области способен определить соответствующие условия для получения композиций, описанных в данном описании. Согласно одной из процедур состав загружают при температуре между -70°C и +25°C (например, при -40°C). Температуру меняли до величин, достаточных для замораживания раствора (любая температура между 0°C и -70°C) и эту температуру выдерживали в течение времени, достаточного для замораживания продукта и, предпочтительно, в течение времени, достаточного для того, чтобы обеспечить получение неразрушающегося осадка. Мы определили, что при -40°C требовалось время замораживания, равное, по меньшей мере, 12 ч (например, по меньшей мере, 15, 18, 20, 24, 36 или 48 ч) для обеспечения получения осадка, который не разрушался. После замораживания создавали вакуум (например, 10-500 мТ, в том числе 20, 50, 100, 200 или 500 мТ) и устанавливали температуру (например, от -15°C до -35°C, в том числе -25°C), достаточную для удаления воды из продукта во время первого цикла. Были испытаны величины давления от 10 до 100 мТ, полученные при этом результаты варьировались незначительно. Время сушки должно быть достаточным (например, равным 6 ч, 12 ч, 1 дню, 2 дням, 4 дням, 6 дням, 8 дням, 10 дням или 14 дням) для удаления значительной части (например, по меньшей мере, 50%, 60%, 70%, 80%, 90%, 95%, 98%. 99%, 99,5%, 99,9%) воды, содержащейся в продукте. После проведения первой стадии сушки проводили вторую стадию сушки для удаления DMSO. Температуру линейно изменяли до более высокой, между 10-30°С, (например, равной 18, 19, 20, 21, 22, 23, 24, 25, 26 или 27°C) для удаления DMSO. Согласно предпочтительному варианту температуру хранения поддерживали равной 27°C в течение 2 ч, затем равной 27°C в течение 1 ч. Затем температуру хранения устанавливали (или поддерживали) равной между 23 и 27°C в течение 30 мин и затем продукт выдерживали при этой температуре в течение, по меньшей мере, еще 10 ч (например, по меньшей мере, в течение 15, 20, 25, 30, 40, 48, 60 или 72 ч). Для того, чтобы предотвратить плавление остаточного DMSO, продукт можно хранить при температуре менее 25°C. Примерный протокол этой процедуры показан в Таблице 7. Лиофилизацию осуществляли с применением сушилки Hull Freezer Dryer, Model 72 FS 100- SS20c.
| Таблица 7 | |||
| Сегмент | Операция | Температура | Время |
| 1 | Загрузка | -40°C | H/O |
| ЗАМОРАЖИВАНИЕ | |||
| 2 | Изменен. хранения до | - 40°C | 0 минут |
| 3 | Выдержка при | -40°C | 420-1440 минут |
| ПЕРВАЯ СТАДИЯ СУШКИ | |||
| Ваккум до 50 мТ и темпер. в конденсаторе до -50°C на стадиях 4-7 | |||
| 4 | Изменен. хранения до | -25°C | 120 минут |
| 5 | Выдержка при | -25°C | 5760 минут |
| 6 | Изменен, хранения до | 27°C | 120 минут |
| 7 | Выдержка при | 27°C | 60 минут |
| 8 | Изменен. хранения до | 23-27°C | 30 минут |
| 9 | Выдержка при | 23-27°C | 900-1200 минут |
Воссоздание продукта
Перед инъекцией пациенту или перед проведением лабораторного анализа продукт может быть воссоздан. Для воссоздания могут быть использованы любой буфер, растворители или комбинация буфера(-ов) и растворителя(-ей); вид буфера не является критическим. Однако часто является желательным, чтобы активный агент был достаточно стабильным в растворе и чтобы применяемые буфер(-ы) и растворитель(-и) в растворах хорошо переносились пациентами при их введении. В случае ANG 1005, поскольку продукт является менее стабильным при pH выше 6,0, обычно желательно применять систему для воссоздания растворитель/буфер, которая позволяет поддерживать величину pH ниже 6,0.
Для ANG 1005 одной из предпочтительных систем растворителей является система, представляющая собой комбинацию этанола и смеси лактатированный раствор Рингера/ 5% декстрозы. В случае этой системы этанол добавляют в сосуд, содержащий продукт, осторожно перемешивают и затем для растворения продукта добавляют смесь лактатированный раствор Рингера/ 5% декстрозы. Применение обычной воды для инъекции (WFI) или физиологического раствора в качестве растворителей привело к высоким значениям pH, что вызывало разложение продукта ANG 1005. После растворения смесь может быть далее разбавлена водой или другими буферными системами. Примерные условия для воссоздания лиофилизированного продукта описаны далее в Примере 4.
Композиции лекарственного средства
Как описано выше, мы разработали композиции на основе гидрофобного агента, ANG 1005, пригодные для введения пациентам. Перед лиофилизацией согласно некоторым вариантам состав содержит значительное количество DMSO. Такие композиции могут содержать следующие компоненты (например, в расчете на сухой вес), которые приведены в Таблицах 8А и 8В. В Таблице 8С приведены примерные концентрации различных компонентов в водном растворе перед лиофилизацией.
| Таблица 8A: | |||
| Количество по весу без воды | |||
| Соединение | Количество (вес. проценты) | Предпочтит. Количество (вес %) | Примерное количество (вес.%) |
| ANG 1005 | 0,1-5% | 1-3% | 1,8% |
| Вещество, регулир. тоничность, (например, хлорид натрия) | 1-15% | 5-12% | 8,6% |
| Буфер (например, глицин) | 1-10% | 3-7% | 4,5% |
| Наполнитель (например, маннит) | 0-15% | 5-12% | 7,7% |
| Solutol HS 15 | 40-75% | 50-70% | 61,1% |
| DMSO | 3-20% | 10-20% | 16,3% |
| Таблица 8B: | ||||
| Количество в водном растворе (предварительная лиофилизация) | ||||
| Соединение | Количество (вес.%) | Предпочтит. количество (вес.%) | Более предпочтит. Количество(вес.%) | Примерное количество (вес.%) |
| ANG 1005 | 0,05-1,5% | 0,1-1,0% | 0,2-0,8% | 0,55% |
| Вещество, регулир. тоничность, (например, хлорид натрия) | 0,1-10% | 0,5-6% | 1-3% | 2,7% |
| Буфер (например, глицин) | 0,05-5% | 0,1-4% | 0,5-1,5% | 1,4% |
| Наполнитель (например, маннит) | 0-5% | 0,2-4% | 1,0-3,0% | 2,4% |
| Solutol HS 15 | 1-40% | 3-30% | 10-25% | 19,0% |
| DMSO | 0,5-15% | 1-10% | 2-8% | 5,0% |
| Вода | 25-85% | 50-80% | 65-75% | 69,0% |
| Таблица 8C: | ||||
| Концентрации (мг/мл) в водном растворе (предварительная лиофилизация) | ||||
| Соединение | Концентрация (мг/мл) | Предпочтит. концентрации | Более предпочтит. концентрации | Примерные концентрации |
| ANG 1005 | 0,1-10,0 | 2-7 | 4-6,5 | 6,0 |
| Вещество, регулир. тоничность, (например, хлорид натрия) | 5-200 | 10-100 | 10-50 | 29 |
| Буфер (например, глицин) | 1-200 | 3-100 | 5-25 | 15 |
| Наполнитель (например, маннит) | 0-100 | 2-50 | 5-35 | 26 |
| Solutol HS 15 | 10-400 | 20-300 | 50-250 | 206 |
| DMSO | 1-200 | 15-200 | 30-100 | 55 |
До лиофилизации композицию обычно разбавляют водой (см. ниже условия лиофилизации). Для большинства клинических назначений раствор делится на соответствующие количества для введения единичной дозы ANG 1005 (например, примерно 10, 20, 30, 60, 90, 120, 150, 200, 240, 300, 400 или 500 мг). После лиофилизации (например, при условиях, описанных в данной заявке) концентрация DMSO может быть значительно снижена. После лиофилизации состав на основе ANG 1005 по изобретению может иметь следующие показатели (например, в расчете на сухой вес), которые приведены в Таблице 9.
| Таблица 9 | ||||
| Соединение | Количество (вес.%) | Предпочтит. количество (вес.%) | Более предпочтит. количество (вес.%) | Примерное количество (0,5% DMSO) |
| ANG 1005 | 0,1-5% | 1,5-3% | 1,8-2,3% | 2,11 |
| Вещество, регулир. тоничность, (например, хлорид натрия) | 0-15% | 0-12% | 9-11% | 10,18 |
| Буфер (например, глицин) | 1-10% | 3-7% | 4,5-6% | 5,27 |
| Наполнитель(например, маннит) | 0-15% | 5-12% | 8-10% | 9.13 |
| Solutol HS 15 | 40-75% | 50-70% | 69-75% | 72,32 |
| DMSO | 0,01-10% | 0,1-5% | 0,2-0,5 | 0.50 |
Гидрофобные агенты
В композициях и в способах согласно данному изобретению могут быть использованы любые гидрофобные агенты. Примеры этих соединений описаны ниже.
Паклитаксел и родственные соединения
Хотя в данной заявке в качестве примера применяли ANG 1005, конъюгат AngioPep-паклитаксел, описанные