Стабильная пестицидная композиция на основе сульфоксимина и способ борьбы с насекомыми
Иллюстрации
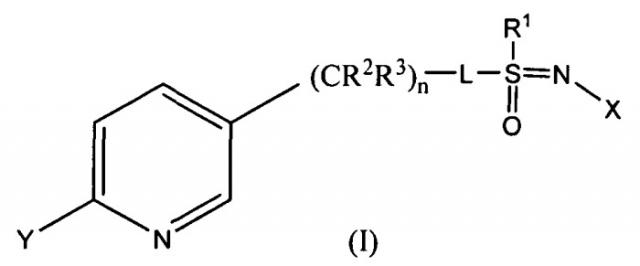
Показать всеИзобретение относится к сельскому хозяйству. Пестицидная композиция содержит: соединение, имеющее следующую формулу (I):
где
X представляет собой NO2, CN или COOR4;
L представляет собой одинарную связь или R1, S и L, взятые вместе, представляют собой 4-, 5- или 6-членное кольцо;
R1 представляет собой (C1-C4)алкил;
R2 представляет собой метил, этил, фтор, хлор или бром, и R3 представляет собой водород;
n равно 1, когда L представляет собой одинарную связь, или равно 0, когда R1, S и L, взятые вместе, представляют собой 4-, 5- или 6-членное кольцо;
Y представляет собой (C1-C4)галогеналкил, F, Cl, Br или I; и
R4 представляет собой (C1-C3)алкил; и органическую кислоту или ее соль. Композицию применяют для борьбы с насекомыми. Изобретение позволяет повысить стабильность композиции. 4 н. и 11 з.п. ф-лы, 10 пр., 5 табл.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА СВЯЗАННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет по предварительной патентной заявке США №61/203689, поданной 26 декабря 2008 года, содержание которой включено в настоящий документ в качестве ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение, описанное в этом документе, относится к области пестицидов и их применения для борьбы с вредителями.
УРОВЕНЬ ТЕХНИКИ
Каждый год вредители вызывают миллионы человеческих смертей по всему миру. Более того, существует более десяти тысяч видов вредителей, которые вызывают убытки в сельском хозяйстве. Эти убытки в сельском хозяйстве достигают миллиардов долларов США каждый год. Термиты вызывают повреждение различных строений, таких как дома. Убытки от этих повреждений термитами достигают миллиардов долларов США каждый год. В качестве заключительной информации, многие вредители хранящихся пищевых продуктов едят и портят хранящиеся пищевые продукты. Эти убытки с хранящимися пищевыми продуктами достигают миллиардов долларов США каждый год, однако более важно, что они лишают людей необходимой им пищи.
С течением времени было разработано множество пестицидных композиций для уничтожения вредителей и уменьшения повреждений, которые они вызывают. Что касается по меньшей мере некоторых из этих композиций, их физическая и химическая нестабильность может привести к снижению пестицидной активности композиции и/или обеспечить трудности, когда наступает время для применения композиции в той области, в которой является необходимой или желательной борьба с насекомыми. Например, физическая и химическая нестабильность может изменить одно или несколько свойств композиции, что делает трудным или невозможным приготовление надлежащих растворов композиции для применения. Более конкретно, многие пестицидные композиции предоставляются производителем в концентрированном составе и конечный пользователь впоследствии разбавляет их перед применением. Во время между изготовлением и применением жидкие формы пестицидных композиций могут застывать в результате химической и физической нестабильности композиции. Часто, это застывание мешает или по существу препятствует диспергированию композиции в раствор, пригодный для применения, что приводит к большим затратам и издержкам для пользователя и/или испорченным пестицидным продуктам. Более того, когда физическая и химическая нестабильность приводят к уменьшению пестицидной активности композиции, часто требуется увеличение концентрации, в которой пестицид применяют, и/или более частое применение пестицидной композиции. В результате, могут возрастать издержки пользования и стоимость для потребителей. Таким образом, существует необходимость в новых пестицидных композициях, которые обладают свойствами увеличенной химической и физической стабильности.
В публикации патентной заявки США 2007/0203191 A1 описаны определенные N-замещенные соединения (6-галогеналкилпиридин-3-ил)алкилсульфоксимина и их применение в борьбе с насекомыми. В настоящее время открыто, как повысить стабильность композиций, включающих одно или несколько из этих соединений, на протяжении более длительных периодов времени.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым композициям, включающим одно или несколько N-замещенных (6-галоалкилпиридин-3-ил)алкилсульфоксиминов и органическую кислоту или ее соль, для борьбы с насекомыми и некоторыми другими беспозвоночными, в частности тлей и другими сосущими насекомыми. Также это изобретение относится к новым способам синтеза для получения композиций и к способам борьбы с насекомыми с использованием композиций.
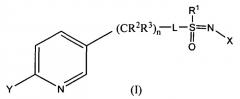
Это изобретение относится к композициям, пригодным для борьбы с насекомыми, особенно пригодным для борьбы с тлей и другими сосущими насекомыми. Более конкретно, изобретение относится к композициям, включающим органическую кислоту или ее соль и соединение формулы (I)
X представляет собой NO2, CN или COOR4;
L представляет собой одинарную связь или R1, S и L, взятые вместе, представляют собой 4-, 5- или 6-членное кольцо;
R1 представляет собой (C1-C4)алкил;
R2 и R3 отличаются друг от друга и по отдельности представляют собой водород, метил, этил, фтор, хлор или бром;
n равно 1, когда L представляет собой одинарную связь, и равно 0, когда R1, S и L, взятые вместе, представляют собой 4-, 5- или 6-членное кольцо;
Y представляет собой (C1-C4)галогеналкил, F, Cl, Br или I; и
R4 представляет собой (C1-C3)алкил.
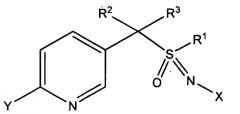
В одном конкретном варианте осуществления композиция включает соединение формулы (I), где L представляет собой одинарную связь, т.е. имеющее следующую структуру, где n равно 1
где
X представляет собой NO2, CN или COOR4;
R1 представляет собой (C1-C4)алкил;
R2 и R3 отличаются друг от друга и по отдельности представляют собой водород, метил, этил, фтор, хлор или бром;
Y представляет собой (C1-C4)галогеналкил, F, Cl, Br или I; и
R4 представляет собой (C1-C3)алкил.
В другом конкретном варианте осуществления композиция включает соединение формулы (I), где R1, S и L, взятые вместе, образуют насыщенное 5-членное кольцо, и n равно 0, т.е. имеющее структуру
где
X представляет собой NO2, CN или COOR4;
Y представляет собой (C1-C4)галогеналкил, F, Cl, Br или I; и R4 представляет собой (C1-C3)алкил.
В определенных вариантах осуществления композиция включает соединения формулы (I) из одного или нескольких из следующих классов:
(1) Соединения формулы (I), где X представляет собой NO2 или CN, наиболее предпочтительно CN.
(2) Соединения формулы (I), где Y представляет собой CF3.
(3) Соединения формулы (I), где R2 и R3 отличаются друг от друга и независимо представляют собой водород, метил или этил.
(4) Соединения формулы (I), где R1 представляет собой CH3.
Специалистам в данной области будет понятно, что одна или несколько из композиций, описанных в настоящем документе, может содержать комбинации описанных выше классов соединения формулы (I).
В одном или нескольких конкретных вариантах осуществления органическая кислота представляет собой карбоновую кислоту, выбранную из группы, состоящей из лимонной кислоты, фталевой кислоты, яблочной кислоты, виннокаменной кислоты, малеиновой кислоты, малоновой кислоты, молочной кислоты и янтарной кислоты.
В другом варианте осуществления способ включает применение в области, в которой является желательной борьба, инактивирующего насекомых количества пестицидной композиции.
Следующие варианты осуществления, формы, признаки, аспекты, выгода, задачи и преимущества настоящего изобретению станут понятными из представленных подробного описания и примеров.
ЗАМЕСТИТЕЛИ (НЕПОЛНЫЙ СПИСОК)
Примеры, приведенные для заместителей, являются (за исключением галогена) неполными, и их не следует истолковывать как ограничивающие изобретение, описанное в этом документе.
"Алкил" (включая производные термины, такие как алкокси) означает неразветвленные, разветвленные и циклические группы, включающие, например, метил, этил, 1-метилэтил, пропил, 1,1-диметилэтил и циклопропил.
"Алкокси" означает алкил, дополнительно содержащий углерод-кислородную одинарную связь, например, метокси, этокси, пропокси, изопропокси, 1-бутокси, 2-бутокси, изобутокси, трет-бутокси, пентокси, 2-метилбутокси, 1,1-диметилпропокси, гексокси, гептокси, октокси, нонокси и декокси.
"Арил" означает циклический ароматический заместитель, состоящий из водорода и углерода, например фенил, нафтил и бифенилил.
"Галоген" означает фтор, хлор, бром и йод.
"Галогеналкил" означает алкильную группу, замещенную посредством от одного до максимально возможного количества атомов галогенов, включая все комбинации галогенов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
На протяжении этого документа все значения температуры приведены в градусах Цельсия и все проценты представляют собой массовые проценты, если нет иных указаний.
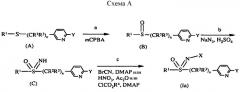
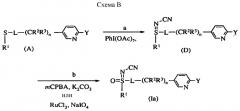
Соединения формулы (Ia), где R1, R2, R3, R4, X, и Y являются такими, как определено выше, L представляет собой одинарную связь и n равно 1, можно получать способами, проиллюстрированными на схеме A:
На стадии a схемы A сульфид формулы (A) окисляется мета-хлорпероксибензойной кислотой (mCPBA) в полярном растворителе при температуре ниже 0°С с образованием сульфоксида формулы (B). В большинстве случаев предпочтительным для окисления растворителем является дихлорметан.
На стадии b схемы A сульфоксид (B) иминируется азидом натрия в присутствии концентрированной серной кислоты в апротонном растворителе при нагревании с образованием сульфоксимина формулы (C). В большинстве случаев хлороформ является предпочтительным растворителем для этой реакции.
На стадии c схемы A азот сульфоксимина (C) может быть цианирован цианогенбромидом в присутствии основания или нитрирован азотной кислотой в присутствии уксусного ангидрида при немного повышенной температуре, или карбоксилирован алкил-(R4)-хлорформиатом в присутствии основания, такого как 4-диметиламинопиридин (DMAP), с образованием N-замещенного сульфоксимина (Ia). Основание требуется для эффективного цианирования и карбоксилирования и предпочтительным основанием является DMAP, в то время как серную кислоту используют в качестве катализатора для эффективной реакции нитрирования.
Соединения формулы (Ia), где X представляет собой CN, и R1, R2, R3, R4 и Y являются такими, как определено выше, и n равно 1, можно получать мягким и эффективным способом, проиллюстрированным на схеме B.
На стадии a схемы B сульфид окисляется йодбензолдиацетатом в присутствии цианамида при 0°С с образованием сульфилимина (D). Реакцию можно проводить в полярном апротонном растворителе, таком как CH2Cl2.
На стадии b схемы B сульфилимин (D) окисляют mCPBA. Для нейтрализации кислотности mCPBA используют основание, такое как карбонат калия. Для повышения растворимости исходного материала сульфилимина и используемого основания используют протонные полярные растворители, такие как этанол и вода. Сульфилимин (D) можно окислять водным раствором перйодината натрия или калия в присутствии катализатора гидрата трихлорида рутения или сходного катализатора. Органический растворитель для этого катализа может представлять собой полярный апротонный растворитель, такой как CH2Cl2, хлороформ или ацетонитрил.
α-углерод N-замещенного сульфоксимина формулы (Ia), т.е., n=1, R3=H в группе (CR2R3), соседней с N-замещенной функциональной группой сульфоксимина, может быть далее алкилирован или галогенирован (R5) в присутствии основания, такого как гексаметилдисиламид (KHMDS), с образованием N-замещенных сульфоксиминов формулы (Ib), где R1, R2, R3, R4, X, L и Y являются такими, как определено выше, и Z представляет собой пригодную уходящую группу, как проиллюстрировано на схеме C. Предпочтительными уходящими группами являются йодид (R5=алкил), бензосульфонимид (R5=F), тетрахлорэтен (R5=Cl) и тетрафторэтен (R5=Br).
Исходные сульфиды (A) на схеме A можно получать различными способами, как проиллюстрировано на схемах D, E, F, G и H.
На схеме D сульфид формулы (A1), где R1, R2 и Y являются такими, как определено выше, n=1 и R3=H, можно получать из хлорида формулы (D) нуклеофильным замещением с натриевой солью алкилтиола.
На схеме E, сульфид формулы (A4), где R1, S и L, взятые вместе, представляют собой 4-, 5- или 6-членное кольцо (m=0, 1 или 2) и n равно 0, можно получать из соответствующего замещенного хлорметилпиридина посредством обработки тиомочевиной, гидролиза и последующего алкилирования соответствующим бромхлоралканом (m=0, 1 или 2) в водных основных условиях, и циклизацией в присутствии основания, такого как трет-бутоксид калия в полярном апротонном растворителе, таком как THF.
Сульфиды формулы (A1), где R1, R2=CH3, Y является таким, как определено выше, и R3=H, альтернативно можно получать способами, проиллюстрированными на схеме F. Таким образом, соответствующий енон подвергают реакции сочетания с диметиламиноакрилонитрилом и циклизуют ацетатом аммония в DMF с получением соответствующего 6-замещенного никотинонитрила. Обработка бромидом метилмагния, восстановление боргидридом натрия, хлорирование тионилхлоридом и нуклеофильное замещение натриевой солью алкилтиола дают желаемые сульфиды (A1).
Сульфиды формулы (A1), где R1 = метил или этил, R2 и R3 отличаются друг от друга и независимо представляют собой водород, метил или этил, и Y является таким, как определено выше, можно получать с помощью варианта схемы F, представленного на схеме G, где енамины, образованные реакцией присоединения амина, например пирролидина, к аддукту Михаэля определенных сульфидов с соответствующим образом замещенными α, β-ненасыщенными альдегидами, подвергают реакции сочетания с замещенными енонами и циклизуют с помощью ацетата аммония в ацетонитриле с получением желаемых сульфидов (A1).
На схеме H сульфиды формулы (A1), где Y представляет собой фторалкильную группу, R1, R2 и R3 являются такими, как определено выше, и n=1, можно получать из 6-ацилпиридина или 6-формилпиридина реакцией с трифторидом диэтиламиносеры (DAST). Последующее галогенирование 3-метильной группы посредством NBS с последующим нуклеофильным замещением натриевой солью алкилтиола приводит к образованию желаемого сульфида.
Неограничивающие примеры соединений формулы (I):
Пример I. Получение {1-[6-(трифторметил)пиридин-3-ил]этил}(метил)оксидо-λ 4 -сульфанилиденцианамида (2)
К раствору 3-хлорметил-6-(трифторметил)пиридина (5,1 г, 26 ммоль) в диметилсульфоксиде (DMSO; 20 мл) добавляли одной порцией тиометоксид натрия
(1,8 г, 26 ммоль). Наблюдали сильную экзотермическую реакцию, которая приводила к тому, что реакционная смесь становилась темной. Реакционную смесь перемешивали в течение 1 ч, затем медленно добавляли дополнительный тиометоксид натрия (0,91 г, 13 ммоль). Реакционную смесь перемешивали в течение ночи, и после этого ее выливали в H2O и добавляли несколько капель концентрированной HCl. Смесь экстрагировали Et2O (3×50 мл) и органические слои объединяли, промывали рассолом, сушили над MgSO4 и концентрировали. Неочищенный продукт очищали хроматографией (Prep 500, 10% ацетон/гексан) с получением сульфида (A) в виде светло-желтого масла (3,6 г, 67%). 1H ЯМР (300 МГц, CDCl3) δ 8,6 (с, 1H), 7,9 (д, 1H), 7,7 (д, 1H), 3,7 (с, 2H), 2,0 (с, 3H); GC-MS: масса, вычисленная для C8H8F3NS, [M]+ 207. Найдено 207.
К раствору сульфида (A) (3,5 г, 17 ммоль) и цианамида (1,4 мг, 34 ммоль) в CH2Cl2 (30 мл) при 0°С добавляли йодбензолдиацетат (11,0 г, 34 ммоль) одной порцией. Реакционную смесь перемешивали в течение 30 мин, затем ей позволяли нагреваться до комнатной температуры в течение ночи. Смесь разбавляли CH2Cl2 (50 мл) и промывали H2O. Водный слой экстрагировали этилацетатом (4×50 мл), и объединенные слои CH2Cl2 и этилацетата сушили над MgSO4 и концентрировали. Неочищенный продукт растирали с гексаном и очищали хроматографией (chromatotron, 60% ацетон/гексан) с получением сульфилимина (B) в виде желтой смолы (0,60 г, 14 %). IR (пленка) 3008, 2924, 2143, 1693 см-1; 1H ЯМР (300 МГц, CDCl3) δ 8,8 (с, 1H), 8,0 (д, 1H), 7,8 (д, 1H), 4,5 (д, 1H), 4,3 (д, 1H), 2,9 (с, 3H); LC-MS (ESI): масса, вычисленная для C9H9F3N3S, [M+H]+ 248,04. Найдено 248.
К раствору м-хлорпербензойной кислоты (mCPBA; 80%, 1,0 г, 4,9 ммоль) в EtOH (10 мл) при 0° добавляли раствор K2CO3 (1,4 г, 10 ммоль) в H2O (7 мл). Раствор перемешивали в течение 20 мин, затем добавляли раствор сульфилимина (B) (0,60 г, 2,4 ммоль) в EtOH (20 мл) одной порцией. Реакционную смесь перемешивали при 0°С в течение 30 мин, затем ей позволяли нагреться до комнатной температуры в течение 1 ч. Затем реакцию гасили водным раствором бисульфита натрия и смесь концентрировали для удаления этанола. Полученную смесь экстрагировали CH2Cl2 и объединенные органические слои сушили над MgSO4 и концентрировали. Неочищенный продукт очищали хроматографией (chromatotron, 50% ацетон/гексан) с получением сульфоксимина (1) в виде не совсем белого твердого вещества (0,28 г, 44%). Mp=135-137°С; 1H ЯМР (300 МГц, CDCl3) δ 8,8 (с, 1H), 8,1 (д, 1H), 7,8 (д, 1H), 4,7 (м, 2H), 3,2 (с, 3H); LC-MS (ELSD): масса, вычисленная для C9H9F3N3OS, [M+H]+ 264,04. Найдено 263,92.
К раствору сульфоксимина (1) (50 мг, 0,19 ммоль) и гексаметилфосфорамида (HMPA; 17 мкл, 0,10 ммоль) в тетрагидрофуране (THF; 2 мл) при -78°С по каплям добавляли гексаметилдисилазан калия (KHMDS; 0,5 M в толуоле, 420 мкл, 0,21 ммоль). Раствор перемешивали при -78°С в течение дополнительных 20 мин, после чего добавляли йодметан (13 мкл, 0,21 ммоль). Реакционной смеси позволяли нагреться до комнатной температуры в течение 1 ч, после чего реакцию гасили насыщенным водным раствором NH4Cl и экстрагировали CH2Cl2. Органический слой сушили над Na2SO4, концентрировали и неочищенный продукт очищали хроматографией (chromatotron, 70% ацетон/CH2Cl2) с получением сульфоксимина (2) в качестве смеси 2:1 диастереомеров (бесцветное масло; 31 мг, 59%). Сульфоксимин (2) широко известен как сульфоксафлор, и дополнительная информация о нем доступна на http://www.alanwood.net/pesticides/index_en_frame.html. Согласно пересмотренной версии номенклатуры IUPAC, сульфоксимин (2) также называют [метил(оксидо)-{1-[6-(трифторметил)-3-пиридил]этил}-λ6-сульфанилиден]цианамидом, и название CAS, данное сульфоксимину (2) представляет собой N-[метилоксидо[1-[6-(трифторметил)-3-пиридинил]этил]-λ4-сульфанилиден]цианамид. 1H ЯМР (300 МГц, CDCl3) δ (главный диастереомер) 8,8 (с, 1H), 8,1 (д, 1H), 7,8 (д, 1H), 4,6 (кв, 1Н), 3,0 (с, 3H), 2,0 (д, 3H); (второстепенный диастереомер) 8,8 (с, 1H), 8,1 (д, 1H), 7,8 (д, 1H), 4,6 (кв, 1H), 3,1 (с, 3H), 2,0 (д, 3H); LC-MS (ELSD): масса, вычисленная для C10H10F3N3OS, [M+H]+ 278,06. Найдено 278,05.
Пример II. Получение 2-(6-трифторметилпиридин-3-ил)-1-оксидотетрагидро-1H-1λ 4 -тиен-1-илиденцианамида (3)
К суспензии тиомочевины (1,2 г, 16 ммоль) в EtOH (25 мл) добавляли раствор 3-хлорметил-6-(трифторметил)пиридина в EtOH (10 мл). Суспензию перемешивали при комнатной температуре в течение 2 суток, и в это время образовывался белый преципитат. Преципитат фильтровали с получением желаемого гидрохлорида амидина в виде белого твердого вещества (2,4 г, 58%). Mp=186-188°С. Дальнейших попыток очистки продукта не предпринимали. 1H ЯМР (300 МГц, CDCl3) δ 8,9 (уш.с, 4H), 8,4 (с, 1H), 7,6 (д, 1H), 7,3 (д, 1H), 4,2 (с, 2H); LC-MS (ELSD): масса, вычисленная для C8H8FN3S, [M+H]+ 236,05. Найдено 236,01.
К раствору гидрохлорида амидина (A) (1,8 г, 6,8 ммоль) в H2O (12 мл) при 10°С добавляли 10 н NaOH (0,68 мл, 6,8 ммоль), который приводил к образованию белого преципитата. Суспензию нагревали при 100°С в течение 30 мин, затем обратно охлаждали до 10°С. Затем добавляли дополнительный 10 н NaOH (0,68 мл, 6,8 ммоль), а затем 1-бром-3-хлорпропан (0,67 мл, 6,8 ммоль) одной порцией. Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем экстрагировали CH2Cl2. Объединенные органические слои промывали рассолом, сушили над Na2SO4 и концентрировали с получением сульфида (B) в виде бесцветного масла (1,7 г, 96%). Дальнейших попыток очистки продукта не предпринимали. 1H ЯМР (300 МГц, CDCl3) δ 8,6 (с, 1H), 7,8 (д, 1H), 7,6 (д, 1H), 3,8 (с, 2H), 3,6 (т, 2H), 2,6 (т, 2H), 2,0 (квинт, 2H).
К суспензии трет-бутоксида калия (1,5 г, 13 ммоль) в THF (12 мл) добавляли HMPA (1,7 мл, 10 ммоль), а затем по каплям добавляли раствор сульфида (B) (1,8 г, 6,7 ммоль) в THF (3 мл). Реакционной смеси позволяли перемешаться при комнатной температуре в течение ночи, а затем ее концентрировали и очищали хроматографией (Biotage, 40% EtOAc/гексаны) с получением циклизованного продукта (C) в виде оранжевого масла (230 мг, 15%). 1H ЯМР (300 МГц, CDCl3) δ 8,7 (с, 1H), 8,0 (д, 1H), 7,6 (д, 1H), 4,6 (дд, 1H), 3,2 (м, 1H), 3,1 (м, 1H), 2,5 (м, 1H), 2,3 (м, 1H), 2,1-1,9 (м, 2H).
К раствору сульфида (C) (230 мг, 0,99 ммоль) и цианамида (83 мг, 2,0 ммоль) в CH2Cl2 (5 мл) при 0°С добавляли йодбензолдиацетат (350 мг, 1,1 ммоль) одной порцией. Реакционную смесь перемешивали в течение 3 ч, затем концентрировали и неочищенный продукт очищали хроматографией (chromatotron, 50% ацетон/гексаны) с получением сульфилимина (D) в виде оранжевого масла (150 мг, смесь диастереомеров, 56%). 1H ЯМР (300 МГц, CDCl3) δ 8,8 (с, 1H), 7,9 (д, 1H), 7,8 (д, 1H), 4,8 (дд, 1H), 3,5 (м, 2H), 2,9-2,7 (м, 2H), 2,6 (м, 1H), 2,3 (м, 1H).
К раствору mCPBA (80%, 180 мг, 0,82 ммоль) в EtOH (3 мл) при 0°С добавляли раствор K2CO3 (230 мг, 1,7 ммоль) в H2O (1,5 мл). Раствор перемешивали в течение 20 мин, затем добавляли раствор сульфилимина (D) (150 мг, 0,55 ммоль) в EtOH (2 мл) одной порцией. Реакционную смесь перемешивали при 0°С в течение 45 мин, после чего растворитель сливали в отдельную колбу и концентрировали с получением белого твердого вещества. Твердое вещество суспендировали в CHCl3, фильтровали и концентрировали с получением чистого сульфоксимина (3) в виде бесцветного масла (72 мг, 44%). 1H ЯМР (300 МГц, CDCl3) δ (1,5:1 смесь диастереомеров) 8,8 (с, 2H), 8,0 (д, 2H), 7,8 (д, 2H), 4,7 (кв, 1H), 4,6 (кв, 1H), 4,0-3,4 (м, с, 4H), 3,0-2,4 (м, 8H); LC-MS (ELSD): масса, вычисленная для C11HHF3N3OS, [M+H]+ 290,06. Найдено 289,99.
Пример III. Получение (1-{6-[хлор(дифтор)метил]пиридин-3-ил)этил)(метил)-оксидо-λ 4 -сульфанилиденцианамида (4)
(3E)-1-хлор-4-этокси-1,1-дифторбут-3-ен-2-он (7,36 г, 40 ммоль) растворяли в сухом толуоле (40 мл) и обрабатывали 3-диметиламиноакрилонитрилом (4,61 г, 48 ммоль) при комнатной температуре. Раствор нагревали при 100°С в течение 3,5 ч. Затем растворитель удаляли при пониженном давлении и оставшуюся смесь повторно растворяли в DMF (20 мл), обрабатывали ацетатом аммония (4,62 г, 60 ммоль) и перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и полученную смесь экстрагировали смесью простой эфир:CH2CH2 (1:2, об./об.) два раза. Объединенные органические слои промывали рассолом, сушили, фильтровали и концентрировали. Осадок очищали на силикагеле с получением 3,1 г 6-[хлор(дифтор)метил]никотинонитрила (A) в виде светлого масла с выходом 41%. GC-MS: масса, вычисленная для C7H3ClF2N2, [M]+ 188. Найдено 188.
6-[хлор(дифтор)метил]никотинонитрил (A) (3,0 г 15,8 ммоль) растворяли в безводном простом эфире (25 мл) и охлаждали на ледяной бане. Шприцем добавляли раствор 3 M бромида метилмагния в гексане (6,4 мл, 19 ммоль). После завершения добавления смесь перемешивали при 0°С в течение 5 ч, а затем при комнатной температуре в течение 10 ч. Реакцию медленно гасили 1 н водным раствором лимонной кислоты при 0°С, и полученную смесь перемешивали при комнатной температуре в течение 1 ч. pH доводили обратно до pH 7 насыщенным водным раствором NaHCO3. Две фазы разделяли и водную фазу экстрагировали этилацетатом два раза. Объединенный органический слой промывали рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали. Оставшуюся смесь очищали на силикагеле, элюируя 15% раствором ацетона в гексане с получением 0,88 г желаемого продукта 1-{6-[хлор(дифтор)метил]пиридин-3-ил}этанона (B) в виде коричневатого масла с выходом 30%. GC-MS: масса, вычисленная для C8H6ClF2NO, [M]+ 205. Найдено 205.
К раствору 1-{6-[хлор(дифтор)метил]пиридин-3-ил}этанона (B) (0,85 г, 4,14 ммоль) в MeOH (10 мл) при 0°С добавляли NaBH4 (0,16 г, 4,14 ммоль). Смесь перемешивали в течение 30 мин и добавляли 2 M водный раствор HCl до достижения pH 7. Растворитель удаляли при пониженном давлении и оставшуюся смесь экстрагировали CH2Cl2 (2×50 мл). Объединенный органический слой сушили над безводным Na2SO4, фильтровали, концентрировали и сушили в вакууме с получением 0,798 г аналитически чистого 1-{6-[хлор(дифтор)метил]-пиридин-3-ил}этанола (C) при GC-MS в виде светло-желтого масла с выходом 93%. GC-MS: масса, вычисленная для C8H6ClF2NO, [M]+ 207. Найдено 207.
К раствору 1-{6-[хлор(дифтор)метил]-пиридин-3-ил}этанола (0,78 г, 3,77 ммоль) в CH2Cl2 (40 мл) по каплям добавляли тионилхлорид (0,54 мл, 7,54 ммоль) при комнатной температуре. Через 1 ч реакционную смесь медленно гасили насыщенным водным раствором NaHCO3 и две фазы разделяли. Органический слой сушили над Na2SO4, фильтровали, концентрировали и сушили в вакууме с получением 0,83 г неочищенного 2-[хлор(дифтор)метил]-5-(1-хлорэтил)пиридина (D) в виде коричневого масла с выходом 98%, который непосредственно использовали для реакции следующей стадии. GC-MS: масса, вычисленная для C8H7Cl2F2N, [M]+ 225. Найдено 225.
К раствору 2-[хлор(дифтор)метил]-5-(1-хлорэтил)пиридина (D) (0,81 г, 3,6 ммоль) в этаноле (10 мл) добавляли тиометоксид натрия (0,52 г, 7,4 ммоль) при перемешивании одной порцией при 0°С. Через 10 мин смеси позволяли нагреться до комнатной температуры и перемешивали в течение ночи. Затем растворитель этанол удаляли при пониженном давлении и осадок повторно отбирали в простой эфир/CH2Cl2 и рассол. Две фазы разделяли и органический слой экстрагировали CH2Cl2 еще один раз. Объединенные органические слои сушили над безводным Na2SO4, фильтровали, концентрировали, очищали на силикагеле с использованием 5% этилацетата в гексане с получением 0,348 г 2-[хлор(дифтор)метил]-5-[1-(метилтио)этил]пиридина (E) с выходом 40% GC-MS: масса, вычисленная для C9H10ClF2NS, [M]+ 237. Найдено 237.
К перемешиваемому раствору 2-[хлор(дифтор)метил]-5-[1-(метилтио)этил]пиридина (E) (0,32 г, 1,35 ммоль) и цианамида (0,058 г, 1,35 ммоль) в THF (7 мл) добавляли йодбензолдиацетат (0,44 г, 1,35 ммоль) одной порцией при 0°С и полученную смесь перемешивали при этой температуре в течение 1 ч, а затем при комнатной температуре в течение 2 ч. Затем растворитель удаляли при пониженном давлении и полученную смесь растворяли в CH2Cl2, промывали полунасыщенным рассолом, сушили над безводным Na2SO4, фильтровали, концентрировали и очищали на силикагеле с использованием 50% ацетона в гексане с получением 0,175 г (1-{6-[хлор(дифтор)метил]пиридин-3-ил}этил)(метил)-λ4-сульфанилиденцианамида (F) в качестве светло-желтого масла с выходом 48%. 1H ЯМР (300 МГц, CDCl3) δ 8,71 (д, J=1,8 Гц, 1H), 7,91 (дд, J=8,4, 1,8 Гц, 1H), 7,78 (д, J=8,4 Гц, 1H), 4,42 (кв, J=6,9 Гц, 1H), 2,64 (с, 3H), 1,92 (д, J=6,9 Гц, 3H); LC-MS: масса, вычисленная для C10H10CIF2N3S, [M+1]+ 278. Найдено 278.
К перемешиваемому раствору (1-{6-[хлор(дифтор)метил]пиридин-3-ил}этил)(метил)-λ4-сульфанилиденцианамида (F) (0,16 г, 0,6 ммоль) в этаноле (10 мл) добавляли 20% водный раствор карбоната калия (1,24 г, 1,8 ммоль) при 0°С при перемешивании. После перемешивания в течение 10 мин к смеси добавляли 80% mCPBA (0,19 г, приблизительно 0,9 ммоль), и ее перемешивали при 0°С в течение 2 ч, после чего реакцию гасили шпателем твердого тиосульфата натрия. Большую часть растворителя этанола удаляли при пониженном давлении и добавляли смесь насыщенный водный раствор NaHCO3:рассол (1:1, об./об.) и смесь экстрагировали хлороформом три раза. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Осадок очищали на силикагеле с использованием 35-50% ацетона в гексане в качестве элюента с получением 0,092 г продукта (1-{6-[хлор(дифтор)метил]пиридин-3-ил}этил)(метил)оксидо-λ4-сульфанилиденцианамида (4) в виде бесцветного масла с выходом 57%. 1H ЯМР (300 МГц, CDCl3) δ 8,79 (С, 1H), 8,09 (д, J=8,1 Гц, 1H), 7,80 (д, J=8,1 Гц, 1H), 4,73 (кв, J=12 Гц, 1H), 3,16 и 3,11 (2с, 3H, смесь двух диастереомерных α-CH3-групп между сульфоксиминовой и пиридиновой частью), 2,00 (д, J=7,2 Гц, 3H); LC-MS: масса, вычисленная для C10H10ClF2N3OS, [M-1]+ 292. Найдено 292.
Пример IV. Получение [1-(6-трихлорметилпиридин-3-ил)этил](метил)-оксидо-λ 4 -сульфанилиденцианамида (5)
Смесь 5-этилпиридин-2-карбоновой кислоты (1,98 г, 13 ммоль), фенилфосфонового дихлорида (2,8 г, 14,3 ммоль), пентахлорида фосфора (7,7 г, 32 ммоль) перемешивали и медленно нагревали. После образования прозрачно желтой жидкости смесь нагревали до температуры кипячения с обратным холодильником в течение ночи. После охлаждения летучие вещества удаляли при пониженном давлении. Осадок осторожно выливали в насыщенный водный раствор карбоната натрия, охлажденный на ледяной бане. Затем водную фазу экстрагировали CH2Cl2 два раза. Объединенный органический слой промывали рассолом, сушили над безводным Na2SO4, фильтровали, концентрировали и частично очищали на силикагеле, элюируя 10% EtOAc в гексане с получением 2,7 г неочищенного продукта, содержащего как 5-этил-2-(трихлорметил)пиридин, так и 5-(1-хлорэтил)-2-(трихлорметил)пиридин в соотношении приблизительно 3:1 (данные GC, масса, вычисленная для C8H8Cl3N и C8H7Cl4N, [M]+ 223 и 257, соответственно. Найдено 223 и 257 соответственно).
Затем смесь указанного выше неочищенного продукта (2,6 г) в тетрахлорметане (100 мл) обрабатывали 80°С N-бромсукцинимидом (1,9 г, 11 ммоль) и бензоилпероксидом (0,66 г, 0,275 ммоль), а затем кипятили с обратным холодильником в течение ночи. Твердое вещество отфильтровывали, фильтрат концентрировали и полученный осадок очищали на силикагеле с использованием 4% EtOAc в гексане с получением 1,0 г желаемого продукта 5-(1-бромэтил)-2-(трихлорметил)пиридина (A) в виде желтого твердого вещества. Объединенный выход для двух стадий составил 25%. GC-MS: масса, вычисленная для C8H7BrCl3N, [M-1-Cl]+ 266. Найдено 266.
Раствор 5-(1-бромэтил)-2-(трихлорметил)пиридина (A) (0,95 г, 3,14 ммоль) в этаноле (15 мл) обрабатывали тиометоксидом натрия (0,44 г, 6,29 ммоль) порционно при 0°С. Смесь перемешивали при комнатной температуре в течение ночи. Затем растворитель этанол удаляли при пониженном давлении и осадок повторно отбирали в CH2Cl2 и рассол. Две фазы разделяли и органический слой сушили над безводным Na2SO4, фильтровали, концентрировали. Осадок очищали на силикагеле с использованием 5% EtOAc в гексане с получением 0,57 г частично чистого 5-[1-(метилтио)этил]-2-(трихлорметил)пиридина (B) с выходом неочищенного продукта 67%. GC-MS: масса, вычисленная для C9H10Cl3NS, [M]+ 269. Найдено 269.
К перемешиваемому раствору 5-[1-(метилтио)этил]-2-(трихлорметил)пиридина (B) (0,55 г 2,3 ммоль) и цианамида (0,097 г, 2,3 ммоль) в THF (7 мл), охлажденному до 0°С, добавляли йодбензолдиацетат (0,75 г, 2,3 ммоль) одной порцией. Полученную смесь перемешивали при 0°С в течение 1 ч, а затем при комнатной температуре в течение 2 ч. Растворитель удаляли в вакууме и полученную смесь очищали на силикагеле с использованием 50% ацетона в гексане с получением 0,254 г (1E)-метил-{1-[6-(трихлорметил)пиридин-3-ил]этил}-λ4-сульфанилиденцианамида (C) в виде не совсем белого твердого вещества с входом 40%. 1H ЯМР для диастереомерной смеси (300 МГц, d6-ацетон) δ 8,87 (с, 1H), 8,21-8,25 (м, 2H), 4,65-4,76 (м, 1H), 2,86-2,66 (м, 3H), 1,88-1,92 (м, 3H).
К перемешиваемому раствору (1E)-метил-{1-[6-(трихлорметил)пиридин-3-ил]этил}-λ4-сульфанилиденцианамида (C) (0,20 г, 0,65 ммоль) в этаноле (15 мл) добавляли 20% водный раствор карбоната калия (1,3 мл) при 0°С, а затем добавляли 80% mCPBA. Полученную смесь перемешивали в течение 2 ч при 0°С, а затем гасили твердым тиосульфатом натрия. Большую часть растворителя выпаривали и к смеси добавляли смесь насыщенный водный раствор NaHCO3:рассол 1:1 (об./об.) и смесь экстрагировали хлороформом три раза. Объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали. Осадок очищали на силикагеле с использованием 40% ацетона в гексане с получением 0,10 г [1-(6-трихлорметилпиридин-3-ил)этил](метил)оксидо-λ4-сульфанилиденцианамида (5) в виде бесцветного масла с выходом 50%. 1H ЯМР (300 МГц, CDCl3) δ 8,83 (с, 1H), 8,12-8,23 (м, 1H), 5,15 (кв, 1H), 3,37 и 3,28 (2с, 3H, смесь двух диастереомерных α-CH3-групп между сульфоксиминовой и пиридиновой частью), 2,03 (д, 3H); LC-MS: масса, вычисленная для C10H12Cl3N3OS, [M+1]+ 328. Найдено 328.
Пример V. Получение [1-(6-дифторметилпиридин-3-ил)этил](метил)-оксидо-λ 4 -сульфанилиденцианамида (6)
К раствору 2-йод-5-бромпиридина (18,4 г, 65 ммоль) в THF (100 мл) при -15°С по каплям добавляли хлорид изопропилмагния (2 M, 35 мл, 70 ммоль) с такой скоростью, чтобы температура реакционной смеси не превышала 0°С. Реакционную смесь перемешивали при -15°С в течение 1 ч, затем по каплям добавляли DMF (7,5 мл, 97 ммоль) с такой скоростью, чтобы температура реакционной смеси не превышала 0°С. Реакционную смесь перемешивали в течение 30 мин, затем нагревали до комнатной температуры в течение дополнительного 1 ч. Реакционную смесь обратно охлаждали до 0°С и по каплям добавляли 2 Н HCl (80 мл), поддерживая температуру ниже 20°С. После перемешивания в течение 30 мин добавляли 2 Н NaOH, пока не достигали pH 7. Затем органический слой отделяли и водный слой экстрагировали CH2Cl2 (3×). Объединенные органические слои сушили над MgSO4, концентрировали и очищали флэш-хроматографией (SiO2, 10% EtOAc/гексан) с получением 5-бромпиридин-2-карбальдегида (A) в виде белого твердого вещества (7,3 г, 60%). 1H ЯМР (300 МГц, CDCl3) δ 10,0 (с, 1H), 8,9 (с, 1H), 8,0 (д, 1H), 7,8 (д, 1H).
К охлажденному раствору 5-бромпиридин-2-карбальдегида (A) (7,0 г, 38 ммоль) в CH2Cl2 (300 мл) при -78°С добавляли трифторид диэтиламиносеры (DAST, 10,8 мл, 83 ммоль). Реакционной смеси позволяли нагреться до комнатной температуры в течение 6 ч, затем ее медленно гасили H2O, промывали насыщенным водным раствором NaHCO3 и сушили над Na2SO4. Концентрирование и очистка на слое силикагеля (элюент CH2Cl2) давали 5-бром-2-дифторметилпиридин (B) в виде коричневых кристаллов (5,3 г, 67%). 1H ЯМР (300 МГц, CDCl3) δ 8,8 (с, 1H), 8,0 (д, 1H), 7,6 (д, 1H), 6,6 (т, 1H).
К раствору 5-бром-2-дифторметилпиридина (B) (1,8 г, 8,6 ммоль) в THF (40 мл) при 25°С по каплям добавляли хлорид изопропилмагния (2M, 8,6 мл, 17 ммоль). Реакционной смеси позволяли перемешаться в течение 2 ч, затем добавляли DMF (660 мкл, 8,6 ммоль) и реакционную смесь перемешивали в течение дополнительных 22 ч. Реакционную смесь гасили 2 M HCl и подщелачивали 1 M NaOH, пока не достигали pH 7. Органический слой отделяли и водный слой экстрагировали CH2Cl2. Объединенные органические слои сушили над Na2SO4, концентрировали и очищали флэш-хроматографией (10% EtOAc/гексан) с получением 6-дифторметилпиридин-3-карбальдегида (C) в виде оранжевого масла (320 мг, 24%).
К раствору 6-дифторметилпиридин-3-карбальдегида (C) (500 мг, 3,2 ммоль) в MeOH (10 мл) при 0°С добавляли NaBH4