Конъюгаты rgd-(бактерио)хлорофилл для фотодинамической терапии и визуализации некротических опухолей
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, а именно к конъюгатам RGD-бактриохлорофилл, которые направляются в некротические домены опухоли и накапливаются в них значительно дольше, чем в ненекротических доменах, для применения в минимально инвазивной нацеленной на опухоль визуализации, нацеленной на опухоль фотодинамической терапии и/или интерактивного прогнозирования некротических опухолей. 5 н. и 11 з.п. ф-лы, 38 пр., 34 ил., 2 табл.
Реферат
Область техники
Настоящее изобретение создано в области онкологии и относится к обнаружению некротических доменов опухолей путем нацеленной на опухоль фотодинамической визуализации и к лечению указанных опухолей нацеленной на опухоль фотодинамической терапией с использованием фотосенсибилизаторов, в частности, конъюгатов производных хлорофилла и бактериохлорофилла с пептидами, содержащими мотив RGD, или с пептидомиметиками RGD.
Определения и сокращения
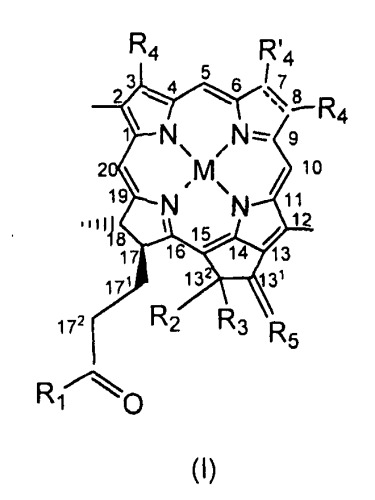
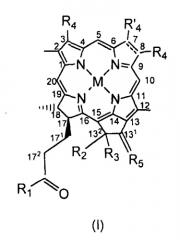
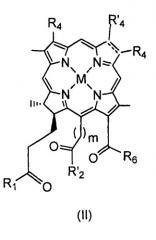
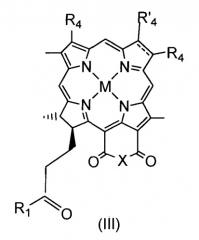
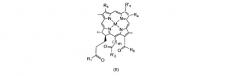
Bchl a: бактериохлорофилл a: пентациклический 7,8,17,18-тетрагидропорфирин с 5-м изоциклическим кольцом, центральным атомом Mg, пентильной или геранилгеранильной группой в положении 17, группой COOCH3 в положении 13, атомом H в положении 13, метильными группами в положениях 2, 7, 12, 18, ацетильной группой в положении 3 и этильной группой в положении 8, в настоящем документе соединение 1; Bphe: бактериофеофитин a (Bchl, в котором центральный Mg заменен двумя атомами H); Bpheid: бактериофеофорбид a (C-172-свободная карбоновая кислота, образованная из Bphe без центрального атома металла); Chl: хлорофилл; родобактериохлорин: тетрациклический 7,8,17,18-тетрагидропорфирин, имеющий группу -CH2CH2COOH в положении 17, -COOH в положении 13, метильные группы в положениях 2, 7, 12, 8, и этильные группы в положениях 3 и 8; Pd-Bpheid: Pd-бактериофеофорбид a; EC: эндотелиальные клетки; ECM: внеклеточный матрикс; NIR: ближняя инфракрасная область; PDT: фотодинамическая терапия; RGD-4C: циклический нонапептид CDCRGDCFC-NH2; ROS: активные формы кислорода.
На протяжении описания для производных бактериохлорофилла используют нумерацию IUPAC. При использовании этой номенклатуры природные бактериохлорофиллы несут два сложных эфира карбоновых кислот в положениях 132 и 172, однако они этерифицированы в положениях 133 и 173.
Уровень техники
Некроз и гипоксия первичных и метастатических опухолей высоко связаны с агрессивностью опухоли и с плохим прогнозом у больных злокачественными опухолями. Солидные опухоли, которые достигают определенного размера, опережают снабжение кислородом и становятся гипоксическими, и, в конечном итоге, некротическими. В областях опухолей, расположенных на расстоянии более 70 мкм от питающего кровеносного сосуда, давление кислорода в интерстиции снижается и на расстоянии более 150-180 мкм клетки становятся практически аноксическими (Vaupel et al. 2001). Полагают, что некроз является результатом хронической ишемии, которую вызывает сосудистый коллапс и быстрый рост опухолевых клеток, превышающий скорость ангиогенеза (Leek et al. 1999).
Некротические области в солидных опухолях претерпевают морфологические модификации. Сначала первоначальная структура в целом сохраняется, и некротические клетки сохраняют общую форму, но становятся более высоко эозинофильными. Через некоторое время эта картина изменяется на разжижающий некроз, при котором клеточные структуры разрушаются (Leek et al. 1999).
Как некроз, так и гипоксия являются общеизвестными индикаторами плохого прогноза. Для переходно-клеточной карциномы верхних мочевыводящих путей, злокачественной мезотелиомы и почечноклеточного рака (RCC) некроз был предложен в качестве независимого прогностического фактора исхода злокачественной опухоли и в качестве очень мощного инструмента для прогностических целей (Edwards et al. 2003; Sengupta et al. 2005; Lee et al. 2007).
При инвазивной карциноме молочной железы некроз был связан с высокой плотностью сосудов и ангиогенезом, высокими уровнями очаговой инфильтрации макрофагов и сниженной выживаемостью пациентов (Kato et al. 1997; Lee et al. 1997; Leek et al. 1999; Tomes et al. 2003). Центральный некроз, который является частым признаком рака молочной железы, связывали с плохим исходом и агрессивным поведением опухоли. Было показано, что макрофаги привлекаются в некротические опухоли хемотактическими факторами, высвобождаемыми гипоксическими или погибающими опухолевыми клетками (Leek et al. 1999). Большие некротические области в просвете протоков наблюдали в угревидной (инвазивной) карциноме протоков in situ (DCIS) в противоположность не угревидной (неинвазивной) DCIS (Cutuli et al. 2002). Некроз и гипоксия в центре очагов повреждения DCIS с диаметром вплоть до 360 мкм показали значительные биологические отличия в природе и поведении неопластических клеток. Таким образом, было обнаружено, что присутствие или отсутствие некроза в протоках является надежным критерием для классификации DCIS (Bussolati et al. 2000).
Было показано, что некроз в большинстве из этих типов опухолей связан с гипоксией (Tomes et al. 2003). Гипоксия и аноксия подвергают опухолевые клетки окислительному стрессу. Было показано, что длительные гипоксические условия повышают частоту мутаций, ускоряют прогрессирование опухоли, усиливают ангиогенез и метастатический потенциал и активируют запускающие рост каскады передачи сигнала. Адаптация к окислительному стрессу часто делает опухолевые клетки устойчивыми к определенным терапевтическим воздействиям (Brown et al., 2001).
Связь между некрозом и гипоксией твердо установлена, однако могут существовать гипоксические состояния, которые не достигают некроза, или некроз, который не обязательно отражает острую или тяжелую гипоксию (Dewhirst 1998). Существует несколько маркерных генов гипоксии, среди них: ген индуцируемого гипоксией фактора 1 (HIF1), переносчика глюкозы 1 и карбоангидразы IX. Только детекция всех трех маркеров позволяет классификацию некроза (Tomes et al. 2003), что делает идентификацию области в качестве некротической по экспрессии генов довольно сложной.
Известно, что некротические и гипоксические состояния создают существенную проблему при терапии злокачественной опухоли. Гипоксические домены опухоли являются относительно устойчивыми к лучевой терапии, поскольку активация лучевой атаки является слабой и поскольку стволовые клетки, которые возможно могут присутствовать в объеме опухоли, не отвечают на лечение хорошо, что приводит к повторному росту опухоли (Brown et al., 1998; Dean et al., 2005). Поскольку большинство химиотерапевтических реагентов обеспечивают гибель клеток вследствие взаимодействий с проходящими жизненный цикл клетками, арест клеток вследствие гипоксии приводит к устойчивости к общепринятой химиотерапии, оставляя непролиферирующие или медленно пролиферирующие клетки неповрежденными (Tannock, 1978). Более того, гипоксические состояния обычно создают кислую среду, которая может изменить свойства лекарственного средства, делая его менее активным (Tannock et al., 1989).
Один из наиболее проблематичных аспектов химиотерапии солидных опухолей связан с доставкой лекарственных средств в опухоли и особенно в гипоксические и некротические домены. Обычно опухоли содержат нерегулярные и пропускающие микрососуды с гетерогенным кровотоком и большими межсосудистыми расстояниями. Эти признаки, в дополнение к отсутствию надлежащего лимфатического дренажа и высокому давлению в интерстиции, делают диффузию наиболее важным механизмом внесосудистого транспорта питательных веществ и лекарственных средств в опухоли. Однако вследствие нерегулярной васкуляризации, многие из опухолевых клеток находятся на больших расстояниях от капилляров, чем клетки в нормальных тканях, что приводит к наличию недостаточных концентраций противоопухолевых средств в этих клеточных областях. Более того, усиленное давление интерстициальной жидкости вследствие недостаточности лимфатического дренажа приводит к конвекционному поглощению и далее ингибирует распределение лекарственных средств, в частности, макромолекул, в опухолевые клетки (Minchinton et al, 2006).
Таким образом, способность выявлять гипоксические и некротические области в опухолях in vivo является крайне важной. Знание о гипоксических опухолевых доменах может помочь в выборе правильного лечения, либо путем повышения доставки кислорода до или в процессе лечения, либо с использованием стратегий, в которых используется гипоксия (Weinmann et al., 2004). С использованием этого подхода применение активированных гипоксией цитотоксинов, таких как 2-циклопропилиндолхиноны, AQ4N, тирапазамин (TPZ) и PR-104 может помочь улучшить исход лечения (Brown et al., 2004; Lee et al., 2007; Patterson et al. 2007).
Для идентификации некроза и гипоксии обычно используют гистопатологию и иммуногистохимию; однако эти методы являются инвазивными и не обеспечивают возможность детекции in situ. Способы in situ включают магнитно-резонансную томографию (MRI) (Kamel et al. 2003; Metz et al. 2003), зависимую от уровня оксигенации крови MRI (Kennan et al. 1997), позитронную эмиссионную томографию (PET) (Lehtio et al. 2004) и диффузионно-взвешенную MRI (Lang et al. 1998).
Авидные к некрозу контрастные средства (NACA) для MRI можно подразделить на основанные на порфирине и основанные не на порфирине средства. Одним из наиболее известных основанных на порфирине NACA является гадофрин-2, который демонстрирует специфичное к некрозу накопление по краям некротической области. Было предположено, что механизм накопления основан на транспорте сывороточного альбумина (SA), однако недавние исследования подвергли этот подход сомнению (Hofmann et al. 1999; Ni et al. 2005).
Большинство злокачественных клеток не могут расти до поддающихся клинической детекции опухолевых масс в отсутствие кровеносных сосудов. Поэтому опухоли, достигающие определенного размера (приблизительно 2-3 мм3) для поддержания их роста должны переключаться на ангиогенный фенотип. Переключение на ангиогенный фенотип может выражаться в несбалансированной экспрессии ангиогенных факторов и ингибиторов ангиогенеза. Для индукции роста новых кровеносных сосудов необходимы и достаточны как сверхэкспрессия ангиогенных факторов, так и подавление ингибиторов ангиогенеза, и для переключения на ангиогенез опухоли эти два процесса обычно протекают одновременно (Cao 2005).
Биохимические признаки, которые указывают на кровеносные сосуды в опухолях, могут включать связанные с ангиогенезом молекулы, такие как некоторые интегрины. Интегриновое семейство рецепторов адгезии клеток включает различные 24 αβ гетеродимеры, которые распознают гликопротеиновые лиганды во внеклеточном матриксе и на поверхностях клеток. Многие представители семейства интегринов, включая α5β1, α8β1, αIIbβ3, αVβ3, αVβ5, αVβ6 и αVβ8, распознают мотив Arg-Gly-Asp (RGD) на их лигандах. Эти лиганды включают фибронектин, фибриноген, витронектин, фактор фон-Виллебранда и многие другие крупные гликопротеины (Takagi 2004). Таким образом, было предположено, что молекулы, содержащие мотив RGD, обеспечивают новые возможности для селективного захвата и последующей визуализации и детекции первичных очагов повреждения опухоли, некротических областей и нацеленных лекарственных средств. Эта область исследования привлекает возрастающее внимание. Существует множество данных об использовании RGD-меченных соединений для визуализации (Temming et al. 2005). Основным недостатком, описанным в литературе, является недостаточная концентрация репортерного элемента в области опухолей менее 4-5 мм. Поэтому применение RGD-нацеленной визуализации, главным образом, ограничено сканированием PET, которое является более чувствительным способом.
Понимание механизма роста опухоли, образования метастазов и взаимодействия опухоль-хозяин и ангиогенеза требует моделей опухолей, которые позволяют легко отслеживать опухолевые клетки, даже на их индивидуальном уровне. Предшествующие способы, используемые для прямого измерения наиболее значимых биологических параметров опухолей, доступны только посредством инвазивных конечных процедур (Lyons 2005). Большинство таких способов включает гистопатологическое исследование или иммуногистохимию, которые являются медленными, инвазивными и не всегда чувствительными подходами (Yang et al. 2000). Таким образом, необходимо внедрение новых способов, которые обеспечивают прямую визуализацию опухолевых тканей, являются неинвазивными и обеспечивают измерение связанных с опухолью параметров как на клеточном, так и на молекулярном уровне.
За последние несколько лет были разработаны неинвазивные способы: MRI и спектроскопия, PET, однофотонная эмиссионная компьютерная томография и компьютерная томография (Lyons 2005).
Существует несколько способов визуализации, которые основаны на трансгенах. Эти способы обеспечивают неинвазивное измерение широкого диапазона биологических параметров с превосходной специфичностью к опухоли, визуализацию всего организма в моделях на живых животных и детекцию метастазов. Двумя из этих способов являются: биолюминесцентная визуализация и флуоресцентная визуализация.
Оптическая биолюминесценция основана на трех компонентах: фермент люцифераза, субстрат люциферин и аденозинтрифосфат (ATP). В этом способе для получения эмиссии света не требуется светового возбуждения. Однако если один из этих компонентов отсутствует, детекция невозможна. Способ обеспечивает мониторинг жизнеспособности клеток или функции клеток с высокой эффективностью вследствие высокого значения сигнал/шум (Lyons 2005). Основным недостатком способа с люциферазой/люциферином является низкое анатомическое разрешение и четкость изображения, таким образом, требуя значительного количества времени для того, чтобы собрать достаточное количество фотонов для формирования изображения от животного под анестезией. Более того, повышенная глубина тканей и необходимость в экзогенной доставке вещества ослабляют эмиссию света in vivo (Yang et al., 2000; Lyons, 2005). Кроме того, эксперименты ex vivo трудно проводить, поскольку для активности фермента требуется ATP. Важно, что способ вовлекает субъективный выбор параметров, который снижает его количественную ценность.
Другой способ мониторинга прогрессии опухоли путем оптической флуоресцентной визуализации основан на трансфекции опухолевых клеток стабильным флуоресцентным белком, таким как зеленый флуоресцентный белок (GFP) и красный флуоресцентный белок (RFP). В этом способе имеется необходимость во внешнем возбуждении перед тем, как можно проводить детекцию эмиссии. Основными недостатками этого способа являются следующие: (1) возбуждающий и эмиссионный свет имеет тенденцию к ослаблению при увеличении глубины ткани и (2) аутофлуоресценция немеченых клеток повышает шум (Lyons, 2005). Основные преимущества включают: множество репортерных длин волн, обеспечивающих мультиплексную визуализацию; высокая совместимость с рядом подходов ex vivo для аналитических способов, таких как анализ свежей ткани; отсутствие необходимости в подготовительных процедурах для визуализации, что делает этот способ особенно пригодным для визуализации в живой ткани; способ является внешним и неинвазивным; способ обеспечивает флуоресцентную оптическую визуализацию в реальном времени внутренних растущих опухолей и метастазов у животных после их трансплантации, которая может дать изображение всего организма, а также изображение отдельных клеток, извлеченных из первичного очага повреждения или метастазов (Yang et al., 2000; Lyons, 2005). Визуализация всего организма является одним из наиболее требуемых инструментов для понимания развития опухоли. Таким образом, путем генетического мечения опухолевых клеток посредством GFP или RPP, можно достигать наружной визуализации первичных и метастатических опухолей по всему организму (Yang et al. 2000).
Флуоресцентное мечение подходит для детекции in vivo, свежей ткани и in vitro. Использование опухолевых клеток, экспрессирующих флуоресцентные белки, обеспечивает визуализацию живых животных и наблюдение за прогрессией опухоли в различные моменты времени. RPP имеет испускание с большей длиной волны, чем GFP, таким образом, обеспечивая более высокую чувствительность и разрешение в отношении роста микроскопических опухолей (длина волны возбуждения GFP - 489 нм, длина волны испускания - 508 нм, длина волны возбуждения RFP - 558 нм, длина волны испускания - 583 нм).
Карцинома протоков in situ (DCIS) включает клональную пролиферацию клеток, которые являются злокачественными и накапливаются в просвете протоков молочной железы без признаков инвазии в соседнюю строму молочной железы и за пределы эпителиальной базальной мембраны. Существует большая вероятность трансформации ненвазивных очагов DCIS в инвазивное, угрожающее жизни заболевание, если их не лечить на ранней стадии. После широкого распространения маммографии значительно выросло число пациентов, у которых диагностируют DCIS на ранней стадии, и рекомендованный способ лечения продвинулся от мастэктомии (с уровнем излечения, близким к 100%) до хирургической операции (BCS) с сохранением молочной железы (BC), например, удаления опухоли молочной железы или минимально инвазивной хирургической операции на молочной железе (Kepple et al., 2004), необязательно в сопровождении RT и адъювантной эндокринной терапии. Однако недавно было выявлено, что частоты рецидивов после BCS, как ипсилатерально (та же молочная железа), так и контрлатерально (другая молочная железа), даже в сопровождении RT, являются значительно более высокими, чем после мастэктомии, в частности, для пациентов в возрасте ≤40 (уровень регрессии 25-35%; Bijker N et al., 2006; Cutuli et al., 2002). Более того, многоочаговое поражение приводит к затруднению неполного иссечения, так же как и постоянное вовлечение краев, которое, как было выявлено, является критическим для полной регрессии опухоли (Cellini et al., 2005). Кроме того, существенными являются физическая и психологическая нагрузка и возможные косметические исходы удаления опухоли молочной железы с последующим RT. Эти недостатки делают лечение и управление течением DCIS в настоящее время спорными вопросами в терапии рака молочной железы и стимулируют поиск новых и/или дополнительных возможностей лечения и прогнозирования.
DCIS представляет собой биологически гетерогенную форму злокачественной опухоли с разнообразными клиническими проявлениями, гистологией, клеточными признаками и биологическим потенциалом. Ее подразделяют на угревидную (инвазивную) и неугревидную (неинвазивную) карциномы, где угревидная является более высокозлокачественным, потенциально более инвазивным субтипом, обычно содержащим большую некротическую область в просвете протоков с выраженной цитологической атипией. Согласно ожиданиям, приблизительно две трети пациентов с DCIS от промежуточной до низкозлокачественной имеют многоочаговое ипсилатеральное заболевание с расстояниями между различными очагами, которые могут достигать 1 см (Cutuli et al., 2002). Высокозлокачественные очаги имеют тенденцию к непрерывности с расстояниями между ними менее 5 мм (Cellini et al., 2005).
Естественное развитие неинвазивной DCIS в инвазивную опухоль молочной железы занимает 15-20 лет и вовлекает от 14 до 60 процентов женщин, у которых поставлен этот диагноз (Burstein et al., 2004). В действительности, DCIS, по-видимому, является стадией развития рака молочной железы, на которой многие из молекулярных явлений, которые определяют инвазивный рак молочной железы, уже присутствуют (Cutuli et al., 2002; Holland et al., 1990). Конкретно, из ~30% низкозлокачественных очагов в отсутствие лечения развивается инвазивная карцинома (Sanders et al., 2005). Очаги с диаметром более 2,5 см часто сопровождаются скрытыми микроинвазивными опухолями, которые могут не превышать 0,1 мм. Вовлечение краев опухоли является важным прогностическим маркером. Близкие к области удаления (менее 1 мм) или положительные края, высокозлокачественные и/или угревидные области связаны с более высоким риском рецидива.
Аналогично многим другим злокачественным опухолям, образование новых кровеносных сосудов (ангиогенез) при раке молочной железы играет центральную роль как в локальной прогрессии опухоли, так и в развитии различных метастазов (Boehm-Viswanathan, 2000; Kieran et al., 2003). В ткани DCIS была выявлена значительно более высокая плотность микрососудов (MVD) по сравнению с окружающей нормальной тканью (Guidi et al., 1994; Guidi et al., 1997; Guinebretiere et al., 1994). Фиброзно-кистозные очаги с наиболее высокой плотностью сосудов ассоциированы с более высоким риском рака молочной железы (Guidi et al., 1994; Guidi et al., 1997; Guinebretiere et al., 1994). При гистопатологическом исследовании агрессивные очаги повреждения DCIS связаны с повышенной MVD и экспрессией сосудисто-эндотелиального фактора роста (VEGF) (Guidi et al., 1997; Schneider et al., 2005). Клинико-патологические связи также подтверждают основную роль ангиогенеза в прогрессировании рака молочной железы, что делает его привлекательной мишенью для терапии и прогнозирования DCIS (Folkman, 1997; Krippl et al., 2003; Relf et al., 1997). Кооптация сосудов, рост путем врастания (Patan et al., 1996), сосудистая мимикрия и васкулогенез являются встречающимися в природе процессами, которые могут снизить зависимость опухоли от классического ангиогенеза. Особенно важным является открытие, что воспалительный рак молочной железы практически полностью зависит от васкулогенеза, по-видимому, вследствие неспособности злокачественных клеток связываться с эндотелиальными клетками.
Критическая зависимость DCIS от высоко плотного сосудистого ложа сделала антиангиогенную (ингибирование образование новых кровеносных сосудов) и антиваскулярную (окклюзия/разрушение существующих кровеносных сосудов) терапии (Shimizu et al., 2005; Thorpe, 2004) привлекательными вариантами локализованной терапии BC (Schneider et al., 2005; Folkman, 1996). Действительно, антиангиогенные лекарственные средства, такие как бевацизумаб (антитело против рецептора VEGF-A) и SU011248 (ингибитор тирозина рецептора VEGF) находятся на фазе II клинических испытаний. Интересно, что также было выявлено, что тамоксифен обладает антиангиогенной активностью. Кроме того, накапливающиеся данные указывают на недостаточность антиангиогенного подхода. Они включают необходимость в длительном лечении, частичный отказ от "теории устойчивости к устойчивости" (Schneider et al., 2005; Streubel et al., 2004) и фармакокинетическую устойчивость. Вследствие этих препятствий, антиваскулярный подход в настоящее время является более перспективным, и, как ожидается, приводящим к устранению всей опухоли без необходимости в длительном лечении (Folkman, 2004) Недавно появившимся перспективным способом нацеленного на сосуды лечения является фотодинамическая терапия (VTP).
Аналогично, нацеливание парамагнитных металлов с соответствующей способностью к релаксации, позитронно-активных химических групп (например, 64Cu), или флуоресцентных зондов на плотное сосудистое ложе DCIS, должно обеспечить новые способы детекции соответствующих очагов, определения краев и прогнозирование, как объяснено ниже. Было показано, что флуоресцентная детекция очагов рака молочной железы является пригодной на глубине вплоть до 10 мм (Britton, 2006). Динамическая MRI с Gd в качестве контрастного средства основана на усиленной проницаемости сосудов опухоли и ее в настоящее время используют для локализации опухоли в молочной железе (Rankin, 2000). Однако использование MRI в настоящее время ограничено коротким временем интеграции доступных контрастных средств, которые действуют кратковременно, но не захватываются опухолевой тканью селективно.
Фотодинамическая терапия (PDT) создает всплеск цитотоксических активных форм кислорода (ROS) в выбранной области лечения. Вследствие их короткого времени жизни, токсичность ROS ограничивается областью облучения. PDT, как правило, состоит из пяти стадий: 1. Внутривенное (IV) введение фотосенсибилизатора; 2. Период времени, который обеспечивает достижения в ткани-мишени желательной концентрации фотосенсибилизаторов; 3. Чрескожное или интерстициальное облучения ткани-мишени высокоинтенсивным лазерным излучением (вплоть до 1 Вт для непрерывного излучения) через тонкие (диаметром 0,4 мм или менее) оптические волокна для облучения глубоких тканей с последующим локальным образованием цитотоксических ROS; 4. Развитие некроза опухоли или эрадикация опухоли; 5. Ремоделирование и заживление ткани.
Нацеленная на сосуды PDT (VTP) направлена на образование ROS в кровеносных сосудах обрабатываемой ткани, которое можно проводить либо путем облучения ткани светом сразу после введения сенсибилизатора, либо с использованием сенсибилизаторов, которые не подвергаются экстравазации из кровотока. В лаборатории авторов настоящего изобретения было разработано несколько поколений бактериохлорофилльных сенсибилизаторов, называемых в настоящем документе "производными Bchl" или "BchlD". Синтезированные соединения (Rosenbach-Belkin et al., 1996; US 5650292) обладают сильным поглощением в NIR (750-765 нм), обеспечивая глубокое проникновение света в ткани субъекта и диаметр лечения вплоть до 4 см вокруг цилиндрического волокна с высокой плотностью потока (20 мВт-1 Вт). При облучении светом, в опухоли и вблизи нее циркулирующие BchlD создают локальную высокую концентрацию ROS (радикалы OH• и O2 -), приводят к сворачиванию крови и перфорации сосудов опухоли с последующем полным блокированием сосудов опухоли после облучения в течение нескольких минут. В случае некоторых производных Bchl наблюдали прямую интоксикацию эндотелиальных клеток (Gross et al., 2003; Mazor et al., 2005). По исследуемым в настоящее время причинам, ответ сосудов опухоли является значительно более быстрым и агрессивным по сравнению с ответом сосудов в окружающей нормальной ткани. Эффективность обработки приводит к высоким уровням излечения (выживание животных 60-90%) (Mazor et al., 2005). Важно, что внутривенно инъецированные сенсибилизаторы быстро выводятся из кровотока подвергаемых лечению животных (T1/2 составляет порядка от нескольких минут до нескольких часов (Mazor et al.,2005)), позволяя избегать длительной токсичности кожи и позволяя повторение обработки, при необходимости. В фазе II клинических испытаний на локализованном раке предстательной железы у пациентов, где лучевая терапия оказалась неуспешной (Weersink et al., 2005), VTP на основе BchlD, как правило, приводила к успешной эрадикации очагов опухоли у 50-60% подвергавшихся обработке пациентов и ремоделированию ткани. Повторная обработка как на моделях животных, так и у человека (клинические испытания фазы II/III), привела к сходным и более высоким уровням излечения на сеанс (в зависимости от дозы лекарственного средства и света), повышая ожидаемый общий уровень успеха до ~90% после 2-3 сеансов. Важно, что в исследованиях на животных были выявлены значительно более высокие уровни излечения на сеанс при более высоких дозах применяемого сенсибилизатора.
Фотодинамическая терапия (PDT) опухолей вовлекает комбинацию вводимого фотосенсибилизатора и локальной доставки света, оба из которых самостоятельно являются безвредными средствами, но в присутствии молекулярного кислорода они способны продуцировать цитотоксические активные формы кислорода (ROS), которые могут устранить клетки. Являясь двойным лечебным воздействием, PDT позволяет большую специфичность и имеет потенциал к тому, чтобы быть более селективной, и в то же время менее деструктивной по сравнению с обычно используемыми химиотерапией или лучевой терапией (Dougherty et al. 1998).
Использование новых производных бактериохлорофилла (Bchl) в качестве сенсибилизаторов при PDT было описано авторами настоящего изобретения в последние годы (Zilberstein et al., 2001; Schreiber et al., 2002; Gross et al., 1997; Zilberstein et al., 1997; Rosenbach-Belkin et al., 1996; Gross et al., 2003a; Koudinova et al., 2003; Preise et al., 2003; Gross et al., 2003b) и в патентных публикациях US 5726169, US 5650292, US 5955585, US 6147195, US 6740637, US 6333319, US 6569846, US 7045117, DE 41 21 876, EP 1 246 826, WO 2004/045492, WO 2005/120573. Спектры, фотофизика и фотохимия производных Bchl делают их оптимальными светособирающими молекулами с очевидными преимуществами над другими сенсибилизаторами, используемыми в настоящее время в PDT. Эти производные Bchl, главным образом, являются полярными и остаются в кровотоке в течение очень короткого периода времени практически без экстравазации в другие ткани (Brandis, 2003; Mazor et al. 2005). Таким образом, эти соединения являются хорошими кандидатами для нацеленной на сосуды PDT (VTP), в основе которой лежит кратковременная (5-10 мин) внутрисосудистая встреча со светом и более высокая чувствительность сосудов опухоли к образованным при PDT цитотоксическим ROS.
Недавние исследования, проведенные группой авторов настоящего изобретения, показали, что первичная фотосенсибилизация является внутрисосудистой с быстрым развитием ишемической окклюзии и стаза в ходе периода облучения. Этот процесс также обеспечивает индуцируемое фотохимически перекисное окисление липидов (LPO) и раннюю гибель эндотелиальных клеток, которая ограничена, главным образом, сосудами опухоли (Koudinova et al. 2003). Вследствие независимого от света прогрессирования цепных реакции свободных радикалов совместно с развитием гипоксии, LPO и гибель клеток распространяются за сосудистый отдел, охватывая весь интерстиций опухоли до достижения полного некроза опухоли приблизительно через 24 часа после PDT. Таким образом, первичное действие PDT блокирует кровоснабжение и индуцирует гипоксию, которая вторично инициирует серию молекулярных и патофизиологических явлений, которые завершаются эрадикацией опухоли. Важно, что этот подход основан на различиях между ответом нормальных и опухолевых кровеносных сосудов на образованные ROS.
В международной заявке WO 2008/023378 тех же заявителей, приведенной в настоящий документ в качестве ссылки в полном объеме, описаны новые конъюгаты производных порфирина, хлорофилла и бактериохлорофилла (Bchl) с пептидами, содержащими мотив RGD или с пептидомиметиками RGD, и их применение в способах фотодинамической терапии и диагностике in vivo опухолей и различных сосудистых заболеваний, таких как связанная со старением дегенерация желтого пятна. В частности, производное Bchl с(RGDfK)-Pd-MLT (соединение 24) показало накопление вплоть до 4-8 мкМ в ксенотрансплантатах первичных опухолей и оно остается в области опухоли в течение длительного периода времени, обеспечивая накопление сигнала и хорошее отношение сигнала к шуму.
Флуоресцентное мечение подходит для детекции in vivo, в свежей ткани и in vitro. c(RGDfK)-Pd-MLT имеет собственную флуоресценцию в нижней инфракрасной области (NIR), которую можно выявлять. c(RGDfK)-2H-MLT имеет способность к свечению на три порядка выше и, таким образом, оно может быть еще лучшим кандидатом для нацеленной визуализации. В этом исследовании авторы настоящего изобретения показали, что эти молекулы открывают возможность для точной детекции краев опухоли и некроза в модели аденокарциномы молочной железы человека. Детекция краев опухолей и детекция некроза на сегодняшний день представляют собой две из наиболее затруднительных проблем в лечении опухоли. Более того, оба эти признака являются достоверными прогностическими факторами повторного роста опухоли после лечения. Таким образом, в будущем, при клиническом применении, ожидается, что указанные выше производные RGD будут пригодны для детекции опухоли и некроза на операционном столе.
Сущность изобретения
В настоящее время в соответствии с настоящим изобретением выявлено, что конъюгаты RGD-(бактерио)хлорофилл, описанные в указанной выше WO 2008/023378, направляются в некротические домены опухоли и накапливаются в них значительно дольше, чем в ненекротических доменах опухоли.
Таким образом, настоящее изобретение относится к применению указанных конъюгатов RGD-бактериохлорофилл и RGD-хлорофилл для минимально инвазивной визуализации опухоли, нацеленной на опухоль фотодинамической терапии и/или интерактивного прогноза некротических опухолей, и к соответствующим способам.
Краткое описание фигур
На фиг.1 представлены плазмиды, использованные для трансфекции опухолевых клеточных линий красным флуоресцентным белком (RFP). 1A: плазмида pDsRed2-N1 (Clontech, Palo Alto. CA). 1B: pDsRed-Monomer-Hyg-C1 (Clontech, Palo Alto, CA), 1C: модифицированная pDsRed-Monomer-Hyg-C1.
На фиг.2A-2B представлены флуоресцентные клоны трансфицированных клеток, представленных на фиг.1, выявленные с помощью флуоресцентного микроскопа (Nikon, увеличение X10) после воздействия в течение 3 с. 2A: MDA-MB-231 RFP клон 1 (устойчивый к G418). 2B: MDA-MB-231 RFP клон 3 (устойчивый к гигромицину).
На фиг.3A-3B представлены изображения удаленных опухолей и гистологический анализ (окрашивание H&E) поперечных срезов опухолей MDA-MB-231-RFP. 3A: большая опухоль (~1 см3). 3B: небольшая опухоль (~0,5 см3) (ND - некротический домен, VD - жизнеспособный домен).
На фиг.4A-4B представлено накопление описанного в настоящем документе ниже соединения 13 в ортотопной опухоли MDA-MB-231-RFP (размер опухоли ~1 см3). Мышам инъецировали соединение 13. Изображения получали от 15 мин до 24 ч после инъекции лекарственного средства. 4A (верхняя панель): визуализация красной флуоресценции. 4B (нижняя панель): визуализация флуоресценции в NIR.
На фиг.5A-5B представлено накопление соединения 13 в ортотопной опухоли MDA-MB-231-RFP (размер опухоли ~1 см3). Мышам инъецировали соединение 13. Изображения получали с 1 по 7 сутки после инъекции лекарственного средства. 5A (верхняя панель): визуализация красной флуоресценции. 5B (нижняя панель): визуализация флуоресценции в NIR.
На фиг.6A-6B представлено накопление соединения 13 в ортотопной опухоли MDA-MB-231-RFP (размер опухоли ~0,5 см3). Мышам инъецировали соединение 13. Изображения получали от 20 мин до 24 ч после инъекции лекарственного средства. 6A (верхняя панель): визуализация красной флуоресценции. 6B (нижняя панель): визуализация флуоресценции в NIR.
На фиг.7A-7B представлено накопление соединения 13 в ортотопной опухоли MDA-MB-231-RFP (размер опухоли ~0,5 см3). Мышам инъецировали соединение 13. Изображения получали с 1 по 3 сутки после инъекции лекарственного средства. 7A (верхняя панель): визуализация красной флуоресценции. 7B (нижняя панель): визуализация флуоресценции в NIR.
На фиг.8 представлен график, на котором показано измерение флуоресцентного сигнала соединения 13 в опухоли относительно противоположной стороны. Флуоресцентный сигнал в фотонах/с/см2 измеряли у 9 животных как для стороны опухоли, так и для противоположной стороны. Результаты получали от 15 мин до 216 ч после инъекции соединения 13. Представлен средний результат для всех животных в каждый момент, а также соотношение флуоресценции между опухолью и противоположной стороной.
На фиг.9A-9B представлено накопление соединения 24 в ортотопной опухоли MDA-MB-231-RFP (размер опухоли ~1 см3). Мышам инъецировали соединение 24. Изображения получали от 1 ч до 24 ч после инъекции лекарственного средства. 9A (верхняя панель): визуализация красной флуоресценции. 9B (нижняя панель): визуализация флуоресценции в NIR.
На фиг.10A-10B представлено накопление соединения 24 в ортотопной опухоли MDA-MB-231-RFP (размер опухоли ~1 см3). Мышам инъецировали соединение 24, и изображения получали с 1 по 7 сутки после инъекции лекарственного средства. 10A (верхняя панель): визуализация красной флуоресценции. 10B (нижняя панель): визуализация флуоресценции в NIR.
На фиг.11A-11B представлено накопление соединения 24 в ортотопной опухоли MDA-MB-231-RFP (размер опухоли ~0,5 см3). Мышам инъецировали соединение 24, и изображения получали от 20 мин до 24 ч после инъекции лекарственного средства. 11A (верхняя панель): визуализация красной флуоресценции. 11B (нижняя панель): визуализация флуоресценции в NIR.
На фиг.12A-12B представлено накопление соединения 24 в ортотопной опухоли MDA-MB-231-RFP (размер опухоли ~0,5 см3). Мышам инъецировали соединение 24, и изображения получали с 1 по 2 сутки после инъекции лекарственного средства. 12A (верхняя панель): визуализация красной флуоресценции. 12B (нижняя панель): визуализация флуоресценции в NIR.
На фиг.13A-13B представлено накопление соединения 13 в ортотопной опухоли MLS-mBanana (размер опухоли ~1 см3). Мышам инъецировали соединение 13. Изображения получали от 1 ч до 24 ч после инъекции лекарственного средства. 13A (верхняя панель): визуализация красной флуоресценции. 13B (нижняя панель): визуализация флуоресценции в NIR.
На фиг.14A-14B представлено накопление соединения 13 в ортотопной опухоли MLS-mBanana (размер опухоли ~1 см3). Мышам инъецировали соединение 13. Изображения получали с 1 по 4 сутки после инъекции лекарственного средства. 14A (верхняя панель): визуализация красной флуоресценции. 14B (нижняя панель): визуализация флуоресценции в NIR.
На фиг.15A-15B представлено накопление соединения 13 в ортотопной опухоли MLS-mBanana (размер опухоли ~0,5 см3). Мышам инъецировали соединение 13. Изображения получали от 10 мин до 24 часов после инъекции лекарственного средства. 15A (верхняя панель): визуализация красной флуоресценции. 15B (нижняя панель): визуализация флуоресценции в NIR.
На фиг.16A-16B представлено накопление соединения 13 в ортотопной опухоли MLS-mBanana (размер опухоли ~0,5 см3). Мышам инъецировали соединение 13. Изображения получали с 1 по 4 сутки после инъекции лекарственного ср