Белки
Иллюстрации
Показать всеИзобретение относится к биотехнологии, в частности к варианту фермента липидацилтрансферазы, с повышенной фосфолипидтрансферазной активностью. Полученный фермент содержит аминокислотный мотив GDSX, где Х представляет собой один или несколько из следующих аминокислотных остатков L, A, V, I, F, Y, H, Q, T, N, M или S и модификацию одной или нескольких аминокислот по сравнению с исходным ферментом. Данный фермент используют для получения пищевых продуктов, а также для уменьшения содержания фосфолипидов в пищевом масле. Изобретение позволяет получить эффективный вариант фермента с повышенной фосфолипидтранферазной активностью. 8 н.п. ф-лы, 61 ил., 1 табл., 10 пр.
Реферат
ССЫЛКА НА СВЯЗАННЫЕ ЗАЯВКИ
Сделана ссылка на следующие связанные заявки: заявка США № 09/750990, поданная 20 июля 1999 г.; заявка США № 10/409391; заявка США № 60/489441, поданная 23 июля 2003 г.; заявка Великобритании № GB 0330016,7, поданная 24 декабря 2003 г. и международная патентная заявка № PCT/IB2004/000655, поданная 15 января 2004 г. Каждая из этих заявок и каждый из приводимых в этих заявках документов ("цитируемые в заявке документы") и каждый документ, на который ссылались или который цитировали в документах ссылочной заявки, в тексте или при выполнении этих заявок, а также во всех подтверждениях патентоспособности, поданных в процессе ее ведения, таким образом, приведен здесь в качестве ссылки. Также в данном тексте процитированы различные документы ("здесь ссылочные документы"). Каждый из ссылочных документов и каждый документ, который процитирован или на который сделана ссылка в ссылочных документах, таким образом, приведен здесь в качестве ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам получения вариантов ферментов. Настоящее изобретение дополнительно относится к новым вариантам ферментов и к применению этих новых вариантов ферментов.
УРОВЕНЬ ТЕХНИКИ
В последнее временя были найдены ферменты липид:холестеринацилтрансферазы (см., например, Buckley - Biochemistry 1983, 22, 5490-5493). В частности, были обнаружены глицерофосфолипид:холестеринацилтрансферазы (GCAT), которые, подобно лецитин:холестеринацилтрансферазам (LCAT) растений и/или млекопитающих, катализируют перенос жирной кислоты между фосфатидилхолином и холестерином.
Upton и Buckley (TIBS 20, May 1995, p178-179), а также Brumlik и Buckley (J. of Bacteriology Apr. 1996, p2060-2064) указывают, что липаза/ацилтрансфераза из Aeromonas hydrophila способна осуществлять перенос ацила на спиртовые рецепторы в водной среде.
Для ацетилтрансферазы A. hydrophila были идентифицированы предполагаемые домен связывания субстрата и активный центр (см., например, Thornton et al 1988 Biochem. et Biophys. Acta. 959, 153-159 and Hilton & Buckley 1991 J. Biol. Chem. 266, 997-1000).
Buckley et al. (J. Bacteriol 1996, 178 (7) 2060-4) указали, что Ser16, Asp116 и His291 являются необходимыми аминокислотами, которые необходимы для поддержания ферментативной активности.
Robertson et al. (J. Biol. Chem. 1994, 269, 2146-50) указали на некоторые конкретные мутации ацилтрансферазы A. hydrophila, а именно Y226F, Y230F, Y30F, F13S, S18G, S18V, ни к одной из которых не относится настоящее изобретение.
КРАТКОЕ ИЗЛОЖЕНИЕ АСПЕКТОВ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на открытии конкретных вариантов содержащего GDSX фермента липидацилтрансферазы, которые обладают повышенной трансферазной активностью по сравнению с исходным ферментом. В частности, варианты по настоящему изобретению обладают повышенной по сравнению с исходным ферментом трансферазной активностью, используя в качестве донора ацила галактолипид. Эти липидацилтрансферазы в настоящем описании обозначены как гликолипидацилтрансферазы. Варианты по настоящему изобретению дополнительно могут обладать повышенным отношением трансферазной активности, используя галактолипиды в качестве доноров ацила к фосфолипидтрансферазной активности (отношение GL:PL), и/или повышенным отношением по сравнению с исходным ферментом отношением трансферазной активности, используя в качестве донора ацила галактолипиды, к галактолипидгидролизной активности (отношение GLt:GLh) по сравнению с отношением исходного фермента.
В первом аспекте настоящее изобретение относится к способу получения варианта фермента гликолипидацилтрансферазы, предусматривающему: (a) отбор исходного фермента, представляющего собой фермент липидацилтрансферазу, отличающуюся тем, что фермент содержит аминокислотный мотив GDSX, где X представляет собой один или несколько из следующих аминокислотных остатков L, A, V, I, F, Y, H, Q, T, N, M или S; (b) модификацию одной или нескольких аминокислот с получением варианта липидацилтрансферазы; (c) тестирование варианта липидацилтрансферазы на активность в отношении галактолипидного субстрата и, необязательно, фосфолипидного субстрата и/или, необязательно, триглицеридного субстрата; (d) отбор варианта фермента с повышенной активностью в отношении галактолипидов по сравнению с исходным ферментом; и, необязательно, (e) получение большого количества варианта фермента.
В другом аспекте настоящее изобретение относится к варианту фермента гликолипидацилтрансферазы, отличающегося тем, что фермент содержит аминокислотный мотив GDSX, где X представляет собой один или несколько из следующих аминокислотных остатков L, A, V, I, F, Y, H, Q, T, N, M или S, и где вариант фермента по сравнению с исходной последовательностью содержит одну или несколько модификаций аминокислот в любых, одном или нескольких, аминокислотных остатках, определенных в наборе 2, или наборе 4, или наборе 6, или наборе 7 (определенных здесь ниже).
В дополнительном аспекте настоящее изобретение относится к варианту фермента гликолипидацилтрансферазы, отличающемуся тем, что фермент содержит аминокислотный мотив GDSX, где X представляет собой один или несколько из следующих аминокислотных остатков L, A, V, I, F, Y, H, Q, T, N, M или S, и где вариант фермента по сравнению с исходной последовательностью содержит одну или несколько модификаций аминокислот в любых, одном или нескольких, аминокислотных остатках, подробно описанных в наборе 2, или наборе 4, или наборе 6, или наборе 7 (определенных здесь ниже), идентифицируемых указанной исходной последовательностью, структурно сравненной с определенной здесь структурной моделью P10480, которая предпочтительно получена посредством структурного сравнения координат кристаллической структуры P10480 с 1IVN.PDB и/или 1DEO.PDB, как указано здесь.
Дополнительно настоящее изобретение относится к варианту фермента гликолипидацилтрансферазы, отличающемуся тем, что фермент содержит аминокислотный мотив GDSX, где X представляет собой один или несколько из следующих аминокислотных остатков L, A, V, I, F, Y, H, Q, T, N, M или S, и где вариант фермента содержит одну или несколько модификаций аминокислот по сравнению с исходной последовательностью в любых, одной или нескольких, аминокислотных остатках указывали в наборе 2, идентифицируемых при сравнении исходной последовательности с консенсусной последовательностью pfam (SEQ ID NO:1) и модифицируемых по структурной модели P10480 для обеспечения наибольшего перекрывания (см. фиг.55), как указано.
В дополнительном аспекте настоящее изобретение относится к варианту фермента гликолипидацилтрансферазы, где вариант фермента содержит аминокислотную последовательность, которая приведена в SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:12, SEQ ID NO:14, SEQ ID NO:16, SEQ ID NO:18, SEQ ID NO:20, SEQ ID NO:22, SEQ ID NO:24, SEQ ID NO:26, SEQ ID NO:28, SEQ ID NO:30, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:39, SEQ ID NO:41, SEQ ID NO:43 или SEQ ID NO:45, за исключением одной или нескольких модификаций аминокислот в любых, одном или нескольких, аминокислотных остатках, определенных в наборе 2, или наборе 4, или наборе 6, или наборе 7 (определенных здесь ниже), идентифицируемых сравнением последовательности с SEQ ID NO:2.
В дополнительном аспекте настоящее изобретение относится к варианту фермента гликолипидацилтрансферазы, где вариант фермента содержит аминокислотную последовательность, которая приведена в SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:12, SEQ ID NO:14, SEQ ID NO:16, SEQ ID NO:18, SEQ ID NO:20, SEQ ID NO:22, SEQ ID NO:24, SEQ ID NO:26, SEQ ID NO:28, SEQ ID NO:30, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:39, SEQ ID NO:41, SEQ ID NO:43 или SEQ ID NO:45, за исключением одной или нескольких модификаций аминокислот в любых, одном или нескольких, аминокислотных остатках, определенных в наборе 2, или наборе 4, или наборе 6, или наборе 7, идентифицируемых указанной исходной последовательностью, структурно сравненной с определенной здесь структурной моделью P10480, предпочтительно полученной посредством структурного сравнения координат кристаллической структуры P10480 с 1IVN.PDB и/или 1DEO.PDB, как указано здесь.
В дополнительном аспекте настоящее изобретение относится к варианту фермента гликолипидацилтрансферазы, где вариант фермента содержит аминокислотную последовательность, которая приведена в SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:12, SEQ ID NO:14, SEQ ID NO:16, SEQ ID NO:18, SEQ ID NO:20, SEQ ID NO:22, SEQ ID NO:24, SEQ ID NO:26, SEQ ID NO:28, SEQ ID NO:30, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:39, SEQ ID NO:41, SEQ ID NO:43 или SEQ ID NO:45, за исключением одной или нескольких модификаций аминокислот в любых, одном или нескольких, аминокислотных остатках указывали в наборе 2, идентифицируемых при сравнении исходной последовательности с консенсусной последовательностью pfam (SEQ ID NO:1) и модифицируемых по структурной модели P10480 для обеспечения наибольшего перекрывания (см. фиг.55), как указано.
Дополнительно настоящее изобретение относится к применению варианта гликолиполитического фермента по настоящему изобретению или полученного способом по настоящему изобретению для производства субстрата (предпочтительно, пищевого продукта) для получения лизогликолипида, например, дигалактозилмоноглицерида (DGMG) или моногалактозилмоноглицерида (MGMG), посредством обработки гликолипида (например, дигалактозилдиглицерида (DGDG) или моногалактозилдиглицерида (MGDG)) вариантом липолитического фермента по настоящему изобретению или полученным способом по настоящему изобретению с получением продукта частичного гидролиза, т.е. лизогликолипида.
В дополнительном аспекте настоящее изобретение относится к применению варианта липолитического фермента по настоящему изобретению или полученного способом по настоящему изобретению для производства субстрата (предпочтительно, пищевого продукта) для получения лизофосфолипида, например, лизолецитина, посредством обработки фосфолипида (например, лецитина) вариантом липолитического фермента по настоящему изобретению или полученным способом по настоящему изобретению с получением продукта частичного гидролиза, т.е. лизофосфолипида.
В одном из аспектов настоящее изобретение относится к способу получения пищевого продукта, где способ предусматривает добавление варианта липолитического фермента по настоящему изобретению или полученного способом по настоящему изобретению к одному или нескольким ингредиентам пищевых продуктов.
В другом аспекте настоящее изобретение относится к способу получения выпеченного из теста продукта, где способ предусматривает добавление варианта липолитического фермента по настоящему изобретению или полученного способом по настоящему изобретению в тесто.
В другом аспекте настоящее изобретение относится к применению варианта липолитического фермента по настоящему изобретению или полученного способом по настоящему изобретению в производстве яичного продукта для получения лизофосфолипидов.
В другом аспекте предоставлен способ обработки яиц или яичных продуктов, предусматривающий добавление варианта липолитического фермента по настоящему изобретению в яйцо или яичный продукт для получения лизофосфолипида.
Варианты изобретения можно применять в способе получения полуфабрикатов пищевых продуктов, таких как макаронные изделия быстрого приготовления по аналогии с WO 02/065854.
Настоящее изобретение относится к применению варианта липидацилтрансферазы по настоящему изобретению для получения предпочтительного технического результата или сочетания технических результатов, например, в пищевом продукте (такие как технические результаты, перечисленные здесь в разделе "Технические результаты").
В дополнительном аспекте настоящее изобретение относится к способу ферментативного рафинирования растительных или пищевых масел, предусматривающему обработку пищевого или растительного масла вариантом липолитического фермента по настоящему изобретению или полученным способом по настоящему изобретению так, чтобы гидролизовать большую часть полярных липидов (например, фосфолипиды и/или гликолипиды).
В другом аспекте настоящее изобретение относится к способу, предусматривающему обработку фосфолипида с тем, чтобы гидролизовать жирные ацильные группы, где способ предусматривает смешивание указанных фосфолипидов с вариантом липолитического фермента по настоящему изобретению или полученным способом по настоящему изобретению.
В другом аспекте настоящее изобретение относится к способу уменьшения содержания фосфолипидов в пищевом масле, предусматривающему обработку масла вариантом липолитического фермента по настоящему изобретению или полученным способом по настоящему изобретению с тем, чтобы гидролизовать большую часть фосфолипидов, и отделение содержащей гидролизованный фосфолипид водной фазы от масла.
Также предоставлен способ получения варианта липолитического фермента по настоящему изобретению или полученного способом по настоящему изобретению, где способ предусматривает трансформацию клетки-хозяина рекомбинантной нуклеиновой кислотой, содержащей нуклеотидную последовательность, кодирующую указанный вариант липолитического фермента, где клетка-хозяин способна к экспрессии нуклеотидной последовательности, кодирующей полипептид липолитического фермента, культивирование трансформированной клетки-хозяина в условиях, при которых возможна экспрессия нуклеиновой кислоты и получение варианта липолитического фермента.
В дополнительном аспекте настоящее изобретение относится к применению варианта липолитического фермента по настоящему изобретению или полученного способом по настоящему изобретению в биоконверсии полярных липидов (предпочтительно гликолипидов) для получения высокоценных продуктов, таких как сложные эфиры углеводов и/или сложные эфиры белков и/или сложные эфиры белковых субъединиц и/или сложные эфиры оксикислот.
Способ биоконверсии полярных липидов (предпочтительно, гликолипидов) в высокоценные продукты включает в себя смешивание указанного полярного липида с вариантом липолитического фермента по настоящему изобретению или полученным способом по настоящему изобретению.
Также настоящее изобретение дополнительно относится к иммобилизованному варианту липолитического фермента по настоящему изобретению или полученному способом по настоящему изобретению.
Аспекты настоящего изобретения предоставлены в формуле изобретения и в следующих ниже комментариях.
Другие аспекты, относящиеся к нуклеотидным последовательностям, которые можно использовать по настоящему изобретению включают в себя: конструкцию, содержащую последовательности по настоящему изобретению; вектор, содержащий последовательности для применения по настоящему изобретению; плазмиду, содержащую последовательности для применения по настоящему изобретению; трансформированную клетку, содержащую последовательности для применения по настоящему изобретению; трансформированную ткань, содержащую последовательности для применения по настоящему изобретению; трансформированный орган, содержащий последовательности для применения по настоящему изобретению; трансформированного хозяина, содержащего последовательности для применения по настоящему изобретению; трансформированный организм, содержащий последовательности для применения по настоящему изобретению. Настоящее изобретение также относится к способам экспрессии нуклеотидной последовательности для применения по настоящему изобретению с ее использованием, таким как экспрессия в клетке-хозяине, включая сюда способы для ее переноса. Настоящее изобретение дополнительно относится к способам выделения нуклеотидной последовательности, таким как выделение из клетки-хозяина.
Другие аспекты, относящиеся к аминокислотной последовательности для применения по настоящему изобретению включают в себя: конструкцию, кодирующую аминокислотные последовательности для применения по настоящему изобретению; вектор, кодирующий аминокислотные последовательности для применения по настоящему изобретению; плазмиду, кодирующую аминокислотные последовательности для применения по настоящему изобретению; трансформированную клетку, экспрессирующую аминокислотные последовательности для применения по настоящему изобретению; трансформированную ткань, экспрессирующую аминокислотные последовательности для применения по настоящему изобретению; трансформированный орган, экспрессирующий аминокислотные последовательности для применения по настоящему изобретению; трансформированного хозяина, экспрессирующего аминокислотные последовательности для применения по настоящему изобретению; трансформированный организм, экспрессирующий аминокислотные последовательности для применения по настоящему изобретению. Настоящее изобретение также относится к способам очистки аминокислотной последовательности для применения по настоящему изобретению с ее использованием, таким как экспрессия в клетке-хозяине; включая сюда способы ее переноса, а затем очистки указанной последовательности.
Для удобства использования, эти и дополнительные аспекты настоящего изобретения будут обсуждены под соответствующими заголовками разделов. Однако информация каждого раздела не обязательно ограничена каждым конкретным разделом.
ОПРЕДЕЛЕНИЕ НАБОРОВ
Набор аминокислот 1:
Набор аминокислот 1 (необходимо отметить, что они представляют собой аминокислоты в 1IVN - фиг.57 и фиг.58).
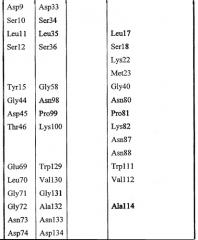
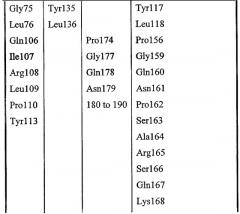
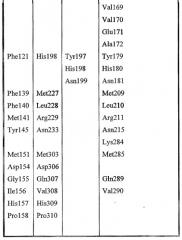
Gly8, Asp9, Ser10, Leu11, Ser12, Tyr15, Gly44, Asp45, Thr46, Glu69, Leu70, Gly71, Gly72, Asn73, Asp74, Gly75, Leu76, Gln106, Ile107, Arg108, Leu109, Pro110, Tyr113, Phe121, Phe139, Phe140, Met141, Tyr145, Met151, Asp154, His157, Gly155, Ile156, Pro158.
Высококонсервативные мотивы, такие как GDSX, и входящие в состав каталитического центра остатки исключены из набора 1 (подчеркнутые остатки). Во избежание неопределенности, набор 1 определен аминокислотными остатками в пределах 10 Å от центрального углеродного атома глицерина в активном центре модели 1IVN.
Набор аминокислот 2:
Набор аминокислот 2 (необходимо отметить, что нумерация аминокислот относится к аминокислотам в зрелой последовательности P10480).
Leu17, Lys22, Met23, Gly40, Asn80, Pro81, Lys82, Asn87, Asn88, Trp111, Val112, Ala114, Tyr117, Leu118, Pro156, Gly159, Gln160, Asn161, Pro162, Ser163, Ala164, Arg165, Ser166, Gln167, Lys168, Val169, Val170, Glu171, Ala172, Tyr179, His180, Asn181, Met209, Leu210, Arg211, Asn215, Lys284, Met285, Gln289 и Val290.
Таблица выбранных остатков в наборе 1 по сравнению с набором 2:
Набор аминокислот 3:
Набор аминокислот 3 идентичен набору 2, но относится к кодирующей последовательности Aeromonas salmonicida (SEQ ID NO:28), т.е. номера аминокислотных остатков в наборе 3 на 18 больше, т.к. это отражает разницу между нумерацией аминокислот в зрелом белке (SEQ ID NO:2) по сравнению с белком, включающем в себя сигнальную последовательность (SEQ ID NO:28).
Зрелые белки Aeromonas salmonicida GDSX (SEQ ID NO:28) и Aeromonas hydrophila GDSX (SEQ ID NO:26) отличаются пятью аминокислотами. Они представляют собой Thr3Ser, Gln182Lys, Glu309Ala, Ser310Asn, Gly318-, где остаток salmonicida приведен первым, а остаток hydrophila приведен последним (фиг.59). Белок hydrophila состоит в длину только из 317 аминокислот и у него отсутствует остаток в положении 318. Aeromonas salmonicidae GDSX обладает значительно большей активностью в отношении полярных липидов, таких как галактолипидные субстраты, чем белок Aeromonas hydrophila. Сканирование участков проводилось на всех пяти позициях аминокислот.
Набор аминокислот 4:
Набор аминокислот 4 представляет собой S3, Q182, E309, S310, и -318.
Набор аминокислот 5:
F13S, D15N, S18G, S18V, Y30F, D116N, D116E, D157N, Y226F, D228N, Y230F.
Набор аминокислот 6:
Набор аминокислот 6 представляет собой Ser3, Leu17, Lys22, Met23, Gly40, Asn80, Pro81, Lys82, Asn87, Asn88, Trp111, Val112, Ala114, Tyr117, Leu118, Pro156, Gly159, Gln160, Asn161, Pro162, Ser163, Ala164, Arg165, Ser166, Gln167, Lys168, Val169, Val170, Glu171, Ala172, Tyr179, His180, Asn181, Gln182, Met209, Leu210, Arg211, Asn215, Lys284, Met285, Gln289, Val290, Glu309, Ser310, -318.
Нумерация аминокислот в наборе 6 относится к аминокислотным остаткам в P10480 (SEQ ID NO:2) - соответствующие аминокислоты в других основных цепях последовательностей можно определить посредством гомологичного сравнения и/или структурного сравнение с P10480 и/или 1IVN.
Набор аминокислот 7:
Набор аминокислот 7 представляет собой Ser3, Leu17, Lys22, Met23, Gly40, Asn80, Pro81, Lys82, Asn87, Asn88, Trp111, Val112, Ala114, Tyr117, Leu118, Pro156, Gly159, Gln160, Asn161, Pro162, Ser163, Ala164, Arg165, Ser166, Gln167, Lys168, Val169, Val170, Glu171, Ala172, Tyr179, His180, Asn181, Gln182, Met209, Leu210, Arg211, Asn215, Lys284, Met285, Gln289, Val290, Glu309, Ser310, -318, Y30X (где X выбран из A, C, D, E, G, H, I, K, L, M, N, P, Q, R, S, T, V или W), Y226X (где X выбран из A, C, D, E, G, H, I, K, L, M, N, P, Q, R, S, T, V или W), Y230X (где X выбран из A, C, D, E, G, H, I, K, L, M, N, P, Q, R, S, T, V или W), S18X (где X выбран из A, C, D, E, F, H, I, K, L, M, N, P, Q, R, T, W или Y), D157X (где X выбран из A, C, E, F, G, H, I, K, L, M, P, Q, R, S, T, V, W или Y).
Нумерация аминокислот в наборе 7 относится к аминокислотным остаткам в P10480 (SEQ ID NO:2) - соответствующие аминокислоты в других основных цепях последовательностей можно определить посредством гомологичного сравнения и/или структурного сравнение с P10480 и/или 1IVN.
ПОДРОБНОЕ ИЗЛОЖЕНИЕ АСПЕКТОВ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Предпочтительно, исходный фермент липидацилтрансфераза содержит любую из следующих ниже аминокислотных последовательностей: SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:12, SEQ ID NO:14, SEQ ID NO:16, SEQ ID NO:18, SEQ ID NO:20, SEQ ID NO:22, SEQ ID NO:24, SEQ ID NO:26, SEQ ID NO:28, SEQ ID NO:30, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:39, SEQ ID NO:41, SEQ ID NO:43 или SEQ ID NO:45 или аминокислотную последовательность, обладающую 75% или более идентичностью с любой из последовательностей, представленных в SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:12, SEQ ID NO:14, SEQ ID NO:16, SEQ ID NO:18, SEQ ID NO:20, SEQ ID NO:22, SEQ ID NO:24, SEQ ID NO:26, SEQ ID NO:28, SEQ ID NO:30, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:39, SEQ ID NO:41, SEQ ID NO:43 или SEQ ID NO:45.
Таким образом, исходный фермент липидацилтрансфераза по настоящему изобретению содержит аминокислотную последовательность, которая по меньшей мере, на 80%, предпочтительно, по меньшей мере, на 85%, более предпочтительно, по меньшей мере, на 90%, более предпочтительно, по меньшей мере, на 95%, больше чем, по меньшей мере, на 98% гомологична любой последовательности, представленной как SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:12, SEQ ID NO:14, SEQ ID NO:16, SEQ ID NO:18, SEQ ID NO:20, SEQ ID NO:22, SEQ ID NO:24, SEQ ID NO:26, SEQ ID NO:28, SEQ ID NO:30, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:39, SEQ ID NO:41, SEQ ID NO:43 или SEQ ID NO:45.
Таким образом, исходный фермент липидацилтрансфераза может кодировать любая из следующих ниже нуклеотидных последовательностей: SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:13, SEQ ID NO:15, SEQ ID NO:17, SEQ ID NO:19, SEQ ID NO:21, SEQ ID NO:23, SEQ ID NO:25, SEQ ID NO:27, SEQ ID NO:29, SEQ ID NO:31, SEQ ID NO:32, SEQ ID NO:35, SEQ ID NO:38, SEQ ID NO:40, SEQ ID NO:42, SEQ ID NO:44 или SEQ ID NO:46 или нуклеотидная последовательность, которая по меньшей мере, на 75% или более идентична любой из последовательностей, представленных как SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:13, SEQ ID NO:15, SEQ ID NO:17, SEQ ID NO:19, SEQ ID NO:21, SEQ ID NO:23, SEQ ID NO:25, SEQ ID NO:27, SEQ ID NO:29, SEQ ID NO:31, SEQ ID NO:32, SEQ ID NO:35, SEQ ID NO:38, SEQ ID NO:40, SEQ ID NO:42, SEQ ID NO:44 или SEQ ID NO:46.
Таким образом, нуклеотидная последовательность может быть на 80% или более, предпочтительно, на 90% или более, более предпочтительно, на 95% или более, даже более предпочтительно, на 98% или более, идентична любой из последовательностей, представленных как SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:13, SEQ ID NO:15, SEQ ID NO:17, SEQ ID NO:19, SEQ ID NO:21, SEQ ID NO:23, SEQ ID NO:25, SEQ ID NO:27, SEQ ID NO:29, SEQ ID NO:31, SEQ ID NO:32, SEQ ID NO:35, SEQ ID NO:38, SEQ ID NO:40, SEQ ID NO:42, SEQ ID NO:44 или SEQ ID NO:46.
Предпочтительно, исходный фермент модифицирован по одному или нескольким из аминокислотных остатков, определенных в наборе 2, или наборе 4, или наборе 6, или наборе 7 при сравнении с эталонной последовательностью (SEQ ID NO:2) или структурном сравнении по структурной модели P10480, или сравненных по консенсусной последовательности pfam и модифицированных по структурной модели P10480.
Таким образом, вариант фермента по сравнению с исходным ферментом может обладать повышенным отношением активности в отношении галактолипидов к активности в отношении либо фосфолипидов, либо/и триглицеридов.
Таким образом, способ по настоящему изобретению может предусматривать тестирование варианта липидацилтрансферазы на:
(i) трансферазную активность в отношении галактолипидного субстрата, и
(ii) трансферазную активность в отношении фосфолипидного субстрата; и
отбор варианта фермента, который по сравнению с исходным ферментом обладает повышенным отношением трансферазной активности в отношении галактолипидов к трансферазной активности в отношении фосфолипидов.
Таким образом, отношение трансферазной активности варианта фермента по настоящему изобретению в отношении галактолипидов к трансферазной активности в отношении фосфолипидов может представлять собой, по меньшей мере, 1, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4 или, по меньшей мере, 5.
Таким образом, способ по настоящему изобретению может предусматривать тестирование варианта липидацилтрансферазы на:
(a) трансферазную активность в отношении галактолипидного субстрата, и
(b) гидролитическую активность в отношении галактолипидного субстрата; и
отбор варианта фермента с повышенным отношением трансферазной активности в отношении галактолипидов к его гидролитической активности в отношении гликолипидов по сравнению с отношением исходного фермента.
Таким образом, отношение трансферазной активности для галактолипидов к гидролитической активности в отношении галактолипидов может составлять более 1, по меньшей мере, 1,5, по меньшей мере, 2, по меньшей мере, 4 или, по меньшей мере, 5.
Анализ для определения трансферазной и гидролитической активности в отношении галактолипидов и/или фосфолипидов указан, например, в примере 8.
Термин "повышенная активность в отношении галактолипидов" означает фермент, который по сравнению с исходным ферментом обладает повышенной (т.е. большей) трансферазной активностью, если липидным донором ацила является галактолипид, (галактолипидтрансферазная активность), и/или по сравнению с исходным ферментом обладает повышенным отношением галактолипидтрансферазной активности к фосфолипидтрансферазной активности (отношение GLt:PLt), и/или по сравнению с исходным ферментом обладает повышенным отношением галактолипидтрансферазной активности к галактолипидгидролазной активности (отношение GLt:GLh).
Таким образом, вариант фермента по сравнению с исходным ферментом может обладать повышенной галактолипидтрансферазной активностью и либо такой же, либо меньшей галактолипидгидролитической активностью. Другими словами, таким образом, вариант фермента может обладать большей галактолипидтрансферазной активностью по сравнению с его галактолипидгидролитической активностью по сравнению с исходным ферментом. Таким образом, вариант фермента может предпочтительно переносить ацильную группу с галактолипида на акцептор ацила вместо простого гидролиза галактолипида.
В одном из вариантов осуществления фермент по настоящему изобретению может обладать повышенной трансферазной активностью в отношении фосфолипидов (т.е. повышенной фосфолипидтрансферазной активностью) по сравнению с исходным ферментом. Эта повышенная фосфолипидтрансферазная активность может быть независимой от повышенной активности в отношении галактолипидов. Однако, таким образом, вариант фермента может обладать повышенной галактолипидтрансферазной активностью и повышенной фосфолипидтрансферазной активностью.
В одном из вариантов осуществления настоящее изобретение относится к варианту фермента липидацилтрансферазы, отличающемуся тем, что фермент содержит аминокислотный мотив GDSX, где X представляет собой один или несколько из следующих аминокислотных остатков L, A, V, I, F, Y, H, Q, T, N, M или S, где вариант обладает повышенной активностью в отношении фосфолипидов, предпочтительно, повышенной фосфолипидтрансферазной активностью, по сравнению с исходным ферментом, и где вариант фермента содержит одну или несколько модификаций аминокислот по сравнению с исходной последовательностью в любых, одном или нескольких, аминокислотных остатках, определенных в наборе 2, или наборе 4, или наборе 6, или наборе 7.
Как применяют здесь, термин "модифицирование" означает добавление, замену и/или удаление. Предпочтительно термин "модифицирование" означает "замену".
Во избежание неопределенности, когда в исходном ферменте замещена аминокислота, она предпочтительно замещена аминокислотой, отличающейся от аминокислоты, первоначально обнаруженной в исходном ферменте в этом положении, таким образом, чтобы получить вариант фермента. Другими словами, термин "замена" не предназначен для обозначения замещения аминокислоты той же аминокислотой.
Предпочтительно, исходный фермент представляет собой фермент, содержащий аминокислотную последовательность, представленную как SEQ ID NO:2 и/или SEQ ID NO:28.
Предпочтительно, вариант фермента представляет собой фермент, содержащий аминокислотную последовательность, где данная аминокислотная последовательность представлена как SEQ ID NO:2, за исключением одной или нескольких модификаций аминокислот в любых одном или нескольких аминокислотных остатках, определенных в наборе 2, или наборе 4, или наборе 6, или наборе 7.
В одном из вариантов осуществления предпочтительный вариант фермента содержит по сравнению с исходной последовательностью одну или несколько модификаций аминокислот, по меньшей мере, в одном из аминокислотных остатков, определенных в наборе 4.
Таким образом, вариант фермента по сравнению с исходным ферментом содержит одну или несколько из следующих ниже модификаций аминокислот:
S3E, A, G, K, M, Y, R, P, N, T или G
E309Q, R или A, предпочтительно Q или R
-318Y, H, S или Y, предпочтительно Y.
Предпочтительно, X из мотива GDSX представляет собой L. Таким образом, предпочтительно исходный фермент содержит аминокислотный мотив GDSL.
Предпочтительно способ получения варианта фермента липидацилтрансферазы дополнительно предусматривает одну или несколько из следующих ниже стадий:
1) картирование структурной гомологии или
2) сравнение по гомологии последовательностей.
Таким образом, картирование структурной гомологии может предусматривать одну или несколько из следующих ниже стадий:
i) сравнение исходной последовательности со структурной моделью (1IVN.PDB), показанной на фиг.52;
ii) выбор одного или нескольких аминокислотных остатков в пределах сферы размером 10 Å с центром в центральном углеродном атоме молекулы глицерина в активном центре (см. фиг.53) (такие как один или несколько из аминокислотных остатков, определенных в наборе 1 или наборе 2); и
iii) модификацию указанной исходной последовательности одной или нескольких аминокислот, выбранных в соответствии со стадией (ii).
В одном из вариантов осуществления выбранный аминокислотный остаток может находиться в пределах сферы размером 9, предпочтительно, в пределах 8, 7, 6, 5, 4, или 3 Å с центром в центральном углеродном атоме молекулы глицерина в активном центре (см. фиг.53).
Таким образом, картирование структурной гомологии может предусматривать одну или несколько из следующих ниже стадий:
i) сравнение исходной последовательности со структурной моделью (1IVN.PDB), показанной на фиг.52;
ii) выбор одой или нескольких аминокислот в пределах сферы размером 10 Å с центром в центральном углеродном атоме молекулы глицерина в активном центре (см. фиг.53) (таких как один или несколько из аминокислотных остатков, определенных в наборе 1 или наборе 2);
iii) определение того, являются ли один или несколько аминокислотных остатков, выбранных в соответствии со стадией (ii) высоко консервативными (особенно являются ли они остатками активного центра, и/или частью мотива GDSX, и/или частью мотива GANDY); и
iv) модификацию указанной исходной последовательности одной или нескольких аминокислот, выбранных в соответствии со стадией (ii), за исключением консервативных областей, идентифицированных в соответствии со стадией (iii).
В одном из вариантов осуществления выбранный аминокислотный остаток может находиться в пределах сферы размером 9, предпочтительно, в пределах 8, 7, 6, 5, 4, или 3 Å с центром в центральном углеродном атоме молекулы глицерина в активном центре (см. фиг.53).
Альтернативно описанному выше картированию структурной гомологии или совместно с ним, картирование структурной гомологии можно проводить посредством выбора конкретных областей петель (LR) или промежуточных областей (IVR), полученных из сравнения с pfam (сравнение 2, фиг.56), перекрывающихся с моделью P10480 и 1IVN. Области петель (LR) или промежуточные области (IVR) определены ниже в таблице:
В некоторых вариантах осуществления настоящего изобретения вариант фермента ацилтрансферазы содержит не только модификации аминокислот по одной или нескольким из аминокислот, определенных в любом из наборов 1-4 и 6-7, но также содержит по меньшей мере одну модификацию аминокислоты, одной или нескольких, определенных выше промежуточных областей (IVR1-6) (предпочтительно, в одной или нескольких из IVR 3, 5 и 6, более предпочтительно, в IVR5 или IVR 6) и/или в одной или нескольких из определенных выше областей петель (LR1-5) (предпочтительно, в одной или нескольких из LR1, LR2 или LR5, более предпочтительно, в LR5).
В одном из вариантов осуществления, вариант ацилтрансферазы по настоящему изобретению или полученный способом по настоящему изобретению может содержать одну или несколько модификаций аминокислот, которые определены не только в одном или нескольких наборах 2, 4, 6 и 7, но также находятся в одной или нескольких IVR 1-6 (предпочтительно, в пределах IVR 3, 5 или 6, более предпочтительно, в пределах IVR 5 или IVR 6) или в одной или нескольких из LR 1-5 (предпочтительно, в пределах LR1, LR2 или LR5, более предпочтительно, в пределах LR5).
Таким образом, вариант ацилтрансферазы по настоящему изобретению или полученный способом по настоящему изобретению может содержать одну или несколько модификаций аминокислот, которые находятся не только в наборе 1 или 2, но также расположены в пределах IVR 3.
Таким образом, вариант ацилтрансферазы по настоящему изобретению или полученный способом по настоящему изобретению может содержать одну или несколько модификаций аминокислот, которые находятся не только в наборе 1 или 2, но также расположены в пределах IVR 5.
Таким образом, вариант ацилтрансферазы по настоящему изобретению или полученный способом по настоящему изобретению может содержать одну или несколько модификаций аминокислот, которые находятся не только в наборе 1 или 2, но также расположены в пределах IVR 6.
Таким образом, вариант ацилтрансферазы по настоящему изобретению или полученный способом по настоящему изобретению может содержать одну или несколько модификаций аминокислот, которые находятся не только в наборе 1 или 2, но также расположены в пределах LR 1.
Таким образом, вариант ацилтрансферазы по настоящему изобретению или полученный способом по настоящему изобретению может содержать одну или несколько модификаций аминокислот, которые находятся не только в наборе 1 или 2, но также расположены в пределах LR 2.
Подобным образом, в некоторых вариантах осуществления настоящего изобретения вариант фермента ацилтрансферазы не только содержит модификацию аминокислоты в одном или нескольких аминокислотных остатках, находящихся в пределах сферы размером 10, предпочтительно, в пределах 9, 8, 7, 6, 5, 4, или 3 Å с центром в центральном углеродном атоме молекулы глицерина в активном центре (см. фиг.53), но также содержит по меньшей мере одну модификацию аминокислоты в одной или нескольких из определенных выше промежуточных областях (IVR1-6) (предпочтительно, в одной или нескольких из IVR 3, 5 и 6, более предпочтительно, в IVR 5 или IVR 6) и/или в одной или нескольких из определенных выше областей петель (LR1-5) (предпочтительно, в одной или нескольких из LR1, LR2 или LR5, более предпочтительно, в LR5).
В одном из вариантов осуществления предпочтительная модификация аминокислоты расположена в одном или нескольких аминокислотных остатках, находящихся в пределах сферы размером 10 Å, а также в пределах LR5.
Таким образом, картирование структурной гомологии может предусматривать одну или несколько из следующих ниже стадий:
i) сравнение исходной последовательности со структурной моделью (1IVN.PDB), показанной на фиг.52;
ii) выбор одного или нескольких аминокислотных остатков в пределах сферы 10 Å с центром в центральном углеродном атоме молекулы глицерина в активном центре (см. фиг.53) (такие как один или несколько аминокислотных остатков, определенных в наборе 1 или наборе 2); и/или выбор одного или нескольких