Антитела к рецептору конечных продуктов глубокого гликирования (rage) и их применения
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к выделенным моноклональным антителам, в частности CDR-привитым гуманизированным антителам, которые связываются с эпитопом молекулы RAGE человека и, в частности обладают способностью ингибировать связывание RAGE с различными лигандами. Изобретение также относится к способу получения указанных антител, выделенной нуклеиновой кислоте, их кодирующей, вектору экспрессии, клетке-хозяину и фармацевтической композиции. Изобретение позволяет эффективно лечить заболевания или расстройства, ассоциированные с рецептором конечных продуктов глубокого гликирования (RAGE), в том числе болезнь Альцгеймера. 9 н. и 7 з. п. формулы, 13 ил., 10 табл., 19 пр.
Реферат
2420-172588RU/011
АНТИТЕЛА К РЕЦЕПТОРУ КОНЕЧНЫХ ПРОДУКТОВ ГЛУБОКОГО ГЛИКИРОВАНИЯ (RAGE) И ИХ ПРИМЕНЕНИЯ
ОПИСАНИЕ
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящая заявка относится к антителам, в частности, к моноклональным антителам и, в частности к их CDR-привитым гуманизированным вариантам, которые можно применять для лечения и диагностики болезни Альцгеймера (AD), дегенерации клеток центральной нервной системы, нарушения обучения и памяти, аномального транспорта амилоида β и других нейровоспалительных состояний, ассоциированных с рецептором конечных продуктов глубокого гликирования (RAGE). В частности, настоящее изобретение относится к антителам и их фрагментам, которые связываются с RAGE.
УРОВЕНЬ ТЕХНИКИ
Болезнь Альцгеймера (AD) является наиболее частой причиной деменции у пожилых людей с частотой встречаемости около 10% в популяции людей в возрасте свыше 65 лет. С увеличением возраста вероятность заболевания также возрастает. В мире около 15 миллионов людей поражены заболеванием, и предполагается, что дальнейшее увеличение продолжительности жизни приведет к увеличению количества людей, пораженных заболеванием, примерно в три раза в течение следующих десятилетий. С точки зрения вышесказанного существует огромная и неотложная потребность в лечении AD. В случае такого лечения пораженные пациенты смогут поддерживать функциональный и активный образ жизни в течение многих лет, что невозможно без такого лечения. Таким образом, существуют не только финансовые последствия такого лечения, но также последствия для «качества жизни» пациентов, а также людей, осуществляющих уход за больными.
С молекулярной точки зрения AD характеризуется отложениями аномально агрегированных белков. В случае внеклеточных амилоидных бляшек такие отложения главным образом состоят из филаментов β-амилоидных пептидов (Aβ), и в случае внутриклеточных нейрофибриллярных клубков (NFT), главным образом, из белка tau. AD также характеризуется повышенной экспрессией RAGE в нейронах. RAGE является рецептором семейства иммуноглобулинов, имеющим много лигандов, который функционирует в качестве передающего сигнал акцептора Aβ на клеточной поверхности.
Несколькими группами показано, что инфузия Aβ40 у мышей приводит к вазоконстрикции сосудов головного мозга и ослаблению мозгового кровообращения (CBF). Пациенты, страдающие AD, также имеют ослабленное мозговое кровообращение. В мышиных моделях AD, в которых трансгенные животные сверхэкспрессируют белок амилоидного предшественника (APP), который приводит к заболеванию, вызывая образование бляшек, показано, что RAGE вовлечен в качестве патогенного фактора в прогрессирование заболевания (Deane et al. Nature Medicine, 9(7) pp. 907-913, 2003; Arancio et al. EMBO J, 1-10, 2004).
Показано, что RAGE связывается с Aβ-пептидами. Ингибирование такого взаимодействия подавляет накопление Aβ у трансгенных животных в модели; поэтому полагают, что RAGE вовлечен в AD. Показано, что лечение с использованием sRAGE (растворимого RAGE), а также анти-RAGE-антителами снижает количество бляшек (Deane et al, 2003). Блокирование взаимодействия RAGE с амилоидом с помощью антител может быть подходящим способом лечения пациентов с AD; однако, существующие поликлональные антитела, полученные из сыворотки животных, не подходят для хронического лечения человека.
Взаимодействие RAGE с Aβ раскрыто в заявке WO 2006/077101 A1, в которой описана конкуренция RAGE, в котором отсутствует v-домен, за связывание Aβ с RAGE, а также конкуренция пептидов, представляющих собой части C-концевого домена RAGE, главным образом, C1-домена. Взаимодействие анти-RAGE-антител с v-доменом RAGE описано в WO2007109749(A2); где также описано, что связывание различных лигандов (S100b, HMGB1 (белок 1 высокомобильной группы), амилоид aβ) с RAGE может осуществляться посредством связывания с указанным доменом.
В публикации WO 2008/137552 A2 описано связывание некоторых моноклональных анти-RAGE-антител с разными доменами RAGE. Большинство из указанных антител ингибируют взаимодействие RAGE человека и комплекса HMGB1 и CpG-ДНК.
Публикация WO2006/077101 относится к идентификации, функциональности и применению пептидов RAGE, названных AGER-RME и AGER-CDP. Указанные пептиды наряду с прочим применимы для идентификации и получения RAGE-связывающих лигандов, подобных анти-RAGE-антителам. В настоящем изобретении описаны новые моноклональные антитела, которые связываются с C-доменами RAGE, и специфичное взаимодействие и конкуренция за связывание с Aβ с моноклональными антителами к C1- и C2-домену RAGE.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к связывающим молекулам, в частности антителам, которые специфично связываются с RAGE; типичные анти-RAGE-антитела согласно изобретению могут содержать, по меньшей мере, одну из аминокислотных последовательностей вариабельной области антитела, показанных в SEQ ID NO: 1, 5, 9, 13, 17 и 21, или их отдельные CDR или родственные CDR последовательности, которые более подробно охарактеризованы ниже.
В частности, в настоящем изобретении предлагаются моноклональные антитела, которые связываются с RAGE, более конкретно, моноклональные антитела, которые связываются с C-доменом RAGE.
В настоящее изобретение включены анти-RAGE-антитела, которые специфично связываются с RAGE и содержат вариабельную область легкой цепи, имеющую аминокислотную последовательность, которая, по меньшей мере, на 90% идентичная любой из последовательностей SEQ ID NO: 5, 13 и 21, или представляет собой RAGE-связывающий фрагмент антитела в пределах указанных последовательностей.
Также предлагаются анти-RAGE-антитела, которые специфично связываются с RAGE и содержат вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, которая, по меньшей мере, на 90% идентична любой из последовательностей SEQ ID NO: 1, 9 и 17, или представляет собой RAGE-связывающий фрагмент антитела в пределах указанных последовательностей.
Конкретный вариант осуществления настоящего изобретения представлен несколькими моноклональными антителами, которые способны связываться с C-доменом RAGE и блокировать связывание Aβ-глобуломеров. Более конкретно настоящее изобретение относится к моноклональному антителу 11E6, которое связывается с C-2-доменом RAGE, не связывается с пептидами с аминокислотными последовательностями, используемыми для создания поликлональных антител, и способно нейтрализовать in vivo влияние Aβ1-40 на сосуды головного мозга у мышей.
К анти-RAGE-антителам согласно изобретению относятся антитела, которые специфично связываются с C-доменом RAGE.
Анти-RAGE-антитела согласно изобретению включают анти-RAGE-антитело или его RAGE-связывающий фрагмент, которое описано выше и которое выбрано из группы, состоящей из химерного антитела, CDR-привитого или гуманизированного антитела, одноцепочечного антитела, слитого белка и антитела человека.
В различных вариантах антитела согласно изобретению представляют собой рекомбинантные антитела или моноклональные антитела. Конкретные нейтрализующие антитела, описанные в настоящей заявке, названы mAb7F9 mAb11E6, и mAb4E5, и функциональные фрагменты таких антител и другие антитела и функциональные фрагменты антител со свойствами, эквивалентными свойствам mAb7F9, mAb11E6 и mAb4E5, такими как высокая аффинность связывания с RAGE с низкой кинетикой диссоциации и высокая нейтрализующая способность, считаются частью настоящего изобретения. Однако антитела человека согласно настоящему изобретению могут содержать аминокислотные остатки, которые не закодированы в иммуноглобулине зародышевой линии к иммуногенному полипептиду RAGE или его фрагменту, которые могут быть определены любым способом, известным в данной области. Например, аффинность связывания может быть измерена в конкурентных ELISA, РИА, с использованием методики BIAcore или KinExA. Скорость диссоциации также может быть измерена с использованием методики BIAcore или KinExA. Аффинность связывания и скорость диссоциации измеряют на основе резонанса поверхностного плазмона, используя, например, BIAcore.
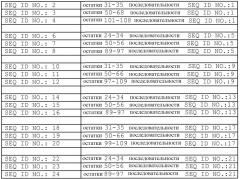
Одно из моноклональных антител согласно настоящему изобретению, антитело mAb7F9, имеет, по меньшей мере, 90% идентичность аминокислотной последовательности с последовательностью, включающей в себя вариабельную область тяжелой цепи (область VH), содержащую последовательность SEQ ID NO: 1 и последовательности SEQ ID NO: 2, 3, и 4, которые представляют собой остатки 31-35, 50-68 и 101-108 последовательности SEQ ID NO: 1, соответственно. Антитело mAb7F9 согласно настоящему изобретению имеет, по меньшей мере, 90% идентичность аминокислотной последовательности с последовательностью, содержащей вариабельную область легкой цепи (область VL), содержащую последовательность SEQ ID NO: 5, и последовательности SEQ ID NO: 6, 7 и 8, которые представляют собой остатки 24-34, 50-56, 89-97 последовательности SEQ ID NO: 5, соответственно.
Другое из указанных моноклональных антител согласно настоящему изобретению, антитело mAb11E6, имеет, по меньшей мере, 90% идентичность аминокислотной последовательности с последовательностью, включающей в себя вариабельную область тяжелой цепи (область VH), содержащую последовательность SEQ ID NO: 9 и последовательности SEQ ID NO: 10, 11 и 12, которые представляют собой остатки 31-35, 50-66 и 99-109 последовательности SEQ ID NO: 9, соответственно. Антитело mAb11E6 согласно настоящему изобретению имеет, по меньшей мере, 90% идентичность аминокислотной последовательности с последовательностью, включающей в себя вариабельную область легкой цепи (область VL), содержащую последовательность SEQ ID NO: 13 и последовательности SEQ ID NO: 14, 15 и 16, которые представляют собой остатки 24-34, 50-56, 89-97 последовательности SEQ ID NO: 13, соответственно. mAb11E6 связывается с C-2-доменом RAGE, не связывается с пептидами с аминокислотными последовательностями, используемыми для создания поликлональных антител, и способно нейтрализовать in vivo влияние Aβ1-40 на сосуды головного мозга у мышей.
Другое из указанных моноклональных антител согласно настоящему изобретению, антитело mAb4E5, имеет, по меньшей мере, 90% идентичность аминокислотной последовательности с последовательностью, содержащей вариабельную область тяжелой цепи (область VH), содержащую последовательность SEQ ID NO: 17 и последовательности SEQ ID NO: 18, 19 и 20, которые представляют собой остатки 31-35, 50-66 и 99-109 последовательности SEQ ID NO: 17, соответственно. Антитело mAb4E5 согласно настоящему изобретению имеет, по меньшей мере, 90% идентичность аминокислотной последовательности с последовательностью, включающей в себя вариабельную область легкой цепи (область VL), содержащую последовательность SEQ ID NO: 21 и последовательности SEQ ID NO: 22, 23 и 24, которые представляют собой остатки 24-34, 50-56, 89-97 последовательности SEQ ID NO: 21, соответственно.
Также предполагается, что выделенные моноклональные антитела, которые взаимодействуют с RAGE, согласно настоящему изобретению могут представлять собой гликозилированный связывающий белок, при этом антитело или его антигенсвязывающая часть содержит один или несколько углеводных остатков. Образуемый in vivo белковый продукт может подвергаться дальнейшему процессингу, известному как посттрансляционная модификация. В частности, могут быть ферментативно добавлены остатки сахара (гликозил) в ходе процесса, называемого гликозилированием. Получаемые в результате белки, несущие ковалентно связанные олигосахаридные боковые цепи, известны как гликозилированные белки или гликопротеиды. Гликозилирование белков зависит от аминокислотной последовательности представляющего интерес белка, а также клетки-хозяина, в которой белок экспрессируется. Разные организмы могут продуцировать разные ферменты гликозилирования (например, гликозилтрансферазы и гликозидазы) и имеют разные доступные субстраты (сахара нуклеотидов). Вследствие таких факторов картина гликозилирования белков и состав гликозильных остатков могут отличаться, в зависимости от системы хозяина, в которой экспрессируется конкретный белок. Остатки гликозила, применимые в настоящем изобретении, могут включать без ограничения глюкозу, галактозу, маннозу, фукозу, н-ацетилглюкозамин и сиаловую кислоту.
Антитела согласно настоящему изобретению содержат константную область тяжелой цепи, такую как константная область IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD. Кроме того, антитело может содержать константную область легкой цепи, либо константную область легкой цепи каппа, либо константную область легкой цепи лямбда. В частности, антитело содержит константную область легкой цепи каппа. Альтернативно, часть антитела может представлять собой, например, Fab-фрагмент или одноцепочечный Fv-фрагмент. В данной области известны замены аминокислотных остатков в Fc-части для изменения эффекторной функции антитела (Winter, et al. Патенты США № 5648260, 5624821). Fc-часть антитела опосредует несколько важных эффекторных функций, например, индукцию цитокинов, ADCC, фагоцитоз, зависимую от комплемента цитотоксичность (CDC) и время полужизни/скорость клиренса антитела и комплексов антиген-антитело. В некоторых случаях такие эффекторные функции требуются для терапевтических антител, но в других случаях они могут быть необязательными или даже вредными, в зависимости от терапевтических целей. Некоторые изотипы IgG человека, в частности, IgG1 и IgG3, опосредуют ADCC и CDC в результате связывания с Fcγ R и C1q комплемента, соответственно. Неонатальные Fc-рецепторы (FcRn) являются важными компонентами, определяющими время полужизни антител в циркуляции. В еще одном варианте заменяют, по меньшей мере, один аминокислотный остаток в константной области антитела, например, Fc-области антитела, так что такие эффекторные функции антитела изменяются.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг. 1A-1C показан анализ ELISA связывания рекомбинантных и полученных из гибридом моноклональных антител против RAGE человека 7F9, 11E6 и 4E5 с рекомбинантным RAGE человека.
На фиг. 2 показана характеристика моноклональных антител 7F9, 11E6 и 4E5 с использованием дот-блот-связывания.
На фиг. 3A-3C показаны результаты анализа HTRF, показывающие конкуренцию sRAGE-Aβ-глобуломеры-моноклональные антитела.
На фиг. 4 показан анализ HTRF связывания sRAGE-Aβ-глобуломер.
На фиг. 5 показано связывание Aβ-глобуломера с sRAGE-Fc и с v-доменом RAGE.
На фиг. 6A-6C показаны эксперименты связывания в ELISA моноклональных антител согласно изобретению с разными фрагментами RAGE.
На фиг. 7A-7C показаны эксперименты связывания в ELISA моноклональных антител согласно изобретению с разными фрагментами RAGE.
На фиг. 8a-8f показаны изменения мозгового кровообращения, индуцированные разными дозами Aβ1-40.
На фиг. 9a-9c показано влияние 11E6 на Aβ1-40-индуцированные изменения мозгового кровообращения.
На фиг. 10 показаны изменения мозгового кровообращения, наблюдаемые у старых мышей Tg2576, которых лечили разными дозами 11E6 или контрольного антитела.
На фиг. 11 показано, что антитело 11E6 защищает нейроны гиппокампа от Aβ-индуцированного расщепления динамина. Верхняя панель: показаны образцы, представляющие повторяющиеся экспериментальные условия в одном эксперименте, концентрации обработки (в мкМ) указаны выше. В клетках без добавления Aβ главным образом наблюдали сигналы интактного (~100 кД) динамина I (1-ый столбик), количество которого уменьшалось, и который превращался в продукт расщепления ~90 кД в клетках, обработанных 5 мкМ Aβ (2-ой столбик). Обработка антителом 11E6 (3-ий столбик) предотвращает расщепление, тогда как контрольное Ig1-антитело (4-ый столбик) не оказывает выраженного защитного эффекта. Нижняя панель: количественная оценка сигнала динамина в трех независимых экспериментах (выраженная в виде % динамина +/- SEM после нормализации по отношению к обработке 0 мкМ Aβ) выявила статистически значимый защитный эффект 11E6 (однофакторный ANOVA, критерий Краскала-Уоллиса с последующим использованием критерия Данна; * означает p<0,05).
На фиг. 12 показано влияние 11E6 (A) или контрольного антитела (B) на индуцированное глобуломером сильное подавление синаптической передачи в культуре среза гиппокампа крыс. 0,1 мкМ 11E6 полностью обращал индуцированное глобуломером нарушение (смотри (A)).
На фиг. 13 показано влияние 12-недельной обработки антителом 11E6 на отложения амилоидных бляшек у мышей Tg2576. Показана площадь, покрытая бляшками (A, B) и количество бляшек (C, D), которые выявляли мечением анти-Aβ-антителом 6G1 после обработки 11E6 или контрольным IgG1-антителом (n=19/группу). Обработка 11E6 уменьшала площадь, покрытую отложениями, и количество отложений в неокортексе на 24,5% (A) и 26,8% (C), соответственно. Статистический анализ выявил сильную тенденцию (звездочки в квадратных скобках, p<0,06; U-критерий Манна-Уитни). Уменьшение было статистически значимым в лобной коре (звездочки, p<0,05; U-критерий Манна-Уитни), при этом площадь отложений уменьшалась на 23,5% (B), а их количество на 26,8% (D) после обработки 11E6.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 1: аминокислотная последовательность VH мАт 7F9.
SEQ ID NO: 2: аминокислотная последовательность CDR-H1 VH мАт 7F9.
SEQ ID NO: 3: аминокислотная последовательность CDR-H2 VH мАт 7F9.
SEQ ID NO: 4: аминокислотная последовательность CDR-H3 VH мАт 7F9.
SEQ ID NO: 5: аминокислотная последовательность VL мАт 7F9.
SEQ ID NO: 6: аминокислотная последовательность CDR-L1 VL мАт 7F9.
SEQ ID NO: 7: аминокислотная последовательность CDR-L2 VL мАт 7F9.
SEQ ID NO: 8: аминокислотная последовательность CDR-L3 VL мАт 7F9.
SEQ ID NO: 9: аминокислотная последовательность VH мАт 11E6.
SEQ ID NO: 10: аминокислотная последовательность CDR-H1 VH мАт 11E6.
SEQ ID NO: 1: аминокислотная последовательность CDR-H2 VH мАт 11E6.
SEQ ID NO: 12: аминокислотная последовательность CDR-H3 VH мАт 11E6.
SEQ ID NO: 13: аминокислотная последовательность VL мАт 11E6.
SEQ ID NO: 14: аминокислотная последовательность CDR-L1 VL мАт 11E6.
SEQ ID NO: 15: аминокислотная последовательность CDR-L2 VL мАт 11E6.
SEQ ID NO: 16: аминокислотная последовательность CDR-L3 VL мАт 11E6.
SEQ ID NO: 17: аминокислотная последовательность VH мАт 4E5.
SEQ ID NO: 18: аминокислотная последовательность CDR-H1 VH мАт 4E5.
SEQ ID NO: 19: аминокислотная последовательность CDR-H2 VH мАт 4E5.
SEQ ID NO: 20: аминокислотная последовательность CDR-H3 VH мАт 4E5.
SEQ ID NO: 21: аминокислотная последовательность VL мАт 4E5.
SEQ ID NO: 22: аминокислотная последовательность CDR-L1 VL мАт 4E5.
SEQ ID NO: 23: аминокислотная последовательность CDR-L2 VL мАт 4E5.
SEQ ID NO: 24: аминокислотная последовательность CDR-L3 VL мАт 4E5.
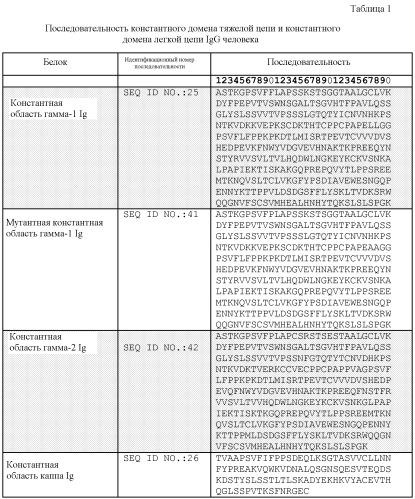
SEQ ID NO: 25: аминокислотная последовательность константной области тяжелой цепи гамма Ig человека.
SEQ ID NO: 26: аминокислотная последовательность константной области легкой цепи каппа Ig человека.
SEQ ID NO: 27: полная плазмидная нуклеотидная последовательность конструкции №1 (жирным шрифтом), кодирующей OmpA-[RAGE (23-340)]-6His.
SEQ ID NO: 28: полная плазмидная нуклеотидная последовательность конструкции №2 (жирным шрифтом), кодирующей 6His-(Thr)-[RAGE (24-129)].
SEQ ID NO: 29: полная плазмидная нуклеотидная последовательность конструкции №3 (жирным шрифтом), кодирующей 6His-(Thr)-[RAGE (24-234)].
SEQ ID NO: 30: полная плазмидная нуклеотидная последовательность конструкции №4 (жирным шрифтом), кодирующей 6His-(Thr)-[RAGE (24-336)].
SEQ ID NO: 31: полная плазмидная нуклеотидная последовательность конструкции №5 (жирным шрифтом), кодирующей 6His-(Thr)-[RAGE (130-234)].
SEQ ID NO: 32: полная плазмидная нуклеотидная последовательность конструкции №6 (жирным шрифтом), кодирующей 6His-(Thr)-[RAGE (130-336)].
SEQ ID NO: 33: полная плазмидная нуклеотидная последовательность конструкции №7 (жирным шрифтом), кодирующей 6His-(Thr)-[RAGE (235-336)].
SEQ ID NO: 34: кодируемая аминокислотная последовательность белка RAGE №1.
SEQ ID NO: 35: кодируемая аминокислотная последовательность белка RAGE №2.
SEQ ID NO: 36: кодируемая аминокислотная последовательность белка RAGE №3.
SEQ ID NO: 37: кодируемая аминокислотная последовательность белка RAGE №4.
SEQ ID NO: 38: кодируемая аминокислотная последовательность белка RAGE №5.
SEQ ID NO: 39: кодируемая аминокислотная последовательность белка RAGE №6.
SEQ ID NO: 40: кодируемая аминокислотная последовательность белка RAGE №7.
SEQ ID NO: 41: аминокислотная последовательность мутантной константной области гамма-1 Ig.
SEQ ID NO: 42: аминокислотная последовательность константной области гамма-2 Ig.
SEQ ID NO: 43: аминокислотная последовательность каркаса VH7-4.1/JH6 FR1.
SEQ ID NO: 44: аминокислотная последовательность каркаса VH7-4.1/JH6 FR2 и VH1-2/JH6 FR2.
SEQ ID NO: 45: аминокислотная последовательность каркаса VH7-4.1/JH6 FR3.
SEQ ID NO: 46: аминокислотная последовательность каркаса VH7-4.1/JH6 FR4 и VH1-2/JH6 FR4.
SEQ ID NO: 47: аминокислотная последовательность каркаса VH1-2/JH6 FR1.
SEQ ID NO: 48: аминокислотная последовательность каркаса VH1-2/JH6 FR3.
SEQ ID NO: 49: аминокислотная последовательность каркаса 1-12/L5/JK2 FR1.
SEQ ID NO: 50: аминокислотная последовательность каркаса 1-12/L5/JK2 FR2.
SEQ ID NO: 51: аминокислотная последовательность каркаса 1-12L5/JK2 FR3.
SEQ ID NO: 52: аминокислотная последовательность каркаса 1-12/L5/JK2 FR4 и 3-15/L2/JK2 FR4.
SEQ ID NO: 53: аминокислотная последовательность каркаса 3-15/L2/JK2 FR1.
SEQ ID NO: 54: аминокислотная последовательность каркаса 3-15/L2/JK2 FR2.
SEQ ID NO: 55: аминокислотная последовательность каркаса 3-15/L2/JK2 FR3.
SEQ ID NO: 56: CDR-привитая аминокислотная последовательность VH 11E6.1-GL.
SEQ ID NO: 57: CDR-привитая аминокислотная последовательность VH 11E6.2-GL.
SEQ ID NO: 58: CDR-привитая аминокислотная последовательность VL 11E6.1-GL.
SEQ ID NO: 59: CDR-привитая аминокислотная последовательность VL 11E6.2-GL.
SEQ ID NO: 60: аминокислотная последовательность hRAGE.
SEQ ID NO: 61: аминокислотная последовательность фрагмента husRAGE.
SEQ ID NO: 62: последовательность гуманизированного антитела VH h11E6.1.
SEQ ID NO: 63: последовательность гуманизированного антитела VL h11E6.1.
SEQ ID NO: 64: последовательность гуманизированного антитела VL h11E6.2.
SEQ ID NO: 65: последовательность гуманизированного антитела VL h11E6.3.
SEQ ID NO: 66: последовательность гуманизированного антитела VL h11E6.4.
SEQ ID NO: 67: последовательность гуманизированного антитела VH h11E6.5.
SEQ ID NO: 68: последовательность гуманизированного антитела VH h11E6.9.
SEQ ID NO: 69: последовательность гуманизированного антитела VH h11E6.16.
SEQ ID NO: 70: аминокислотная последовательность полученного из RAGE пептида NtermR31.
SEQ ID NO: 71: аминокислотная последовательность полученного из RAGE пептида 1.
SEQ ID NO: 72: аминокислотная последовательность полученного из RAGE пептида 2.
SEQ ID NO: 73: аминокислотная последовательность полученного из RAGE пептида 3.
SEQ ID NO: 74: аминокислотная последовательность полученного из RAGE пептида 4.
SEQ ID NO: 75: аминокислотная последовательность полученного из RAGE пептида 5.
SEQ ID NO: 76: аминокислотная последовательность полученного из RAGE пептида 6.
SEQ ID NO: 77: аминокислотная последовательность полученного из RAGE пептида 7.
SEQ ID NO: 78: аминокислотная последовательность полученного из RAGE пептида 8.
SEQ ID NO: 79: аминокислотная последовательность полученного из RAGE пептида 9.
SEQ ID NO: 80: аминокислотная последовательность полученного из RAGE пептида 10.
SEQ ID NO: 81: нуклеотидная последовательность олигонуклеотидных праймеров.
SEQ ID NO: 82: нуклеотидная последовательность олигонуклеотидных праймеров.
SEQ ID NO: 83: нуклеотидная последовательность олигонуклеотидных праймеров.
SEQ ID NO: 84: нуклеотидная последовательность олигонуклеотидных праймеров.
SEQ ID NO: 85: нуклеотидная последовательность олигонуклеотидных праймеров.
SEQ ID NO: 86: нуклеотидная последовательность олигонуклеотидных праймеров.
SEQ ID NO: 87: нуклеотидная последовательность олигонуклеотидных праймеров.
SEQ ID NO: 88: нуклеотидная последовательность олигонуклеотидных праймеров.
SEQ ID NO: 89: нуклеотидная последовательность олигонуклеотидных праймеров.
SEQ ID NO: 90: нуклеотидная последовательность олигонуклеотидных праймеров.
SEQ ID NO: 91: нуклеотидная последовательность олигонуклеотидных праймеров.
SEQ ID NO: 92: нуклеотидная последовательность олигонуклеотидных праймеров.
SEQ ID NO: 93: нуклеотидная последовательность олигонуклеотидных праймеров.
SEQ ID NO: 94: нуклеотидная последовательность олигонуклеотидных праймеров.
ПОДРОБНОЕ ОПИСАНИЕ
1. Общие определения
Если в настоящем описании не указано иное, научные и технические термины, используемые в связи с настоящим изобретением, будут иметь значения, которые обычно подразумевают специалисты в данной области. Значение и объем терминов должен быть ясен, однако, в случае какой-либо скрытой неясности, определения, приведенные в настоящем описании, принимают значения в соответствии с прецедентом любого словарного или внешнего определения. Кроме того, если контекст не требует иного, формы единственного числа будут включать формы множественного числа, и термины во множественном числе включают форму единственного числа. В настоящем описание использованием «или» означает «и/или», если не указано иное. Кроме того, использование термина «включающий в себя», а также других форм, таких как «включает в себя» и «включены», не ограничено. Также, такие термины, как «элемент» или «компонент», охватывают элементы и компоненты, содержащие одну единицу, и элементы и компоненты, которые содержат более одной субъединицы, если специально не указано иное.
В общем, используемые номенклатуры и методики культивирования клеток и тканей, молекулярной биологии, иммунологии, микробиологии, генетики и химии белков и нуклеиновых кислот и гибридизации, описанные в настоящей публикации, хорошо известны и широко используются в данной области. Способы и методики согласно настоящему изобретению обычно осуществляют согласно стандартным способам, хорошо известным в данной области, которые описаны в различных общих и более конкретных публикациях, которые цитированы и обсуждаются на протяжении настоящего описания, если не оговорено особо. Ферментативные реакции и способы очистки осуществляют согласно инструкциям производителя, которые обычно выполняют в данной области, или как описано в настоящей публикации. Номенклатура, используемая в связи с лабораторными способами и методиками аналитической химии, химии органического синтеза и медицинской и фармацевтической химии, описанными в настоящей публикации, хорошо известны и широко применяются в данной области. Для химических синтезов, химических анализов, получения фармацевтических препаратов, приготовления композиций и доставки и лечения пациентов применяют стандартные способы.
Чтобы было легче понять настоящее изобретение, ниже приведены определения выбранных терминов.
Термин «полипептид» в используемом в настоящем изобретении смысле относится к любой полимерной цепи аминокислот. Термины «пептид» и «белок» используют взаимозаменяемо с термином «полипептид», и они также относятся к полимерной цепи аминокислот. Термин «полипептид» охватывает нативные или искусственные белки, фрагменты белков и полипептидные аналоги последовательности белка. Полипептид может быть мономерным или полимерным.
Термин «выделенный белок» или «выделенный полипептид» представляет собой белок или полипептид, который в силу своего происхождения или источника получения не ассоциирован с компонентами, ассоциированными с ним в естественных условиях, которые сопровождают его в его нативном состоянии; который по существу не содержит других белков того же самого вида; который экспрессируется клеткой из другого вида; или который не встречается в природе. Таким образом, полипептид, который синтезирован химическим путем или синтезирован в клеточной системе, отличной от клетки, из которой он происходит в природе, будет «выделенным» от ассоциированных с ним в природе компонентов. Белок также можно сделать по существу не содержащим ассоциированных с ним в природе компонентов путем выделения с использованием способов очистки белка, хорошо известных в данной области.
Термин «извлечение» в используемом в настоящем изобретении смысле относится к способу, позволяющему получить химическую молекулу, такую как полипептид, по существу не содержащую ассоциированных с ней в природе компонентов, путем выделения, например, с использованием методик очистки белка, хорошо известных в данной области.
Термин «рецептор конечных продуктов глубокого гликирования (RAGE)» означает имеющий множество лигандов рецептор семейства иммуноглобулинов, который связывает наряду с другими лигандами растворимый пептид Aβ, S100b и HMGB1 (также известный как амфотерин). RAGE опосредует значимые с точки зрения патофизиологии клеточные изменения в ответ на связывание таких лигандов. У трансгенных животных, сверэкспрессирующих RAGE и APP человека, наблюдают ранние аномалии в пространственном обучении и памяти, что свидетельствует о том, что RAGE является кофактором для Aβ-индуцированного нарушения нейронов при патологиях типа болезни Альцгеймера, и свидетельствует о том, что RAGE является потенциальной терапевтической мишенью для ослабления клеточной дисфункции.
Структура RAGE не расшифрована. Гомология с другими белками приводит к модели, в которой RAGE имеет несколько доменов. Такие домены названы по аналогии с иммуноглобулинами: (i) V-подобный домен на N-конце: такой эквивалентный домен в иммуноглобулинах связывает антиген и представляет собой единственную связывающую область в таких белках. В RAGE такой домен связывается с некоторыми лигандами, подобными S100 (Ostendorp et al. EMBOJ. 26, 3875, 2007; Leclerc et al. JBC 282, 31317, 2007). Связывание моноклонального антитела с v-подобным доменом в RAGE конкурирует со связыванием различных лигандов S100b, HMGB1 и амилоида β (WO2007109749(A2)), что означает, что такие лиганды также могут связываться с RAGE посредством такого же домена. (ii) Первый C2-подобный домен: два домена в RAGE имеют гомологию с C2-доменами иммуноглобулинов; один из этих доменов был назван C1 (номенклатура также использована в Ostendorp et al. BBRC 2006). Описано несколько лигандов, связывающихся с таким доменом, например, S100A12 (также называемый ENRAGE или калгранулином C), который связывается с аффинностью Kd=90 нМ (Hofmann et al. Cell 97, 889, 1999; Xie et al. JBC, 282, 4218, 2007). Aβ конкурирует с S100A12 за такой домен, что свидетельствует о том, что Aβ также связывается с C1-домен. (iii) Второй C2-подобный домен: такой домен называют C2 (номенклатура также использована в Ostendorp et al. BBRC 2006). RAGE-лиганд S100A6 связывается с C2-доменом, и было показано, что антитело, созданное против пептида из C2-домена, конкурирует с S100A6 за такое связывание; антитело приводило к снижению трансдукции сигнала в SH-SY5Y (Leclerc et al. JBC 282, 31317, 2007).
«Домен RAGE» можно определить в соответствии с разными определениями, предлагаемыми в данной области:
Согласно Xie et al. 2007, J. Biol. Chem., Vol. 282: 4218-4231 применимо следующее определение доменов hRAGE:
- V домен (аминокислоты 24-129 SEQ ID NO: 60),
- C1-домен (аминокислоты 130-234 SEQ ID NO: 60),
- C2-домен (аминокислоты 235-336 SEQ ID NO: 60).
Согласно более позднему определению Hudson et al., The FASEB Journal. 2008; 22: 1572-1580, hRAGE (404 аминокислотных остатка согласно последовательности SEQ ID NO: 60) имеет внеклеточную область (аминокислоты 1-342 SEQ ID NO: 60), состоящую из
- сигнального пептида (аминокислоты 1-22 SEQ ID NO: 60), после которого следуют три подобных иммуноглобулину домена, включая
- Ig-подобный домен V-типа (аминокислоты 23-116 SEQ ID NO: 60) и
- двух Ig-подобных 1/2-доменов C2-типа (аминокислоты 124-221 SEQ ID NO: 60; также называемые C1-доменом; и аминокислоты 227-317 SEQ ID NO: 60; также называемые C2-доменом);
- одного трансмембранного домена (аминокислоты 343-363 SEQ ID NO: 60), и
- короткого цитоплазматического хвоста (аминокислоты 364-404 SEQ ID NO: 60).
С точки зрения высокой степени идентичности, в частности в отношении определения доменов V, C1 и C2, и если не оговорено особо, каждое из определений может быть применимо, чтобы определить характеристики связывания связывающих белков согласно настоящему изобретению.
Как указано выше, RAGE способен связывать разные лиганды посредством разных доменов. Результаты экспериментов по конкуренции с другими лигандами, по-видимому, свидетельствуют, что Aβ связывается с C1-доменом (Hofmann et al. Cell 97, 889, 1999 или Xie et al. JBC, 282, 4218, 2007). В качестве не ограничивающих примеров лигандов RAGE могут быть указаны:
- конечные продукты глубокого гликирования (AGE) (Baynes J. W., 1991, Diabetes. 1991, 40: 405-412; Ahmed K. A., 2007, J. Clin. Biochem. Nutr. 41 (2): 97-105);
- представители семейства S100/калгранулин (например, калгранулин C (также известный как ENRAGE и S100A12), S100A1, S100A4, S100A11, S100A13, S100B, и S100P);
- амилоидный-β-пептид (Aβ), как, например, пептид Aβ 1-40;
- глобуломеры амилоида-β; как, например, глобуломеры Aβ1-42, Aβ12-42, Aβ20-42 (смотри Barghorn et al., Globular amyloid β peptide 1-42 oligomer - a homogenous and stable neuropathological protein in Alzheimer's disease) Journal of Neurochemistry, 95(3): 834-847, November 2005; WO2007/062852; WO2008/150949; все публикации включены в виде ссылки);
- интегрины лейкоцитов (например, Mac-1).
Термин «RAGE» в используемом в настоящем изобретении смысле, в частности, относится к RAGE человека, также называемому «hRAGE» или «huRAGE». Если не указано иное, термин «RAGE» также охватывает молекулы RAGE, выделенные или полученные из других, отличных от человека, видов, например, грызунов, подобных мышам или крысам; или молекулы RAGE быка.
Термин «sRAGE» относится к растворимой форме RAGE, полученной из внеклеточного домена RAGE. Например, молекула sRAGE, полученная из RAGE человека, также называемая husRAGE, содержит аминокислотные остатки 1-331 (смотри SEQ ID NO: 61) RAGE человека (смотри SEQ ID NO: 60).
«Биологическая активность» в используемом в настоящем изобретении смысле относится ко всем биологическим свойствам, присущим RAGE, которые определены в настоящем описании.
Термины «специфичное связывание» или «специфично связывающийся» в используемом в настоящем изобретении смысле в отношении к взаимодействию антитела, белка или пептида со второй химической молекулой, означают, что взаимодействие зависит от наличия конкретной структуры (например, «антигенной детерминанты» или «эпитопа», которые определены ниже) на химической молекуле; например, антитело узнает и связывается с конкретной белковой структурой, а не с белками вообще. Если антитело является специфичным для эпитопа «A», то присутствие молекулы, содержащей эпитоп A (или свободного немеченого A), в реакционной смеси, содержащей меченый «A» и антитело, будет уменьшать количество меченого A, связанного с антителом.
Термин «антитело» в используемом в настоящем изобретении широком смысле относится к любой молекуле иммуноглобулина (Ig), состоящей из четырех полипептидных цепей, двух тяжелых (H) цепей и двух легких (L) цепей, или к его любому функциональному фрагменту, мутанту, варианту или производному, который сохраняет существенные свойства молекулы Ig в связывании эпитопа. Такие мутантные формы, варианты или производные формы антитела известны в данной области. Не ограничивающие варианты таких форм обсуждаются ниже. Говорят, что антитело «способно к связыванию» молекулы, если оно способно специфично взаимодействовать с молекулой, связывая тем самым молекулу с антителом.
Подразумевают, что «моноклональное антитело» в используемом в настоящем изобретении смысле относится к препарату молекул антител, которые имеют общую последовательность тяжелой цепи и легкой цепи, в отличие от препаратов «поликлональных» антител, которые содержат смесь разных антител. Моноклональные антитела могут быть получены несколькими новыми способами, подобными фаговому, бактериальному, дрожжевому или рибосомному дисплею, а также классическими способами, например, получаемые из гибридом антитела (например, антитело, секретируемое гибридомой, получаемой с использованием методики гибридом, такой как стандартная методика гибридом Колера и Мильштейна ((1975) Nature 256: 495-497).
В полноразмерном антителе каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно называемой в настоящем описании HCVR или VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно называемой в настоящем описании LCVR или VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена CL. Области VH и VL могут быть дополнительно разделены на области гипервариабельности, называемые областями, определяющими комплементарность (CDR), между которыми находятся области, которые являются более консервативными и называются каркасными областями (FR). Каждая VH и VL состоят из трех CDR и четырех FR, расположенных от амино-конца к карбоксильному концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Молекулы иммуноглобулина могут быть любого типа (например, IgG, IgE, IgM, IgD, IgA и IgY), класса (например, IgG1, IgG2, IgG3, IgG 4, IgA1 и IgA2) или подкласса.
Термин «антигенсвязывающая часть» или «антигенсвязывающий фрагмент» антитела (или просто «часть антитела» или «фрагмент антитела») в используемом в настоящем изобретении смысле относится к одному или нескольким фрагментам ант