Способ селекции аптамеров к заданным белковым мишеням на поверхности клеток
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к способу селекции аптамеров к клеточным рецепторам и поверхностным белкам, который включает проведение раундов селекции, каждый из которых включает стадии: позитивной селекции с дальнейшим удалением несвязавшаяся ДНК; негативной селекции с последующим отделением связавшихся с негативной мишенью последовательностей; амплификацию полученных в ходе селекции аптамеров с получением ПЦР-продукта. Второй и все последующие раунды селекции начинают с негативной селекции аптамеров, в четвертом раунде селекции после проведения стадий негативной и позитивной селекции аптамеров к комплексам аптамер-клетка добавляют избыток моноклональных антител специфичных к белковой мишени на поверхности клетки, аптамеры, перешедшие в раствор отделяют и амплифицируют. Изобретение позволяет получать аптамеры, специфичные к нативным белкам. 5 з.п. ф-лы, 2 ил., 1 пр.
Реферат
Изобретение относится к способу селекции аптамеров к клеточным рецепторам и поверхностным белкам.
На сегодняшний день для диагностики заболеваний, требующих детекции определенных рецепторов используются моноклональные и поликлональные антитела.. С их помощью определяют белки крови, гормоны, ростовые факторы, клеточные рецепторы, медиаторы воспаления и иммунитета, бактериальные и вирусные антигены, различные яды и т.п. Например, для определения иммунного статуса используют моноклональные антитела к CD-4. CD-8, CD-20, CD-I6 и др. С помощью антител осуществляют экспресс-определение групп крови, проводят тесты на беременность и ВИЧ, идентифицируют клетки в недифференцированных опухолях, используют их для диагностики и типирования опухолей [Peter Kuhn et al. Fluid biopsy in patients with metastatic prostate, pancreatic and breast cancers. Phys. Biol. 9 (2012)]. Кроме того, моноклональные антитела начинают успешно применять в терапевтических целях для лечения различных патологий.
Однако, процедура получения антител является достаточно трудоемкой и дорогостоящей, поскольку требуют использования животных. Кроме того, белковые антитела не стабильны, чувствительны к нарушению условий хранения и иммуногенны.
Аптамеры, выбранные к заданным клеточным рецепторам, благодаря высокому сродству к молекулам-мишеням могут быть использованы как аналоги антител. Аптамеры - это короткие синтетические однонитевые ДНК или РНК, способные образовывать уникальные третичные структуры, позволяющие им связываться с заданными мишенями с высокой специфичностью.
По сравнению с моноклональными антителами аптамеры имеют ряд преимуществ: 1. аптамеры могут быть синтезированы химически, и в отличие от естественных антител не требуют использования животных; 2. количество выбранных аптамеров может быть легко увеличено с помощью полимеразной цепной реакции; 3. простая химическая структура аптамеров позволяет легко модифицировать их в соответствии с поставленными задачами; 4. аптамеры являются более стабильными к воздействию температуры и химических веществ; 5. При потере афинности аптамеров их свойства легко восстанавливаются с помощью процедуры денатурации с последующей ренатурации.
Кроме того, процедура получения аптамеров является менее трудозатратой, и менее дорогостоящей по сравнению с процедурой получения моно- и поликлональных антител.
Аптамеры к заданной мишени получают с помощью селекции in vitro (SELEX). Технология SELEX - технология получения аптамеров путем системной эволюции лигандов экспоненциальным обогащением (Systematic Evolution of Ligands by Exponential Enrichment). [Ellington, A.D. and Szostak, J.W. (1990) In vitro selection of RNA molecules that bind specific ligands. Nature 346, 818-822]; Tuerk, C. and Gold, L. (1990) Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase. Science 249, 505-510]. Традиционный метод SELEX состоит из нескольких повторяющихся раундов. Каждый раунд включает 3 основные стадии: 1) библиотека олигонуклеотидов инкубируется с биологической мишенью, несвязавшаяся ДНК удаляется; 2) полученные аптамеры инкубируются с негативной мишенью, связавшиеся с негативной мишенью последовательности отделяются; 3) полученные в ходе селекции аптамеры амплифицируются.
Для селекции аптамеров к поверхностным рецепторам обычно используют рекомбинантные (очищенные) белки. Однако, для аналитических целей чаще всего требуется определить белок, находящийся не в свободной форме, а в составе клеточной мембраны. Поскольку конформацию белка определяет липидный бислой мембраны, то конформации нативных и рекомбинантных белков могут различаться. Аптамеры подобранные к рекомбинантным белкам обладают меньшим сродством к этим же белкам, находящимся в составе клеточной мембраны. Поэтому специфичность выявления целых клеток, белки которых находятся в нативном состоянии с помощью аптамеров, подобранных к рекомбинантным белкам может быть не достаточно высока.
Задачей настоящего изобретения является получение аптамеров, специфичных к нативным поверхностным белкам целых клеток.
Поставленная задача решается тем, что в способе селекции аптамеров к заданным белковым мишеням на поверхности клеток, включающем проведение раундов селекции, каждый из которых включает стадии: позитивной селекции - инкубирования библиотеки олигонуклеотидов с биологической мишенью, с удалением несвязавшаяся ДНК; негативной селекции - инкубирование полученных аптамеров с негативной мишенью, с отделением связавшихся с негативной мишенью последовательностей; амплификацию полученных в ходе селекции аптамеров с получением ПЦР-продукта, согласно изобретению, второй и все последующие раунды селекции начинают с негативной селекции аптамеров, в четвертом раунде селекции после проведения стадий негативной и позитивной селекции аптамеров к комплексам аптамер-клетка добавляют избыток моноклональных антител специфичных к белковой мишени на поверхности клетки, аптамеры перешедшие в раствор отделяют и амплифицируют.
Способ селекции можно осуществлять с повторением четвертого раунда селекции во всех последующих раундах.
Способ селекции можно осуществлять с чередованием третьего и четвертого раундов во всех последующих раундах, после четвертого
В третьем раунде способа селекции после инкубирования ПЦР-продукта с негативными мишенями и отделения от несвязавшихся остатков, полученный надосадок можно проинкубировать с плазмой или сывороткой крови, после чего провести позитивную селекцию с последующей амплификации аптамеров.
Инкубирование образца с плазмой крови можно проводить через один раунд селекции аптамеров.
В каждом раунде селекции концентрацию добавляемых антител можно увеличивать.
Концентрации аптамеров и моноклональных антител при проведении раундов селекции можно варьировать.
Заявляемый способ селекции аптамеров, основан на конкурентном замещении аптамеров моноклональными и поликлональными антителами. Аптамеры-кандидаты, находясь в меньшинстве на поверхности рецептора-мишени, вымещаются с него большей концентрацией антител. Новизна изобретения заключается в использовании принципа конкурентного вытеснения кандидатов в ДНК-аптамеры. связавшихся с рецептором-мишенью с помощью моноклональных антител, специфичным к данным рецепторам.
Первые несколько раундов селекции могут не отличаться от традиционных и направлены на обогащение пула аптамеров последовательностями специфичными к заданной клеточной мишени. Дальнейшая селекция для достижения поставленного результата требует введения дополнительных новых стадий селекции, а именно: к комплексам аптамер-клетка добавляют избыток моноклональных антител специфичных к белковой мишени на поверхности клетки, при этом аптамеры. находясь в меньшей концентрации вытесняются с поверхности клеток за счет высокой концентрации антител; аптамеры перешедшие в раствор отделяют и амплифицируют.
Для получения аптамеров высокоспецифичных к заданной белковой мишени на поверхности клетки необходимо проведение нескольких раундов селекции. Чтобы пул аптамеров обогатился именно теми последовательностями, которые вытесняются моноклональными антителами желательно в каждом раунде увеличивать концентрацию добавляемых антител. Варьируя концентрации аптамеров и моноклональных антител можно получать аптамеры разной силы связывания с белковой мишенью.
В результате такой селекции будут получены аптамеры, специфически связывающиеся с заданными рецепторами на клетке.
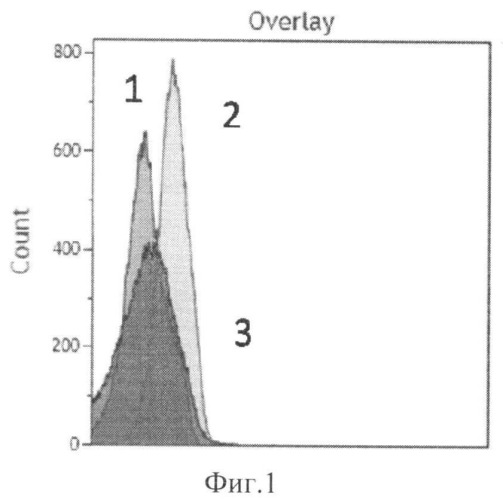
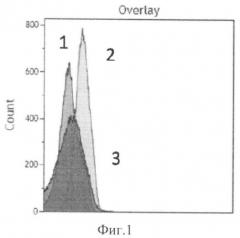
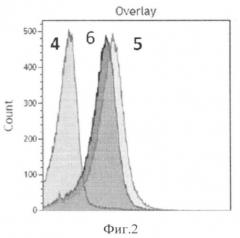
Способ иллюстрируется графиками. На фиг.1 показана интенсивность флуоресценции аптамеров, связавшихся с цитокератинами опухолевых клеток (кривая 1 - интактные клетки (не связанные с аптамерами), кривая 2 - флуоресценция 50 нМ пула аптамеров, связанных с клетками рака легкого человека, кривая 3 - флуоресценция аптамеров после их конкурентного вымещения с поверхности клеток избытком антител к цитокератинам). На фиг.2 показана интенсивность флуоресценции антител к цитокератинам меченых FITC (кривая 4 - интактные клетки (не связанные с антителами к цитокератинам), кривая 5 - флуоресценция антител к цитокератинам связанным с клетками, кривая 6 - флуоресценция антител к цитокератинам связанным с клетками, выместивших аптамеры с поверхности клеток).
Способ осуществляют следующим образом.
Селекцию проводят в среде, содержащей все необходимые компоненты для нормальной жизнедеятельности живых клеток, и в фосфатном буфере в случае молекулярных мишеней или фиксированных клеток. Необходимым условием для селекции аптамеров является наличие в среде или буфере инкубации с библиотекой аптамеров ионов магния и кальция, и, желательно, натрия и калия. Эти ионы необходимы для формирования вторичной и третичной структуры аптамеров, за счет которой и происходит высокоспецифичное распознавание мишени. Первые три раунда селекции аптамеров практически ничем не отличаются от традиционного метода SELEX.
В первом раунде селекции библиотеку аптамеров инкубируют с клетками, на поверхности которых находятся необходимые для выбора аптамеров рецепторы в течение 10-60 минут при 22-37°C (время и температура инкубации не фиксированы и могут варьировать в зависимости от мишени, желаемых результатов и предполагаемого использования). Затем клетки-мишени центрифугированием при 3500 об/мин в течение 3 мин освобождают от несвязавшихся олигонуклеотидов и отмывают в буфере PBS, содержащем Ca2+ и Mg2+. Связавшиеся олигонуклеотиды, находящиеся в осадке после центрифугирования, отделяют от биологической мишени с помощью денатурирования с использованием ТЕ-буфера при 95°C с последующим осаждением на 13000 об/мин в течение 15 мин. Далее надосадок собирают и проводят симметричную и асимметричную полимеразные цепные реакции.
После первого, и всех последующих раундов селекции, ПЦР-продукт очищают от праймеров осаждением ДНК этанолом или с помощью 30 кДа фильтров (например, Pall centrifugal devices). Второй и все последующие раунды начинают с негативной селекции аптамеров. В качестве негативных мишеней могут быть использованы клетки, не имеющие на поверхности заданных рецепторов. Полученный в ходе первого раунда ПЦР-продукт инкубируют с негативными мишенями в течение 10-40 минут. Далее проводят центрифугирование при 3500 об/мин в течение 3 мин и собирают надосадок. С собранным надосадком осуществляют позитивную селекцию. После чего центрифугируют и отмывают в буфере PBS, содержащем ионы Ca2+ и Mg2f. Связавшиеся олигонуклеотиды отделяют от биологической мишени денатурированием при 95°C с использованием ТЕ-буфера, с последующим осаждением при 13000 об/мин в течение 15 мин. После чего из собранного надосадка проводят симметричную и асимметричную полимеразные цепные реакции. В третьем раунде к стандартным этапам селекции после инкубирования ПЦР-продукта с негативными мишенями и центрифугирования для отделения от несвязавшихся остатков, надосадок можно проинубировать с плазмой или сывороткой крови в течение 10 минут для выбора устойчивых к нуклеазам аптамеров. После чего с надосадком проводят позитивную селекцию с последующей амплификации аптамеров. Инкубирование образца с плазмой крови можно проводить в среднем через один раунд селекции аптамеров. Начиная с четвертого раунда селекции, для получения аптамеров к заданным рецепторам, используют конкурентное замещение аптамеров естественными антителами. Полученный в ходе предыдущего раунда селекции ПЦР-продукт инкубируют с негативными мишенями в течение 10-40 минут. Далее проводят центрифугирование при 3500 об/мин в течение 3 мин и собирают надосадок. С собранным надосадком осуществляют позитивную селекцию. После чего центрифугируют и отмывают в буфере PBS. После этого к осадку добавляют антитела, специфичные к заданному рецептору и инкубируют в течение 30 минут. После отмывки добавляют антитела в большой концентрации (0,1-7 мг/мл). Можно добавлять антитела последовательно в разных концентрациях, тем самым, получая фракции аптамеров с разной силой взаимодействия с мишенью. Антитела замещают аптамеры, связавшиеся с рецепторами, в результате чего связавшиеся с заданными рецепторами аптамеры переходят в раствор. Затем образец центрифугируется для отделения аптамеров, перешедших в раствор от осадка. После чего надосадок собирается и проводится симметричная и ассиметричная ПЦР. Этапы, описанные в четвертом раунде селекции, повторяются в последующих раундах. Можно также чередовать третий и четвертый раунды селекции. Селекция аптамеров к заданным рецепторам с использованием конкурентного замещения антителами осуществляется в течение 10-15 раундов.
Ниже приведен пример осуществления способа селекции к цитокератинам.
Пример. Была проведена селекция аптамеров к цитокератинам, содержащимся в опухолевых клетках легкого.
Для осуществления селекции аптамеров к цитокератинам были использованы следующие реактивы:
1. Рандомизированная одноцепочечная ДНК-библиотека с внутренней вариабельной частью и нуклеотидами для посадки праймеров с каждой стороны.
2. Смесь для симметричной ПЦР, содержащая 1X ПЦР-буфер, 2.5 mM MgCl2, 0.025 U µL4 полимеразу KAPA2G HotStart Robust (KAPABiosystems, USA), 220 µМ dNTPs, прямой праймер 300 nM (5′-СТС СТС TGA CTG ТАА CCA CG-3′), обратный праймер 300 пМ (5′-GGC ТТС TGG ACT АСС TAT GC-3′) (Integrated DNA Technologies, USA). Смесь для асимметричной ПЦР. содержащая 1X ПЦР-буфер, 2.5 mM MgCl2, 0.025 U µL-l полимеразу KAPA2G HotStart Robust, 220 µМ dNTPs, 1 µМ прямого парймера Alexa-488 (5′-А1еха488-СТС СТС TGA CTG ТАА ССА CG-3′), и 50 nM обратного праймера (5′-GGC ТТС TGG ACT АСС TAT GC-3′).
3. Фосфатный буфер, содержащий ионы Са2+и Mg2+
4. Tris EDTA-буфер (ТЕ-буфер)
5. Моноклональные антитела к цитокератинам 4, 5, 6, 8, 10, 13 и 18 с меткой FITC (Sigma Aldrich, USA).
Первые три раунда селекции аптамеров были проведены по стандартному методу SELEX. В качестве позитивных мишеней были использованы опухолевые клетки легкого человека. В качестве негативных мишеней были использованы лимфоциты, поскольку они не экспрессируют цитокератины.
В первом раунде селекции библиотеку аптамеров инкубировали с опухолевыми клетками легкого в течение 30 минут при комнатной температуре. Затем клетки-мишени центрифугированием при 3500 об/мин в течение 3 мин освобождали от несвязавшихся олигонуклеотидов и отмывали в буфере PBS, содержащем Ca2+ и Mg2+. Связавшиеся с клетками олигонуклеотиды, находящиеся в осадке после центрифугирования, отделяли от биологической мишени с помощью денатурирования в ТЕ-буфере при 95°C с последующим осаждением на 13000 об/мин в течение 15 мин. Далее надосадок собирали и проводили симметричную и асимметричную полимеразные цепные реакции. В ходе симметричной ПЦР реакции получали двухцепочечные ДНК продукты, в ходе ассиметричной, одноцепочечные ДНК аптамеры. Симметричную ПЦР проводили с использованием 5 uL пула аптамеров в ТЕ-буфере с симметричной ПЦР-смесью. Асимметричную ПЦР проводили с использованием 5 µL симметричного ПЦР-продукта, смешанного с 45 uL смеси для ассиметричной ПЦР.
Амплификация проводилась по следующей программе: подогрев в течение двух минут при 95°C, 15 циклов по 30 секунд при 95°С, 15 секунд при 56.3°C, 15 секунд при 72°C; дальнейшие поддержание температуры на уровне 4°C.
Полученный ПЦР-продукт очищали от ПЦР смеси с помощью фильтров с использованием буфера PBS, содержащего ионы Ca2+ и Mg2+.
Во втором раунде селекции полученный в ходе первого раунда ПЦР-продукт инкубировали с лимфоцитами в течение 30 минут. Далее проводили центрифугирование при 3500 об/мин в течение 3 мин и собирали надосадок. С собранным надосадком осуществляли позитивную селекцию, с использованием опухолевых клеток легкого. Далее центрифугировали и отмывали в буфере PBS, содержащем ионы Ca2+ и Mg2+. Связавшиеся олигонуклеотиды отделяли от биологической мишени денатурированием при 95°C с использованием ТЕ-буфера, с последующим осаждением при 13000 об/мин в течение 15 мин. Из собранного надосадка проводили симметричную и асимметричную полимеразные цепные реакции. Полученный ПЦР-продукт очищали от примеров с помощью фильтров с использованием буфера PBS, содержащего ионы Ca2+ и Mg2+.
В третьем раунде после негативной селекции, к надосадку добавляли плазму крови, разведенную в буфере PBS, содержащем ионы Ca2+ и Mg2+. И инкубировали в течение примерно 10 минут. Затем, с надосадком проводили позитивную селекцию с последующей амплификации аптамеров и их очисткой от ПЦР смеси.
В четвертом раунде, полученный в ходе предыдущего раунда селекции ПЦР-продукт инкубировали с негативными мишенями в течение 30 минут, центрифугировали при 3500 об/мин в течение 3 мин, аптамеры не связавшиеся с мишенями, находящиеся в надосадке собирали и использовали для позитивной селекции. В ходе позитивной селекции аптамеры связывались с клетками опухоли, и осаждались с помощью центрифугирования с использованием буфера PBS, содержащего ионы Ca2+ и Mg2+. После этого осадок ресуспендировали и к клеточно-аптамерным комплексам добавляли антитела к цитокератинам, инкубацию проводили в течение 30 минут при комнатной температуре. Затем, образец центрифугировали для отделения перешедших в раствор аптамеров. Надосадочную жидкость с аптамерами собирали и проводили симметричную и ассиметричную полимеразные цепные реакции, с последующей очисткой продукта от ПЦР смеси. Всего было проведено восемь раундов селекции.
Для подтверждения того, что в результате селекции, использующей метод конкурентного вытеснения антителами, были получены аптамеры, специфичные к цитокератинам использовали метод проточной цитометрии (проточый цитометр FC-500, Beckman Coulter Inc., USA).
На фиг.1 показана интенсивность флуоресценции аптамеров, связавшихся с цитокератинами опухолевых клеток. В качестве контроля были использованы опухолевые клетки легкого человека, разведенные в буфере PBS, содержащем ионы Ca2+ и Mg2+, фиг.1 кривая 1. Опухолевые клетки легкого человека были проинкубированы с аптамерами, мечеными А1еха-647 в концентрации 50 нм в 200 мкл буфера PBS, содержащим ионы Ca2+ и Mg2+. Образец, проинкубированный с аптамерами показал увеличение флуоресценции, что свидетельствовало о связывании клеток с аптамерами, фиг.1 кривая 2. После добавления к этому же образцу антител к цитокератинам, меченых FITC в концентрации 2 мг/мл наблюдалось снижение флуоресценции (фиг.1 кривая 3), свидетельствовавшее о замещении аптамеров антителами к цитокератинам (при том что антитела к цитокератинам меченные FITC действительно связались с клетками фиг.2, кривая 6).
На фиг.2 показана интенсивность флуоресценции антител к цитокератинам меченых FITC. На фиг.2 кривая 4 показаны интактные опухолевые клетки (не связанные с антителами к цитокератинам). После инкубации опухолевых клеток с мечеными антителами к цитокератинам образец показал значительное увеличение флуоресценции, что свидетельствует о связывании антител с цитокератинами, фиг.2, кривая 5. После того как меченые антитела были добавлены к образцу, содержащему клетки, связавшиеся с аптамерами, наблюдалось незначительное уменьшение уровня флуоресценции по сравнению с образцом, содержащим только связавшиеся с клетками меченые антитела, фиг.2, кривая 6, что возможно явилось следствием неполного замещения аптамеров антителами (из за сильных электростатических взаимодействий).
Данные, полученные с помощью проточной цитометрии, показали, что антитела к цитокератинам заняли те же сайты связывания, что и аптамеры полученные в ходе конкурентной селекции. Этот факт доказывает специфичность полученных аптамеров к цитокератинам на поверхности раковых клеток.
Таким образом, с помощью способа селекции аптамеров к заданным белковым мишеням на поверхности клеток, основанном на конкурентном замещении одноцепочечных ДНК-библиотек моноклональными антителами, можно получать аптамеры, специфичные к нативным белкам.
1. Способ селекции аптамеров к заданным белковым мишеням на поверхности клеток, включающий проведение раундов селекции, каждый из которых включает стадии: позитивной селекции - инкубирования библиотеки олигонуклеотидов с биологической мишенью, с удалением несвязавшаяся ДНК; негативной селекции - инкубирование полученных аптамеров с негативной мишенью, с отделением связавшихся с негативной мишенью последовательностей; амплификацию полученных в ходе селекции аптамеров, с получением ПЦР-продукта, отличающийся тем, что второй и все последующие раунды селекции начинают с негативной селекции аптамеров, в четвертом раунде селекции после проведения стадий негативной и позитивной селекции аптамеров к комплексам аптамер-клетка добавляют избыток моноклональных антител, специфичных к белковой мишени на поверхности клетки, аптамеры, перешедшие в раствор, отделяют и амплифицируют.
2. Способ селекции по п.1, отличающийся тем, что четвертый раунд селекции повторяют во всех последующих раундах.
3. Способ селекции по п.1, отличающийся тем, что его осуществляют с чередованием третьего и четвертого раундов во всех последующих раундах после четвертого.
4. Способ селекции по п.1, отличающийся тем, что в третьем раунде селекции после инкубирования ПЦР-продукта с негативными мишенями и отделения от несвязавшихся остатков полученный надосадок инкубируют с плазмой или сывороткой крови, после чего проводят позитивную селекцию, с последующей амплификации аптамеров.
5. Способ селекции по п.4, отличающийся тем, что инкубирование образца с плазмой крови можно проводить через один раунд селекции аптамеров.
6. Способ селекции по п.1, отличающийся тем, что в каждом раунде селекции концентрацию добавляемых антител увеличивают.