Режим дозирования ингибиторов комт
Иллюстрации
Показать всеИзобретение относится к применению оксадиазолильного соединения формулы I
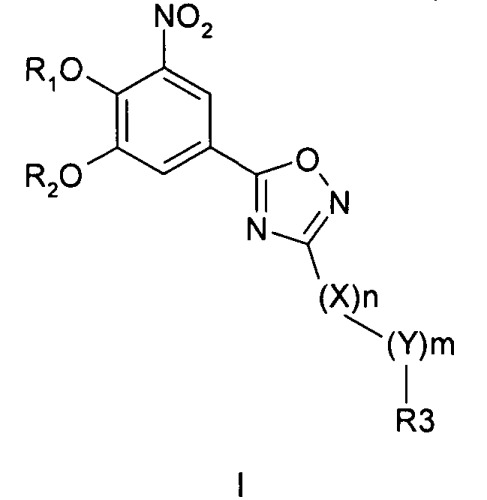
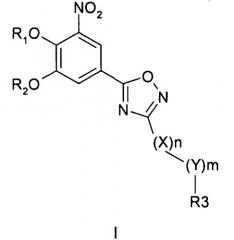
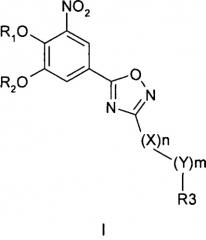
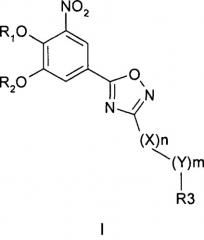
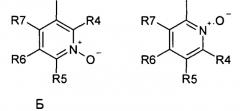
где R1 и R2 обозначают водород; X обозначает метиленовую группу; Y представляет собой атом кислорода; n представляет собой число 0, 1, 2 или 3, и m представляет собой число 0 или 1; R3 обозначает группу N-оксида пиридина согласно формуле Б, которая присоединяется, как показано неотмеченной связью:
где R4, R5, R6 и R7 являются одинаковыми или разными и обозначают водород, низший алкил, галоген, галоалкил, трифторметил; термин алкил означает углеродные цепи, неразветвленные или разветвленные, содержащие от одного до шести углеродных атомов; термин галоген означает фтор, хлор, бром или йод; или его фармакологически приемлемой соли для получения лекарства для предотвращения или лечения заболеваний, связанных с центральной и периферической нервной системой, где указанное лекарство вводят согласно схеме приема, имеющей периодичность дозирования в диапазоне от приблизительно двух раз в день до приблизительно одного раза через день. 6 н. и 78 з.п. ф-лы, 3 ил., 3 пр.
Реферат
Данное изобретение относится к новым замещенным нитрокатехолам и их применению при лечении расстройств центральной и периферической нервной системы в соответствии с определенной схемой приема.
Основная причина применения ингибиторов КОМТ в качестве вспомогательных средств при L-ДОПА/ААОС терапии основывается на их способности уменьшать метаболическое 0-метилирование L-ДОПА до 3-0-метил-L-ДОПА (3-ОМД). Период вызванного L-ДОПА клинического улучшения непродолжителен, как результат короткого времени полужизни in vivo L-ДОПА в отличие от длительного времени полужизни 3-ОМД. Кроме того, 3-ОМД конкурирует с L-ДОПА за перенос через гематоэнцефалический барьер (ВВВ, от blood-brain barrier), что означает, что только очень ограниченное количество перорально введенной дозы L-ДОПА действительно достигает места действия, т.е. головного мозга. Обычно только через несколько лет после начальной L-ДОПА терапии с обычной схемой приема вызванное L-ДОПА клиническое улучшение снижается к концу каждого цикла дозирования, приводя к так называемому состоянию «изнашивания» двигательных флуктуации. Описана прямая взаимосвязь между феноменом «изнашивания» и накоплением 3-ОМД (Tohgi, H., et al., Neurosci. Letters, 132: 19-22, 1992). Предполагается, что это может быть следствием замедленного проникания L-ДОПА в мозг из-за конкуренции за транспортную систему через ВВВ с 3-ОМД (Reches, A. et al., Neurology, 32: 887-888, 1982) или, проще говоря, небольшое количество L-ДОПА способно достигнуть головного мозга (Nutt, J.G., Fellman, J.H., Clin. Neuropharmacol., 7: 35-49, 1984). В действительности ингибирование КОМТ защищает L-ДОПА от метаболического расщепления на периферии в ходе 0-метилирования, так что при повторных дозах L-ДОПА средняя величина концентрации L-ДОПА в плазме повышается. В дополнение к пониженной конкуренции за перенос к головному мозгу значительно больший процент перорально введенной дозы L-ДОПА способен достигнуть места действия. Таким образом, ингибирование КОМТ способствует увеличению биологической доступности L-ДОПА, и период антипаркинсонического действия удлиняется с однократными дозами L-ДОПА (Nutt, J.G., Lancet, 351: 1221-1222, 1998).
Наиболее эффективными ингибиторами КОМТ, описанными к настоящему времени, являются 3,4-дигидрокси-4'-метил-5-нитробензофенон (толкапон, Австралийский патент AU-B-69764/87) и (Е)-2-циано-N,N-диэтил-3-(3,4-дигидрокси-5-нитрофенил)акриламид (энтакапон, Германский патент DE 3740383 А1).
Имея по существу одинаковый фармакофор, толкапон отличается от энтакапона тем, что легко проникает в центральную нервную систему (ЦНС) и способен ингибировать церебральную КОМТ, а также периферическую КОМТ. Однако вскоре после его выпуска толкапон изъяли из продажи после того, как стало известно о нескольких случаях гепатотоксичности, включая три внезапных смерти от летального фульминантного гепатита. На сегодняшний день толкапон можно использовать только для больных паркинсонизмом, которые не восприимчивы к другим способам лечения, и строго только при постоянном наблюдении за функцией печени, что дорого и неудобно для пациента. Хотя фактические механистические причины печеночной токсичности, связанной с толкапоном, понятны неполностью, in vitro изучения показали, что толкапон можно уменьшить метаболически до реакционно-способных промежуточных соединений, и предполагается, что они могут образовывать ковалентные аддукты с белками печени, вызывая гепатоцеллюлярное повреждение (Smith, K.S. et al, Chem. Res. Toxicol., 16: 123-128,2003).
Энтакапон напротив, имея с толкапоном один и тот же нитрокатехоловый фармакофор, не связан с печеночной токсичностью и, как правило, рассматривается как безопасное лекарственное вещество. К сожалению, однако, энтакапон является значительно менее эффективным ингибитором КОМТ, чем толкапон, и обладает намного более коротким временем полужизни in-vivo. Это означает, что энтакапон имеет очень ограниченную продолжительность действия и, как следствие, лекарственно вещество следует вводить в очень больших дозах с каждой дозой L-ДОПА, принятой пациентом. В связи с этим клиническая эффективность энтакапона была подвергнута сомнению - действительно, недавнее исследование (Parashos, S.A. et al., Clin. Neuropharmacol., 27(3): 119-123, 2004) показало, что основной причиной для прекращения лечения энтакапоном пациентов с болезнью Паркинсона является ощутимая нехватка эффективности.
Кроме того, относительно короткое время полужизни in-vivo известных ингибиторов КОМТ требует продолжительных схем лечения, обычно включающих введение нескольких доз в день, что многие пациенты найдут обременительным. Например, толкапон следует вводить три раза в день. Следовательно, данное обстоятельство может мешать соблюдению пациентом схемы лечения и вредить качеству жизни.
Соответственно все еще существует потребность в ингибиторах КОМТ, проявляющих сбалансированные свойства биологической активности, биологической доступности и безопасности. А именно, существует потребность в ингибиторах КОМТ, имеющих длительно время полужизни in-vivo и, таким образом, пролонгированное действие на КОМТ, позволяющее, используя меньшее количество доз, получить требуемый лечебный эффект.
Нами в настоящее время неожиданно было обнаружено, что соединения общей формулы 1 представляют собой очень эффективные ингибиторы КОМТ, которые также обладают исключительно длительной продолжительностью действия по сравнению с ингибиторами КОМТ из известного уровня техники.
Кроме того, нами неожиданно было установлено, что соединения общей формулы 1 заметно усиливают биологическую доступность L-ДОПА и увеличивают доставку L-ДОПА к головному мозгу. Соединения значительно повышают уровни дофамина в головном мозге.
Даже более неожиданно повышенные уровни L-ДОПА остаются стабильными в течение двадцатичетырехчасового периода. Эти влияния как на активность КОМТ, так и биологическую доступность L-ДОПА через 24 часа после введения соединений общей формулы 1 заметно больше, чем те, что наблюдались с толкапоном, к настоящему времени единственным известным ингибитором КОМТ, обладающим довольно длительной продолжительностью действия. При коротких промежутках времени (2 и 7 часов) соединения общей формулы 1 дают увеличения при доставке L-ДОПА к головному мозгу, подобные тем, что наблюдались через 24 часа, и расходятся с теми, что наблюдались с толкапоном. Это приводит к более стабильной доставке L-ДОПА к головному мозгу после введения соединений общей формулы I, тогда как толкапон вызывает заметные колебания при доставке L-ДОПА к головному мозгу. Таким образом, соединения общей формулы 1 по всей вероятности обладают терапевтическими преимуществами вследствие длительного постоянного повышения уровней L-ДОПА, тогда как применение толкапона вероятно вызывает нежелательные побочные эффекты, такие как дискинезия, из-за внезапных увеличений и уменьшений уровней L-ДОПА.
Соединения общей формулы 1 представляют собой соединения, имеющие следующую формулу
где R1 и R2 независимо друг от друга представляют собой водород или группу, которая гидролизуется при физиологических условиях, возможно замещенный 5 низший алканоил или ароил; Х представляет собой метиленовую группу; Y представляет собой атом кислорода, азота или серы; n представляет собой число 0, 1, 2 или 3, и m представляет собой число 0 или 1; R3 представляет собой группу N-оксида пиридина согласно формуле А, Б или В, которая присоединяется, как показано неотмеченной связью:
где R4, R5, R6 и R7 являются одинаковыми или разными и обозначают водород, низший алкил, низший тиоалкил, низший алкокси, арилокси или тиоарильную группу, низшую алканоильную или ароильную группу, возможно замещенную арильную группу, амино, низший алкиламино, низший диалкиламино, циклоалкиламино или гетероциклоалкиламино группу, низшую алкилсульфонильную или арилсульфонильную группу, галоген, галоалкил, трифторметил, циано, нитро или гетероарильную группу, или, взятые вместе, обозначают алифатические или гетероалифатические кольца, или ароматические или гетероароматические кольца; термин алкил означает углеродные цепи, неразветвленные или разветвленные, содержащие от одного до шести углеродных атомов; термин арил означает фенильную или нафтильную группу, возможно замещенную алкокси группами или галогенами; термин гетероциклоалкил представляет собой четырех - восьмичленное циклическое кольцо, возможно включающее дополнительные атомы кислорода, серы или азота; термин гетероарил представляет собой пяти- или шестичленное кольцо, включающее атом серы, кислорода или азота; термин галоген означает фтор, хлор, бром или йод.
В вышеприведенной формуле предпочтительно R4, R5, R6 и R7 независимо друг от друга представляют собой водород, C1-C6-алкил, C1-C6-тиоалкил, C1-C6-алкокси, С6-С12-арилокси или С6-С12-тиоарильную группу, C1-C6-алканоильную или С7-С13-ароильную группу, амино, C1-C6-алкиламино, C1-C6-диалкиламино, С7-С13-циклоалкиламино, С3-С12-гетероциклоалкиламино, С3-С12-алкилсульфонил, C3-C12-арилсульфонил, галоген, C1-C6-галоалкил, трифторметил, циано, нитро или гетероарильную группу; или два или более взятых вместе остатка R4, R5, R6 и R7 представляют собой алифатические или гетероалифатические кольца, или ароматические или гетероароматические кольца.
Предпочтительно С1-С6-алкильные остатки представляют собой метил, этил, н-пропил, изопропил, н-бутил, елюр-бутил, тpeт-бутил, гептил или гексил. Предпочтительно C1-C6-тиоалкильные остатки представляют собой тиометил, тиоэтил, тио-н-пропил, тио-изопропил и тио-н-бутил. Предпочтительно C1-C6-алкокси остатки представляют собой метокси, этокси, н-пропокси, изопропокси, н-бутокси, втор-бутокси и трет-бутокси. Предпочтительно С6-С12-арилокси остатки представляют собой фенокси или нафтокси, которые могут быть замещены. Предпочтительно С6-С12-тиоарильные остатки представляют собой тиофенил и тионафтил, которые могут быть замещены. Предпочтительно C1-C6-алканоильные остатки представляют собой метаноил, этаноил, пропаноил или бутаноил. Предпочтительно С7-С13-ароильные остатки представляют собой бензоил и нафтоил. Предпочтительно остатки C1-С6-алкиламино представляют собой метиламино, этиламино, н-пропиламино, изопропиламино и н-бутиламино. Предпочтительно остатки С1-С6-диалкиламино представляют собой диметиламино, диэтиламино, ди-н-пропиламино, ди-н-бутиламино, ди-изопропиламино, метилэтиламино, метилпропиламино и этилпропиламино. Предпочтительно остатки С3-С12-циклоалкиламино представляют собой пирролидино, пиперидино, циклогексиламино и дициклогексиламино. Предпочтительно остатки С3-С12-гетероциклоалкиламино представляют собой морфолино, 2,6-диметилморфолино, 3,5-диметилморфолино, пиперазино, N-метилпиперазино и N-этилпиперазино. Предпочтительно С1-С6-алкилсульфонильные или С6-С12-арилсульфонильные остатки представляют собой метилсульфонил, этилсульфонил, фенилсульфонил и толилсульфонил. Предпочтительно остатки галогенов представляют собой хлор, бром, йод и фтор. Предпочтительно C1-С6-галоалкил представляет собой хлорметил, фторметил, дихлорметил, дифторметил, трихлорметил и трифторметил. Предпочтительно гетероарильные остатки представляют собой пиридил, пиримидил, изоксазолил, оксазолил, изоксадиазолил, оксадиазолил, триазолил и тетразолил. В тех случаях, когда два или более взятых вместе остатка R4, R5, R6 и R7 представляют собой алифатические, или гетероалифатические кольца, или ароматические или гетероароматические кольца, предпочтительные объединенные остатки представляют собой индолизинил, изоиндолил, индолил, индазолил, пуринил, хинолизинил, нафтиридинил, изохинолил и хинолил. Предпочтительно каждый пит обозначает число 0 или 1, или оба означают 0 или 1.
В следующем описании медицинских показаний, методов лечения и схем приема фармацевтических композиций, содержащих соединения согласно общей формуле I по изобретению, наиболее предпочтительным примером соединения согласно общей формуле I является 5-[3-(2,5-дихлор-4,6-диметил-1-окси-пиридин-3-ил)-[1,2,4]оксадиазол-5-ил]-3-нитробензол-1,2-диол, далее обозначаемый как соединение А, и его фармакологически приемлемые соли и эфиры.
Другие предпочтительные соединения вышеприведенной общей формулы (I) в следующих медицинских показаниях, методах лечения и схемах приема включают 3-(5-(3,4-дигидрокси-5-нитрофенил)-1,2,4-оксадиазол-3-ил)-4-(трифторметил)пиридин-1 -оксид, 2-хлор-3-(5-(3,4-дигидрокси-5-нитрофенил)-1,2,4-оксадиазол-3-ил)-4,6-диметилпиридин-1-оксид, 3-(5-(3,4-дигидрокси-5-нитрофенил)-1,2,4-оксадиазол-3-ил)-2-метил-6-(трифторметил)пиридин-1-оксид, 5-(5-(3,4-дигидрокси-5-нитрофенил)-1,2,4-оксадиазол-3-ил)-2-(трифторметил)пиридин-1 -оксид, 5-(5-(3,4-дигидрокси-5-нитрофенил)-1,2,4-оксадиазол-3-ил)-2-метил-4-(трифторметил)пиридин-1 -оксид, 3-(5-(3,4-дигидрокси-5-нитрофенил)-1,2,4-оксадиазол-3-ил)-2,6-диметил-4-(трифторметил)пиридин-1-оксид, 3,5-дихлор-4-(5-(3,4-дигидрокси-5-нитрофенил)-1,2,4-оксадиазол-3-ил)пиридин-1 -оксид, 3-(5-(3,4-дигидрокси-5-нитрофенил)-1,2,4-оксадиазол-3-ил)-6-метил-2-фенил-4-(трифторметил)пиридин-1-оксид, 2-бром-3-(5-(3,4-дигидрокси-5-нитрофенил)-1,2,4-оксадиазол-3-ил)-4,5,6-триметилпиридин-1 -оксид, 2-хлор-3-(5-(3,4-дигидрокси-5-нитрофенил)-1,2,4-оксадиазол-3-ил)-4,5,6-триметилпиридин-1-оксид, 3-(5-(3,4-дигидрокси-5-нитрофенил)-1,2,4-оксадиазол-3-ил)-2-(трифторметил)пиридин-1 -оксид, 2-хлор-3-(5-(3,4-дигидрокси-5-нитрофенил)-1,2,4-оксадиазол-3-ил)-6-метилпиридин-1-оксид, 2-бром-3-(5-(3,4-дигидрокси-5-нитрофенил)-1,2,4-оксадиазол-3-ил)-6-метилпиридин-1-оксид, 2-бром-5-хлор-3-(5-(3,4-дигидрокси-5-нитрофенил)-1,2,4-оксадиазол-3-ил)-4,6-диметилпиридин-1-оксид, 5-[3-(2-хлор-1-окси-пиридин-4-ил)-[1,2,4]оксадиазол-5-ил]-3-нитро-бензол- 1,2-диол, 5-[3-(2-морфолин-4-ил-1-окси-пиридин-4-ил)-[1,2,4]оксадиазол-5-ил]-3-нитро-бензол-1,2-диол, 5-[3-(4-бром-1-окси-пиридин-3-ил)-[1,2,4]оксадиазол-5-ил]-3-нитро-бензол-1,2-диол, 5-[3-(2-морфолин-4-ил-1 -окси-пиридин-3-ил)-[1,2,4]оксадиазол-5-ил]-3-нитро-бензол-1,2-диол, 5-[3-(2-метил-1-окси-6-фенил-4-трифторметил-пиридин-3-ил)-[1,2,4]оксадиазол-5-ил]-3-нитро-бензол-1,2-диол и 5-[3-(2-бром-4,6-диметил-1-окси-пиридин-3-ил)-[1,2,4]оксадиазол-5-ил]-3-нитро-бензол-1,2-диол, и их фармакологически приемлемые соли и эфиры.
Настоящее изобретение относится к применению соединений общей формулы I, их фармацевтически приемлемых солей или эфиров для предотвращения или лечения конкретных патологических состояний, особенно у людей (например расстройств центральной и периферической нервной системы), и к получению фармацевтических композиций, содержащих их.
Подвергающиеся лечению патологические состояния предпочтительно являются связанными с центральной и периферической нервной системой заболеваний людей. Предпочтительные заболевания включают двигательные расстройства и шизоаффективные расстройства. Двигательные расстройства характеризуются либо недостатком движения, либо чрезмерным движением. Двигательные расстройства, предпочтительно излечиваемые соединениями общей формулы I, включают болезнь Паркинсона, дистонию, дискинезию, экстрапирамидные синдромы, нарушение походки, тремор, хорею, дрожательный паралич, акатизию, атетоз, брадикинезию, обморожение, ригидность, постуральную неустойчивость, миоклонию и судорожные сокращения или синдром Туретта. Наиболее предпочтительным заболеванием является болезнь Паркинсона.
Как используется здесь, термин «лечение» и такие варианты, как «лечить» или «подвергающийся лечению», относятся к режиму, который может оказывать благоприятное воздействие на человека или животное. Лечение может относиться к существующему состоянию или может быть профилактическим (превентивным лечением). Лечение может включать целебное, облегчающее или профилактическое действия. Лечение может предотвращать или задерживать появление болезни, замедлять прогрессирование или улучшать симптомы заболевания или состояния.
Соединения общей формулы I предпочтительно используются для получения лекарства для предотвращения или лечения заболеваний, связанных с центральной и периферической нервной системой, согласно определенной схеме приема.
Подходящие схемы приема (режимы дозирования) включают режимы, имеющие периодичность дозирования в диапазоне от приблизительно двух раз в день до приблизительно одного раза через день.
Как используется здесь, термин «периодичность дозирования» относится к числу эффективных доз соединения общей формулы I, даваемых в определенный промежуток времени.
Предпочтительно периодичность дозирования выбрана из двух раз в день, одного раза в день и одного раза через день.
В случае периодичности дозирования два раза в день эффекты изобретения могут быть достигнуты при введении один раз в течение каждых 12 часов, даже когда время между введениями (или интервал дозирования) не составляет 12 часов. Дозы предпочтительно вводят с интервалами дозирования от 8 до 16 часов, более предпочтительно 12 часов, причем два интервала дозирования предпочтительно составляют приблизительно 24 часа. Подходящие неограниченные начальные точки для интервалов дозирования включают утро, середину дня, полдень, день, вечер и полночь. Например, схема приема два раза в день согласно изобретению может требовать введение дозы в 8.00 утра и другой дозы в 17.00 дня (в этом случае интервалы дозирования составляют 11 часов и 13 часов и сводятся приблизительно к 24 часам). Предпочтительно, чтобы временной интервал между двумя дозами составлял около 12 часов.
В случае периодичности дозирования один раз в день эффекты изобретения могут быть достигнуты при введении один раз в течение каждых 24 часов, даже когда время между введениями не составляет 24 часа. Дозы предпочтительно вводят с интервалами дозирования около 24 часов. Подходящие неограниченные начальные точки для интервалов дозирования включают утро, середину дня, полдень, день, вечер и полночь. Например, схема приема один раз в день согласно изобретению может требовать введение дозы в 8.00 утра и другой дозы в 8.00 утра следующего дня (в этом случае интервал дозирования составляет около 24 часов).
В случае периодичности дозирования один раз через день эффекты изобретения могут быть достигнуты при введении один раз в течение каждых 48 часов, даже когда время между введениями не составляет 48 часов. Дозы предпочтительно вводят с интервалами дозирования от 36 до 60 часов, причем интервалы дозирования предпочтительно в среднем составляют около 48 часов. Подходящие неограниченные начальные точки для интервалов дозирования включают утро, середину дня, полдень, день, вечер и полночь. Например, схема приема один раз через день согласно изобретению может требовать введение дозы в 8.00 утра первого дня и другой дозы в 13.00 третьего дня (в этом случае интервал дозирования составляет 53 часа). Предпочтительно время между введениями составляет около 48 часов.
В настоящем изобретении эффективные суточные дозы соединений общей формулы I находятся в диапазоне 1-1000 мг/день, более предпочтительно от 2 до 500 мг/день, даже более предпочтительно от 3 до 250 мг/день и наиболее предпочтительно 5-100 мг/день.
Предпочтительно, чтобы отдельные единицы дозирования соединений общей формулы I находились в интервале 1-500 мг, более предпочтительно от 2 до 300 мг/день, даже более предпочтительно от 3 до 100 мг/день и наиболее предпочтительно 5-50 мг, причем суточная доза может различаться в зависимости от времени введения. Например, при схеме приема два раза в день возможно вводить дозу, содержащую 11/24 суточной дозы соединения общей формулы I, в 8.00 утра и другую дозу, содержащую 13/24 суточной дозы соединения общей формулы I, в 17.00 дня.
Как используется здесь, термин «единица дозирования» относится к отдельному фармацевтическому препарату, например таблетке, содержащему соединение общей формулы I, который вводиться пациенту во время режима дозирования.
Предпочтительно, чтобы объект, подвергаемый лечению с соединением общей формулы I, также получал лечение с L-ДОПА и/или ингибитором декарбоксилазы ароматических L-аминокислот (AADC).
Подходящие AADC включают карбидопу и бенсеразид.
Соединения общей формулы I, L-ДОПА и AADC могут быть введены раздельно или в любом сочетании. Их можно вводить параллельно (например одновременно) или последовательно и с одинаковой или различающейся периодичностью дозирования. Например, соединения общей формулы I могут быть введены параллельно или последовательно с L-ДОПА. В случае одновременного введения также возможно объединять оба активных компонента в одном фармацевтическом препарате.
Согласно другому аспекту настоящего изобретения создан способ лечения по меньшей мере одного состояния или заболевания у пациента, нуждающегося в лечении, включающий стадию, на которой вводят пациенту приблизительно два раза в день - приблизительно один раз через день фармакологически эффективную дозу соединения общей формулы I, как определено выше.
Предпочтительно вводят один раз в день для всех воплощений изобретения.
Предпочтительно для всех способов по изобретению, чтобы объект, подвергаемый лечению с соединением общей формулы I, также получал лечение с L-ДОПА и/или ингибитором декарбоксилазы ароматических L-аминокислот (AADC).
Согласно другому аспекту изобретения создан способ снижения ингибирования КОМТ у объекта в течение 24-48 часов, включающий стадию, на которой вводят объекту от приблизительно двух раз в день до приблизительно одного раза через день эффективную дозу соединения общей формулы I, как определено выше.
Согласно другому аспекту изобретения создан способ увеличения уровней L-ДОПА в головном мозге объекта в течение 24-48 часов, включающий стадию, на которой вводят объекту от приблизительно двух раз в день до приблизительно одного раза через день эффективную дозу соединения общей формулы I, как определено выше.
Согласно другому аспекту изобретения создан способ увеличения уровней L-ДОПА в плазме объекта в течение 24-48 часов, включающий стадию, на которой вводят объекту от приблизительно двух раз в день до приблизительно одного раза через день эффективную дозу соединения общей формулы I, как определено выше.
Согласно другому аспекту изобретения создан способ уменьшения уровней 3-0-метил-1--ДОПА (3-ОМД) в головном мозге объекта в течение 24-48 часов, включающий стадию, на которой вводят объекту от приблизительно двух раз в день до приблизительно одного раза через день эффективную дозу соединения общей формулы I, как определено выше.
Согласно другому аспекту изобретения создан способ уменьшения уровней 3-ОМД в плазме объекта в течение 24-48 часов, включающий стадию, на которой вводят объекту от приблизительно двух раз в день до приблизительно одного раза через день эффективную дозу соединения общей формулы I, как определено выше.
Согласно другому аспекту изобретения создан способ увеличения биологической доступности L-ДОПА в головном мозге объекта в течение 24-48 часов, включающий стадию, на которой вводят объекту от приблизительно двух раз в день до приблизительно одного раза через день эффективную дозу соединения общей формулы I, как определено выше.
Согласно другому аспекту изобретения создан способ увеличения биологической доступности L-ДОПА в плазме объекта в течение 24 - 48 часов, включающий стадию, на которой вводят объекту от приблизительно двух раз в день до приблизительно одного раза через день эффективную дозу соединения общей формулы I, как определено выше.
Согласно дополнительному аспекту изобретения создана фармацевтическая композиция, приспособленная к введению соединения общей формулы 1 от приблизительно двух раз в день до приблизительно одного раза через день.
Настоящее изобретение также относится к упаковке, включающей фармацевтическую композицию соединения общей формулы 1 в сочетании с инструкциями по вводу указанного препарата со схемой приема, имеющей периодичность дозирования в диапазоне от двух раз в день до приблизительно одного раза через день.
В одном воплощении соединения общей формулы 1 можно получить по способу, согласно которому соединение общей формулы IIА, IIБ или IIIВ,
где R4, R5, R6 и R7 являются такими, как определено в общей формуле I, подвергают реакции циклизации, включающей конденсацию и дегидратацию, с соединением общей формулы III,
где R8 и R9 независимо друг от друга представляют собой водород или подходящие защитные группы для ароматических гидроксильных групп, при условиях, пригодных для получения оксадиазольных производных формулы IVA, IVБ или IVB,
Затем при необходимости удаляют гидроксилзащищающие группы, чтобы получить соединения общей формулы I.
В другом воплощении соединения общей формулы 1 можно получить по способу, согласно которому соединение общей формулы VA, V5 или VB,
где R4, R5, R6 и R7 являются такими, как определено в общей формуле I, подвергают реакции циклизации, включающей конденсацию и дегидратацию, с соединением общей формулы III при условиях, пригодных для получения оксадиазольных производных формулы VIA, VIБ или VIB,
затем окисляют пиридиновый атом азота, что дает соединение согласно формуле IVA, IVB или IVB, как показано выше, и при необходимости удаляют гидроксилзащищающие группы, чтобы получить соединения общей формулы I.
Подходящие защитные группы для ароматических гидроксильных групп хорошо известны в данной области техники. Примеры подходящих защитных групп для ароматических гидроксильных групп включают метил, этил, изопропил, бензил, 4-метоксибензил, метоксиметил, бензилоксиметил, метоксиэтоксиметил, тетрагидропиранил, фенацил, аллил, триметилсилил, трет-бутилдиметилсилил, бензилоксикарбонил, трет-бутоксикарбонил, эфир, сульфонат, карбамат, фосфинат, ацетальные и кетальные производные.
В предпочтительном воплощении одна из групп R8 и R9 представляет собой водород, и другая является метилом. В особенно предпочтительном воплощении R8 представляет собой метил и R9 представляет собой водород.
В альтернативном предпочтительном воплощении защитные группы R8 и R9 заменяют на водород или группу, которая гидролизуется при физиологических условиях. Защитные группы R8 и R9 могут быть удалены независимо друг от друга в ходе отдельных реакционных стадий или могут быть удалены в ходе одной реакционной стадии. Таким же образом введение группы, которая гидролизуется при физиологических условиях, можно осуществлять либо на этой же, либо на последующей реакционной стадии.
В настоящем изобретении условия пригодные для получения оксадиазольных производных включают условия, которые дают оксадиазольное производное с высоким выходом и чистотой. Предпочтительно выход требуемого оксадиазольного производного составляет по меньшей мере 70%, более предпочтительно 75-99%, даже более предпочтительно 80-97% и наиболее предпочтительно 85-95%. Предпочтительно чистота требуемого оксадиазольного производного составляет по меньшей мере 90%, более предпочтительно по меньшей мере 95%, даже более предпочтительно по меньшей мере 99% и наиболее предпочтительно по меньшей мере 99,5%. Исходя из предмета настоящего изобретения квалифицированный специалист может обычным путем установить наиболее подходящие реакционные условия, чтобы оптимизировать выход и чистоту оксадиазола. Параметры, которые следует учитывать квалифицированному специалисту, включают, но не ограничиваются этим, реагенты, осуществляющие конденсацию, и дегидратирующие агенты, выбор защитных групп R8 и R9, систему растворителей, температуру реакции и время реакции, и растворимость реагентов.
Соединение общей формулы III требует активации перед реакцией конденсации с соединением формулы IIА-IIВ или VA-VB. Подходящие реагенты для активации соединения формулы III включают 1,1-карбонилдиимидазол, тионилхлорид, сульфонилхлорид, N,N'-дициклогексилкарбодиимид, 1-гидроксибензотриазол и М-(3-диметиламинопропил)-N'-этилкарбодиимид, фосген, РСl3, РОСl3, PCl5, ангидриды, трихлортриазин и хлордиметокситриазин и подобные. Особенно предпочтительны 1,1-карбонилдиимидазол и тионилхлорид. В некоторых случаях те же самые реагенты можно применять для выполнения стадии циклизации, которая состоит из конденсации и дегидратации. Альтернативные реагенты для осуществления конденсации и/или дегидратации включают пиридин и фторид тетрабутиламмония. Предпочтительно дегидратацию можно выполнить в ходе теплового нагревания реакционной смеси совместно с вышеупомянутыми реагентами.
Соединение общей формулы III можно активировать с избытком реагента, такого как тионилхлорид, в подходящем растворителе или без необходимости в дополнительном растворителе. Предпочтительно избыток реагента можно затем удалить, например, перегонкой, и заменить растворителем и другим реагентом, таким как пиридин, чтобы выполнить стадии конденсации и дегидратации. Предпочтительные системы растворителей для активации соединения общей формулы III и циклизации с соединениями общих формул IIА-IIВ или VA-VB представляют собой диполярные апротонные растворители, включающие диметилформамид, диметилсульфоксид, диметилацетамид и N-метилпирролидинон. Особенно предпочтительны диметилсульфоксид и диметилацетамид.
Подходящие температуры реакции и время реакции зависят от реакционной способности используемых для осуществления конденсации и дегидратации реагентов. Предпочтительно температура реакции находится в диапазоне от 0°С до точки кипения используемой системы растворителей, более предпочтительно в диапазоне 20-150°С и наиболее предпочтительно в диапазоне 25-120°С. Предпочтительно время реакции находится в интервале от 30 минут до 24 часов, более предпочтительно в интервале от 1 часа до 18 часов и наиболее предпочтительно 2-6 часов.
В альтернативном предпочтительном воплощении реакцию конденсации и дегидратации проводят в присутствии органического или неорганического основания. Подходящие предпочтительные основания включают триэтиламин, трибутиламин, 2,6-лутидин, N-метилморфолин, пиридин, имидазол, N-метилимидазол и 4-диметиламинопиридин. Особенно предпочтительные основания включают пиридин, N-метилимидазол и 4-диметиламинопиридин.
В предпочтительном воплощении настоящего изобретения конденсацию и дегидратацию проводят в ходе двух отдельных реакционных стадий. В этом конкретном воплощении разные агенты конденсации и дегидратации и системы растворителей можно использовать, чтобы оптимизировать выход и чистоту получаемого продукта.
В альтернативном предпочтительном воплощении настоящего изобретения конденсацию и дегидратацию проводят последовательно в одном и том же сосуде без выделения 0-ацилированных промежуточных соединений. В этом конкретном воплощении реагенты, осуществляющие конденсацию и дегидратацию, могут быть одинаковыми или разными, но предпочтительно идентичными.
Количество реагентов, осуществляющих конденсацию и дегидратацию, не является определяющим. Обычные количества реагентов, осуществляющих конденсацию и дегидратацию, включают по меньшей мере количество в 1 моль, предпочтительно от 2,1 моль до 5 моль, более предпочтительно 2,2-4 моль и наиболее предпочтительно от 2,3 моль до 3 моль на моль пиридинового производного. В тех случаях, когда реагенты, осуществляющие конденсацию и дегидратацию, также служат в качестве растворителя или сорастворителя, избыточное количество может быть намного выше.
Как упоминалось выше, в предпочтительных воплощениях изобретение включает стадию, на которой атом азота пиридиновой группировки VIA, VIБ или VIВ окисляют при подходящих условиях до соответствующего производного пиридил-N-оксида IVA, IVB или IVB после реакции циклизации.
В настоящем изобретении окислительные условия пригодные для получения пиридил-N-оксида включают условия, которые дают производное пиридил-N-оксида с высоким выходом и чистотой. Предпочтительно выход требуемого производного пиридил-N-оксида составляет по меньшей мере 90%, более предпочтительно 92-99%, даже более предпочтительно 94-98% и наиболее предпочтительно 95-97%. Предпочтительно чистота требуемого производного пиридил-N-оксида составляет по меньшей мере 90%, более предпочтительно по меньшей мере 95%, даже более предпочтительно по меньшей мере 99% и наиболее предпочтительно по меньшей мере 99,5%. Исходя из предмета настоящего изобретения квалифицированный специалист может обычным путем установить наиболее подходящие реакционные условия, чтобы оптимизировать выход и чистоту пиридил-N-оксида. Параметры, которые следует учитывать квалифицированному специалисту, включают, но не ограничиваются этим, окислитель, количество окислителя, выбор защитных групп, систему растворителей, температуру реакции и время реакции, и растворимость реагентов.
Предпочтительные окислители включают пероксид водорода, МnO2, надуксусную кислоту, трифторнадуксусную кислоту, трет-бутилгидропероксид, мета-хлорпероксибензойную кислоту, надсерные кислоты, Оксон®, комплекс мочевины с пероксидом водорода и трифторуксусный ангидрид, хлорхромат пиридиния и перманганат ионы. Особенно предпочтителен комплекс мочевины с пероксидом водорода и трифторуксусный ангидрид.
Предпочтительное количество окислителя находится в интервале эквимолярных количеств до 20-кратного избытка относительно пиридинового производного. Предпочтительно количество окислителя находится в интервале от 1,2-кратного до 10-кратного избытка, более предпочтительно от 1,5-кратного до 8-кратного избытка и наиболее предпочтительно от 2-кратного до 5-кратного избытка.
Предпочтительные системы растворителей для проведения окисления представляют собой растворители, которые инертны к окислителю. Особенно предпочтительны галогенированные растворители, такие как дихлорметан, хлороформ, хлорбензол и тетрахлорид углерода, ароматические растворители, такие как бензол и толуол, алканы, такие как циклогексан и гексан, и эфиры, такие как ТГФ, 1,4-диоксан и трет-бутилметиловый эфир.
Подходящие температуры реакции и время реакции зависят от реакционной способности используемого окислителя. Предпочтительно температура реакции находится в диапазоне от 0°С до точки кипения используемой системы растворителей, более предпочтительно в диапазоне 20-100°С и наиболее предпочтительно в диапазоне 40-80°С. Предпочтительно время реакции находится в интервале от 30 минут до 24 часов, более предпочтительно в интервале от 1 часа до 18 часов и наиболее предпочтительно 2-6 часов.
Окисление пиридинового атома азота можно выполнить на любой стадии процесса получения соединений согласно общей формуле I. Предпочтительно окисление проводят до образования соединений формул IIА-IIВ или альтернативно после образования оксадиазольного кольца как в соединениях формул VIA-VIB.
В другом аспекте изобретения соединения формулы НА, ИБ или ИВ получают в ходе взаимодействия соединений общей формулы VIIA, VIIB или VIIB,
с гидроксиламином в присутствии хелатообразующего агента при п