Терапевтическая система для выделения энергии
Иллюстрации
Показать всеИзобретение относится к терапевтическим системам для выделения энергии в целевую точку. Система содержит терапевтический модуль для индуцированного нагрева целевой зоны, выполненный с возможностью измерения температуры в поле измерений целевой зоны, и управляющий модуль регулировки терапевтического модуля, выполненный с возможностью создания априорной оценки индуцированного нагрева перед выделениями энергии на основе измеренной температуры, причем последовательные выделения энергии разделены периодом охлаждения. Управляющий модуль дополнительно выполнен с возможностью априорной оценки периода охлаждения на основе оценки индуцированного нагрева перед выделениями энергии и с возможностью регулирования периода охлаждения на основе оценки периода охлаждения. Машиночитаемый носитель системы имеет сохраненную на нем компьютерную программу, которая при выполнении предписывает терапевтическому модулю выполнять последовательные выделения энергии и содержит команды для создания априорной оценки, регулировки терапевтического модуля и создания перед выделениями энергии априорной оценки периода охлаждения. Использование изобретения позволяет повысить точность выделения энергии в целевую зону. 2 н. и 8 з.п. ф-лы, 2 ил.
Реферат
Уровень техники изобретения
Изобретение относится к терапевтической системе для выделения энергии в целевую зону.
Такая терапевтическая система известна из статьи "Determination of the optimal delay between sonications during focused ultrasound surgery in rabbits by using MR imaging to monitor thermal build-up in vivo", автор N.J. McDannold и др., Radiology 211 (1999)419-426.
В этом документе упоминается эксперимент по обработке ультразвуком in vivo, в котором исследуется система контроля абляции ткани. Эта известная система контролирует процесс абляции, при котором контролируется тепловое повреждение ткани. Известная система контроля абляции выполняет контроль, например, на основе магниторезонансных изображений. Кроме того, процитированный документ упоминает, что энергия может подаваться посредством обработки ультразвуком в форме сфокусированных ультразвуковых волн. Дополнительно упоминается, что осуществляется воздействие ультразвуком с малым промежутком, который представляет собой задержку между воздействиями ультразвуком для минимизации аккумулирования тепла. То есть последовательные выделения энергии разделяются во времени периодами охлаждения. Чтобы минимизировать эту задержку между воздействиями ультразвуком, нарастание температуры во время терапии должно измеряться. Эта информация о температуре затем используется для управления задержкой между воздействиями ультразвуком.
Период охлаждения между последовательными выделениями энергии позволяет снизить температуру в области вокруг фокальной зоны, в которую непосредственно выделяется энергия. Таким образом, нарастание температуры в области вокруг фокальной зоны, то есть так называемое несфокусированное нарастание температуры, понижается. Тем самым снижается риск теплового повреждения здоровой ткани за пределами фокальной зоны.
Известная терапевтическая система снабжена термометрическим модулем в виде устройства получения изображения на основе магнитного резонанса (MR), чтобы измерять температуру в поле измерений. Обычно поле измерений содержит фокальную зону, в которую напрямую выделяется энергия. Продолжительность периода охлаждения между последовательными выделениями энергии управляется на основе измеренной температуры. Таким образом, удается избежать того, что время, требуемое для последовательных выделений энергии, будет превышать необходимое время, в то же время избегая несфокусированного нарастания температуры.
Сущность изобретения
Задача изобретения состоит в обеспечении терапевтической системы, способной более точно выделять энергию в целевую зону, в частности более точно устанавливать период охлаждения. Эта задача достигается терапевтической системой, соответствующей изобретению, содержащей:
- терапевтический модуль для выполнения последовательных выделений энергии в целевую зону и
- управляющий модуль для регулирования терапевтического модуля,
причем управляющий модуль выполнен с возможностью создания априорной оценки индуцированного нагрева перед выделениями энергии.
В соответствии с изобретением индуцированный нагрев формируется перед активацией терапевтического модуля, так чтобы могло быть установлено, безопасна ли активация терапевтического модуля. Важно то, что безопасность каждого выделения энергии оценивается априорно, когда были определены количество энергии, которое должно быть выделено, и место выделения. Индуцированный нагрев может быть оценен на основе установки параметров терапевтического модуля и модели ткани, или индуцированный нагрев может быть оценен по результатам измерений температуры целевой зоны. Энергия непосредственно выделяется в так называемую фокальную зону. Если оцененный индуцированный нагрев вокруг фокальной зоны, то есть в так называемой внефокусной зоне, при требуемых терапевтических параметрах считается чрезмерным относительно некоторой заданной меры, то тогда терапия с этого запланированного выделения энергии запрещается и требуется повторное планирование, пока не будет дана оценка, что внефокусный нагрев приемлем. Риск выполнения небезопасных выделений энергии, таким образом, снижается посредством первой оценки индуцированного нагрева при запланированном выделении энергии. Кроме того, риск внефокусного нарастания температуры оценивается более точно, поскольку учитывается перенос тепла от целевой зоны в окружающую область. Индуцированный внефокусный нагрев эквивалентен нарастанию температуры при внефокусном нагреве. Таким образом, риск выполнения небезопасных выделений энергии снижается. Эта априорная оценка точно устанавливается для конкретной целевой зоны и ее окружения.
Эти и другие аспекты изобретения будут дополнительно описаны подробно со ссылкой на варианты осуществления, определенные в зависимых пунктах формулы изобретения.
В соответствии с аспектом изобретения априорная оценка периода охлаждения делается перед выделениями энергии. В частности, период охлаждения оценивается на основе оцененного индуцированного нагрева за счет последующего выделения энергии. Как альтернатива, индуцированный нагрев оценивается на основе результата измерения, например, посредством магниторезонансной (MR) термометрии или MR-термографии. Первый период охлаждения между первыми выделениями энергии уже является точным. Кроме того, между последовательными выделениями энергии необходимы только относительно незначительные регулировки периода охлаждения. Поскольку продолжительность периода охлаждения устанавливается более точно, следующее выделение энергии может быть инициировано, как только температура достаточно понизилась, таким образом оставляя низким риск внефокусного нарастания температуры. Априорная оценка индуцированного нагрева может быть точно определена, основываясь на измеренном тепловом поведении. Таким образом, продолжительность периода охлаждения точно устанавливается уже для первых выделений энергии, так что следующее выделение энергии делается сразу после того, как риск внефокусного нарастания температуры становится достаточно низким. Альтернативно, априорная оценка периода охлаждения может быть сделана на основе измерений температуры целевой зоны и ее окружения до выделений энергии. Эти результаты измерений могут также использоваться, чтобы точно установить параметры модели ткани для индивидуального пациента, подлежащего воздействию терапии, и конкретной части анатомии, в которой располагается целевая зона.
В частности, когда используется MR-термометрия, получают относительный результат измерения температуры особенно целевой зоны, а также внефокусной области. То есть температура получается точной относительно отсчетного значения в начале индивидуального выделения энергии. Поскольку период охлаждения между поочередными выделениями энергии уже был точно установлен при первом выделении энергии, равно надежные отсчетные значения температуры применяют для последующих выделений энергии.
В соответствии с дополнительным аспектом изобретения априорные оценки для индуцированного нагрева внефокусной и/или целевой зоны и/или периода охлаждения делаются на основе тепловой модели ткани. Тепловая модель ткани представляет тепловую перфузию и диффузию, то есть передачу тепла через ткань. Тепловая модель ткани, используемая для моделирования, может быть основана на уравнении бионагрева Пенни или других подобных моделях, которые требуют распределения мощности в качестве входного параметра в дополнение к другим тепловым параметрам. Распределение мощности, в свою очередь, может быть вычислено на основе многоуровневой модели ткани, используемой, например, для алгоритма трассировки лучей, или алгоритма Вейвеллера, или, при более упрощенном подходе, для интеграла Рэлея. Многоуровневая модель ткани может, в свою очередь, быть получена, основываясь на сегментированных изображениях для планирования терапии. Акустические и тепловые параметры могут быть определены для каждого уровня, основываясь на предварительном знании и/или на уточнении, основанном на наблюдаемом нагреве, еще более улучшающем, таким образом, точность оценок. Моделирования могут также быть предпочтительно использованы для оценки нагрева фокальной зоны перед инициированием выделения тепла.
В соответствии с дополнительным аспектом изобретения термоакустические моделирования, использующие конкретную трехмерную геометрию ткани, могут улучшить точность оценки максимальной внефокусной температуры до начала выделения энергии. Трехмерная геометрия используется для того, чтобы учесть передачу тепла вдоль и поперек направления выделения энергии. В частности, когда используется сфокусированный ультразвук, тепловая модель ткани учитывает теплопередачу вдоль и поперек траектории ультразвукового пучка. Дополнительно температура измеряется, например, внутри нескольких слоев в целевой зоне и рядом с ней. На практике хорошие результаты были получены, когда использовались шесть (6) слоев. Такие моделирования могут выполняться перед каждым запланированным выделением энергии, дополнительно повышая таким образом уровень безопасности терапии и ее эффективность. При конкретных термоакустических моделированиях, использующих конкретную трехмерную геометрию ткани, точность оценки охлаждения, обеспечиваемая тепловой моделью ткани, может быть улучшена. Такие моделирования могут выполняться перед каждым запланированным выделением энергии или после наблюдения теплового состояния во время охлаждения, чтобы дополнительно повысить точность оценки охлаждения, повышая таким образом уровень безопасности терапии и эффективность.
Согласно другому аспекту изобретения управляющий модуль сравнивает оцененный индуцированный нагрев с безопасным пределом. Если априорно оцененный индуцированный нагрев для предстоящего запланированного выделения энергии создает недопустимый риск для пациента, то тогда управляющий модуль запрещает включение терапевтического модуля при параметрах установки, соответствующих оцененному индуцированному нагреву. Индуцированный нагрев может быть представлен, например, оцененной максимальной температурой и/или тепловой дозой. Безопасный предел задается, основываясь на предыдущих экспериментах или на основе вычислений по модели. Значение безопасного предела может зависеть от особенностей пациента, подлежащего воздействию терапии, таких как возраст, физическое состояние, пол и т.д.
В соответствии с другим аспектом изобретения период охлаждения устанавливается на основе максимальной температуры при предыдущем выделении энергии. При этом производится относительно простое измерение максимальной температуры. Одной из особенностей изобретения является то, что нарастание температуры ткани за пределами фокальной зоны зависит от плотности выделенной энергии. Примечательно здесь то, что в данном случае выделение энергии производится в форме сфокусированного ультразвукового пучка. Плотность выделяемой энергии в любом заданном месте может быть точно вычислена на основе параметров выделения тепла. В частности, плотность выделяемой энергии (например, сфокусированного ультразвукового) пучка точно вычисляется на основе мощности пучка, направления распространения пучка, глубины от кожи до целевой зоны и дополнительной геометрии пучка. Дополнительно, улучшенная оценка плотности выделяемой энергии получается при учете поглощения и отклонения пучка энергии. Плотность энергии может использоваться для оценки максимальной температуры во внефокусной области. Максимальная температура во внефокусной области приблизительно линейно зависит от плотности выделяемой энергии, то есть от плотности ультразвуковой энергии, попадающей во внефокусную область. Внефокусная область формируется сечением, поперечным траектории пучка. Как представляется, линейная зависимость верна, когда снижением температуры за счет рассеивания тепла можно пренебречь в середине невнефокусного ультразвукового конуса во время нагревания. Эта оценка максимальной температуры, основанная на плотности энергии, может сама по себе быть использована для снижения риска чрезмерного индуцирования нагревания в нежелательной внефокусной области.
В соответствии с дополнительным аспектом изобретения сравнительно простым приближением для продолжительности периода охлаждения является его пропорциональность квадрату максимальной температуры внефокусной области, достигнутой при предыдущем выделении энергии. Эта зависимость периода охлаждения от максимальной температуры соблюдается очень хорошо, когда поперечное сечение траектории пучка выделения энергии является круговым (как в примере, когда траектория пучка имеет форму конуса). В других случаях квадратичное соотношение может немного нарушаться, но точное соотношение может быть вычислено повторно для любого поперечного сечения траектории пучка.
В конкретном варианте осуществления изобретения терапевтический модуль является сфокусированным ультразвуковым излучателем высокой мощности. В настоящем варианте осуществления выделение энергии выполняется путем облучения целевой зоны сфокусированным ультразвуковым пучком высокой мощности (HIFU), часто упоминаемая как "ультразвуковое воздействие". HIFU-пучок производит местный нагрев ткани, главным образом, в фокальной области, вызывающий тепловую абляцию в фокальной области. Также внутри HIFU-пучка возникает небольшой нагрев других областей.
В другом варианте осуществления изобретения терапевтический модуль является микроволновым излучателем. В этом варианте осуществления выделение энергии выполняется посредством облучения целевой зоны микроволновым излучением. Микроволновое излучение вызывает местный нагрев ткани, вызывающий тепловую абляцию в фокальной области, в то же время немного нагревая ткани во внефокусной области.
В другом варианте осуществления изобретения терапевтическим модулем является радиочастотная антенна. В этом варианте осуществления энергия выделяется за счет теплопроводности от антенны, расположенной в контакте с целевой зоной. Радиочастотный нагрев создает местное повышение температуры, вызывающее тепловую абляцию вокруг антенны, и, изменяя плотность энергии в зависимости от максимального повышения температуры, все описанные выше аспекты могут быть использованы.
В другом варианте осуществления изобретения модуль контроля может работать на основе получения изображений на основе магнитного резонанса, ультразвука или компьютерной томографии для контроля терапии. Могут также использоваться любые другие способы получения изображений, чувствительных к температуре.
Изобретение дополнительно относится к компьютерной программе. Компьютерная программа, соответствующая изобретению, может обеспечиваться на носителе информации, таком как диск CD-ROM или карта памяти USB, или компьютерная программа, соответствующая изобретению, может быть загружена из сети передачи данных, такой как Интернет. Когда она установлена на компьютере, введенном в состав терапевтической системы, терапевтическая система способна работать в соответствии с изобретением и достигнуть более высокой безопасности использования и более точной установки периода охлаждения.
Эти и другие аспекты изобретения будут объяснены со ссылкой на варианты осуществления, описанные здесь далее и со ссылкой на сопроводительные чертежи, на которых
Описание чертежей
Фиг. 1 - схематическое представление терапевтической системы, в которой используется изобретение.
Фиг. 2 - пример времени охлаждения.
Подробное описание вариантов осуществления
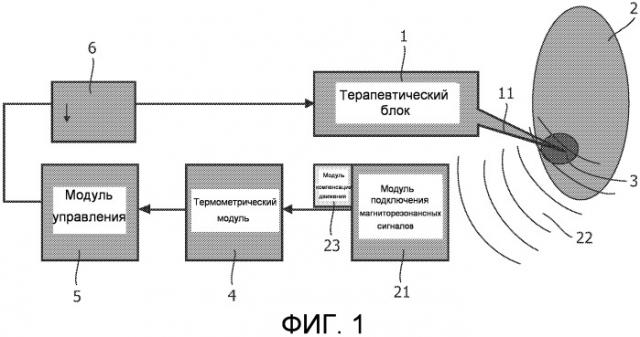
На фиг. 1 приведено схематическое представление терапевтической системы, в которой используется изобретение. Терапевтический модуль 1, например, в форме сфокусированного ультразвукового блока высокой мощности (HIFU) создает терапевтическое действие в форме сфокусированного ультразвукового пучка 11. Сфокусированный ультразвуковой пучок 11 направляется точно на целевую зону 2, которая содержит фактическую цель 3. Например, целью является опухоль (части) органа 2 пациента, подлежащего воздействию терапии. Модуль 1 HIFU управляется таким образом, чтобы сфокусированный ультразвуковой пучок 11 проходил по объему целевой зоны 2. Ультразвуковой пучок 11 выделяет энергию в целевую зону, вызывая повышение температуры, особенно в опухоли. Таким образом, температура соответствующих участков ткани поднимается до уровня, при котором возникает некроз ткани. В конечном счете некроз возникает в опухолевой ткани и вокруг нее в целевой зоне, когда обеспечивается требуемая тепловая доза или температура. В частности, тепловая доза может быть вычислена простой аппроксимацией, как T D = ∫ 0 t r 43 − T ( τ ) d τ , где r=0,25, когда T<43°C, и r=0,5, когда T≥43°C. Предельная доза 240 минут при 43°C, как обычно считается, приводит к некрозу. Существует модифицированная версия уравнения, которая учитывает эффект неопределенности. В этом контексте один или несколько пределов (или потенциально более низкий из них) могут быть проверены, чтобы гарантировать, что, когда он будет достигнут, выделение энергии прекратится. Наблюдение только температуры говорит нам, что некроз, по всей вероятности, имеет место, поскольку доза теплоты обеспечивает это.
Например, некроз достигается, когда мощность в фокусе сфокусированного ультразвукового пучка составляет примерно 1600 Вт·см-2 для длительности порядка десятков секунд. При этом максимальном уровне энергии эффективный некроз достигается без риска кавитации. Ультразвуковой пучок может также использоваться для увеличения температуры ткани до уровней температуры, не соответствующих образованию некроза. Эти более низкие температуры полезны при применениях типа гипертермии.
Распределение температур в поле измерений получают на основе магниторезонансных сигналов. С этой целью пациента помещают в систему исследования, использующую магнитный резонанс (не показана), и создают магниторезонансные сигналы 22. Магниторезонансные сигналы принимаются системой 21 приема MR-сигналов, являющейся частью системы исследования с использованием магнитного резонанса. Система получения MR-сигналов содержит радиочастотные приемные антенны (катушки) и систему обработки сигналов, такую как спектрометр. Полученные магниторезонансные сигналы подаются на термометрический модуль 4, который определяет распределение температур в целевой зоне. Фаза магниторезонансных сигналов, а также и другие параметры зависят от температуры. Магниторезонансные сигналы пространственно кодируются посредством кодирующих магнитных градиентных полей, таких как градиенты фазового кодирования и считывания. Пространственное разрешение магниторезонансных сигналов и последующее распределение температуры имеет масштаб в миллиметрах; может быть получено даже субмиллиметровое разрешение, при котором самая малая деталь, которая может различаться, имеет размер нескольких десятых долей миллиметра.
Например, если в стеке, контролирующем температуру, имеется несколько срезов, то используемое поле измерений может предпочтительно проецироваться на все параллельные срезы в фокальной области даже при том, что траектория фокуса находится только в среднем срезе стека. Поскольку самая широкая и самая горячая плоскость обычно эллипсоидальной нагретой области может дрейфовать в направлении датчика во время нагревания, это снижает риск наличия радиуса у подвергаемой воздействию терапии области, большего, чем требуемый, измеренного от оси пучка. Поле измерений вдоль оси пучка также может применяться для контроля того, чтобы продолжительность дозы 240 эквивалентных минут не превысила максимальную продолжительность, если имеется сагиттальная плоскость (что и есть на самом деле). Это значительно повышает безопасность.
Внефокусные срезы (например, два из них) также могут быть добавлены в конкретно интересующих областях, например, границы контакта с тканью, где акустическое сопротивление значительно изменяется, поскольку такие области склонны к внефокусному нагреванию. Они могут использоваться для автоматического обнаружения перегрева и/или чрезмерной тепловой дозы в этих внефокусных интересующих областях для любого одиночного выделения энергии и чрезмерного кумулятивного нагревания и/или тепловой дозы в течение всей терапевтической процедуры.
Точные результаты в движущейся ткани получаются, когда применяется коррекция движения и вклад фазы за счет движения отделяется от вкладов фазы за счет изменений температуры. Коррекция движения может быть получена по магниторезонансным сигналам, особенно с помощью избыточных магниторезонансных сигналов от центральной части k-пространства. Модуль 23 компенсации движения предусмотрен для получения коррекции движения и применения коррекции движения к магниторезонансным сигналам. Магниторезонансные сигналы со скорректированным движением подаются на термометрический модуль 4, позволяющий получить местное распределение температур в целевой зоне 3. В альтернативном варианте модуль 23 компенсации движения может быть выполнен или запрограммирован в программном обеспечении для получения отдельного вклада в фазу магниторезонансных сигналов благодаря движению и вычисления вклада в фазу за счет изменений температуры. Местное распределение температур подается на управляющий модуль 5, который управляет терапевтическим модулем, то есть модулем 1 HIFU, чтобы фокусировать фокусируемый ультразвуковой пучок вдоль следующей траектории. Центр концентричности может, например, непрерывно оцениваться (например, посредством гауссовской аппроксимации или взвешенного среднего), чтобы учесть возможность некоторого сдвига подвергаемой воздействию терапии (особенно нагретой) области немного смещаться (обычно на l-2 воксела или на 0,5-5 мм) во время терапевтической процедуры, например, из-за спазмов или несколько неравномерной тепловой диффузии.
Терапевтическая система, соответствующая изобретению, снабжена модулем 6 задержки, который задерживает активацию терапевтического модуля 1. Задержка приводит к периоду охлаждения. Задержка устанавливается блоком управления на основе измеренной температуры. Модуль задержки может быть выполнен с возможностью запуска терапевтического модуля. В другом варианте осуществления терапевтический модуль выполнен с возможностью применения регулярных выделений энергии, например применения регулярных ультразвуковых импульсов (то есть воздействий ультразвуком). В этом варианте осуществления модуль задержки выполнен с возможностью прерывания работы терапевтического модуля. На практике после нескольких воздействий ультразвуком происходит прерывание или отмена, чтобы начать период охлаждения.
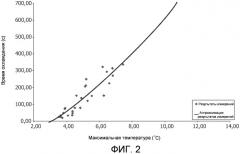
На фиг. 2 представлен пример времени охлаждения для достижения допуска в пределах 3°C от начальной температуры в зависимости от максимальной температуры вблизи поля. Аппроксимация является квадратичной, то есть квадратичной функцией максимальной температуры, аппроксимируемой до 3°C, и значение R составляет 0,90. В этих случаях температура фильтровалась медианным фильтром, имеющим 5×5 вокселов (размер воксела 2,5×2,5 мм2). В частности, пространственная фильтрация измеренной температуры, например, с помощью медианного фильтра улучшает отношение сигнал/шум результатов измерения температуры. Потеря пространственного разрешения не приводит к проблемам, поскольку внефокусный нагрев обычно не дает резких пространственных градиентов. Эти данные были получены для модуля HIFU-терапии с круговым поперечным сечением траектории пучка. Аппроксимация до 3°C может быть изменена на любой желаемый уровень температуры относительно заданной линии отсчета.
1. Терапевтическая система, содержащая:терапевтический модуль для выполнения последовательных выделений энергии в целевую зону для индуцированного нагрева целевой зоны, причем терапевтическая система содержит:термометрический модуль, выполненный с возможностью измерения температуры в поле измерений целевой зоны, иуправляющий модуль, выполненный с возможностью регулировки терапевтического модуля,причем управляющий модуль выполнен с возможностью создания априорной оценки индуцированного нагрева перед выделениями энергии на основе измеренной температуры,причем последовательные выделения энергии разделены периодом охлаждения иуправляющий модуль дополнительно выполнен с возможностью априорной оценки периода охлаждения на основе оценки индуцированного нагрева перед выделениями энергии и с возможностью регулирования периода охлаждения на основе оценки периода охлаждения.
2. Терапевтическая система по п.1, в которой управляющий модуль дополнительно выполнен с возможностью оценки индуцированного нагрева на основе термоакустической многоуровневой модели ткани.
3. Терапевтическая система по п.2, в которой термоакустическая многоуровневая тепловая модель ткани учитывает распределение тепла как вдоль, так и поперек направления выделений энергии.
4. Терапевтическая система по п.1, в которой управляющий модуль дополнительно выполнен с возможностью оценки внефокусного нагрева, основываясь на местной плотности выделяемой энергии.
5. Терапевтическая система по п.1, в которой управляющий модуль дополнительно выполнен с возможностью сравнения оцененного индуцированного нагрева с безопасным значением и запрета последующего выделения энергии, когда оцененный индуцированный нагрев превышает безопасное значение.
6. Терапевтическая система по п.1, в которой управляющий модуль дополнительно выполнен с возможностью регулировки периода охлаждения на основе термоакустической многоуровневой модели ткани.
7. Терапевтическая система по п.1, в которой управляющий модуль дополнительно выполнен с возможностью регулировки периода охлаждения в зависимости от измеренной максимальной температуры во время выделения энергии, предшествующего периоду охлаждения.
8. Терапевтическая система по п.1, в которой управляющий модуль выполнен с возможностью по меньшей мере одного из:регулировки пространственного выделения тепла в зависимости от температуры, измеренной и/или оцененной во время предыдущего нагрева и периода охлаждения, ирекомендации положения для следующего выделения тепла, чтобы понизить риск внефокусного перекрытия и, таким образом, нарастания тепла.
9. Терапевтическая система по п.1, в которой терапевтический модуль является ультразвуковым излучателем высокой мощности, микроволновым излучателем и/или радиочастотной антенной.
10. Машиночитаемый носитель, имеющий сохраненную на нем компьютерную программу, которая при выполнении предписывает терапевтическому модулю выполнять последовательные выделения энергии, разделенные периодом охлаждения, в целевую зону для индуцированного нагрева целевой зоны и содержит команды для:создания перед выделениями энергии априорной оценки индуцированного нагрева на основе измеренной температуры целевой зоны,регулировки терапевтического модуля на основе априорной оценки исоздания перед выделениями энергии априорной оценки периода охлаждения на основе оценки индуцированного нагрева и регулирования периода охлаждения на основе оценки периода охлаждения.