Доставка октреотида из сухих лекарственных форм
Иллюстрации
Показать всеИзобретение относится к медицине и применяется для лечения лиц, страдающих гормональными заболеваниями. Описаны способ и устройство для доставки октреотида пациентам, включающие имплантирование композиции с контролируемым высвобождением для доставки октреотида, причем композиция не требует гидратирования перед имплантацией и при этом композиция необязательно содержит разделительное вещество. 2 н. и 8 з.п. ф-лы, 11 пр., 7 табл., 17 ил.
Реферат
Уровень техники
Акромегалия является гормональным заболеванием, которое возникает тогда, когда гипофиз вырабатывает слишком много гормона роста (GH). Чаще всего она поражает людей среднего возраста и может привести к серьезному заболеванию и преждевременной смерти. Если поставлен диагноз акромегалии, то она поддается лечению у большинства пациентов, но из-за медленного и зачастую скрытого развития ее часто не удается правильно диагностировать. Наиболее серьезными последствиями акромегалии для здоровья являются сахарный диабет, гипертензия и повышенный риск возникновения сердечно-сосудистых заболеваний. Больные акромегалией также подвергаются повышенному риску возникновения полипов толстой кишки, которые могут перерасти в рак. Если вырабатывающая GH опухоль появляется в детском возрасте, то возникающее заболевание называется гигантизм, а не акромегалия. После достижения половой зрелости происходит слияние пластинок роста длинных трубчатых костей, поэтому у взрослых при чрезмерной выработке GH не происходит повышения роста. А длительное воздействие чрезмерного уровня GH до слияния пластинок роста вызывает усиление роста трубчатых костей и повышение роста.
Акромегалия возникает при длительной чрезмерной выработке гормона роста (GH) гипофизом. Гипофиз представляет собой небольшую железу у основания мозга, которая вырабатывает несколько важных гормонов, контролирующих такие функции организма, как рост и развитие, размножение и метаболизм. GH является частью каскада гормонов, которые, как это видно из названия, регулируют физический рост организма. Этот каскад начинается в той части мозга, что называется гипоталамус, который вырабатывает гормоны, регулирующие гипофиз. Один из них - гормон высвобождения гормона роста (GHRH) - стимулирует вырабатывание GH гипофизом. Другой гормон гипоталамуса - соматостатин - ингибирует вырабатывание и выделение GH. Секреция GH из гипофиза в кровоток вызывает выработку другого гормона - инсулиноподобного фактора роста 1 (IGF-1) в печени. IGF-1 является фактором, вызывающим рост костей и других тканей организма. В свою очередь IGF-1 подает сигнал гипофизу об уменьшении выработки GH. Уровни GHRH, соматостатина, GH и IGF-1 в организме жестко регулируются друг другом, и на них влияют такие внешние раздражители, как сон, упражнения, стресс, прием пищи и уровень сахара в крови. Если гипофиз вырабатывает GH независимо от нормальных регуляторных механизмов, то уровень IGF-1 будет возрастать, что приведет к росту костей и увеличению органов. Избыток GH также вызывает изменения метаболизма сахаров и липидов и может вызвать диабет.
У свыше 90% больных акромегалией чрезмерная выработка GH вызывается доброкачественной опухолью гипофиза, которая именуется аденомой. Эти опухоли вырабатывают избыток GH и по мере их увеличения сдавливают окружающие ткани мозга, как-то зрительные нервы. Такое увеличение вызывает головные боли и зрительные нарушения, которые часто являются симптомами акромегалии. Кроме того, сдавливание окружающей нормальной ткани гипофиза может изменить вырабатывание других гормонов, что приводит к изменениям месячных и выделениям из молочной железы у женщин и импотенции у мужчин.
У некоторых больных акромегалия вызывается не опухолью гипофиза, а опухолью поджелудочной железы, легких или надпочечников. Эти опухоли вызывают избыток GH либо потому, что они сами вырабатывают GH, либо, что встречается чаще, потому, что они вырабатывают GHRH, то есть гормон, стимулирующий выработку GH гипофизом. У этих больных отмечается избыток GHRH в крови, который свидетельствует, что причиной акромегалии не является дефект гипофиза. При удалении этих негипофизарных опухолей уровень GH падает и симптомы акромегалии улучшаются.
Схемы лечения акромегалии включают уменьшение продукции GH до нормального уровня, чтобы уменьшить давление, которое растущая опухоль гипофиза оказывает на окружающие зоны мозга, сохранить нормальное функционирование гипофиза и обратить или ослабить симптомы акромегалии. Возможные способы лечения включают хирургическое удаление опухоли, лекарственную терапию и лучевую терапию гипофиза.
Было показано, что октреотид эффективен при лечении акромегалии. Уровень GH обычно снижается уже через 2 часа после подкожного введения октреотида. Октреотид приводит к снижению уровней GH и IGF-1 у большинства пациентов с нормализацией уровня IGF-1 у вплоть до 60% пациентов, что означает биохимическую ремиссию. У большинства пациентов отмечается заметное улучшение симптомов акромегалии, включая головные боли, боли в суставах и потоотделение, сразу же после начала лечения октреотидом. Сейчас октреотид доступен в виде Sandostatin LAR® Depot, который после восстановления представляет собой суспензию микросфер, содержащих октреотида ацетат. Sandostatin LAR® Depot является единственным медикаментом, показанным для продолжительной поддерживающей терапии у больных акромегалией. Он также показан для продолжительного лечения тяжелой диареи и гиперемии при метастатических карциноидных опухолях и профузной водянистой диареи при VIP-секретирующих опухолях. Sandostatin LAR® Depot вводится путем внутримышечной инъекции раз в 4 недели после периода титрования. Октреотида ацетат также доступен в форме для немедленного высвобождения - раствора Sandostatin® Injection, который нужно вводить уколом 3 раза в день.
У больных, не проявляющих существенного снижения уровня GH в ответ на периодическое введение октреотида, более частое введение октреотида может привести к большему клиническому ответу. Больным рефрактерной акромегалией можно вводить октреотид непрерывно с помощью подкожного насоса, чтобы предотвратить утечку GH между инъекциями.
В свете эффективности октреотида при лечении акромегалии и отсутствия способа лечения и лекарственной формы октреотида с контролируемым высвобождением существует явная потребность в такой лекарственной форме и способе введения, которые способны вводить октреотид в течение определенного времени с контролируемой скоростью, чтобы избежать осложнений у больных, которым приходится страдать, к примеру, от множественных периодических уколов.
Сущность изобретения
Настоящее изобретение в общем касается фармацевтической композиции октреотида, которая может применяться для лечения лиц, страдающих гормональными заболеваниями. Настоящее изобретение предпочтительно выполняется в виде формы с контролируемым высвобождением. В частности, настоящее изобретение основывается на неожиданном открытии того, что октреотид может высвобождаться с контролируемой скоростью из имплантируемого устройства, например имплантируемого устройства, не требующего заправки перед имплантированием.
Одно воплощение касается способа доставки октреотида субъекту с профилем высвобождения практически нулевого порядка в течение длительного времени, но не менее 6 месяцев, при этом субъектом является млекопитающее, кроме собак, а способ включает подкожное имплантирование субъекту по меньшей мере одного имплантируемого устройства, причем данное по меньшей мере одно имплантируемое устройство включает композицию, содержащую октреотид, а композиция заключена в гидрофильный полимер, и при этом имплантируемое устройство имплантируется в сухом состоянии так, чтобы субъект на протяжении по меньшей мере 6 месяцев получал в пересчете на суточную дозу такое количество октреотида, которое эффективно для лечения субъекта. В предпочтительном воплощении гидрофильный полимер включает один или несколько полимеров на основе полиуретана либо один или несколько полимеров на основе метакрилата. В предпочтительном воплощении октреотид находится в виде свободного вещества, соли или в виде комплекса, например, в котором октреотид представляет собой ацетат октреотида. В предпочтительном воплощении субъект страдает расстройством гормона GH или IGF-1 либо его симптомами, например акромегалии. В предпочтительном воплощении субъект получает октреотид со средней скоростью от 75 мкг в сутки до 300 мкг в сутки на протяжении по меньшей мере 6 месяцев. В предпочтительном воплощении дозировка октреотида, получаемого субъектом, дает уровень октреотида в сыворотке от 0,5 нг/мл до 2 нг/мл, от 0,5 нг/мл до 1,4 нг/мл, от 0,6 нг/мл до 1,2 нг/мл, от 0,8 нг/мл до 1,2 нг/мл или от 0,9 нг/мл до 1,0 нг/мл. В предпочтительном воплощении субъект получает эффективное количество октреотида на протяжении по меньшей мере 12 месяцев. В целях определения уровня в сыворотке интервал может быть указан в виде среднего за какой-то период времени, например от 3 дней до 150 дней, от 3 дней до 120 дней, от 5 дней до 100 дней, от 10 дней до 75 дней и т.д. В предпочтительном воплощении дозировка октреотида, получаемого субъектом, дает величину Cmax для уровня октреотида в сыворотке менее 1,2 нг/мл. В предпочтительном воплощении дозировка октреотида, получаемого субъектом, дает величину Cmax для уровня октреотида в сыворотке менее 1,0 нг/мл. В предпочтительном воплощении высвобождение октреотида происходит по меньшей мере от 3 до 10 дней после имплантирования. В предпочтительном воплощении субъект страдает заболеванием, выбранным из группы, состоящей из карциноидного синдрома, VIP-омы, нейроэндокринных опухолей, пролиферативной диабетической ретинопатии, красных угрей, панкреатита, желудочно-кишечных кровотечений, свищей поджелудочной железы и кишечных свищей, базедовой болезни (офтальмопатии Грейвса), глаукомы и симптомов, связанных с химиотерапией или СПИД.
Одно воплощение касается имплантируемого устройства, включающего композицию с контролируемым высвобождением, содержащую октреотид, которая прочно заключена в полимер на основе полиуретана или метакрилата, при этом имплантируемое устройство выделяет октреотид для субъекта с профилем высвобождения практически нулевого порядка в течение длительного времени, но не менее 6 месяцев, а субъектом является млекопитающее, кроме собак, причем имплантируемое устройство имплантируется субъекту в сухом состоянии. В предпочтительном воплощении гидрофильный полимер включает один или несколько полимеров на основе полиуретана. В предпочтительном воплощении октреотид находится в виде свободного вещества, соли или в виде комплекса, например, ацетата октреотида. В предпочтительном воплощении при имплантировании субъекту имплантируемого устройства субъект получает октреотид со средней скоростью от 75 мкг в сутки до 300 мкг в сутки на протяжении по меньшей мере 6 месяцев. В предпочтительном воплощении при имплантировании имплантируемого устройства субъекту дозировка октреотида, получаемого субъектом, дает уровень октреотида в сыворотке от 0,5 нг/мл до 2 нг/мл. В предпочтительном воплощении при имплантировании имплантируемого устройства субъекту дозировка октреотида, получаемого субъектом, дает уровень октреотида в сыворотке от 0,8 нг/мл до 1,8 нг/мл. В предпочтительном воплощении при имплантировании имплантируемого устройства субъекту дозировка октреотида, получаемого субъектом, дает величину Cmax для уровня октреотида в сыворотке менее 1,2 нг/мл. В предпочтительном воплощении при имплантировании имплантируемого устройства субъекту дозировка октреотида, получаемого субъектом, дает величину Cmax для уровня октреотида в сыворотке менее 1,0 нг/мл. В предпочтительном воплощении при имплантировании имплантируемого устройства субъекту высвобождение октреотида происходит по меньшей мере от 3 до 10 дней после имплантирования.
Одно воплощение касается применения октреотида для изготовления медикамента для лечения субъекта из млекопитающих, кроме собак, при этом медикамент представляет собой композицию с контролируемым высвобождением, которая прочно заключена в полимер на основе полиуретана или метакрилата, тем самым образуя имплантируемое устройство, причем при имплантировании субъекту имплантируемое устройство выделяет октреотид для субъекта с профилем высвобождения практически нулевого порядка в течение длительного времени, но не менее 6 месяцев, а субъектом является млекопитающее, кроме собак, причем имплантируемое устройство имплантируется субъекту в сухом состоянии.
Настоящее изобретение обеспечивает терапевтически эффективное количество октреотида в течение длительного времени, предпочтительно по меньшей мере 2 месяцев, более предпочтительно 6 месяцев и вплоть до 2 лет. Настоящее изобретение также предусматривает композиции, обеспечивающие контролируемое высвобождение октреотида на протяжении по меньшей мере 2 месяцев, предпочтительно 6 месяцев и вплоть до 2 лет.
Воплощения настоящего изобретения касаются фармацевтической композиции, содержащей октреотид либо его соли, пролекарственные формы или производные, которые могут применяться при эффективном лечении различных заболеваний.
Краткое описание чертежей
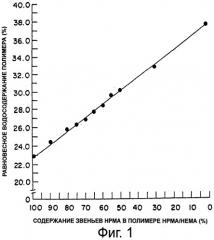
На фиг.1 приведен график, представляющий линейную зависимость между равновесным водосодержанием и процентным содержанием звеньев гидроксипропилметакрилата (НРМА) в сшитых полимерах НЕМА/НРМА в состоянии максимальной гидратации.
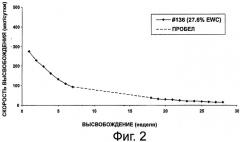
На фиг.2 приведен график, представляющий высвобождение октреотида из композиции импланта настоящего изобретения.
На фиг.3 приведен график, представляющий высвобождение октреотида из композиции импланта настоящего изобретения.
На фиг.4 приведен график, представляющий высвобождение октреотида из композиции импланта настоящего изобретения.
На фиг.5 приведен график, представляющий высвобождение октреотида из композиции импланта настоящего изобретения.
На фиг.6 приведен график, представляющий уровни октреотида и IGF-1 в сыворотке у здоровой собаки, которой имплантировали композицию октреотида по настоящему изобретению.
На фиг.7 приведен график, представляющий уровни октреотида и IGF-1 в сыворотке на протяжении 6 месяцев в группе из 3 здоровых собак, которым имплантировали по одной композиции октреотида настоящего изобретения.
На фиг.8 приведен график, представляющий уровни октреотида и IGF-1 в сыворотке на протяжении 6 месяцев в группе из 3 здоровых собак, которым имплантировали по две композиции октреотида настоящего изобретения.
На фиг.9A и 9B приведены графики, представляющие уровень IGF-1 в сыворотке и его изменения на протяжении 6 месяцев у 11 субъектов с акромегалией, которым имплантировали композицию октреотида по настоящему изобретению.
На фиг.10 приведен график, представляющий уровень октреотида в сыворотке на протяжении 6 месяцев у 11 субъектов с акромегалией, которым имплантировали композицию октреотида по настоящему изобретению.
На фиг.11 приведен график, представляющий уровень октреотида в сыворотке на протяжении 6 месяцев у 2 собак, которым имплантировали композицию октреотида по настоящему изобретению.
На фиг.12 приведен график, представляющий уровень IGF-1 в сыворотке на протяжении 6 месяцев у 2 собак, которым имплантировали композицию октреотида по настоящему изобретению.
На фиг.13 приведен график, представляющий уровни октреотида в сыворотке при выделении его гидратированным имплантом и сухим имплантом (также см. табл.6).
На фиг.14 приведен график, представляющий уровни октреотида в сыворотке при выделении его гидратированным имплантом и сухим имплантом (также см. табл.6).
На фиг.15 приведены графики, представляющие уровень гормона роста при выделении октреотида гидратированными и сухими имплантами (в верхней части - концентрация GH, в нижней части - уменьшение GH в %).
На фиг.16 приведены графики, представляющие уровень инсулиноподобного фактора роста 1 (IGF-1) при выделении октреотида гидратированными и сухими имплантами (в верхней части - концентрация IGF-1, в нижней части - стандартное отклонение).
На фиг.17 приведены графики, представляющие уровень инсулиноподобного фактора роста 1 (IGF-1) при выделении октреотида гидратированными и сухими имплантами (в обеих частях представлены данные опытов, а значения выражены в виде % от нормального уровня).
Раскрытие сущности изобретения
Перед описанием композиций и способов настоящего изобретения следует уяснить, что данное изобретение не ограничивается описываемыми конкретными молекулами, композициями, методами или методиками, поскольку они могут варьироваться. Следует также уяснить, что используемая при описании терминология предназначается только для описания конкретных вариантов или воплощений и не предназначается для ограничения сферы действия настоящего изобретения, которая должна ограничиваться только прилагаемой формулой изобретения. Используемые термины имеют значения, признанные и известные специалистам, однако, для удобства и полноты определенные термины и их значения излагаются ниже.
Формы единственного числа включают и значения множественного, если из контекста четко не следует иное. Если не указано иначе, все технические и научные термины в настоящем изобретении имеют те же значения, что обычно подразумеваются рядовыми специалистами в этой области. Хотя при выполнении или тестировании воплощений настоящего изобретения можно применять способы и материалы, аналогичные или эквивалентные описанным в нем, но предпочтительные способы, устройства и материалы описаны ниже. Все публикации, приведенные в изобретении, включены путем ссылки в пределах того, что они подтверждают настоящее изобретение. Ничто в настоящем изобретении не должно восприниматься как допущение того, что оно не может предвосхищать такое описание по факту предшествующего изобретения.
В настоящем изобретении термин "примерно" означает плюс-минус 10% от численного значения того числа, к которому оно относится. Например, примерно 50% означает в пределах 45-55%.
"Композиция с контролируемым высвобождением" означает композицию, предназначенную для последовательного высвобождения заданного, терапевтически эффективного количества препарата или иного активного агента, как-то полипептида или синтетического соединения, в течение длительного времени, в результате чего уменьшается количество обработок, необходимых для достижения требуемого терапевтического эффекта. Композиция с контролируемым высвобождением уменьшает количество обработок, необходимых для достижения требуемого терапевтического эффекта, в смысле снижения уровня гормона роста или снижения уровня IGF-1 либо улучшения симптомов, связанных, к примеру, с акромегалией, в том числе аномального роста, карциноидного синдрома, VIP-омы (аденомы, секретирующей вазоактивный интестинальный пептид), нейроэндокринных опухолей (в частности лечения симптомов гиперемии и диареи), пролиферативной диабетической ретинопатии, красных угрей, панкреатита, желудочно-кишечных кровотечений, свищей поджелудочной железы и кишечных свищей, базедовой болезни (офтальмопатии Грейвса), глаукомы или лечения симптомов при химиотерапии и СПИД. Композиции с контролируемым высвобождением по настоящему изобретению достигают желательного фармакокинетического профиля у субъекта, предпочтительно начинают высвобождать активное средство практически немедленно после помещения в рабочую среду с последующим постоянным, непрерывным высвобождением активного средства, предпочтительно нулевого или почти нулевого порядка.
В настоящем изобретении термин "контролируемое высвобождение" обозначает заранее установленное постоянное высвобождение активного средства из дозовой формы с такой скоростью, чтобы поддерживался терапевтически полезный уровень активного средства в крови ниже токсического уровня на протяжении, к примеру, по меньшей мере 2 месяцев, 6 месяцев или больше (например, вплоть до 2 лет).
Термины "пациент" или "субъект" охватывают всех животных, включая человека. Примеры пациентов или субъектов включают людей, коров, собак, кошек, коз, овец и свиней.
Термин "фармацевтически приемлемые соли, эфиры, амиды и пролекарственные формы" в настоящем изобретении относится к тем солям карбоновых кислот, солям с аминокислотами, эфирам, амидам и пролекарственным формам соединений настоящего изобретения, которые, в пределах здравого медицинского суждения, подходят для применения в контакте с тканями пациентов без излишней токсичности, раздражения, аллергических реакций и т.п. Их применение соразмерно с удовлетворительным соотношением между выгодой и риском и эффективно для их предназначения. Цвиттерионные формы, по возможности, тоже являются полезными соединениями изобретения. Кроме того, соединения настоящего изобретения могут существовать, к примеру, в несольватированных, равно как и сольватированных формах с фармацевтически приемлемыми растворителями, такими, к примеру, как вода, этанол и др. В общем, сольватированные формы считаются эквивалентными несольватированным формам в целях настоящего изобретения.
Термин "пролекарственная форма" относится к таким соединениям, которые подвергаются быстрому превращению in vivo с образованием исходных соединений вышеприведенной формулы, например, при гидролизе в крови. Всестороннее обсуждение приведено в работах Т. Higuchi and V. Stella, "Pro-drags as Novel Delivery Systems," Vol.14 of the A.C.S. Symposium Series, и Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987, которые обе включены путем ссылки во всей полноте.
Термин "соли" относится к сравнительно нетоксичным солям соединений настоящего изобретения с неорганическими и органическими кислотами. Такие соли могут быть получены in situ при окончательном выделении и очистке соединений или отдельно проведением реакции очищенного соединения в виде свободного основания с подходящей органической или неорганической кислотой и выделением образовавшейся при этом соли. Примеры солей включают соли ацетата, гидробромида, гидрохлорида, сульфата, бисульфата, нитрата, ацетата, оксалата, валерата, олеата, пальмитата, стеарата, лаурата, бората, бензоата, лактата, фосфата, тозилата, цитрата, малеата, фумарата, сукцината, тартрата, нафтилата, мезилата, глюкогептоната, лактобионата, лаурилсульфоната и др. Они могут включать катионы щелочных и щелочноземельных металлов, как-то натрия, лития, калия, кальция, магния и др., а также нетоксические катионы аммония, тетраметиламмония, тетраэтиламмония, метиламина, диметиламина, триметиламина, триэтиламина, этиламина и др. (например, см. S.M.Barge et al., "Pharmaceutical Salts," J. Pharm. Sci., 1977, 66:1-19, которая включена путем ссылки во всей полноте).
"Лечение" означает введение лекарства или проведение медицинских процедур в отношении пациента, либо для профилактики, либо для лечения заболевания или болезни в том случае, когда пациент этим страдает.
"Терапевтически эффективное количество" есть такое количество, которое достаточно для уменьшения, предотвращения или ослабления симптомов, связанных с медицинским заболеванием. В плане гормональной терапии оно может означать и такое количество, которое достаточно для нормализации функций организма или уровня гормонов при заболевании. Например, терапевтически эффективное количество композиции октреотида с контролируемым высвобождением есть предварительно установленное количество, рассчитанное на достижение требуемого эффекта, например, на эффективное снижение уровня гормона роста или IGF-1 у пациента.
Настоящее изобретение может применяться для лечения целого ряда гормональных расстройств, в том числе акромегалии и других заболеваний, нарушений или симптомов, которые эффективно лечатся, к примеру, октреотидом, например, карциноидного синдрома, VIP-омы (аденомы, секретирующей вазоактивный интестинальный пептид), нейроэндокринных опухолей (в частности, лечения симптомов гиперемии и диареи), пролиферативной диабетической ретинопатии, красных угрей, панкреатита, желудочно-кишечных кровотечений, свищей поджелудочной железы и кишечных свищей, базедовой болезни (офтальмопатии Грейвса), глаукомы или лечения симптомов при химиотерапии и СПИД.
Акромегалия характеризуется рядом клинических симптомов, включающих увеличение рук и ног, изменения лица, включая выступание лобных бугров, увеличение нижней челюсти и расстояния между зубами, артралгию, обильное потоотделение, апноэ во сне, гипертензию, сахарный диабет и гипертрофическую кардиомиопатию. Опухоли, вызывающие акромегалию, зачастую вызывают местное анатомическое сдавливание, которое приводит, к примеру, к ограничению поля зрения, головным болям, гипопитуитаризму и парезу черепно-мозговых нервов. При этом у больных акромегалией в 2-5 раз повышается смертность, в основном из-за сердечно-сосудистых и цереброваскулярных заболеваний. Также повышается степень злокачественности в связи с акромегалией, причем лучше всего изучен рак толстой кишки.
Карциноидные опухоли обычно встречаются в аппендиксе, бронхиолах, толстом или тонком кишечнике и секретируют химические вещества, вызывающие расширение кровеносных сосудов типа серотонина. Расширение сосудов может отвечать за симптомы, которые обычно наблюдаются при карциноидных опухолях, таких, к примеру, как диарея, гиперемия и астма. В зависимости от гормонов и биохимических веществ, секретируемых карциноидными опухолями, может отмечаться целый ряд симптомов. Они собирательно известны как "карциноидный синдром". В биохимическом отношении люди с карциноидными опухолями склонны вырабатывать больше серотонина исходя из аминокислоты триптофана, а серотонин далее разрушается в организме с образованием 5-гидрокси-индолуксусной кислоты (5-HIAA), которая обнаруживается в моче у большинства таких больных. Диагностические анализы крови и мочи показывают, что больные с карциноидными опухолями проявляют повышение уровня 5-HIAA в моче, понижение триптофана в крови, повышение хромогранина A и серотонина в крови. Также применяются анализы крови на содержание гистамина, брадикинина, нейроноспецифичной енолазы, кальцитонина, субстанции P, нейрокинина A и панкреатического полипептида.
"ОктреоСкан" означает сканирующий тест для идентификации карциноидных опухолей и нейроэндокринных опухолей. В нем применяется радиоактивное производное октреотида под названием пентетреотид. После инъекции он концентрируется в тканях, экспрессирующих соматостатиновый рецептор. Нейроэндокринные опухоли суперэкспрессируют этот рецептор и выявляются при таком тестировании.
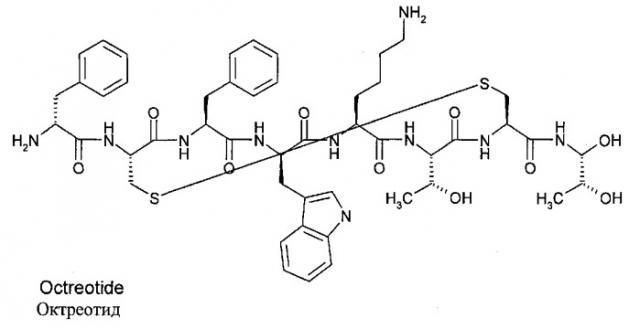
В настоящем изобретении термин "октреотид" относится вообще ко всем соединениям, содержащим приведенную структуру, включая разнообразные соли. Октреотид включает октапептид со следующей последовательностью аминокислот: L-цистеинамид-D-фенилаланил-L-цистеинил-L-фенилаланил-D-триптофанил-L-лизил-L-треонил-N-[2-гидрокси-1-(гидроксиметил)пропил]-цикло(2→7)дисульфид; [R-(R*,R*)]. Ниже представлена структура октреотида:
Его химическая формула - C49H66N10O10S2, а молекулярный вес - 1019,3 Да. Терапевтическая категория - желудочное антисекреторное средство. Октреотид по настоящему изобретению может существовать, к примеру, в виде свободного вещества, соли или в виде комплекса. Соли с кислотами могут образовываться, к примеру, с органическими кислотами, полимерными кислотами и неорганическими кислотами. К ним относятся, к примеру, гидрохлориды и ацетаты. Комплексы образуются, к примеру, из октреотида при добавлении неорганических веществ, например, неорганических солей или гидроокисей типа солей Ca и Zn, и/или при добавлении полимерных органических веществ. Предпочтительной солью для композиций настоящего изобретения является ацетатная соль.
Воплощениями настоящего изобретения предусмотрено устройство для доставки лекарств, которое может выполнять следующие цели: контролируемая скорость высвобождения (кинетика высвобождения нулевого или почти нулевого порядка), чтобы максимально увеличить терапевтические эффекты и свести к минимуму нежелательные побочные эффекты; удобный способ извлечения устройства, если нужно прекратить лечение; и повышение биодоступности с меньшими отклонениями всасывания и отсутствием пресистемного метаболизма.
Фармацевтическая композиция с контролируемым высвобождением, содержащая ацетат октреотида, может быть частью гидрогелевого устройства для контролируемого высвобождения. Композиция настоящего изобретения способна обеспечить, при введении пациенту, такой профиль высвобождения октреотида, который растянется по меньшей мере на 2 месяца, предпочтительно на 6 месяцев или больше, например, вплоть до 2 лет. Октреотид может находиться, к примеру, внутри гидрогеля, а композиция будет выделять терапевтически эффективное количество октреотида в течение длительного времени. Гидрогель может включать полимер, выбранный из полимеров на основе метакрилата, полимеров на основе полиуретана и их комбинаций. Терапевтически эффективное количество есть такое количество октреотида, предпочтительно ацетата октреотида, которое при введении пациенту или субъекту ослабляет симптомы акромегалии. Композиция может дополнительно включать фармацевтически приемлемые наполнители.
При введении композиций настоящего изобретения пациентам концентрация октреотида в плазме пациента по времени (профиль высвобождения) может сохраняться на протяжении по меньшей мере 2 месяцев, предпочтительно 6 месяцев и вплоть до 2 лет. Композиции могут обеспечить среднюю концентрацию октреотида в плазме человека в стационарном состоянии от 0,1 до 9 нг/мл, от 5 до 1 нг/мл, от 1 до 2 нг/мл или от 1,2 до 1,6 нг/мл. Стационарное состояние - это точка, в которой количество введенного за данный интервал препарата равна количеству препарата, подвергнувшегося элиминации за тот же самый период.
Гидрофильный имплант, содержащий композицию октреотида, может быть сформирован из ксерогеля с тем, чтобы он хорошо впитывал воду. В гидратированном состоянии ксерогель именуется гидрогелем. В любой форме, гидратированной или не гидратированной, он биосовместим и не токсичен для организма и не подвержен биодеградации. Он набухает, но не растворяется в воде. Когда гидрогель достигает максимальной степени гидратации, его водосодержание именуется "равновесным водосодержанием" (EWC). Относительное водосодержание гидрогеля (в любой степени гидратации) определяется следующим образом:
Гидрогель может представлять собой гомогенный гомополимер или сополимер с заданной величиной равновесного водосодержания (EWC), образовавшийся при полимеризации смеси из этиленового ненасыщенного мономера A и этиленового ненасыщенного мономера B, например 2-гидроксиэтилметакрилата (HEMA) и гидроксипропилметакрилата (HPMA). Заданную величину EWC можно рассчитать путем определения значений EWC гомополимера гидрогеля из гидрофильного мономера A (гомополимера A) и гомополимера гидрогеля из гидрофильного мономера В (гомополимера B); определения зависимости значений EWC гомогенных сополимеров AB от химического состава данных сополимеров АВ; выбора намеченного значения EWC и определения химического состава сополимера AB с намеченным значением EWC; составления полимеризуемой смеси из мономера A и мономера B в количествах, достаточных для получения сополимера АВ с намеченным значением EWC; и выполнения реакции полимеризации, дающей сополимер AB, характеризующийся намеченным значением EWC.
В настоящем изобретении "сополимер AB" или "сополимер AB, состоящий в основном из звеньев мономера A и звеньев мономера В", означает то, что полиприсоединение мономера A и мономера B осуществлялось через полимеризуемую этиленовую связь мономеров. Для примера, если мономером A является 2-гидроксиэтилметакрилат, а мономером B является N-метилакриламид, то сополимер AB содержит повторяющиеся звенья мономера A и повторяющиеся звенья мономера B.
Если из контекста не следует иное, термин "сополимер" охватывает полимеры, полученные при полимеризации смеси по меньшей мере двух ненасыщенных этиленовых мономеров.
В настоящем изобретении "звено HEMA" означает повторяющуюся структуру в полимере, полученном при полимеризации гидрофильного материала, содержащего 2-гидроксиэтилметакрилат ("HEMA"). Термином "звено HEMA" обозначается структура:
В настоящем изобретении "звено HPMA" означает повторяющуюся структуру в полимере, полученном при полимеризации гидрофильного материала, содержащего гидроксипропилметакрилат ("HPMA"). Термином "звено НРМА" обозначается структура:
Жидкие полимеризуемые материалы, используемые в гидрофильных продуктах, включают широкий круг полимеризуемых гидрофильных, ненасыщенных этиленовых соединений, в частности гидрофильных мономеров, таких, к примеру, как моноэфиры акриловой кислоты или метакриловой кислоты с полигидроксисоединениями, содержащими эфирообразующую гидроксильную группу и по меньшей мере еще одну гидроксильную группу, как-то, к примеру, моноалкиленовые и полиалкиленовые полиоли метакриловой кислоты и акриловой кислоты, например, 2-гидроксиэтилметакрилат и -акрилат, диэтиленгликольметакрилат и -акрилат, пропиленгликольметакрилат и -акрилат, дипропиленгликольметакрилат и -акрилат, глицидилметакрилат и -акрилат, глицерилметакрилат и -акрилат и др.; 2-алкенамиды, например акриламид, метакриламид и др.; N-алкил- и N,N-диалкилзамещенные акриламиды и метакриламиды типа N-метилметакриламида, N,N-диметилметакриламида и др.; N-винилпирролидон; алкилзамещенные N-винилпирролидоны, например метилзамещенный N-винилпирролидон; N-винилкапролактам; алкилзамещенные N-винилкапролактамы, например N-винил-2-метилкапролактам, N-винил-3,5-диметилкапролактам и др. В этих композициях также могут использоваться акриловая и метакриловая кислота.
В реакции полимеризации используются смеси гидрофильных мономеров. Тип и пропорции мономеров выбираются так, чтобы получить гомогенный полимер, предпочтительно сшитый гомогенный полимер, который при гидратации будет иметь требуемую величину EWC для предусмотренного применения. Такую величину EWC можно определить заранее путем приготовления ряда сополимеров с использованием различных соотношений мономеров, например смесей НЕМА и НРМА в различных пропорциях; установления величины EWC этих сополимеров; и составления графика зависимости относительной величины EWC этих сополимеров от % звеньев НРМА (или НЕМА) в сополимерах НРМА/НЕМА (фиг.1).
В некоторых случаях полимеризация определенных смесей гидрофильных мономеров приводит к образованию таких гомогенных гидрофильных сополимеров, которые в некоторой степени растворяются в водной среде. В таких случаях в смесь мономеров можно включить небольшое количество, например до 3% сополимеризуемого ненасыщенного многоэтиленового сшивающего реагента, получая гомогенные сшитые сополимеры, которые нерастворимы в воде, но набухают в воде. Малосшитые гомополимеры НЕМА могут иметь значение EWC, к примеру, около 38%. Сшитые сополимеры НЕМА и НРМА имеют значения EWC менее 38%. С другой стороны, сшитые сополимеры НЕМА и акриламида проявляют значения EWC более 38%, например, вплоть до 75% и выше. Таким образом, в зависимости от полезной или эффективной скорости выделения активного соединения, например лекарственного препарата, которая требуется от гидрогелевой системы доставки для конкретного применения, специалист в этой области, следуя изложенным в настоящем изобретении предписаниям, может приспособить гидрогелевые мембраны из сополимера для выделения препарата с нужной скоростью. Сополимеры могут содержать, к примеру, от 15% до 70% масс, звеньев НЕМА и от 85 до 30% масс. звеньев второго этиленового мономера будут иметь заданные значения EWC в пределах от 20% до 75%, предпочтительно около 25%. Гомогенные сополимеры могут включать сополимеры, сделанные из смеси гидрофильных мономеров, содержащей около 80% масс. НРМА и около 20% масс. НЕМА. В дополнительных воплощениях смесь может дополнительно содержать небольшое количество многоэтиленового ненасыщенного сшивающего реагента, например триметилолпропантриметакрилата ("ТМРТМА").
Различные аспекты изобретения включают гомогенные гидрофильные сополимеры, у которых структура гомогенного полимера образуется при полимеризации смеси гидрофильных мономеров, описанных ранее; и устройство для доставки препаратов, в котором использу