Производные 4-изопропилфенилглюцита в качестве ингибиторов sglt1
Иллюстрации
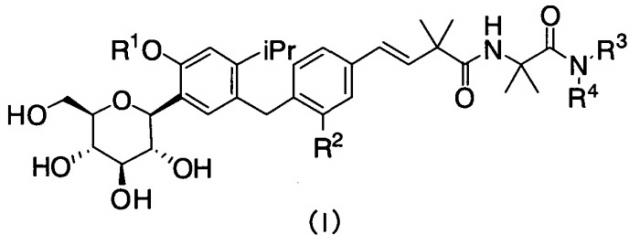
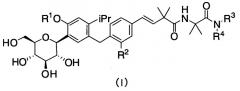
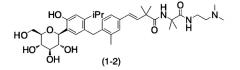
Показать всеИзобретение относится к производным 4-изопропилфенилглюцита, которые не склонны накапливаться в организме и которые ингибируют активность SGLT1, подавляя постпрандиальную гипергликемию (или ухудшенную переносимость глюкозы) за счет ингибирования абсорбции глюкозы в тонком кишечнике, вследствие чего соединения по настоящему изобретению могут, например, замедлять наступление диабета или метаболического синдрома или лечить эти заболевания. Указанные производные 4-изопропилфенилглюцита представлены следующей формулой (I)
где R1 означает атом водорода или С1-4алкильную группу, R2 означает атом водорода или метильную группу, R3 означает «С1-4алкильную группу, замещенную аминогруппой(ами) или ди-С1-4алкиламиногруппой(ами)» или пиперидильную группу, и R4 означает атом водорода или, в качестве альтернативы, R3 и R4, совместно с атомом азота, к которому они присоединены, образуют пиперидиногруппу или пиперазинильную группу, которые могут быть замещены С1-4алкильной группой(ами) или диметиламиногруппой(ами) или являются фармацевтически приемлемыми солями указанных соединений. 7 н.п. ф-лы, 3 табл., 17 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к производным 4-изопропилфенилглюцита, которые проявляют специфическую ингибирующую активность в отношении натрийзависимого транспортера глюкозы 1 (далее по тексту для удобства сокращенно именуемого «SGLT1»), принимающего участие в абсорбции глюкозы и галактозы в тонком кишечнике.
УРОВЕНЬ ТЕХНИКИ
Уровни глюкозы в крови используются в качестве биомаркера метаболического синдрома, и у людей определяют наличие диабета, если уровень глюкозы в крови натощак превышает 126 мг/дл. Кроме того, даже если уровень глюкозы в крови натощак находится в нормальном диапазоне, у некоторых людей уровни глюкозы через 2 часа после приема пищи находятся в диапазоне от 140 до 200 мг/дл, и у этих людей диагностируют плохую переносимость глюкозы (или постпрандиальную гипергликемию). Современные эпидемиологические исследования позволили установить, что ухудшенная переносимость глюкозы увеличивает опасность сердечно-сосудистых расстройств (см. NPL 1 и NPL 2). Кроме того, сообщалось, что лечебная физкультура и/или медикаментозное лечение не только препятствует превращению плохой переносимости глюкозы в диабет II типа, но также в значительной степени препятствует началу гипертензии (см. NPL 3).
Ввиду вышеизложенного подавление постпрандиальной гипергликемии имеет важное значение для противодействия наступлению диабета и/или метаболического синдрома и, соответственно, существует возрастающая потребность в лекарственных средствах, применяемых для регулирования постпрандиальной гипергликемии.
В качестве средств, препятствующих развитию постпрандиальной гипергликемии, обычно широко применялись ингибиторы α-глюкозидазы, которые ингибируют гидролазы сахаров и тем самым замедляют абсорбцию сахара из тонкого кишечника. Помимо этих средств, для борьбы с постпрандиальной гипергликемией были разработаны другие средства с новым механизмом действия.
На эпителии тонкого кишечника млекопитающих интенсивно экспрессируется натрийзависимый транспортер глюкозы 1 (SGLT1). Известно, что активность SGLT1 зависит от натрия и что он участвует в активном транспорте глюкозы или галактозы в тонком кишечнике. На основании этих данных были разработаны производные пиразола, которые ингибируют активность SGLT1, тем самым подавляя абсорбцию глюкозы из пищи, и которые могут применяться для профилактики или лечения постпрандиальной гипергликемии (см. PTL1-PTL6). С другой стороны, натрийзависимый транспортер глюкозы 2 (SGLT2) с высокой интенсивностью экспрессируется в почках, и глюкоза, отфильтрованная клубочками, повторно абсорбируется с участием SGLT2 (см. NPL 4). Кроме того, сообщалось, что при ингибировании активности SGLT2 облегчается выделение сахара в мочу, что вызывает гипогликемическое действие (см. NPL 5). Ингибиторы SGLT2 характеризуются тем, что они обладают отличным гипогликемическим действием, понижая временно повысившийся уровень глюкозы в крови, но в отличие от ингибиторов SGLT1 их эффективность при регулировании постпрандиальной гипергликемии является низкой. Кроме того, сообщалось о производных C-фенилглюцита, которые одновременно ингибируют не только активность SGLT1, но и активность SGLT2 (см. PTL 7).
С другой стороны, в случае лекарственных средств, которые требуется вводить непрерывно, в том числе средств для подавления постпрандиальной гипергликемии, важно иметь широкую область безопасности между терапевтической дозой и дозой, вызывающей побочные эффекты или токсическое действие. В частности, в случае препаратов, склонных оставаться в организме, трудно контролировать их дозировку, необходимую для лечения, так, чтобы не развивались эффекты, связанные с избытком лекарственного средства, в результате накопления остатков лекарственного средства в организме, что приводит к неожиданному проявлению токсичности или возникновению побочных эффектов. Например, известно, что катионные лекарственные средства, в молекулах которых содержится гидрофильная группа (например, третичный амин) и гидрофобная группа (например, ароматический цикл), связываются с фосфолипидами за счет гидрофобного взаимодействия, поглощаются лизосомами и в результате накапливаются во всех тканях тела. В качестве типового примера было показано, что хлорохин вызывает ретинопатию, в то время как пергексилин является источником невропатических проблем, поскольку он вызывает изменения в легких и мозжечке (см. NPL 6).
Таким образом, желательно, чтобы лекарственные средства быстро выводились из организма после того, как они оказали свое действие. В частности, желательно, чтобы средства для борьбы с постпрандиальной гипергликемией, которые необходимо вводить постоянно, не вызывали проблемы накопления в организме.
Список упомянутых источников
Патентная литература
[PTL 1] международная публикация № WO 2002/098893
[PTL 2] международная публикация № WO 2004/014932
[PTL 3] международная публикация № WO 2004/018491
[PTL 4] международная публикация № WO 2004/019958
[PTL 5] международная публикация № WO 2005/121161
[PTL 6] международная публикация № WO 2004/050122
[PTL 7] международная публикация № WO 2007/136116
Непатентная литература
[NPL 1] Pan XR, et al. Diabets Care, vol. 20, p. 537, 1997
[NPL 2] M Tominaga, et al. Diabets Care, vol. 22, p. 920, 1999
[NPL 3] J.-L. Chiasson, et al. Lancent, vol. 359, p. 2072, 2002
[NPL 4] E.M. Wright, Am. J. Physiol. Renal. Physiol., vol. 280, p. F10, 2001
[NPL 5] G. Toggenburger, et al. Biochem. Biophys. Acta., vol. 688, p. 557, 1982
[NPL 6] Folia Pharmacol. Jpn. vol. 113, p. 19, 1999
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Техническая задача
Цель настоящего изобретения заключалась в разработке соединений или их солей, обладающих ингибирующим действием в отношении SGLT1, которые имеют широкую область безопасности между терапевтическими дозами и дозами, вызывающими токсическое действие или побочные эффекты, а также фармацевтических композиций, включающих указанные соединения или соли.
Решение проблемы
Было обнаружено, что производные C-фенилглюцита, раскрытые в PTL 7, склонны оставаться в почках, не подвергаясь выведению. На основе этого факта авторы настоящего изобретения приложили значительные и интенсивные усилия для исследования соединений, которым не свойственна проблема накопления в организме. В результате, авторы изобретения неожиданно обнаружили, что производные 4-изопропилфенилглюцита, представленные приведенной ниже формулой (I), которые образуются, в частности, путем введения изопропильной группы в бензольный цикл, непосредственно присоединенный к остатку сахара, и введения бутеноильной группы с аминогруппой в другое бензольное кольцо, не склонны накапливаться в почках. Этот результат привел к созданию настоящего изобретения.
Ниже по тексту будут приведены варианты осуществления производных 4-изопропилфенилглюцита по настоящему изобретению (далее по тексту именуемых «соединениями по настоящему изобретению»).
(1) Производные 4-изопропилфенилглюцита, представленные приведенной ниже формулой (I) или их фармацевтически приемлемые соли:
Схема 1
где
R1 означает атом водорода или C1-4алкильную группу,
R2 означает атом водорода или метильную группу,
R3 означает «С1-4алкильную группу, замещенную аминогруппой(ами) или ди-C1-4алкиламиногруппой(ами)» или пиперидильную группу, и
R4 означает атом водорода или, в качестве альтернативы, R3 и R4, совместно с атомом азота, к которому они присоединены, образуют пиперидиногруппу или пиперазинильную группу, которая может быть замещена C1-4алкильной группой(ами) или диметиламиногруппой(ами).
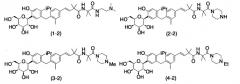
(2) Производное 4-изопропилфенилглюцита, выбранное из следующей группы, или его фармацевтически приемлемая соль:
Схема 2
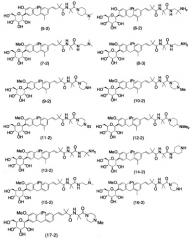
(3) Производное 4-изопропилфенилглюцита, выбранное из следующей группы, или его фармацевтически приемлемая соль:
Схема 3
(4) Фармацевтическая композиция, которая включает в качестве активного ингредиента производное 4-изопропилфенилглюцита по любому из (1)-(3) или его фармацевтически приемлемую соль.
(5) Ингибитор активности натрийзависимого транспортера 1 глюкозы (SGLT1), который включает в качестве активного ингредиента производное 4-изопропилфенилглюцита по любому из (1)-(3) или его фармацевтически приемлемую соль.
(6) Средство для борьбы с постпрандиальной гипергликемией, которое включает в качестве активного ингредиента производное 4-изопропилфенилглюцита по любому из (1)-(3) или его фармацевтически приемлемую соль.
(7) Профилактическое или терапевтическое средство для лечения диабета, которое включает в качестве активного ингредиента производное 4-изопропилфенилглюцита по любому из (1)-(3) или его фармацевтически приемлемую соль.
(8) Применение производного 4-изопропилфенилглюцита по любому из (1)-(3) или его фармацевтически приемлемой соли для производства профилактического или терапевтического средства для лечения диабета.
(9) Способ профилактики или лечения диабета, который включает введение млекопитающему терапевтически эффективного количества производного 4-изопропилфенилглюцита по любому из (1)-(3) или его фармацевтически приемлемой соли.
Полезные эффекты изобретения
Настоящее изобретение представляет возможность получения производных 4-изопропилфенилглюцита, которые не склонны к накоплению в организме и которые ингибируют активность SGLT1.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Использованные в настоящей заявке термины и фразы определяются следующим образом.
Термин «C1-4алкильная группа» служит для обозначения линейной или разветвленной алкильной группы, содержащей 1-4 атома углерода. Примеры включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу и трет-бутильную группу.
Термин «ди-C1-4алкиламиногруппа» служит для обозначения аминогруппы, замещенной двумя C1-4алкильными группами. Примеры включают диметиламиногруппу и диэтиламиногруппу.
Кроме того, термин «фармацевтически приемлемая соль» служит для обозначения, например, соли со щелочным металлом, щелочноземельным металлом, аммонием или алкиламмонием, или же соли с минеральной кислотой или органической кислотой. Примеры включают соли натрия, соли калия, соли кальция, соли аммония, соли алюминия, соли триэтиламмония, соли муравьиной кислоты, соли уксусной кислоты, соли пропионовой кислоты, соли масляной кислоты, соли гексановой кислоты, соли октановой кислоты, соли трифторуксусной кислоты, соли малеиновой кислоты, соли винной кислоты, соли лимонной кислоты, соли стеариновой кислоты, соли янтарной кислоты, соли этилянтарной кислоты, соли лактобионовой кислоты, соли глюконовой кислоты, соли глюкуроновой кислоты, соли глюкогептановой кислоты, соли глутаровой кислоты, соли пимелиновой кислоты, соли пробковой кислоты, соли азелаиновой кислоты, соли себациновой кислоты, соли 1,9-нонандикарбоновой кислоты, соли додекандиовой кислоты, соли тридекандиовой кислоты, соли тетрадекандиовой кислоты, соли пентадекандиовой кислоты, соли гексадекандиовой кислоты, соли гептадекандиовой кислоты, соли бензойной кислоты, соли 2-гидроксибензойной кислоты, соли метансульфоновой кислоты, соли этансульфоновой кислоты, соли этандисульфоновой кислоты, соли 2-гидроксиэтансульфоновой кислоты, соли бензолсульфоновой кислоты, соли п-толуолсульфоновой кислоты, соли 1,5-нафталиндисульфоновой кислоты, соли лаурилсерной кислоты, соли молочной кислоты, соли гиппуровой кислоты, соли фумаровой кислоты, соли малоновой кислоты, соли транс-коричной кислоты, соли яблочной кислоты, соли аспарагиновой кислоты, соли глутаминовой кислоты, соли адипиновой кислоты, соли цистеина, соли N-ацетилцистеина, соли хлористоводородной кислоты, соли бромистоводородной кислоты, соли фосфорной кислоты, соли серной кислоты, соли йодистоводородной кислоты, соли никотиновой кислоты, соли щавелевой кислоты, соли пикриновой кислоты, соли роданистоводородной кислоты, соли ундекановой кислоты, соли с полимерами акриловой кислоты и соли с карбоксивиниловыми полимерами.
Фраза «средство для борьбы с постпрандиальной гипергликемией» служит для обозначения лекарственного средства, которое подавляет постпрандиальную гипергликемию и, тем самым, препятствует началу заболеваний, связанных с постпрандиальной гипергликемией (например, диабета, метаболического синдрома), или лечит эти заболевания. В настоящем описании термин «постпрандиальная гипергликемия» служит для обозначения состояния, при котором имеет место аномальное повышение уровней глюкозы в крови после приема пищи, более конкретно, состояние, при котором уровень глюкозы в крови через 2 часа после приема пищи превышает 140 мг/дл.
Далее по тексту будет описана применимость соединений по настоящему изобретению (для ознакомления с подробностями, см. приведенные ниже тестовые примеры).
Соединения по настоящему изобретению обладают сильным ингибирующим действием на SGLT1 и, кроме того, определенным, хотя и слабым, ингибирующим действием на SGLT2. Кроме того, соединения по настоящему изобретению обладают гипогликемическим действием такой же силы, как и соединения, раскрытые в WO2007/136116. Кроме того, соединения, раскрытые в WO2007/136116, имеют тенденцию накапливаться в почках, не подвергаясь выведению даже через 7 дней после перорального приема в количестве 1 мг/кг, в то время, как соединения по настоящему изобретению демонстрируют характерную особенность, которая заключается в том, что даже после приема в течение 3 последовательных дней в дозировке 3 мг/кг они, неожиданно, не обнаруживаются в почках уже на 2-й день после окончания введения.
Таким образом, соединения по настоящему изобретению не склонны к накоплению в организме, и существует меньшая вероятность того, что они вызовут побочные эффекты и токсичность в результате непрерывного введения, и, следовательно, эти соединения обладают отличными с практической точки зрения свойствами в качестве фармацевтических композиций.
Если соединения по настоящему изобретению входят в состав фармацевтических композиций, то в соответствии с необходимостью, можно выбрать различные типы дозированных форм, например, твердые формы и растворы. В этом случае в состав композиций может быть включен также фармацевтически приемлемый носитель(и). Примеры такого носителя включают широко применяемые эксципиенты, наполнители, связующие вещества, дезинтегрирующие средства, покрытия, покрытия с содержанием сахара, регуляторы pH, солюбилизаторы, а также водные или неводные растворители. Соединения по настоящему изобретению и указанные носители могут входить в состав таблеток, пилюль, капсул, гранул, порошков, растворов, эмульсий, суспензий или других дозированных форм.
Например, соединения по настоящему изобретению можно включать в состав таблеток для перорального приема путем смешивания их с эксципиентами, таблетирования и других способов, которые традиционно применяются для изготовления твердых препаратов.
Кроме того, соединения по настоящему изобретению можно включать в состав лекарственных форм в сочетании, например, с α-, β- или γ-циклодекстрином или метилированным циклодекстрином, для улучшения их растворимости.
Дозировка соединений по настоящему изобретению будет меняться в зависимости от заболевания или симптома, подвергаемого лечению, массы тела, возраста пациента, его пола, пути введения и т.д. Дневная дозировка для взрослых составляет от 0,1 до 1000 мг/кг массы тела, предпочтительно от 0,1 до 200 мг/кг массы тела и более предпочтительно от 0,1 до 10 мг/кг массы тела, при введении в виде одной дозы или нескольких отдельных доз.
В качестве предпочтительных вариантов осуществления настоящего изобретения могут быть названы следующие соединения, получение которых описано в разделе примеров.
Схема 4
Способы получения соединений формулы (I) по настоящему изобретению будут более подробно описаны ниже по тексту в форме ряда примеров, но они не ограничены описанными ниже конкретными случаями.
Методика получения 1
Соединения формулы (I) по настоящему изобретению можно синтезировать следующим образом.
На приведенной ниже схеме, X означает ацетильную группу или C1-4алкильную группу, R5 означает группу R3 или группу R3, в которой аминогруппа защищена трет-бутилкарбонатом (Boc), и другие символы соответствуют данным выше определениям.
Схема 5
(1) Стадия 1 (Реакция Хека)
Соединение (II) и олефинкарбоновую кислоту (III) можно ввести в реакцию Хека в присутствии палладиевого катализатора, фосфинового лиганда и подходящего основания с получением соединения (IV). Примеры палладиевого катализатора, применяемого в этой реакции, включают ацетат палладия, тетракис(трифенилфосфин)палладий, дибензилиденацетонпалладий, хлорид бис(трифенилфосфин)палладия, хлорид бис(трициклогексилфосфин)палладия и палладий на активированном угле. Примеры фосфинового лиганда включают трифенилфосфин и три-O-толилфосфин. Кроме того, примеры подходящего основания включают триэтиламин, N-этил-N,N-диизопропиламин, карбонат калия, карбонат кальция, карбонат цезия и трет-бутоксид калия. Примеры растворителя, подходящего для применения в описываемой реакции, включают ацетонитрил, толуол и тетрагидрофуран. Температура проведения реакции меняется от 0°C до температуры кипения, или же вместо этого можно применять микроволновое излучение.
(2) Стадия 2 (введение амидной группы)
Соединение (IV) можно ввести в реакцию конденсации с амином (R5R4NH), происходящую за счет дегидратации, с получением соединения (V). Примеры растворителя, который является предпочтительным для применения в этой реакции, включают хлороформ, дихлорметан и N,N-диметилформамид. Примеры дегидратирующего конденсирующего агента, предпочтительного для проведения указанной реакции, включают N,N'-дициклогексилкарбодиимид (DCC), гидрохлорид N-этил-N'-3-диметиламинопропилкарбодиимида (EDC·HCl), 1,1'-карбонилдимидазол (CDI) и EDC·HCl/1-гидроксибензотриазола моногидрат (HOBt·H2O). Температура проведения реакции в этом случае находится в пределах от 0°C до 60°C.
Стадия 3 (снятие защиты)
Группу Boc в соединении (V) можно удалить в кислой среде и ацетильные группы (Ac) можно удалить в основной среде с получением соединения (I). Группу Boc удаляют обработкой хлористоводородной кислотой или трифторуксусной кислотой в присутствии растворителя (например, дихлорметана, хлороформа, диоксана) или без него. Для удаления ацетильной группы можно применять такое основание, как метоксид натрия, гидроксид натрия, гидроксид лития, карбонат калия, карбонат цезия или триэтиламин. Примеры предпочтительного растворителя для этой реакции включают метанол, этанол и водный метанол. Температура проведения указанной реакции меняется в пределах от 0°C до 60°C.
Методика получения 2
Соединение (I) по настоящему изобретению можно также синтезировать другим путем, который показан ниже. На помещенной далее схеме символы соответствуют данным выше определениям.
Схема 6
(4) Стадия 4 (реакция Хека)
Можно применять соединение (II) и олефинкарбоновую кислоту (VI), вводя их в реакцию Хека, показанную на стадии 1 методики получения 1, с образованием соединения (VII).
(5) Стадия 5 (введение амидной группы)
Можно использовать соединение (VII) и амин (VIII), конденсируя их с дегидратацией, как показано на стадии (2) методики получения 1, с образованием соединения (V)
(6) Стадия 6 (снятие защиты)
Полученное выше соединение (V) можно превратить в соединение (I) путем снятия защиты, как показано на стадии 3 методики получения 1.
Методика получения 3
Методика получения промежуточного соединения (II)
Ниже показана методика получения промежуточного соединения (II), которое необходимо для получения соединения (I) по настоящему изобретению.
На приведенной схеме, X1 означает бензильную группу или C1-4алкильную группу, X2 означает триметилсилильную группу или C1-4алкильную группу, и остальные символы соответствуют данным выше определениям.
Схема 7
(7) Стадия 7 (сочетание)
Соединение (IX) можно обработать металлорганическим реагентом (например, н-бутиллитием, втор-бутиллитием, трет-бутиллитием) с получением ариллития. К этому соединению можно добавить глюконолактон (X) с образованием соединения (XI). Примеры растворителя, который подходит для проведения этой реакции, включают тетрагидрофуран, диэтиловый эфир и толуол. Температура проведения реакции находится в пределах от -80°C до комнатной температуры, предпочтительно от -78°C до -25°C.
(8) Стадия 8 (кислый гидролиз)
Одновременно с удалением силильных групп из соединения (XI) в метаноле в присутствии кислоты в 1-е положение остатка сахара может быть введена метильная группа с получением простого метилового эфира (XII). Примеры кислоты, которая применяется в этой реакции, включают хлористоводородную кислоту, серную кислоту, метансульфоновую кислоту, моногидрат п-толуолсульфоновой кислоты, п-толуолсульфонат пиридиния, гидрофторид пиридина и н-Bu4NF. Хотя температура проведения реакции должна меняться в зависимости от типа применяемой кислоты, она находится в пределах от 0°C до 100°C, предпочтительно от 25°C до 80°C.
(9) Стадия 9 (ацетилирование)
Гидроксильные группы в соединении (XII) можно защитить ацетильными группами с получением соединения (XIII). Соединение (XII) можно ввести в реакцию, например, с уксусным ангидридом или ацетилхлоридом, в растворителе в присутствии подходящего основания, с получением соединения (XIII). Примеры растворителя, который подходит для применения в этой реакции, включают хлороформ, дихлорметан, диоксан, этилацетат, тетрагидрофуран и N,N-диметилформамид. Примеры оснований, которые предпочтительны для проведения данной реакции, включают триэтиламин, коллидин и пиридин. В качестве катализатора реакции можно использовать 4-диметиламинопиридин. Температура проведения реакции предпочтительно находится в диапазоне от 0°C до комнатной температуры.
(10) Стадия 10 (восстановление)
Соединение (XIII) можно ввести в реакцию с Et3SiH, i-Pr3SiH, t-BuMe2SiH или Ph2SiHCl в присутствии кислоты Льюиса с получением соединения (XIV). Примеры кислот Льюиса, которые подходят для применения в этой реакции, включают BF3·Et2O, CF3COOH, InCl3, TiCl4, TMSOTf, п-толуолсульфоновую кислоту и метансульфоновую кислоту. Примеры растворителя включают хлороформ, дихлорметан, толуол, тетрагидрофуран, ацетонитрил или их смеси, причем предпочтительными являются смеси растворителей, содержащие ацетонитрил, например, ацетонитрил/хлороформ, ацетонитрил/дихлорметан, ацетонитрил/тетрагидрофуран, ацетонитрил/тетрагидрофуран/толуол и т.д. В этом случае температура реакции находится в пределах от -60°C до 25°C, предпочтительно от -30°C до 25°C.
(11) Стадия 11 (снятие защиты)
В случае если X1 в соединении (XIV) является бензильной группой, дебензилирование можно осуществить путем каталитического гидрирования в атмосфере водорода с использованием такого катализатора, как палладий на активированном угле, гидроксид палладия или платина-палладий на активированном угле. Из перечисленного в качестве катализатора предпочтительными являются палладий на активированном угле или гидроксид палладия. Примеры растворителей, подходящих для применения в этой реакции, включают метанол, этанол, изопропанол, этилацетат, уксусную кислоту и смеси этих растворителей. Температура проведения реакции находится в пределах от комнатной температуры до температуры кипения с обратным холодильником, причем комнатная температура является предпочтительной.
(12) Стадия 12 (бромирование)
Соединение (XIV) или соединение, полученное на описанной выше стадии 11, можно ввести в реакцию с бромом, N-бромсукцинимидом, бромистым водородом и т.п. в растворителе, с получением соединения (XV). Примеры растворителя, который подходит для использования в этой реакции, включают хлороформ, дихлорметан, уксусную кислоту, метанол и N,N-диметилформамид. Температура проведения этой реакции находится в пределах от 0°C до комнатной температуры.
(13) Стадия 13 (снятие защиты)
Ацетильные группы в соединении (XV) можно удалить при действии основания с получением соединения (XVI). Примеры оснований, которые подходят для проведения данной реакции, включают метоксид натрия, гидроксид натрия, гидроксид лития, карбонат калия, карбонат цезия и триэтиламин. Примеры растворителей, подходящих для этой реакции, включают метанол, этанол и водный метанол. Температура проведения реакции находится в пределах от 0°C до 60°C.
(14) Стадия 14 (силилирование)
Гидроксильные группы в соединении (XVI) можно защитить силильными группами (например, триметилсилильными группами) с получением соединения (XVII). Соединение (XVI) можно ввести в реакцию с триметилсилилхлоридом, триэтилсилилхлоридом, трет-бутилдиметилсилилхлоридом или подобными соединениями в растворителе в присутствии подходящего основания с получением соединения (XVII). Примеры растворителя, подходящего для применения в этой реакции, включают хлороформ, дихлорметан, диоксан, этилацетат, тетрагидрофуран и N,N-диметилформамид. Примеры основания, предпочтительного для проведения реакции, включают триэтиламин, коллидин и пиридин. Температура проведения реакции находится в пределах от 0°C до комнатной температуры.
(15) Стадия 15 (сочетание)
Соединение (XVII) можно обработать металлорганическими соединениями (например, н-бутиллитием, втор-бутилитием, трет-бутилитием) с получением ариллитиевого соединения. К этому соединению можно добавить альдегид (XVIII) с получением соединения (XIX). Примеры растворителя, подходящего для проведения этой реакции, включают тетрагидрофуран, диэтиловый эфир и толуол. Температура проведения реакции находится в диапазоне от -80°C до комнатной температуры, предпочтительно от -78°C до -25°C.
(16) Стадия 16 (кислый гидролиз)
Полученное выше соединение (XIX) можно превратить в соединение (XX) реакцией кислого гидролиза, показанной для стадии 8 методики получения 3.
(17) Стадия 17 (ацетилирование)
Полученное выше соединение (XX) можно превратить в соединение (XXI) реакцией ацетилирования, показанной для стадии 9 методики получения 3.
(18) Стадия 18 (восстановление)
Полученное выше соединение (XXI) можно превратить в промежуточное соединение (II) реакцией восстановления, показанной для стадии 10 методики получения 3.
Методика получения 4
Методика получения промежуточного соединения (II)
Промежуточное соединение (II) можно также синтезировать другим путем, который показан ниже. В этой методике стадии 19-21 могут быть проведены в одном реакционном сосуде для сокращения количества стадий. Символы на приведенной ниже схеме соответствуют данным выше определениям.
Схема 8
(19) Стадия 19 (сочетание)
Соединение (XXII) можно обработать металлоорганическим реагентом (например, н-бутилитием, втор-бутилитием, трет-бутиллитием) с получением ариллитиевого соединения. К этому соединению можно добавить глюконолактон (X) с получением соединения (XXIII). Примеры растворителя, подходящего для применения в этой реакции, включают тетрагидрофуран, диэтиловый эфир и толуол. Температура реакции меняется в пределах от -80°C до комнатной температуры, предпочтительно от -78°C до -25°C.
(20) Стадия 20 (силилирование)
После проведения описанной выше стадии 19, гидроксильную группу в 1-м положении соединения (XXIII) можно защитить силильной группой (например, триметилсилильной группой). Реакционную смесь, полученную на стадии 19, можно ввести в реакцию с триметилсилилхлоридом с получением соединения (XXIV). Растворитель, который подходит для применения в этой реакции, и предпочтительная температура проведения реакции те же самые, что и для стадии 19.
(21) Стадия 21 (сочетание)
После проведения описанной выше стадии 20, полученное соединение (XXIV) можно обработать металлоорганическим реагентом (например, н-бутилитием, втор-бутилитием, трет-бутиллитием) с получением ариллитиевого соединения. К этому соединению можно добавить альдегид (XVIII) с получением соединения (XXV). Растворитель, который подходит для этой реакции, является таким же, как и для стадии 19.
(22) Стадия 22 (кислый гидролиз)
Полученное выше соединение (XXV) можно превратить в соединение (XXVI) реакцией кислого гидролиза, которая показана для стадии 8 методики получения 3.
(23) Стадия 23 (ацетилирование)
Полученное выше соединение (XXVI) можно превратить в соединение (XXVII) реакцией ацетилирования, которая показана для стадии 9 методики получения 3.
(24) Стадия 24 (восстановление)
Полученное выше соединение (XXVII) можно превратить в соединение (XXVIII) реакцией восстановления, которая показана для стадии 10 методики получения 3.
(25) Стадия 25 (ацетилирование или алкилирование)
Гидроксильную группу в соединении (XXVIII) можно защитить ацетильной группой или алкилировать (например, метилировать) с получением промежуточного соединения (II). Соединение (XXVIII) можно ввести во взаимодействие, например, с уксусным ангидридом или ацетилхлоридом в растворителе в присутствии подходящего основания с получением промежуточного соединения (II). Примеры растворителей, подходящих для использования в этой реакции, включают хлороформ, дихлорметан, диоксан, этилацетат, тетрагидрофуран и N,N-диметилформамид. Примеры оснований, предпочтительных для осуществления этой реакции, включают триэтиламин, коллидин и пиридин. В качестве катализатора может применяться 4-диметиламинопиридин и т.п. Температура проведения реакции предпочтительно находится в пределах от 0°C до комнатной температуры. В качестве альтернативы, соединение (XXVIII) можно ввести во взаимодействие с метилиодидом, этилиодидом, 2-йодпропаном или подобными реагентами, в растворителе, в присутствии подходящего основания с получением промежуточного соединения (II). Примеры растворителей, которые подходят для проведения этой реакции, включают хлороформ, дихлорметан, тетрагидрофуран, N,N-диметилформамид и ацетон. Примеры оснований, предпочтительных для осуществления реакции, включают карбонат калия и карбонат цезия.
ПРИМЕРЫ
Далее по тексту настоящее изобретение будет описано более подробно с привлечением следующих справочных примеров, примеров и тестовых примеров, но не следует считать, что настоящее изобретение ограничено этими примерами.
Справочный пример 1: Получение промежуточного соединения (A)
Схема 9
(1) Справочный пример 1-1: Соединение (A1)
Схема 10
К раствору 3-изопропилфенола (25,0 г, 0,184 моль) в уксусной кислоте (200 мл) добавляли суспензию иодата калия (7,88 г, 0,0368 моль) в воде (75 мл) и йод (18,7 г, 0,0736 моль). Реакционную смесь перемешивали при комнатной температуре в течение 20 часов. После добавления диэтилового эфира (400 мл) и воды (300 мл) отделяли органический слой. Органический слой промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и затем высушивали над безводным сульфатом магния. После отделения осушающего вещества фильтрованием отгоняли растворитель при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=95:5), получая соединение (A1) (27,6 г, 57%) в виде бесцветного масла.
1H ЯМР (200 МГц, хлороформ-d) δ м.д.: 1,16-1,25 (м, 6H), 2,64-2,98 (м, 1H), 5,21 (с, 1H), 6,57 (дд, J=8,13, 2,20 Гц, 1H), 6,88 (д, J=2,20 Гц, 1H), 7,54 (д, J=8,13 Гц, 1H).
(2) Справочный пример 1-2: Соединение (A2)
Схема 11
К суспензии соединения (A1) (26,5 г, 0,101 моль) и карбоната калия (20,9 г, 0,152 моль) в ацетонитриле добавляли бензилбромид (14,4 мл, 0,121 моль) и перемешивали при комнатной температуре в течение 2 часов, после чего добавляли метанол (1,0 мл) и перемешивали в течение еще 30 минут. Нерастворимые вещества отделяли фильтрованием и фильтрат концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=95:5), получая соединение (A2) (30,2 г, 85%) в виде бесцветного масла.
1H ЯМР (200 МГц, хлороформ-d) δ м.д.: 1,21 (д, J=7,03 Гц, 6H), 2,84 (септет, J=7,03 Гц, 1H), 5,14 (с, 2H), 6,62 (дд, J=8,35, 2,20 Гц, 1H), 6,74 (д, J=2,20 Гц, 1H), 7,23-7,58 (м, 5H), 7,68 (д, J=8,35 Гц, 1H).
(3) Справочный пример 1-3: Соединение (A3)
Схема 12
К раствору соединения (A2) (30,2 г, 85,7 ммоль) в ТГФ (450 мл) по каплям добавляли 2,6М раствор н-бутиллития в гексане (33 мл, 85,7 ммоль) при -78°C в атмосфере азота и перемешивали при этой температуре в течение 15 минут. Затем по каплям в течение 15 минут добавляли раствор 2,3,4,6-тетра-O-триметилсилил-D-глюконо-1,5-лактона (40,0 г, 85,7 ммоль) в ТГФ (230 мл) и перемешивали при этой температуре в течение 20 минут. К полученной реакционной смеси добавляли насыщенный водный раствор хлорида аммония (150 мл) и воду (100 мл). Температуру полученной смеси повышали до комнатной и затем дважды экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным раствором соли и высушивали над безводным сульфатом магния. После отделения осушителя фильтрованием растворитель отгоняли при пониженном давлении.
Полученный остаток растворяли в растворе, метансульфоновой кислоты (2,9 г) в метаноле (840 мл), и перемешивали при комнатной температуре в течение 14,5 часов. После нейтрализации триэтиламином (2,5 мл) реакционную смесь концентрировали.
Полученный остаток (46,4 г) растворяли в пиридине (125 мл) и охлаждали до 4°C. К этому раствору добавляли уксусный ангидрид (75 мл) и 4-диметиламинопиридин (102 мг, 0,835 ммоль) и перемешивали при комнатной температуре в течение 19 часов. После добавления ледяной воды (500 мл) смесь дважды экстрагировали этилацетатом (500 мл). Объединенные органические соли промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и затем высушивали над безводным сульфатом магния. После отделения осушающего средства фильтрованием растворитель отгоняли при пониженном давлении, получая неочищенное соединение (53 г).
К раствору этого неочищенного соединения в хлороформе (250 мл) и ацетонитриле (250 мл) при 4°C добавляли Et3SiH (13,7 мл, 85,7 ммоль) и BF3·Et2O (10,9 мл, 85,7 ммоль) в атмосфере азота, и перемешивали при этой температуре в течение 1,5 часов. Реакционную смесь перемешивали с насыщенным водным раствором бикарбоната натрия и экстрагировали хлороформом. Органический слой промывали насыщенным раствором соли и высушивали над безводным сульфатом магния. После отделения осушающего вещества фильтрованием растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=5:1→2:1), получая соединение (A3) (19,1 г, 40%; 4 стадии) в виде светло-желтого аморфного вещества.
1H ЯМР (300 МГц, хлороформ-d) δ м.д.: 1,21 (д, J=6,99 Гц, 6H), 1,78 (с, 3H), 2,01 (с, 6H), 2,05 (с, 3H), 2,86 (септет, J=6,99 Гц, 1H), 3,80 (ддд, J=9,95, 4,59, 2,25 Гц, 1H), 4,06-4,13 (м, 1H), 4,19-4,27 (м, 1H), 4,96 (д, J=9,95 Гц, 1H), 5,10 (с, 2H), 5,16-5,25 (м, 1H), 5,33 (т, J=9,17 Гц, 1H), 5,40-5,49 (м, 1H), 6,79 (д, J=1,40 Гц, 1H), 6,85 (дд, J=7,93, 1,40 Гц, 1H), 7,26-7,52 (м, 6H).
МС ESI/APCI Двойной положительный: 579[M+Na]+.
(4) Справочный пример 1-4: соединение (A4)
Схема 13
К раствору соединения (A3) (19,1 г, 34,3 ммоль) в метаноле (200 мл) добавляли 10% палладий на активированном угле (1,8 г) и перемешивали в атмосфере водорода при комнатной температуре в течение 2 часов. После фильтрования реакционной смеси через целит растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=2:1→1:1), получая соединение (A4) (12,3 г, 77%) в виде бесцветного аморфного вещес