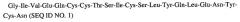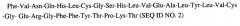Конъюгат инсулина с применением фрагмента иммуноглобулина
Иллюстрации
Показать всеГруппа изобретений относится к области фармакологии и медицины и касается конъюгата инсулина, обладающего улучшенными продолжительностью действия и стабильностью in vivo, который получают посредством ковалентного связывания инсулина с Fc-областью иммуноглобулина через непептидильный полимер, а также к составу длительного действия, содержащему его, и способу их получения. Группа изобретений обеспечивает поддерживание in vivo активность инсулина на относительно высоком уровне и значительно увеличивает период его полувыведения из сыворотки, таким образом, значительно улучшая соблюдение режима приема лекарственного средства по сравнению с терапией инсулином. 6 н. и 15 з.п. ф-лы, 8 пр.,6 ил.
Реферат
Область техники
Настоящее изобретение относится к конъюгату инсулина, обладающему улучшенными продолжительностью действия и стабильностью in vivo, который получают посредством ковалентного связывания инсулина с Fc-областью иммуноглобулина через непептидильный полимер, составу длительного действия, содержащему его, и способу их получения. Изобретение относится к способу лечения индивидуума, имеющего инсулин-дефицитное нарушение, такое как диабет. Конъюгат инсулина по настоящему изобретению поддерживает in vivo активность пептида на относительно высоком уровне и значительно увеличивает период его полувыведения из сыворотки, таким образом, значительно улучшая соблюдение режима приема лекарственного средства по сравнению с терапией инсулином.
Предшествующий уровень техники
Инсулин, пептид, секретируемый бета-клетками поджелудочной железы, играет центральную роль в контроле за уровнем глюкозы в крови в организме. Когда инсулин секретируется не должным образом или секретируемый инсулин не работает в организме, уровень глюкозы в крови не регулируется, и таким образом возникает диабет. Такой диабет называется диабетом II типа. Диабет I типа возникает, когда поджелудочная железа не вырабатывает достаточно инсулина для понижения уровня глюкозы в крови.
Диабет II типа, как правило, лечат пероральными химически синтезированными средствами, и в некоторых случаях пациентов лечат инсулином. В то же время при диабете I типа требуется лечение инсулином.
Широко распространенным способом лечения инсулином является инъекция инсулина перед/после еды. Однако такую инъекцию инсулина следует постоянно делать три раза в сутки, что причиняет боль или дискомфорт пациентам. Предпринимались различные попытки преодоления этой проблемы. Одной из них является способ доставки пептидного лекарственного средства посредством пероральной или назальной ингаляции за счет улучшения его мембранной проницаемости. К сожалению, этот способ демонстрировал очень низкую эффективность доставки по сравнению с инъекционными составами, и таким образом, все еще остается много трудностей в поддержании in vivo активности пептидного лекарственного средства на требуемом уровне.
В то же время существовал способ замедленной абсорбции лекарственного средства после подкожной инъекции большого количества лекарственного средства для поддержания уровня в крови посредством только одной ежедневной инъекции. Были одобрены некоторые разработанные лекарственные средства (лантус®, Sanofi-aventis), и сейчас они применяются для лечения пациентов. Кроме того, проводили исследования для пролонгации действия, что привело к разработке левемира (Novo Nordisk), полученного посредством модификации инсулина жирной кислотой, в котором длительное действие достигается благодаря самоассоциации молекул инсулина в области инъекции и благодаря обратимому связыванию с альбумином в крови. Однако эти способы приводят к болям в области инъекции, и ежедневные инъекции также причиняют значительный дискомфорт пациенту.
Много усилий приложили для улучшения стабильности пептидных лекарственных средств в сыворотке и поддержания содержания лекарственных средств в крови на высоком уровне в течение продолжительного периода времени, таким образом, максимизируя фармацевтическую эффективность лекарственных средств. Эти составы пептидных лекарственных средств длительного действия необходимы для увеличения стабильности пептидных лекарственных средств и поддержания титров на достаточно высоком уровне, не вызывая иммунных ответов у пациентов. Для получения составов пептидных лекарственных средств длительного действия, традиционно применяли полимер, имеющий высокую растворимость, такой как полиэтиленгликоль (ПЭГ), для химической модификации поверхности пептидного лекарственного средства.
ПЭГ неспецифически связывается со специфическим участком или различными участками таргетного пептида для достижения эффекта увеличения молекулярной массы пептида, и таким образом ингибируя его выведение почкой, и предотвращая гидролиз, без причинения каких-либо побочных эффектов. Например, в WO 2006/076471 описано, что натрийуретический пептид В-типа (BNP), который связывается с NPR-A для активации образования cGMP и ведет к снижению артериального давления в данной области, и как результат применяется в качестве терапевтического средства для лечения застойной сердечной недостаточности, связывают с ПЭГ, таким образом, поддерживая его физиологическую активность. В патенте США № 6924264 описано, что ПЭГ связан с лизиновым остатком экзендина-4 для увеличения времени его удержания in vivo. Этот способ увеличивает молекулярную массу ПЭГ, и таким образом, увеличивает время удержания in vivo пептидного лекарственного средства. Однако вследствие увеличения молекулярной массы титр пептидного лекарственного средства значительно уменьшается, и способность вступать в реакцию с пептидом также снижена. Таким образом, это, к сожалению, снижает выход препарата.
В WO 02/46227 описан слитый белок, полученный посредством соединения GLP-1, экзендина-4 или их аналога с сывороточным альбумином человека или фрагментом иммуноглобулина (Fc) с применением технологии генетической рекомбинации. В патенте США № 6756480 описан Fc слитый белок, полученный посредством соединения паратиреоидного гормона (PTH) и его аналога с Fc-областью. Этими способами можно решать такие проблемы, как низкий выход пегилирования и неспецифичность, но все еще существует проблема, которая заключается в том, что эффект увеличения периода полувыведения из крови не так заметен, как и ожидалось, и в некоторых случаях титры также являются низкими. Чтобы максимизировать эффект увеличения периода полувыведения из крови, использовали различные виды пептидных линкеров, но при этом существует возможность вызвать иммунный ответ. Кроме того, если применяют пептид, имеющий дисульфидные связи, такой как BNP, существует высокая вероятность неправильного сворачивания, и если применяют пептид, имеющий неприродные аминокислотные остатки, его можно получать посредством генетической рекомбинации только с большим трудом.
Раскрытие предмета изобретения
Техническая проблема
В отношении этого, к настоящему изобретению привело интенсивное и тщательное исследование развития способа, который может одновременно максимизировать период полувыведения из сыворотки и активность инсулина in vivo, результатом чего стало то открытие, что Fc-область иммуноглобулина, непептидильный полимер и инсулин сайт-селективно связаны друг с другом ковалентной связью, таким образом, значительно увеличивая период полувыведения из сыворотки по сравнению с известным способом внутрирамочного слияния.
Решение проблемы
Объектом по настоящему изобретению является предоставление превосходного конъюгата инсулина, который поддерживает активность инсулина in vivo и значительно пролонгирует период его полувыведения из сыворотки, состава длительного действия, содержащего его, и способ их получения.
Полезные эффекты по изобретению
Конъюгат инсулина по настоящему изобретению поддерживает активность пептида in vivo на относительно высоком уровне и значительно увеличивает период его полувыведения из сыворотки, таким образом, значительно улучшая соблюдение режима приема лекарственного средства пациента, нуждающегося в терапии инсулином.
Краткое описание чертежей
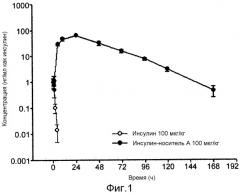
ФИГ. 1 является результатом фармакокинетического анализа конъюгата инсулин-ПЭГ-Fc иммуноглобулина;
ФИГ. 2 является результатом сравнения in vivo эффективности конъюгатов производное инсулина-ПЭГ-Fc иммуноглобулина; и
ФИГ. 3 является результатом анализа пегилирования на 90% или более на фенилаланине (B1F) бета-цепи конъюгата инсулин-ПЭГ-Fc иммуноглобулина с применением эксклюзионной колонки.
ФИГ. от 4a до 4c являются результатом анализа специфического связывания бета-цепи конъюгата инсулин-ПЭГ-Fc иммуноглобулина.
Лучший вариант осуществления изобретения
В одном из аспектов для достижения вышеназванных целей настоящее изобретение относится к конъюгату инсулина, который получают посредством связывания инсулина с Fc-областью иммуноглобулина через непептидильный полимер, в котором непептидильный полимер связан с N-концом бета-цепи инсулина.
По настоящему изобретению инсулином является пептид, который секретируется поджелудочной железой в ответ на повышенный уровень глюкозы в крови для захвата глюкозы в печени, мышцах или жировой ткани и превращения в гликоген, и прекращения превращения жира в источник энергии, и таким образом он контролирует уровень глюкозы в крови. Этот пептид включает агонисты, предшественники, производные, фрагменты и их варианты, и предпочтительно природный инсулин, инсулин быстрого действия или инсулин длительного действия.
Природный инсулин является гормоном, который секретируется поджелудочной железой для активизации абсорбции глюкозы и ингибирования распада жира, и таким образом выполняет функцию контроля уровня глюкозы в крови. Инсулин образуется из предшественника, не предназначенного для регулирования уровня глюкозы в крови, известного как проинсулин, в результате процессинга. Аминокислотные последовательности инсулина представлены ниже:
Альфа цепь:
Бета цепь:
Под агонистом инсулина понимают соединение, которое связывается с рецептором инсулина для проявления биологической активности равной биологической активности инсулина, который является нерелевантным инсулину по структуре.
Под производным инсулина понимают пептид, имеющий по меньшей мере 80% гомологии аминокислотной последовательности с природным инсулином, который может обладать несколькими группами на химически замещенном (например, альфа-метилирование, альфа-гидроксилирование), удаленном (например, дезаминирование), или модифицированном (например, N-метилирование) аминокислотном остатке, и обладает функцией регулирования уровня глюкозы в крови в организме.
Под фрагментом инсулина понимают одну или несколько аминокислот, присоединенных или удаленных на N-конце или C-конце природного инсулина, к которым могут быть присоединены аминокислоты неприродного происхождения (например, аминокислота D-типа), и который обладает функцией регулирования уровня глюкозы в крови в организме.
Под вариантом инсулина понимают пептид, имеющий одну или несколько аминокислотных последовательностей, отличных от аминокислотной последовательности природного инсулина, и выполняющий функции регулирования уровня глюкозы в крови в организме.
Каждый способ получения агонистов, производных, фрагментов и вариантов инсулина можно использовать индивидуально или в комбинации. Например, настоящее изобретение относится к пептиду, который имеет одну или несколько аминокислот, отличных от аминокислот природного пептида, и дезаминирование N-концевого аминокислотного остатка, и выполняет функцию регулирования уровня глюкозы в крови в организме.
В конкретном варианте осуществления инсулин, применяемый в настоящем изобретении, можно получать посредством технологии рекомбинации, и можно синтезировать с применением способа твердофазного синтеза.
Дополнительно, инсулин, применяемый в настоящем изобретении, характеризуется тем, что непептидильный полимер связан с N-концом бета-цепи инсулина. Этот непептидильный полимер применяют в качестве линкера в настоящем изобретении. Модификация альфа-цепи инсулина ведет к уменьшению активности и безопасности. В настоящем изобретении, таким образом, непептидильный полимер в качестве линкера связан с N-концом бета-цепи инсулина, чтобы поддерживать активность инсулина и повышать безопасность.
Как применяют в настоящем документе, термин "активность" означает способность инсулина связываться с рецептором инсулина, и означает, что инсулин проявляет свое действие через связывание с рецептором инсулина.
Такое связывание непептидильного полимера с N-концом бета-цепи инсулина может быть достигнуто посредством pH-контроля, и предпочтительно, в диапазоне от 4,5 до 7,5.
Как применяют в настоящем документе, термин "N-конец" можно использовать взаимозаменяемо с "N-концевая область".
В одном конкретном примере авторами настоящего изобретения получен конъюгат инсулин-ПЭГ-Fc иммуноглобулина посредством связывания ПЭГ с N-концом Fc-области иммуноглобулина, и селективного связывания N-конца бета-цепи инсулина с ним. Период полувыведения из сыворотки конъюгата инсулин-ПЭГ-Fc иммуноглобулина, полученного в настоящем изобретении, был значительно увеличен до приблизительно 18 часов, и это продемонстрировало гипогликемический эффект в животных моделях заболеваний. Таким образом, можно получать новый состав инсулина длительного действия, который поддерживает активность инсулина in vivo.
Fc-область иммуноглобулина является безопасной для применения в качестве носителя лекарственного средства, потому что она является биодеградируемым полипептидом, который метаболизируется in vivo. Кроме того, Fc-область иммуноглобулина имеет относительно низкую молекулярную массу по сравнению с целыми молекулами иммуноглобулина, и таким образом, он является предпочтительным при получении, очистке и выходе конъюгата. Fc-область иммуноглобулина не содержит Fab-фрагмент, который является чрезвычайно негомогенным из-за различных аминокислотных последовательностей, соответствующих субклассам антител, и таким образом можно ожидать, что Fc-область иммуноглобулина может значительно увеличивать гомогенность веществ и быть менее антигенной.
Как применяют в настоящем документе, термин " Fc-область иммуноглобулина" относится к белку, который содержит константную область 2 тяжелой цепи (CH2) и константную область 3 тяжелой цепи (CH3) иммуноглобулина, исключая вариабельные области тяжелых и легких цепей, константную область 1 тяжелой цепи (CH1) и константную область 1 легкой цепи (CL1) иммуноглобулина. Дополнительно он может включать шарнирную область в константной области тяжелой цепи. Кроме того, Fc-область иммуноглобулина по настоящему изобретению может содержать часть или всю Fc-область, включая константную область 1 тяжелой цепи (CH1) и/или константную область 1 легкой цепи (CL1), за исключением вариабельных областей тяжелых и легких цепей, при условии, что он выполняет физиологическую функцию, по существу сходную или лучшую, чем природный белок. Кроме того, она может быть фрагментом, имеющим делецию в относительно длинной части аминокислотной последовательности CH2 и/или CH3. То есть Fc-область иммуноглобулина по настоящему изобретению может содержать 1) домен CH1, домен CH2, домен CH3 и домен CH4, 2) домен CH1 и домен CH2, 3) домен CH1 и домен CH3, 4) домен CH2 и домен CH3, 5) комбинацию одного или нескольких доменов и шарнирную область иммуноглобулина (или часть шарнирной области), и 6) димер каждого домена константных областей тяжелой цепи и константную область легкой цепи.
Дополнительно, Fc-область иммуноглобулина по настоящему изобретению включает последовательность, производную от нее (мутантную), а также природную аминокислотную последовательность. Производное аминокислотной последовательности имеет последовательность, которая отличается от природной аминокислотной последовательности из-за делеции, вставки, неконсервативной или консервативной замены или их сочетания из одного или нескольких аминокислотных остатков. Например, в Fc IgG аминокислотные остатки, известные как важные при связывании в положениях от 214 до 238, от 297 до 299, от 318 до 322, или от 327 до 331, можно использовать в качестве подходящей мишени для модификации. Кроме того, возможными являются другие различные производные, включая производные, имеющие делецию области, способной образовывать дисульфидную связь, делецию нескольких аминокислотных остатков на N-конце природной Fc формы, или присоединение остатка метионина к N-концу природной Fc формы. Более того, для устранения эффекторных функций можно произвести делецию в области участка связывания комплемента, такого как участок связывания C1q и участок ADCC. Способы получения таких производных последовательностей Fc-области иммуноглобулина описаны в WO 97/34631 и WO 96/32478.
Аминокислотные замены в белках и пептидах, которые, как правило, не влияют на активность молекул, известны в данной области (H.Neurath, R.L.Hill, The Proteins, Academic Press, New York, 1979). Наиболее часто происходящими заменами являются Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Thy/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile Leu/Val, Ala/Glu и Asp/Gly в обоих направлениях.
Fc-область, при желании, может быть модифицирована посредством фосфорилирования, сульфатирования, ацилирования, гликозилирования, метилирования, фарнесилирования, ацетилирования, аминирования и т.п.
Указанные выше производные Fc являются производными, которые обладают биологической активностью, идентичной биологической активности Fc-области по настоящему изобретению, или улучшенной структурной стабильностью, например, против нагревания, pH или т.п.
Кроме того, эти Fc-области можно получать из природных форм, выделенных от людей и других животных, включая коров, коз, свиней, мышей, кроликов, хомяков, крыс и морских свинок, или могут быть рекомбинантами или их производными, полученными из трансформированных клеток животных или микроорганизмов. В настоящем документе, их можно получать из природного иммуноглобулина посредством выделения целых иммуноглобулинов из организма человека или животного и их обработки протеолитическим ферментом. Папаин перерабатывает природный иммуноглобулин в Fab и Fc-области, и обработка пепсином приводит к образованию pF'c и F(ab)2 фрагментов. Эти фрагменты можно подвергать, например, эксклюзионной хроматографии для выделения Fc или pF'c.
Предпочтительно, Fc-область, полученная от человека, является Fc-областью рекомбинантного иммуноглобулина, которую получают из микроорганизма.
Кроме того, Fc-область иммуноглобулина по настоящему изобретению может быть в форме, имеющей природные цепи сахаров, увеличенные цепи сахаров по сравнению с природной формой или уменьшенные цепи сахаров по сравнению с природной формой, или могут быть в дегликозилированной форме. Увеличение, уменьшение или удаление цепей сахаров Fc иммуноглобулина может быть достигнуто такими распространенными в данной области способами, как химический способ, биокаталитический способ и способ генетической инженерии с применением микроорганизмов. Результатом удаления цепей сахаров из Fc-области является резкое снижение аффинности связывания с комплементом (c1q) и снижение или потеря антителозависимой клеточной цитотоксичности или комплементзависимой цитотоксичности, таким образом, без индукции ненужного иммунного ответа in vivo. В отношении этого, Fc-область иммуноглобулина в дегликозилированной или агликозилированной форме может быть подходящей для цели по настоящему изобретению в качестве носителя лекарственного средства.
Как применяют в настоящем документе, термин "дегликозилирование" означает ферментативное удаление составных групп сахаров из Fc-области, и термин "агликозилирование" означает, что Fc-область продуцируется в негликозилированной форме в прокариотах, предпочтительно E. coli.
Кроме того, Fc-область иммуноглобулина может быть Fc-областью, полученной из IgG, IgA, IgD, IgE и IgM, или составлена их сочетаниями или гибридами. Предпочтительно, ее получают из IgG или IgM, которые относятся к наиболее многочисленным белкам в крови человека, и наиболее предпочтительно из IgG, который, как известно, увеличивает период полувыведения лиганд-связывающих белков.
Как применяют, в настоящем документе термин "комбинация" означает, что полипептиды, кодирующие Fc-области одноцепочечного иммуноглобулина того же происхождения, связаны с одноцепочечным полипептидом другого происхождения в форме димера или мультимера. То есть димер или мультимер могут быть образованы из двух или более фрагментов, выбранных из группы, состоящей из Fc IgG, Fc IgA, Fc IgM, Fc IgD и Fc IgE фрагментов.
Как применяют в настоящем документе, термин "гибрид" означает, что в Fc-области одноцепочечного иммуноглобулина присутствуют последовательности, кодирующие две или более Fc-областей иммуноглобулина различного происхождения. В настоящем изобретении возможны различные типы гибридов. То есть гибриды доменов можно составлять из от одного до четырех доменов, выбранных из группы, состоящей из CH1, CH2, CH3 и CH4 Fc IgG, Fc IgM, Fc IgA, Fc IgE и Fc IgD, и могут включать шарнирную область.
С другой стороны, IgG разделен на субклассы IgG1, IgG2, IgG3 и IgG4, и настоящее изобретение относится к их комбинациям или гибридам. Предпочтительными являются субклассы IgG2 и IgG4, и наиболее предпочтительной является Fc-область IgG4, редко выполняющая эффекторные функции, такие как CDC (обусловленная комплементом цитотоксичность).
В качестве носителя лекарственного средства по настоящему изобретению наиболее предпочтительной Fc-областью иммуноглобулина является негликозилированная Fc-область, полученная из IgG4 человека. Fc-область, полученная от человека, является более предпочтительной, чем Fc-область, полученная не от человека, которая может выступать в качестве антигена в организме человека и вызывать такие нежелательные иммунные ответы, как продуцирование нового антитела против антигена.
Как применяют в настоящем документе, термин "непептидильный полимер" относится к биосовместимому полимеру, включающему две или более повторяющихся единиц, связанных друг с другом посредством ковалентной связи, исключая пептидную связь.
Непептидильный полимер, который можно использовать в настоящем изобретении, можно выбирать из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, сополимеров этиленгликоля и пропиленгликоля, полиоксиэтилированных полиолов, поливинилового спирта, полисахаридов, декстрана, поливинилэтил простого эфира, таких биодеградируемых полимеров, как PLA (поли(молочная кислота)) и PLGA (полимолочно-гликолевая кислота), липидных полимеров, хитинов, гиалуроновой кислоты и их сочетаний, и предпочтительно полиэтиленгликоля. Их производные, хорошо известные в данной области и легко получаемые в данной области техники, также включены в рамки настоящего изобретения.
Пептидный линкер, который применяют в слитом белке, получаемый посредством общепринятого способа внутрирамочного слияния, имеет тот недостаток, что он легко расщепляется in vivo посредством протеолитического фермента, и таким образом не может быть получен достаточный эффект увеличения периода полувыведения из сыворотки активного лекарственного средства посредством носителя, как и ожидалось. Однако в настоящем изобретении можно применять полимер, обладающий устойчивостью к протеолитическому ферменту, для поддержания периода полувыведения из сыворотки пептида, являющегося сходным с носителем. Таким образом, любой непептидильный полимер можно использовать без ограничений, при условии, что он является полимером, выполняющим указанную выше функцию, т.е. полимером, обладающим устойчивостью к протеолитическому ферменту in vivo. Непептидильный полимер обладает молекулярной массой в диапазоне от 1 до 100 кДа, и предпочтительно от 1 до 20 кДа. Непептидильный полимер по настоящему изобретению, связанный с Fc-областью иммуноглобулина, может быть одним полимером или комбинацией различных типов полимеров.
Непептидильный полимер, применяемый в настоящем изобретении, имеет реакционноспособную группу, способную связаться с Fc-областью иммуноглобулина и белковым лекарственным средством.
Непептидильный полимер имеет реакционноспособную группу на обоих концах, которая предпочтительно выбрана из группы, состоящей из реакционноспособной альдегидной группы, пропиональдегидной группы, бутиральдегидной группы, малеинимидной группы и производного сукцинимида. Производное сукцинимида может быть сукцинимидилпропионатом, гидроксисукцинимидом, сукцинимидилкарбоксиметилом или сукцинимидилкарбонатом. В частности, когда непептидильный полимер имеет реакционноспособную альдегидную группу на его обоих концах, это является эффективным при связывании на обоих концах с физиологически активным полипептидом и иммуноглобулином с минимальными неспецифическими реакциями. Конечный продукт, образованный посредством восстановительного алкилирования посредством альдегидной связи, является гораздо более стабильным, чем связанный посредством амидной связи. Альдегидная реакционноспособная группа селективно связывается с N-концом при низком pH, и связывается с лизиновым остатком для образования ковалентной связи при высоком pH, таком как pH 9,0.
Реакционноспособные группы на обоих концах непептидильного полимера могут быть одинаковыми или различными. Например, непептидильный полимер может обладать малеинимидной группой на одном конце и альдегидной группой, пропиональдегидной группой или бутирилальдегидной группой на другом конце. Когда полиэтиленгликоль, имеющий реакционноспособную гидроксигруппу на его обоих концах, применяют в качестве непептидильного полимера, гидроксигруппа может быть активирована для различных реакционноспособных групп посредством известных химических реакций, или полиэтиленгликоль, имеющий коммерчески доступную модифицированную реакционноспособную группу, можно использовать, чтобы приготовить конъюгат белка по настоящему изобретению.
В другом аспекте настоящего изобретения настоящее изобретение относится к инсулиновому составу длительного действия, содержащему конъюгат инсулина по настоящему изобретению.
Как применяют в настоящем документе, термин "введение" означает введение предопределенного количества вещества пациенту посредством определенного подходящего способа. Конъюгат можно вводить любым из общепринятых путей, при условии, что он способен достичь желаемой ткани. Рассматривается ряд способов введения, включающих интраперитонеальный, внутривенный, внутримышечный, подкожный, интрадермальный, пероральный, местный, интраназальный, интрапульмональный и интраректальный, но настоящее изобретение не ограничено этими примерами способов введения. Однако ввиду того, что пептиды перевариваются при пероральном введении, активные ингредиенты композиции для перорального введения должны быть покрыты оболочкой или иметь состав для защиты от разрушения в желудке. Предпочтительно конъюгат можно вводить в инъекционной форме. Кроме того, состав длительного действия можно вводить с применением определенного устройства, способного транспортировать активные ингредиенты в клетку-мишень.
Состав длительного действия, содержащий конъюгат по настоящему изобретению, может содержать фармацевтически приемлемые носители. Для перорального введения фармацевтически приемлемый носитель может включать связывающее средство, смазочное средство, дезинтегрирующее средство, эксципиент, растворитель, диспергирующее средство, стабилизатор, суспендирующее средство, краситель и отдушку. Для инъекционных препаратов фармацевтически приемлемый носитель может включать буферное средство, консервант, анальгетик, растворитель, средство придания изотоничности и стабилизатор. Для препаратов для местного введения фармацевтически приемлемый носитель может включать основу, эксципиент, смазочное средство и консервант. Состав длительного действия по настоящему изобретению можно формулировать в ряде лекарственных форм в комбинации с указанными выше фармацевтически приемлемыми носителями. Например, для перорального введения, состав длительного действия можно формулировать в таблетки, пастилки, капсулы, эликсиры, суспензии, сиропы или вафли. Для инъекционных препаратов состав длительного действия можно формулировать в ампулу с однократной дозой или в многодозовый контейнер. Состав длительного действия можно также формулировать в растворы, суспензии, таблетки, пилюли, капсулы и препараты с длительным высвобождением.
Примеры носителя, эксципиента и разбавителя, подходящих для составов, включают лактозу, декстрозу, сахарозу, сорбит, маннит, ксилит, эритритол, мальтит, крахмал, гуммиарабик, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, микрокристаллическую целлюлозу, поливинилпирролидон, воду, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния и минеральные масла. Кроме того, составы могут дополнительно включать наполнители, антикоагулянты, смазочные средства, увлажнители, отдушки и антисептики.
Состав длительного действия по настоящему изобретению можно определять несколькими связанными между собой факторами, включающими типы заболеваний, которые необходимо лечить, способы введения, возраст пациента, пол, массу и тяжесть заболевания, а также типы лекарственного средства в качестве активного компонента. Ввиду того, что фармацевтическая композиция по настоящему изобретению имеет превосходные in vivo продолжительность действия и титр, она может значительно уменьшить частоту введения и дозу фармацевтического лекарственного средства по настоящему изобретению.
Состав длительного действия по настоящему изобретению поддерживает in vivo продолжительность действия и стабильность инсулина на очень высоком уровне, и таким образом эффективно применяется для лечения инсулинозависимого диабета.
В другом аспекте, настоящее изобретение относится к способу получения конъюгата инсулина, включающему стадии:
(1) ковалентное связывание непептидильного полимера, имеющего реакционноспособную группу производных альдегида, малеинимида или сукцинимида на каждом его конце, с аминогруппой или тиоловой группой Fc-области иммуноглобулина;
(2) выделение конъюгата из реакционной смеси (1), в которой конъюгат содержит Fc-область иммуноглобулина, ковалентно связанного с непептидильным полимером; и
(3) ковалентное связывание инсулина с другим концом непептидильного полимера выделенного конъюгата для продуцирования пептидного конъюгата, содержащего Fc-область иммуноглобулина и инсулин, которые связаны с каждым концом непептидильного полимера.
Предпочтительно, непептидильный полимер стадии (1) имеет реакционноспособное производное альдегида на его конце, и более предпочтительно три реакционноспособных группы альдегидов.
В другом аспекте, настоящее изобретение относится к способу получения конъюгата инсулина, включающему стадии:
(1) ковалентное связывание непептидильного полимера, имеющего альдегидную реакционноспособную группу на каждом его конце, с N-концом Fc иммуноглобулина при pH 6,0;
(2) выделение конъюгата из реакционной смеси (1), в которой конъюгат содержит Fc-область иммуноглобулина, ковалентно связанную с непептидильным полимером на его N-конце; и
(3) ковалентное связывание инсулина с другим концом непептидильного полимера выделенного конъюгата для получения пептидного конъюгата, содержащего Fc-область иммуноглобулина и инсулин, которые связаны с каждым концом непептидильного полимера.
В другом аспекте, настоящее изобретение относится к способу получения конъюгата инсулина, включающему стадии:
(1) ковалентное связывание непептидильного полимера, имеющего реакционноспособную группу производных альдегида, малеинимида или сукцинимида на каждом его конце, с аминогруппой или тиоловой группой инсулина;
(2) выделение конъюгата из реакционной смеси (1), в которой конъюгат содержит инсулин, ковалентно связанный с непептидильным полимером; и
(3) ковалентное связывание Fc-области иммуноглобулина с другим концом непептидильного полимера выделенного конъюгата для получения пептидного конъюгата, содержащего Fc-область иммуноглобулина и инсулин, которые связаны с каждым концом непептидильного полимера.
В другом аспекте, настоящее изобретение относится к способу получения конъюгата инсулина, включающему стадии:
(1) ковалентное связывание непептидильного полимера, имеющего альдегидную реакционноспособную группу на каждом его конце с аминогруппой инсулина;
(2) выделение конъюгата из реакционной смеси (1), в которой конъюгат содержит инсулин, ковалентно связанный с непептидильным полимером; и
(3) ковалентное связывание Fc-области иммуноглобулина с другим концом непептидильного полимера выделенного конъюгата для получения пептидного конъюгата, содержащего Fc-область иммуноглобулина и инсулин, которые связаны с каждым концом непептидильного полимера.
В другом аспекте, настоящее изобретение относится к способу лечения индивидуума, имеющего инсулин-дефицитное заболевание, способу, содержащему введение индивидууму эффективного количества состава длительного действия. Предпочтительно, инсулин-дефицитное заболевание является диабетом.
Как применяют в настоящем документе, индивидуум может быть млекопитающим, например человеком, приматом, не являющимся человеком, лошадью, овцой, кошкой, собакой, коровой или свиньей.
Способ изобретения
Далее в настоящем документе лучшее понимание настоящего изобретения можно получить на следующих примерах, которые представлены для иллюстрации, но не подразумевают ограничений настоящего изобретения.
Пример 1. Очистка Fc-области пегилированного иммуноглобулина
Для пегилирования Fc иммуноглобулина на его N-конце применяли 5K PropionALD(3) ПЭГ (ПЭГ, имеющий три пропилальдегидные группы, NOF, Japan) для проведения пегилирования посредством реакции Fc иммуноглобулина и ПЭГ при 4°C в течение 4,5 часов и при молярном отношении 1:2, с концентрацией Fc иммуноглобулина 10 мг/мл. На данном этапе реакцию проводили в 100 мМ калий-фосфатном буферном растворе при pH 6,0, и в качестве восстановителя к нему добавляли 20 мМ SCB (NaCNBH3). Монопегилированный Fc иммуноглобулин очищали от реакционного раствора с применением колонки Source 15Q (GE Healthcare).
Пример 2. Получение конъюгата инсулин-ПЭГ-Fc иммуноглобулина
Для получения Fc конъюгата инсулин-ПЭГ-иммуноглобулин, имеющего 90% или более пегилирования на фенилаланине (B1F) бета-цепи инсулина, проводили реакцию между монопегилированным Fc иммуноглобулина, полученным в примере 1, и инсулином в молярном отношении 4:1 и при 4°C в течение 20 часов, с суммарной концентрацией белка 20 мг/мл. На данном этапе реакцию проводили в 100 мМ калий-фосфатном буферном растворе при pH 6,0, и в качестве восстановителя к нему добавляли 20 мМ SCB. После окончания реакции реакционный раствор подвергали первичной очистке с применением колонки Source 15Q. После чего проводили вторичную очистку с применением колонки Source 15ISO для получения конъюгата инсулин-ПЭГ-Fc иммуноглобулина. Для анализа 90% или более пегилирования B1F полученного конъюгата инсулин-ПЭГ-Fc иммуноглобулина применяли эксклюзионную колонку, и результаты представлены на ФИГ. 3.
Пример 3. Получение конъюгата инсулин лизпро (хумалог)-ПЭГ-Fc Иммуноглобулин
Монопегилированный Fc иммуноглобулина, полученный в примере 1, и инсулин лизпро вступали в реакцию при молярном отношении 4:1 и при 4°C в течение 20 часов, с суммарной концентрацией белка 20 мг/мл. На данном этапе реакцию проводили в 100 мМ калий-фосфатном буферном растворе при pH 6,0, и в качестве восстановителя к нему добавляли 20 мМ SCB. После окончания реакции проводили очистку таким же образом, как в примере 2.
Пример 4. Получение конъюгата инсулин гларгин (лантус)-ПЭГ-Fc иммуноглобулина
Монопегилированный Fc иммуноглобулина, полученный в примере 1, и инсулин гларгин вступали в реакцию при молярном отношении 4:1 и при 4°C в течение 20 часов, с суммарной концентрацией белка 20 мг/мл. На данном этапе реакцию проводили в 100 мМ калий-фосфатном буферном растворе при pH 6,0, и в качестве восстановителя к нему добавляли 20 мМ SCB. После окончания реакции проводили очистку таким же образом, как в примере 2.
Пример 5. Получение конъюгата инсулин детемир (левемир)-ПЭГ-Fc иммуноглобулина
Монопегилированный Fc иммуноглобулина, полученный в примере 1, и инсулин детемир вступали в реакцию при молярном отношении 4:1 и при 4°C в течение 20 часов, с суммарной концентрацией белка 20 мг/мл. На данном этапе реакцию проводили в 100 мМ калий-фосфатном буферном раст