Композиции для смягчения поражений, вызванных ультрафиолетовым излучением
Иллюстрации
Показать всеИзобретение относится к фармацевтической и косметической отраслям промышленности и представляет собой композицию для облегчения вызванного ультрафиолетовым облучением поражения посредством введения после ультрафиолетового облучения, включающую одно или более соединений, выбранных из группы, состоящей из D-глутаминовой кислоты и/или ее солей, и по меньшей мере одну приемлемую добавку. Изобретение обеспечивает эффективное облегчение кожных поражений, вызванных ультрафиолетовым облучением. 10 з.п. ф-лы, 34 пр., 1 табл., 8 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к композиции для смягчения вызванного ультрафиолетовым излучением поражения, включающей одно или более соединений, выбранных из группы, состоящей из D-глутаминовой кислоты, L-глутаминовой кислоты, D-пролина, D-цистеина и L-цистеина, и их производных и/или солей, способу облегчения вызванного ультрафиолетовым излучением кожного заболевания и улучшения эстетического состояния кожи, включающему стадию, на которой вводят одно или более соединений, выбранных из группы, состоящей из D-глутаминовой кислоты, L-глутаминовой кислоты, D-пролина, D-цистеина и L-цистеина, и их производных и/или солей, и способу лечения и/или профилактики катаракты, включающему стадию, на которой вводят вышеописанное соединение.
Уровень техники
Ультрафиолетовые лучи классифицируют на ультрафиолетовые лучи длинноволнового диапазона с длинами волн более чем около 320 нм (UV-A), ультрафиолетовые лучи средневолнового диапазона от около 320 до около 280 нм (UV-B) и ультрафиолетовые лучи коротковолнового диапазона с длинами волн короче, чем около 280 нм (UV-C). Среди них UV-C-излучение не содержится в солнечном свете, достигающем земной поверхности, поскольку оно поглощается озоновыми слоями. Излучение UV-A не поглощается озоновыми слоями и преобладает в ультрафиолетовых лучах, достигающих земной поверхности. В то время как излучение UV-B частично поглощается озоновыми слоями, оно вызывает поражения кожи в дозе, составляющей одну тысячную от дозы излучения UV-А. Соответственно этому, важными являются как UV-А, так и UV-B, будучи основными факторами кожных поражений. Непатентный документ 1 раскрывает заболевания, которые обусловливаются ультрафиолетовым излучением, в том числе образование морщин, эритему, пигментную ксеродерму, хронический актинический дерматит, эпидермоидную карциному, базально-клеточную карциному, злокачественную меланому, болезнь Боуэна, солнечный кератоз, фотодерматоз, световую оспу Базена и фотоконтактный дерматит, тогда как в непатентном документе 2 приводятся примеры солнечного дерматита, хронической актинической дерматопатии, актинического кератоза, актинического хейлита, синдрома Фавра-Ракушо, фотодерматоза, фотоконтактного дерматита, брелокового дерматита, фоточувствительной лекарственной сыпи, полиморфной световой сыпи, световой оспы Базена, солнечной крапивницы, хронического фоточувствительного дерматита, пигментной ксеродермы, образования веснушек, порфирии, пеллагры, болезни Хартнупа, солнечного кератоза, дерматомиозита, красного плоского лишая, болезни Дарье, красного волосистого питириаза, розовых угрей, атопического дерматита, хлоазмы, подострого пруриго и красной волчанки.
ДОКУМЕНТЫ ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ
Непатентные документы
Непатентный документ 1: «HIHUSHIKKAN SAISHIN NO CHIRYO» («Новейшие методы лечения кожных заболеваний»), 2005-2006 (Nankodo Co., Ltd.)
Непатентный документ 2: «HYOJUN HIHUKAGAKU» («Общая дерматология»), 7-е издание (Igaku-Shoin Ltd.)
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Проблема, решаемая изобретением
Известные общеупотребительные профилактические и/или терапевтические средства для поражений кожи, вызванных ультрафиолетовым излучением, включают средство, рассеивающее ультрафиолетовое излучение, которое ингибирует абсорбцию ультрафиолетового излучения кожей, такое как оксид титана, поглотитель ультрафиолетового излучения, такой как этилгексил-пара-метоксикоричная кислота, или антиоксидант, который удаляет свободные радикалы, образуемые ультрафиолетовым излучением. Однако средство, рассеивающее ультрафиолетовое излучение, или поглотитель ультрафиолетового излучения не применяют регулярно каждый день, хотя оно является эффективным вне помещений для предотвращения солнечных ожогов. Антиоксидант является проблематичным в плане стабильности и надежности. В дополнение, известные терапевтические средства для обусловленных ультрафиолетовым излучением поражений кожи ограничиваются только симптоматическими терапевтическими препаратами. Соответственно этому, нужно разработать профилактическое и/или терапевтическое средство для кожных поражений, вызванных ультрафиолетовым излучением, которое может использоваться повседневно и которое является стабильным и надежным, а также фармацевтические, косметические и пищевые продукты, содержащие его.
Средства решения проблемы
Настоящее изобретение представляет композицию для смягчения поражения, вызванного ультрафиолетовым излучением, включающую одно или более соединений, выбранных из группы, состоящей из D-глутаминовой кислоты, L-глутаминовой кислоты, D-пролина, D-цистеина и L-цистеина, и их производных и/или солей.
Композиция для смягчения поражения, обусловленного ультрафиолетовым излучением, согласно изобретению может быть применена в виде состава для нанесения на кожу.
В композиции для смягчения поражения, вызванного ультрафиолетовым излучением, согласно изобретению вышеописанный состав для нанесения на кожу может быть применен в качестве косметического продукта.
В композиции для смягчения поражения, обусловленного ультрафиолетовым излучением, согласно изобретению вышеописанный косметический продукт может представлять собой средство против морщин.
В композиции для смягчения поражения, вызванного ультрафиолетовым излучением, согласно изобретению вышеописанный косметический продукт может представлять собой солнцезащитное средство.
В композиции для смягчения поражения, обусловленного ультрафиолетовым излучением, согласно изобретению вышеописанный косметический продукт может быть использован в качестве фармацевтического продукта для кожного заболевания.
Вышеописанное кожное заболевание может быть выбрано из группы, состоящей из эритемы, солнечного дерматита, хронической актинической дерматопатии, актинического кератоза, актинического хейлита, синдрома Фавра-Ракушо, фотодерматоза, фотоконтактного дерматита, брелокового дерматита, фоточувствительной лекарственной сыпи, полиморфной световой сыпи, световой оспы Базена, солнечной крапивницы, хронического фоточувствительного дерматита, пигментной ксеродермы, образования веснушек, порфирии, пеллагры, болезни Хартнупа, солнечного кератоза, дерматомиозита, красного плоского лишая, болезни Дарье, красного волосистого питириаза, розовых угрей, атопического дерматита, хлоазмы, подострого пруриго, красной волчанки, плоскоклеточного рака, базально-клеточной карциномы и болезни Боуэна.
В композиции для смягчения поражения, вызванного ультрафиолетовым излучением, согласно изобретению фармацевтический продукт для вышеописанного кожного заболевания может представлять собой терапевтическое средство для кожного заболевания.
В композиции для смягчения поражения, вызванного ультрафиолетовым излучением, согласно изобретению фармацевтический продукт для вышеописанного кожного заболевания может представлять собой профилактическое средство для кожного заболевания.
Композиция для смягчения поражения, вызванного ультрафиолетовым излучением, согласно изобретению может быть использована в качестве пищевого продукта.
Композиция для смягчения поражения, вызванного ультрафиолетовым излучением, согласно изобретению может быть применена в качестве фармацевтического продукта для катаракты.
В композиции для смягчения поражения, вызванного ультрафиолетовым излучением, согласно изобретению фармацевтический продукт для вышеописанной катаракты может быть терапевтическим или профилактическим средством для катаракты.
Композиция для смягчения поражения, вызванного ультрафиолетовым излучением, согласно изобретению может быть применена в виде глазных капель.
Вышеописанная катаракта может представлять собой возрастную катаракту.
Настоящее изобретение может представить способ лечения и/или профилактики кожного заболевания, вызванного воздействием ультрафиолетового излучения, включающий стадию, на которой вводят композицию, включающую одно или более соединений, выбранных из группы, состоящей из D-глутаминовой кислоты, L-глутаминовой кислоты, D-пролина, D-цистеина и L-цистеина, и их производных и/или солей. Вышеописанное кожное заболевание может быть выбрано из группы, состоящей из эритемы, солнечного дерматита, хронической актинической дерматопатии, актинического кератоза, актинического хейлита, синдрома Фавра-Ракушо, фотодерматоза, фотоконтактного дерматита, брелокового дерматита, фоточувствительной лекарственной сыпи, полиморфной световой сыпи, световой оспы Базена, солнечной крапивницы, хронического фоточувствительного дерматита, пигментной ксеродермы, образования веснушек, порфирии, пеллагры, болезни Хартнупа, старческого кератоза, дерматомиозита, красного плоского лишая, болезни Дарье, красного волосистого питириаза, розовых угрей, атопического дерматита, хлоазмы, подострого пруриго, красной волчанки, плоскоклеточного рака, базально-клеточной эпителиомы и болезни Боуэна.
Настоящее изобретение может представлять способ улучшения состояния кожи, включающий стадию, на которой вводят композицию, включающую одно или более соединений, выбранных из группы, состоящей из D-глутаминовой кислоты, L-глутаминовой кислоты, D-пролина, D-цистеина и L-цистеина, и их производных и/или солей. В способе вышеописанного улучшения эстетического состояния кожи композиция, включающая одно или более соединений, выбранных из группы, состоящей из D-глутаминовой кислоты, L-глутаминовой кислоты, D-пролина, D-цистеина и L-цистеина, и их производных и/или солей, может представлять собой косметическую композицию и/или пищевую композицию.
В способе улучшения эстетического состояния кожи согласно изобретению улучшение эстетического состояния кожи включает, но не ограничивается таковыми, обработку против морщин и/или обработку для защиты от солнца.
Настоящее изобретение может представлять способ лечения и/или профилактики катаракты, включающий стадию, в которой вводят композицию, включающую одно или более соединений, выбранных из группы, состоящей из D-глутаминовой кислоты, L-глутаминовой кислоты, D-пролина, D-цистеина и L-цистеина, и их производных и/или солей.
В способе лечения и/или профилактики катаракты согласно изобретению фармацевтический продукт для вышеописанной катаракты может быть в виде глазных капель.
В способе лечения и/или профилактики катаракты согласно изобретению вышеописанная катаракта может быть возрастной катарактой.
В описании термин «соль» означает любую соль, в том числе соль металла, аммониевую соль и тому подобную, при условии, что эффект смягчения вызванного ультрафиолетовым излучением поражения, проявляемый D-глутаминовой кислотой, L-глутаминовой кислотой, D-пролином, D-цистеином и L-цистеином, снижен. Вышеописанная соль металла может включать соль щелочного металла, соль щелочноземельного металла и тому подобную. Вышеописанная аммониевая соль может включать соль триэтиламина, соль бензиламина и тому подобную.
Термин «его производное» означает D-глутаминовую кислоту, L-глутаминовую кислоту, D-пролин, D-цистеин и L-цистеин, каждая(-ый) из которых ковалентно связан по своей аминогруппе, карбоксильной группе или боковой цепи с любым заместителем, при условии, что отсутствует вредное влияние на эффект смягчения вызванного ультрафиолетовым излучением поражения, проявляемый D-глутаминовой кислотой, L-глутаминовой кислотой, D-пролином, D-цистеином и L-цистеином. Любой заместитель включает, но не ограничивается таковыми, защитную группу, такую как N-фенилацетильная группа, 4,4'-диметокситритильная (DMT) группа и тому подобные, биополимер, такой как белок, пептид, сахарид, липид, нуклеиновая кислота и тому подобные, синтетический полимер, такой как полистирол, полиэтилен, поливинил, сложный полиэфир и тому подобные, и функциональную группу, такую как сложноэфирная группа и тому подобные. Вышеупомянутая сложноэфирная группа может включать, например, метиловый сложный эфир, этиловый сложный эфир, другой алифатический сложный эфир или ароматический сложный эфир.
Поскольку аминокислота может существовать в виде оптического изомера, который представляет собой L-форму или D-форму, но природный белок имеет L-аминокислоты, соединенные пептидными связями, и используются только L-аминокислоты, за некоторыми исключениями, такими как стенки бактериальных клеток, считалось, что у млекопитающих, в том числе у человека, присутствуют и используются только L-аминокислоты (Kinouchi, T. и др., TANPAKUSHITSU KAKUSAN KOSO (Белки, нуклеиновые кислоты и ферменты), том 50: стр. 453-460 (2005), Lehninger Principles of Biochemistry [Том 1], 2-е издание, стр. 132-147 (1993), издательство Hirokawa Publishing Co., Harper's Biochemistry, Original version, 22-е издание, стр. 21-30 (1991), издательство Maruzen Co., Ltd.). Соответственно этому, только L-аминокислоты в течение длительного времени главным образом использовались в качестве аминокислот в научных исследованиях и в промышленности.
Исключительным случаем, где может быть применена D-аминокислота, например, является ситуация с использованием в качестве исходного материала для антибиотика, продуцируемого микроорганизмом, и ситуация с пищевой добавкой, в которой применяют D-аминокислоту в DL-смеси аминокислот, всего лишь для снижения расходов на фракционирование с выделением только L-аминокислоты из смеси L-аминокислоты и D-аминокислоты. Тем не менее, не было случая использования свободной или неразделенной D-аминокислоты как таковой в промышленности в качестве биоактивного вещества.
Недавно сообщалось, что D-серин и D-аспарагиновая кислота проявляют биоактивность и что даже в человеческом организме присутствует D-серинрацемаза, и было установлено, что в организме млекопитающих также присутствует D-аминокислота, где она проявляет биоактивность. Однако поскольку наблюдаются совершенно разные биоактивности для D-серина и L-серина, а также D-аспарагиновой кислоты и L-аспарагиновой кислоты, биоактивность которых проявляется в человеческом организме, очевидно, что D-аминокислоту следовало бы рассматривать как вещество, которое отличается от L-аминокислоты, и общеизвестные научные факты относительно аминокислот следует понимать как научные сведения, касающиеся L-аминокислот.
Как показано в описанных ниже примерах, L-пролин не проявляет смягчающего действия в отношении поражения, обусловленного ультрафиолетовым излучением, и любое смягчающее действие D-глутаминовой кислоты, L-глутаминовой кислоты, D-пролина, D-цистеина и L-цистеина в отношении вызванного ультрафиолетовым излучением поражения вообще неизвестно. Соответственно этому, композиция для смягчения поражения, обусловленного ультрафиолетовым излучением, включающая одно или более соединений, выбранных из группы, состоящей из D-глутаминовой кислоты, L-глутаминовой кислоты, D-пролина, D-цистеина и L-цистеина, согласно изобретению представляет собой новое изобретение.
Недавно появилось сообщение, что мышам линии ddY открыли доступ к 10 мМ водному раствору D-аминокислоты в течение 2 недель и затем определяли концентрацию D-аминокислоты в каждом органе, которая составляла от 3 до 1000 пмоль (пикомолей) на железу в эпифизе и от 2 до 500 нмоль на грамм влажной мозговой ткани (Morikawa, A. и др., Amino Acids, том 32: стр. 13-20 (2007)). На этой основе был рассчитан нижний предел дневного потребления L- или D-глутаминовой кислоты, D-пролина, L- или D-цистеина, содержащихся в композиции согласно настоящему изобретению.
Как указано в описанных ниже примерах, L- и D-глутаминовая кислоты согласно настоящему изобретению проявляют, даже когда взяты неразделенными, смягчающее действие на вызванное ультрафиолетовым излучением поражение при концентрации, варьирующей от 0,1 до 100 мкМ, на выращенном человеческом кератиноците и фибробласте. Соответственно, количество L- и/или D-глутаминовой кислоты, содержащейся в композиции согласно изобретению, включающей фармацевтическую композицию согласно изобретению, средство против морщин, солнцезащитное средство, косметическую композицию и пищевую композицию, может варьировать в широком диапазоне при условии, что L- и/или D-глутаминовая кислота как единое целое доставляется в кератиноцит или фибробласт в кожной ткани in vivo с концентрацией в вышеуказанном диапазоне. Когда композиция согласно изобретению представляет собой состав для нанесения на кожу, тогда содержание L- и/или D-глутаминовой кислоты может варьировать в диапазоне от 0,000015% по весу до 10% по весу от общего количества композиции согласно изобретению или до максимальной концентрации по весу, которую можно ввести. Таким образом, когда композиция согласно изобретению представляет собой состав для нанесения на кожу, тогда содержание L- и/или D-глутаминовой кислоты предпочтительно составляет от 0,00003% по весу до 0,3% по весу, наиболее предпочтительно от 0,0003% по весу до 0,03% по весу. Когда композиция согласно изобретению представляет собой состав для внутреннего применения, содержание L- и/или D-глутаминовой кислоты может составлять от 0,00001% по весу до 100% по весу. Когда композиция согласно изобретению представляет собой состав для внутреннего применения, содержание L- и/или D-глутаминовой кислоты предпочтительно варьирует от 0,00002% по весу до 80% по весу, наиболее предпочтительно от 0,0002% по весу до 60% по весу. Нижний предел ежедневной дозы D-глутаминовой кислоты, содержащейся в композиции согласно изобретению, может составлять 0,01 нг, предпочтительно 0,1 нг, более предпочтительно 1 нг на кг массы тела. Нижний предел ежедневной дозы L-глутаминовой кислоты, содержащейся в композиции согласно изобретению, является меньшим, чем доза клинического лекарственного средства (80 мг или более на кг массы тела), и может составлять 0,1 мг, предпочтительно 1 мг, более предпочтительно 10 мг на кг массы тела.
Как указано в описанных ниже примерах, D-пролин согласно изобретению сам по себе проявляет смягчающее действие на вызванное ультрафиолетовым излучением поражение при концентрации, варьирующей от 0,01 до 1 мкМ, на выращенном человеческом фибробласте. Соответственно, количество D-пролина, содержащегося в фармацевтической композиции согласно изобретению, средстве против морщин, солнцезащитном средстве, косметической композиции и пищевой композиции, может варьировать в широком диапазоне при условии, что сам D-пролин доставляется в фибробласт в кожной ткани in vivo с концентрацией в вышеуказанном диапазоне. Когда композиция согласно изобретению представляет собой состав для нанесения на кожу, тогда содержание D-пролина может варьировать в диапазоне от 0,000015% по весу до 50% по весу от общего количества композиции согласно изобретению, или до максимальной концентрации по весу, которую можно ввести. Таким образом, когда композиция согласно изобретению представляет собой состав для нанесения на кожу, тогда содержание D-пролина предпочтительно составляет от 0,00003% по весу до 30% по весу, наиболее предпочтительно от 0,0003% по весу до 3% по весу. Когда композиция согласно изобретению представляет собой состав для внутреннего применения, содержание D-пролина может составлять от 0,00001% по весу до 100% по весу. Когда композиция согласно изобретению представляет собой состав для внутреннего применения, содержание D-пролина предпочтительно варьирует от 0,00002% по весу до 80% по весу, наиболее предпочтительно от 0,0002% по весу до 60% по весу. Нижний предел ежедневной дозы D-пролина, содержащегося в композиции согласно изобретению, может составлять 0,01 нг, предпочтительно 0,1 нг, более предпочтительно 1 нг на кг массы тела.
Как указано в описанных ниже примерах, L- и D-цистеины согласно изобретению проявляют, даже будучи взятыми как отдельные вещества, смягчающее действие на вызванное ультрафиолетовым излучением поражение при концентрации, варьирующей от 0,1 до 100 мкМ, на выращенном человеческом кератиноците и фибробласте. Соответственно этому, количество L- и/или D-цистеина, содержащегося в соответствующей изобретению композиции, включающей фармацевтическую композицию, средство против морщин, солнцезащитное средство, косметическую композицию и пищевую композицию, может варьировать в широком диапазоне при условии, что сам L- и/или D-цистеин доставляется в кератиноцит или фибробласт в кожной ткани in vivo с концентрацией в вышеуказанном диапазоне. Когда композиция согласно изобретению представляет собой состав для нанесения на кожу, тогда содержание L- и/или D-цистеина может варьировать в диапазоне от 0,000015% по весу до 10% по весу от общего количества композиции согласно изобретению или до максимальной концентрации по весу, которую можно ввести. Таким образом, когда композиция согласно изобретению представляет собой состав для нанесения на кожу, тогда содержание L- и/или D-цистеина предпочтительно составляет от 0,00003% по весу до 0,3% по весу, наиболее предпочтительно от 0,0003% по весу до 0,03% по весу. Когда композиция согласно изобретению представляет собой состав для внутреннего применения, содержание L- и/или D-цистеина может составлять от 0,00001% по весу до 100% по весу. Когда композиция согласно изобретению представляет собой состав для внутреннего применения, содержание L- и/или D-цистеина предпочтительно варьирует от 0,00002% по весу до 80% по весу, наиболее предпочтительно от 0,0002% по весу до 60% по весу. Нижний предел ежедневной дозы D-цистеина, содержащегося в композиции согласно изобретению, может составлять 0,01 нг, предпочтительно 0,1 нг, более предпочтительно 1 нг на кг массы тела. Нижний предел ежедневной дозы L-цистеина, содержащегося в композиции согласно изобретению, является меньшим, чем доза клинического лекарственного средства (3 мг или более на кг массы тела), и может составлять 0,01 мг, предпочтительно 0,1 мг, более предпочтительно 1 мг на кг массы тела.
Фармацевтическая композиция согласно изобретению может дополнительно включать в дополнение к одному или более соединений, выбранных из группы, состоящей из D-глутаминовой кислоты, L-глутаминовой кислоты, D-пролина, D-цистеина и L-цистеина, каждого как отдельного вещества, соли D-глутаминовой кислоты, L-глутаминовой кислоты, D-пролина, D-цистеина и L-цистеина, и производные, способные подвергаться in vivo воздействию метаболизирующих ферментов и тому подобных, с высвобождением в результате D-глутаминовой кислоты, L-глутаминовой кислоты, D-пролина, D-цистеина и L-цистеина, по меньшей мере одну фармацевтически приемлемую добавку при условии, что смягчающий эффект на вызванное ультрафиолетовым излучением поражение, проявляемый D-глутаминовой кислотой, L-глутаминовой кислотой, D-пролином, D-цистеином и L-цистеином, не снижается. Такая добавка включает, но не ограничивается таковыми, разбавитель, наполнитель, связующее средство, адгезив, смазочное средство, регулятор сыпучести, пластификатор, дезинтегрирующее средство, растворитель-носитель, буферный реагент, окрашивающую добавку, вкусоароматическую добавку, подсластитель, консервант, стабилизатор, адсорбент, а также другие фармацевтические добавки, известные квалифицированным специалистам в этой области технологии.
Средство против морщин и/или солнцезащитное средство согласно изобретению могут быть приготовлены с использованием D-глутаминовой кислоты, L-глутаминовой кислоты, D-пролина, D-цистеина и L-цистеина, каждой как отдельного вещества, солей D-глутаминовой кислоты, L-глутаминовой кислоты, D-пролина, D-цистеина и L-цистеина, и производных, способных подвергаться in vivo воздействию метаболизирующих ферментов и тому подобных, с высвобождением в результате D-глутаминовой кислоты, L-глутаминовой кислоты, D-пролина, D-цистеина и L-цистеина. Однако прочие компоненты, используемые в составах для нанесения на кожу, такие как косметические и фармацевтические продукты, в том числе квазилекарственные препараты, могут быть надлежащим образом введены, если это требуется, в такой мере, чтобы эффект изобретения не снижался. Такие прочие компоненты (необязательно вводимые компоненты) включают, например, масла, поверхностно-активные вещества, порошки, окрашивающие добавки, воду, спирты, загустители, хелатирующие реагенты, силиконы, антиоксиданты, поглотители УФ-излучения, увлажнители, душистые добавки, разнообразные фармацевтически эффективные компоненты, консерванты, регуляторы величины рН, нейтрализующие реагенты.
Состав для нанесения на кожу и косметическая композиция согласно настоящему изобретению могут быть любыми из тех, которые традиционно применяют в составе для нанесения на кожу и косметической композиции, такими как мазь, крем, эмульсия, лосьон, тампон, соль для ванны и тому подобные, и их лекарственные формы не являются в особенности конкретизированными.
Косметическая композиция согласно настоящему изобретению может надлежащим образом содержать другие компоненты, применяемые в составах для нанесения на кожу, такие как косметические и фармацевтические продукты, включающие квазилекарственные препараты, при условии, что смягчающий эффект на поражение, вызванное ультрафиолетовым излучением, проявляемый D-глутаминовой кислотой, L-глутаминовой кислотой, D-пролином, D-цистеином и L-цистеином, не снижается. Такие другие компоненты (необязательно вводимые компоненты) включают, например, масла, поверхностно-активные вещества, порошки, окрашивающие добавки, воду, спирты, загустители, хелатирующие реагенты, силиконы, антиоксиданты, поглотители УФ-излучения, увлажнители, душистые добавки, разнообразные фармацевтически эффективные компоненты, консерванты, регуляторы величины рН, нейтрализующие реагенты.
Пищевая композиция согласно настоящему изобретению может дополнительно включать, в дополнение к D-глутаминовой кислоте, L-глутаминовой кислоте, D-пролину, D-цистеину и L-цистеину, как отдельному веществу, соли D-глутаминовой кислоты, L-глутаминовой кислоты, D-пролина, D-цистеина и L-цистеина, и/или производные, способные подвергаться in vivo воздействию метаболизирующих ферментов и тому подобных, тем самым высвобождая D-глутаминовую кислоту, L-глутаминовую кислоту, D-пролин, D-цистеин и L-цистеин, приемлемый для пищевой промышленности компонент, такой как приправа, окрашивающая добавка, консервант, при условии, что смягчающий эффект на поражение, вызванное ультрафиолетовым излучением, проявляемый D-глутаминовой кислотой, L-глутаминовой кислотой, D-пролином, D-цистеином и L-цистеином, не снижается.
Пищевая композиция согласно настоящему изобретению может быть любой из тех, какие традиционно применяют в пищевой композиции, такой как напиток, жевательная конфета, леденец, таблетка, которыми это не ограничивается.
Как считается, воздействие ультрафиолетового излучения вызывает не только кожное заболевание, но также офтальмологическое заболевание, такое как катаракта. Как сообщалось, продолжительное воздействие ультрафиолетового излучения на мышей вызывает помутнение переднего слоя хрусталика, тем самым обусловливая полученную экспериментально модель катаракты (Maeda, T., и Iwata, S., “SUISHOTAI SONO SEIKAGAKUTEKI KIKO” (“Хрусталики, их биохимические механизмы”), стр. 318-323, под редакцией Iwata, S., издательство Medical-Aoi Publishings, Inc., Токио (1986)). Кроме того, ультрафиолетовое излучение относят к одной из причин возрастной катаракты (Fujinaga, Y., “HAKUNAISHO (катаракта), GANKA (офтальмология) MOOK No. 17”, стр. 10, под редакцией Mishima и др., издательство Kanehara & Co., Ltd., Токио (1982)), и авторы Zigman и др. провели эпидемиологическое наблюдение в Маниле, Тампе и Рочестере и сообщили, что существует корреляция между величиной ультрафиолетового облучения и частотой заболеваний катарактой, и ультрафиолетовые лучи представляют собой фактор риска для катаракты (Zigman, S. и др., Invest. Ophthalmol. Visual Sci., том 18: стр. 462-467 (1979)). Соответственно этому, эти научные факты, в сочетании с описанными ниже примерами, наводят на мысль, что D-глутаминовая кислота, L-глутаминовая кислота, D-пролин, D-цистеин и L-цистеин, проявляющие смягчающее действие на обусловленное ультрафиолетовым излучением поражение, являются эффективными для профилактики или лечения катаракты.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
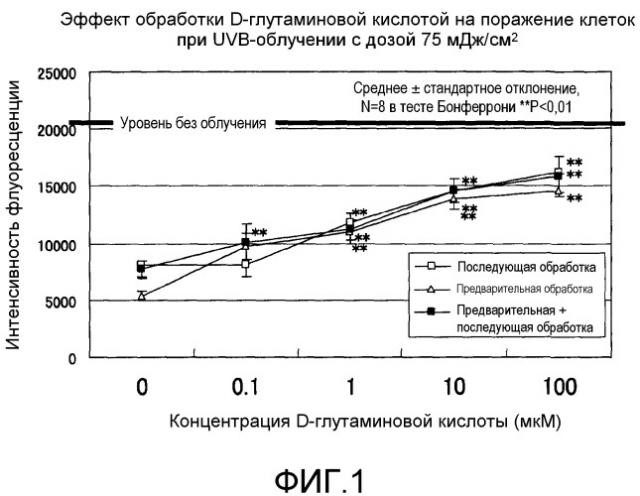
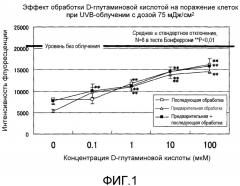
Фиг.1 представляет график, показывающий эффект обработки D-глутаминовой кислотой в нормальных человеческих эпидермальных кератиноцитах.
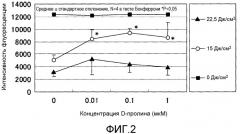
Фиг.2 представляет график, показывающий эффект обработки D-пролином после ультрафиолетового облучения в нормальных человеческих дермальных фибробластах.
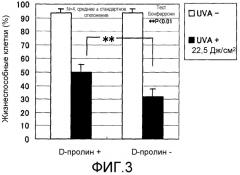
Фиг.3 представляет график, показывающий эффект обработки D-пролином до ультрафиолетового облучения в нормальных человеческих дермальных фибробластах.
Фиг.4 представляет график, показывающий эффект обработки D-пролином и глутаминовой кислотой до ультрафиолетового облучения в нормальных человеческих дермальных фибробластах.
Фиг.5 представляет график, показывающий эффект обработки цистеином в нормальных человеческих эпидермальных кератиноцитах.
Фиг.6 представляет график, показывающий эффект обработки L- и D-глутаминовой кислотой в XP-клетках.
Фиг.7 представляет график, показывающий эффект обработки L- и D-пролином в XP-клетках.
Фиг.8 представляет график, показывающий эффект обработки L- и D-цистеином в XP-клетках.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Примеры настоящего изобретения, описанные ниже, предназначены скорее только для иллюстрирования изобретения, а не для ограничения его объема. Объем изобретения ограничен только описанием в патентной формуле.
Пример 1
Смягчающее действие D-глутаминовой кислоты на вызванное ультрафиолетовым излучением поражение
Клеточная культура
Используемая клеточная культура представляла собой имеющийся в продаже на рынке человеческий неонатальный эпидермальный кератиноцит (Cryo NHEK-Neo, фирма Sanko-Junyaku Co., Ltd.). Эту клеточную культуру инокулировали при концентрации 2×105 клеток/мл в имеющуюся в продаже на рынке чашку для культивирования с диаметром 35 мм, покрытую коллагеном типа I (COL1, фирма Asahi Techno Glass Co., Ltd.), где ее культивировали в имеющейся в продаже на рынке питательной бессывороточной среде (Defined Keratinocyte-SFM, Gibco., далее называемой как «ординарная среда 1»). Эту клеточную культуру культивировали в течение от 5 до 7 дней в содержащей 5% СО2 и насыщенной водяными парами атмосфере при температуре 37°С до слияния, при этом заменяя питательную среду каждые 2 дня.
Для выявления эффекта от добавления глутаминовой кислоты до УФ-облучения (далее называемого как «предварительная обработка») питательную среду для культуры за 24 часа до облучения заменяли на среду, дополненную L- или D-глутаминовой кислотой в концентрации от 0,1 до 100 мкМ.
УФ-облучение
Перед УФ-облучением питательную среду для культуры заменяли на 1 мл PBS (фосфатно-солевого буфера). UV-В-облучение проводили с использованием самодельного устройства для УФ-экспонирования (две УФ-лампы фирмы Toshiba Medical Supply Corporation, TOREX FL20S-E-30/DMR) при облучении УФ-лучами с длиной волны от 280 до 320 нм при дозе облучения 75 Дж/см2 с расстояния 40 см над чашкой с культурой в состоянии, где крышку с соответствующей чашки с культурой снимали. Дозу УФ-облучения измеряли с использованием УФ-РАДИОМЕТРА UVR-3036/S (фирма Topcon Corporation).
Клеточную культуру, облученную таким образом УФ-лучами, возвращали в ординарную среду 1, где ее культивировали в содержащей 5% СО2 и насыщенной водяными парами атмосфере при температуре 37°С в течение 21 часа. Для выявления эффекта от добавления глутаминовой кислоты после УФ-облучения (далее называемого как «последующая обработка») этой 21-часовой культуральной среде добавляли L- или D-глутаминовую кислоту в концентрации от 0,1 до 100 мкМ.
Количественная оценка поражения клеточной культуры
После этого питательную среду для культуры дополняли красителем Alamar Blue (торговая марка фирмы Biosource International Inc.) до конечной концентрации 10%, и ее надосадочную жидкость испытывали на интенсивность флуоресценции через 3 часа при возбуждении излучением с длиной волны 544 нм и длине волны флуоресценции 590 нм, как описано авторами Ahmed S.A. и др. (J. Immunol. Method., том 170, стр. 211-224 (1994)) и в соответствии с инструкцией изготовителя.
Результаты
Фиг.1 показывает результаты экспериментального исследования действия D-глутаминовой кислоты на поражение клеточной культуры в кератиноцитах, вызванное ультрафиолетовым облучением с UV-В при дозе облучения 75 мДж/см2. Доверительные интервалы для соответствующих экспериментальных условий представляют собой среднеквадратичные отклонения измеренных значений для результатов экспериментов, повторенных по восемь раз в идентичных условиях. Звездочка (**) обозначает P<1% в тесте Бонферрони. Интенсивность флуоресценции красителя Alamar Blue (торговая марка) в отсутствие УФ-облучения составляла около 22000, которая снижалась до величины от 5000 до 7000, когда вследствие UV-В-облучения происходило поражение клеточной культуры. Тем не менее, когда добавляли D-глутаминовую кислоту, интенсивность флуоресценции повышалась и поражение клеточной культуры смягчалось. В то время как этот эффект смягчения поражения клеточной культуры наблюдали независимо от времени обработки D-глутаминовой кислотой, которую проводили до или после УФ-облучения, более высокая концентрация D-глутаминовой кислоты приводила к более выраженному смягчающему эффекту. Никакого смягчающего действия для поражения клеточной культуры не наблюдали, когда добавляли L-глутаминовую кислоту (данные не приведены). Судя по вышеописанным результатам, D-глутаминовая кислота смягчает вызванное UV-В-излучением поражение в кератиноцитах в концентрационно-зависимом режиме.
Пример 2
Смягчающее действие D-пролина на вызванное ультрафиолетовым излучением поражение
Клеточная культура
Используемая клеточная культура представляла собой имеющийся в продаже на рынке человеческий неонатальный дермальный фибробласт (Cryo NHDF-Neo, фирма Sanko-Junyaku Co., Ltd.). Эту клеточную культуру инокулировали при концентрации 2×105 клеток/мл в имеющуюся в продаже на рынке чашку для культивирования с диаметром 35 мм (BD FALCON 353001, Beckton Dickinson Japan), где ее культивировали в имеющейся в продаже на рынке культуральной среде (D-MEM (1 г/мл глюкозы, фирма Wako Pure Chemical Industries, Ltd.)), дополненной 10% телячьей сыворотки крови (далее называемой как «ординарная среда 2»). Эту клеточную культуру культивировали в течение примерно 24 часов в содержащей 5% СО2 и насыщенной водяными парами атмосфере при температуре 37°С.
После этого вышеописанную питательную среду для культивирования клеток заменяли на 1 мл среды BSO, содержащей ингибитор биосинтеза глутатиона BSO (L-бутионин-(S,R)-сульфоксимин, Wako Pure Chemical Industries, Ltd.) в концентрации 1×10-3%, где культивирование проводили в течение около 24 часов в содержащей 5% СО2 и насыщенной водяными парами атмосфере при температуре 37°С. Вышеописанную среду BSO приготавливали 200-кратным разбавлением маточного раствора, содержащего 0,2% BSO в этиловом спирте, вышеописанной ординарной средой 2.
Для выявления эффекта от добавления пролина до УФ-облучения (далее называемого как «предварительная обработка»), питательную культуральную среду за 24 часа до облучения заменяли на среду, дополненную L- или D-пролином в концентрации 0,1 мкМ.
Среда для УФ-облучения
В дистиллированной воде растворяли хлорид железа(II) до концентрации 2×10-3%, и полученный раствор подвергали 200-кратному разбавлению (до конечной концентрации: 1×10-5%) фосфатным буферным раствором PBS, содержащим ионы кальция и ионы магния (PBS+) для получения среды (далее называемой как «среда для УФ-облучения»), которую предварительно нагревали перед применением.
УФ-облучение
Перед UV-А-облучением питательную среду для культуры заменяли на 1 мл вышеописанной среды для УФ-облучения. UV-А-облучение проводили с использованием устройства для экспонирования однородным УФ-светом UVE-502S+EL-160 (фирмы SAN-EI ELECTRIC) при облучении УФ-лучами с длиной волны от 320 до 400 нм при дозах облучения 15 Дж/см2 и 22,5 Дж/см2 с расстояния примерно 20 см над чашкой с культурой в состоянии, где крышку с соответствующей чашки с культурой снимали. Дозу УФ-облучения измеряли с использованием УФ-РАДИОМЕТРА UVR-3036/S (фирма Topcon Corporation).
Обработка пролином после УФ-облучения
После УФ-облучения клеточную культуру возвращали в вышеописанную ординарную среду 2, где ее культивировали в содержащей 5% СО2 и насыщенной водяными парами атмосфере при температуре 37°С в течение 21 час